Las pacientes con diabetes mellitus gestacional (DMG) presentan un mayor riesgo de desarrollar hipertensión arterial inducida por el embarazo (HIE). La monitorización ambulatoria de presión arterial (MAPA) ha sido usada para detectar HIE y preeclampsia, pero hasta la fecha no ha sido suficientemente estudiada en DMG. El objetivo del presente trabajo es identificar de forma precoz, en mujeres con DMG, perfiles de presión arterial (PA), detectados mediante MAPA, que pudieran definir una población de mayor riesgo de desarrollar HIE y preeclampsia.
Material y métodosEstudio prospectivo en 93 pacientes con PA normal con DMG. Se les implantó entre la semana 28-32 de gestación la MAPA durante 24h (Spacelabs 90207) y se analizaron variables clínicas, analíticas y resultados obstétricos y perinatales.
ResultadosLa edad media fue 34,8±4,39años. Cinco pacientes (5,4%) desarrollaron HIE. Encontramos niveles más elevados de HbA1c (p=0,005) y microalbuminuria (p=0,001) entre las que desarrollaron HIE. Las pacientes con patrón no dipper (50,5%) presentaron cifras de PAS nocturna (106,7 vs 98,4mmHg) y PAD nocturna (64,8 vs 57,2mmHg) más elevadas (p<0,001). Se observó menor peso al nacimiento (3.084,57 vs 3.323,7; p=0,021) y menor semana de gestación en el momento del parto (38,67 vs 39,27 semanas; p=0,04) en pacientes con patrón no dipper respecto al dipper. La PAS nocturna elevada se asoció con un incremento significativo de la probabilidad de HIE (OR: 1,18; IC95%: 1,00-1,39; p=0,043).
ConclusionesEn la DMG existen alteraciones tensionales con un predominio de patrón no dipper de PA y con valores más elevados de PAS y PAD nocturnos, pudiendo ser estas alteraciones predictoras de HIE. Los valores elevados de PAS nocturna aumentan el riesgo de desarrollo de HIE. Se requieren futuros estudios para determinar la relación entre las alteraciones tensionales y las complicaciones maternas y perinatales.
Gestational diabetes mellitus (GDM) is associated to an increased risk of pregnancy-induced hypertension (PIH). Ambulatory blood pressure monitoring (ABPM) has been used to detect PIH and preeclampsia, but few data are currently available on its use in women with GDM. The aim of this study was to achieve early identification in women with GDM of BP profiles (detected by ABPM) that could define a population at greater risk of developing PIH and preeclampsia.
Material and methodsA prospective study of 93 normotensive women with GDM in whom 24-h ABPM was performed (using a Spacelabs 90207 monitor) at 28-32 weeks of pregnancy. Clinical and laboratory variable and obstetric and perinatal outcomes were analyzed.
ResultsMean age was 34.8±4.39years, and 5.4% of patients developed PIH. Higher levels of HbA1c (P=.005) and microalbumin (P=.001) were seen in patients with PIH. Patients with non-dipper patterns (50.5%) had higher values of night-time systolic BP (106.7 vs 98.4mmHg) and night-time diastolic BP (64.8 vs 57.2mmHg) (P<.001). Lower birth weights (3,084.57 vs 3,323.7) (P=.021) and shorter gestational age at delivery (38.67 vs 39.27 weeks) (P=.04) were found in women with non-dipper pattern. High night-time systolic BP significantly increased the chance of developing PIH (OR: 1.18; 95%CI: 1.00-1.39; P=.043).
ConclusionsPatients with GDM have BP changes, with predominance of the non-dipper pattern and higher night-time systolic and diastolic BP, changes that could be useful predictors of PIH. High night-time systolic BP values increase the risk of developing PIH. Further studies are needed to ascertain the relationships between BP changes and obstetric and perinatal complications.
La diabetes mellitus gestacional (DMG) se define como la hiperglucemia diagnosticada en el segundo o tercer trimestre de la gestación sin evidencia clara de una diabetes mellitus (DM) previa1. Se estima que la DMG afecta en España al 8% de las embarazadas2. La hiperglucemia durante el embarazo puede favorecer la aparición de complicaciones fetales (p.ej., macrosomía), complicaciones en el parto (distocia de hombros o necesidad de cesárea, etc.) o complicaciones maternas (p.ej., preeclampsia)3.
La hipertensión inducida por el embarazo (HIE) afecta al 5-10% de los embarazos4 y engloba la hipertensión arterial gestacional, la preeclampsia, la eclampsia y la hipertensión crónica5. Al igual que la DMG6, la HIE implica un mayor riesgo de desarrollo de enfermedad cardiovascular (ECV)7 y de morbilidad materna y perinatal4. A pesar de que la HIE es 2-3 veces más frecuente en pacientes con DMG8, existen pocos estudios que evalúen métodos de detección precoz que permitan un tratamiento temprano y, por tanto, reduzcan su impacto en la gestación.
La monitorización ambulatoria de la presión arterial (MAPA) permite hacer mediciones durante 24-48h y analizar el ritmo circadiano9, ya que la presión arterial (PA) alcanza un mínimo durante las primeras horas del sueño y se eleva en las primeras de la mañana, estableciéndose una diferencia entre el 10 al 20% en situación de normalidad (patrón dipper). Los descensos nocturnos inferiores al 10% definen el patrón no dipper10. Numerosos estudios han tratado de establecer si la MAPA podría ser una herramienta útil para predecir cambios precoces en el ritmo circadiano de la PA de pacientes que posteriormente desarrollarán HIE. De hecho, en algunos estudios realizados en gestantes con DM tipo111, se ha observado que un incremento de la frecuencia del patrón no dipper en el segundo trimestre predecía el desarrollo de HIE.
El objetivo de nuestro estudio consiste en establecer si determinados perfiles de PA (detectados mediante MAPA) en DMG pueden identificar una población en riesgo de desarrollar HIE y preeclampsia y, por tanto, permite establecer acciones precoces de carácter preventivo orientadas a reducir las complicaciones maternas y perinatales.
Material y métodosSe diseña un estudio prospectivo en pacientes con DMG y PA normal atendidas en la consulta de Endocrinología y Embarazo del Hospital Universitario Puerta del Mar para analizar la presencia de alteraciones tensionales detectadas mediante MAPA de 24h y su potencial evolución a HIE; además, se analiza su relación con parámetros inflamatorios y clínicos y las complicaciones obstétricas y perinatales. El periodo de estudio comprendió desde agosto de 2014 a agosto de 2017.
Los criterios de inclusión fueron los siguientes: mujeres con PA normal (PA sistólica [PAS] ≤130mmHg, PA diastólica [PAD] ≤80mmHg en mediciones puntuales de PA de consultas o ambulatorias) con gestación de curso fisiológico y diagnosticadas de DMG, tras test de O'Sullivan patológico, mediante una sobrecarga oral de glucosa con 100g, presentando dos valores anormalmente elevados, tomando como valores de referencia 105, 190, 165 y 145mg/dl (basal y a los 60, 120 y 180min, respectivamente). Los criterios de exclusión fueron: mujeres con hipertensión crónica o que presentan cifras de PAS >130 o PAD >80mmHg, en mediciones puntuales de PA de consultas o ambulatorias o que tengan tratamiento con fármacos antihipertensivos, con diagnóstico de insuficiencia placentaria, diabetes pregestacional o monogénica, así como obesidad mórbida (IMC >40kg/m2), enfermedad sistémica subyacente crónica, proceso agudo infeccioso, hábito tabáquico o falta de consentimiento informado.
En el momento de la inclusión en el estudio se recogieron los datos relativos a antecedentes familiares de diabetes e hipertensión, edad, historia obstétrica, paridad, altura, peso previo y actual, índice de masa corporal, PAS y PAD, edad gestacional y parámetros analíticos. Al final de la gestación se recogieron los datos relativos a las complicaciones gestacionales, desarrollo de HIE y su manifestación clínica (hipertensión gestacional o preeclampsia), tipo de tratamiento (dieta o insulina), tipo de parto (eutócico, distócico, cesárea), semanas de finalización del embarazo, peso del recién nacido, test de Apgar y complicaciones del recién nacido (hipoglucemias, hiperbilirrubinemia, infecciones, ingresos en UCI del recién nacido).
Se definió, de acuerdo a Marín et al.4, como hipertensión arterial (HTA) gestacional a aquella que se diagnostica tras la semana 20 de gestación, sin presencia de proteinuria, incluyendo el momento del parto y con retorno a cifras normales de PA al cabo de 12semanas posparto; y como preeclampsia, a aquella hipertensión que se presenta con cifras mayores a 140/90 en mujeres normotensas después de la semana 20 en al menos dos ocasiones separadas 4h y se acompaña de proteinuria >0,3g/24h (o cociente proteínas/creatinina ≥300mg/g).
Un total de 123 gestantes con PA normal diagnosticadas de DMG fueron incluidas en el estudio; entre la semana 28 y 32 de gestación se les colocó la MAPA a las 08:30-09:30h (marca Spacelabs 90207), cuyo monitor se programa para realizar lecturas cada 20min durante el período diurno y cada 30min durante el período nocturno. Se excluyeron finalmente 30 pacientes que no cumplieron con los requisitos para aceptar la MAPA como válida (al menos un 66% de lecturas teóricas realizadas, al menos una lectura por hora y los que presenten un mínimo de 14 lecturas en el periodo diurno y 7 en el período nocturno). El número total de pacientes incluidas en el estudio fue de 94 gestantes. Se establecieron como patrones circadianos de MAPA: patrón dipper (descenso de PA >10% en periodo nocturno en relación con el periodo diurno), dipper extremo (descenso de PA >20% en el periodo nocturno en relación con el periodo diurno), no dipper (descenso de PA <10% en el periodo nocturno en relación con el periodo diurno) y riser (PA aumentadas en el periodo de descanso en relación con el periodo nocturno).
Este estudio fue aprobado por el Comité de Ética e Investigación del Hospital Universitario Puerta del Mar de Cádiz. El proyecto se realizó siguiendo las recomendaciones éticas internacionales contenidas en la Declaración de Helsinki.
Análisis estadísticoEl análisis descriptivo de las variables cualitativas se realizó mediante el cálculo de las frecuencias y de los porcentajes, y para las variables cuantitativas se determinaron la media, la desviación típica para las variables que se ajustaron a la normalidad, y la mediana y el rango para las que no siguieron una distribución normal. Tras la comprobación del supuesto de normalidad en la muestra mediante la prueba de Kolmogorov-Smirnov, se realizaron las siguientes pruebas: para comparar las variables cuantitativas entre grupos independientes se utilizó el test de Student o la prueba de U de Mann-Whitney para el contraste no paramétrico; para comparar las variables cualitativas entre grupos independientes se empleó el test de chi cuadrado (Fisher si precisaba). Todos los valores de significación se refieren al test de 2 colas, considerando la asociación estadísticamente significativa si el valor de p fue menor de 0,05.
Se calcularon, para cada modalidad de PA, las curvas COR, con el objetivo de determinar los puntos de corte para cada una de ellas con los que se consigue mayor capacidad predictiva de desarrollo de HIE.
Finalmente, se efectuó un análisis multivariante con la construcción de modelos de regresión logística binaria. Las variables independientes a incluir en los modelos se eligieron en función de criterios clínicos y estadísticos (p<0,05 en análisis bivariante), estableciendo el criterio de inclusión en el modelo en 0,10 y de exclusión en 0,15. Sobre los modelos resultantes, se exploró la introducción manual de variables con significación de p<0,30 en el análisis bivariante y se comprobó la necesidad de dejar en el modelo aquellas variables no significativas cuya eliminación producía cambios relevantes en el coeficiente del resto de las variables del modelo. Se evaluó la bondad de ajuste del modelo final mediante el test de Hosmer-Lemeshow. Los datos fueron codificados, introducidos y analizados mediante el programa estadístico SPSS versión 15.0 para Windows.
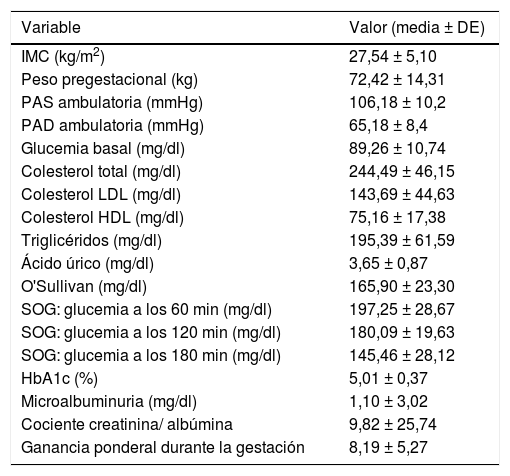
ResultadosLas gestantes incluidas en el análisis (n=93) presentaron una edad media de 34,8±4,39años. Presentaron antecedentes familiares de primer grado de diabetes (tipos1 y 2) 43 (46,2%) de las pacientes, y 34 (36,6%), antecedentes de primer grado de HTA. Veintiséis (28%) de las pacientes presentaban antecedentes de DMG en gestaciones previas. En la tabla 1 se describen las características clínicas y analíticas de las pacientes.
Variables analíticas y clínicas de la población en estudio
| Variable | Valor (media ± DE) |
|---|---|
| IMC (kg/m2) | 27,54 ± 5,10 |
| Peso pregestacional (kg) | 72,42 ± 14,31 |
| PAS ambulatoria (mmHg) | 106,18 ± 10,2 |
| PAD ambulatoria (mmHg) | 65,18 ± 8,4 |
| Glucemia basal (mg/dl) | 89,26 ± 10,74 |
| Colesterol total (mg/dl) | 244,49 ± 46,15 |
| Colesterol LDL (mg/dl) | 143,69 ± 44,63 |
| Colesterol HDL (mg/dl) | 75,16 ± 17,38 |
| Triglicéridos (mg/dl) | 195,39 ± 61,59 |
| Ácido úrico (mg/dl) | 3,65 ± 0,87 |
| O'Sullivan (mg/dl) | 165,90 ± 23,30 |
| SOG: glucemia a los 60 min (mg/dl) | 197,25 ± 28,67 |
| SOG: glucemia a los 120 min (mg/dl) | 180,09 ± 19,63 |
| SOG: glucemia a los 180 min (mg/dl) | 145,46 ± 28,12 |
| HbA1c (%) | 5,01 ± 0,37 |
| Microalbuminuria (mg/dl) | 1,10 ± 3,02 |
| Cociente creatinina/ albúmina | 9,82 ± 25,74 |
| Ganancia ponderal durante la gestación | 8,19 ± 5,27 |
DE: desviación estándar; PAD: presión arterial diastólica; PAS: presión arterial sistólica; SOG: sobrecarga oral de glucosa.
Las cifras medias de PA registradas en la MAPA de 24h fueron las siguientes: PAS promedio de 24h: 107,06±9,40mmHg; PAS promedio en periodo de actividad: 109,23±9,73mmHg; PAS promedio en periodo de descanso: 102,61±10,28mmHg; PAD promedio de 24h: 65,77±6,47mmHg; PAD promedio en periodo de actividad: 68,01±6,65mmHg; PAD promedio en periodo de descanso: 61,09±7,50mmHg.
En cuanto a los resultados obstétricos y perinatales, 49 (52,7%) de las pacientes realizaban el tratamiento con insulina; 45 (48,9%) desarrollaron parto eutócico; 24 (26,1%) precisaron parto instrumental y 23 (25%), la realización de cesárea.
En cuanto a resultados perinatales, 6 (6,5%) presentaron crecimiento intrauterino retardado (percentil<5); 24 (26,1%) resultaron pequeños para la edad gestacional (percentil<10); 24 (26,1%) se hallaban en normopeso; 22 (23,9%) fueron grandes para la edad gestacional (percentil >90) y 16 (17,4%) presentaron macrosomía (percentil >95 o >4.000g). Un total de 8 (8,7%) de los recién nacidos requirieron ingreso en UCI neonatal. Los motivos de ingreso más frecuentes fueron: hiperbilirrubinemia (7; 7,6%), malformaciones congénitas (1; 1,1%) e ingreso por otro motivo: síndrome febril, prematuridad, rechazo de tomas, bajo peso, etc. (3; 3,3%). Ninguno de los recién nacidos presentó hipoglucemia al nacimiento.
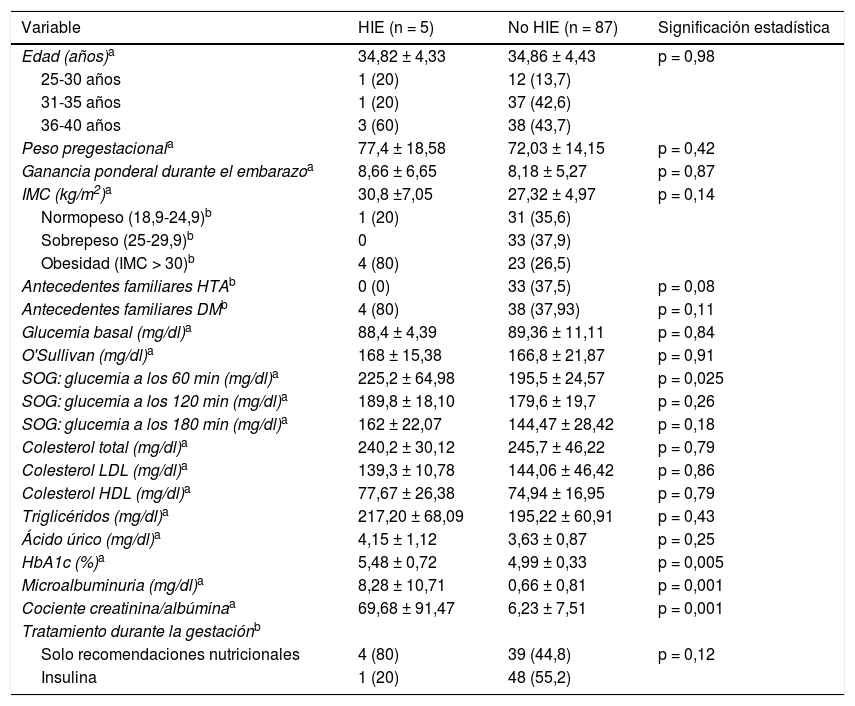
En cuanto a resultados maternos, 5 (5,4%) desarrollaron HTA gestacional (dos en la semana 32, una en la semana 36, una en la semana 39 y otra en el posparto inmediato), y una (1,1%), preeclampsia en el posparto inmediato. En total, 5 (5,4%) desarrollaron algún tipo de trastorno hipertensivo del embarazo (HTA gestacional y/o preeclampsia). En la tabla 2 se comparan variables analíticas, demográficas y clínicas entre las pacientes que desarrollaron HIE y las que no lo hicieron.
Análisis bivariante de la asociación existente entre la presencia de HIE, con variables demográficas, analíticas y clínicas
| Variable | HIE (n = 5) | No HIE (n = 87) | Significación estadística |
|---|---|---|---|
| Edad (años)a | 34,82 ± 4,33 | 34,86 ± 4,43 | p = 0,98 |
| 25-30 años | 1 (20) | 12 (13,7) | |
| 31-35 años | 1 (20) | 37 (42,6) | |
| 36-40 años | 3 (60) | 38 (43,7) | |
| Peso pregestacionala | 77,4 ± 18,58 | 72,03 ± 14,15 | p = 0,42 |
| Ganancia ponderal durante el embarazoa | 8,66 ± 6,65 | 8,18 ± 5,27 | p = 0,87 |
| IMC (kg/m2)a | 30,8 ±7,05 | 27,32 ± 4,97 | p = 0,14 |
| Normopeso (18,9-24,9)b | 1 (20) | 31 (35,6) | |
| Sobrepeso (25-29,9)b | 0 | 33 (37,9) | |
| Obesidad (IMC > 30)b | 4 (80) | 23 (26,5) | |
| Antecedentes familiares HTAb | 0 (0) | 33 (37,5) | p = 0,08 |
| Antecedentes familiares DMb | 4 (80) | 38 (37,93) | p = 0,11 |
| Glucemia basal (mg/dl)a | 88,4 ± 4,39 | 89,36 ± 11,11 | p = 0,84 |
| O'Sullivan (mg/dl)a | 168 ± 15,38 | 166,8 ± 21,87 | p = 0,91 |
| SOG: glucemia a los 60 min (mg/dl)a | 225,2 ± 64,98 | 195,5 ± 24,57 | p = 0,025 |
| SOG: glucemia a los 120 min (mg/dl)a | 189,8 ± 18,10 | 179,6 ± 19,7 | p = 0,26 |
| SOG: glucemia a los 180 min (mg/dl)a | 162 ± 22,07 | 144,47 ± 28,42 | p = 0,18 |
| Colesterol total (mg/dl)a | 240,2 ± 30,12 | 245,7 ± 46,22 | p = 0,79 |
| Colesterol LDL (mg/dl)a | 139,3 ± 10,78 | 144,06 ± 46,42 | p = 0,86 |
| Colesterol HDL (mg/dl)a | 77,67 ± 26,38 | 74,94 ± 16,95 | p = 0,79 |
| Triglicéridos (mg/dl)a | 217,20 ± 68,09 | 195,22 ± 60,91 | p = 0,43 |
| Ácido úrico (mg/dl)a | 4,15 ± 1,12 | 3,63 ± 0,87 | p = 0,25 |
| HbA1c (%)a | 5,48 ± 0,72 | 4,99 ± 0,33 | p = 0,005 |
| Microalbuminuria (mg/dl)a | 8,28 ± 10,71 | 0,66 ± 0,81 | p = 0,001 |
| Cociente creatinina/albúminaa | 69,68 ± 91,47 | 6,23 ± 7,51 | p = 0,001 |
| Tratamiento durante la gestaciónb | |||
| Solo recomendaciones nutricionales | 4 (80) | 39 (44,8) | p = 0,12 |
| Insulina | 1 (20) | 48 (55,2) |
No se encontraron diferencias estadísticamente significativas al analizar la asociación entre la presencia de HIE y los resultados obstétricos y perinatales (macrosomía, pequeño para la edad gestacional, crecimiento intrauterino retardado, hiperbilirrubinemia, hipoglucemia, malformaciones congénitas).
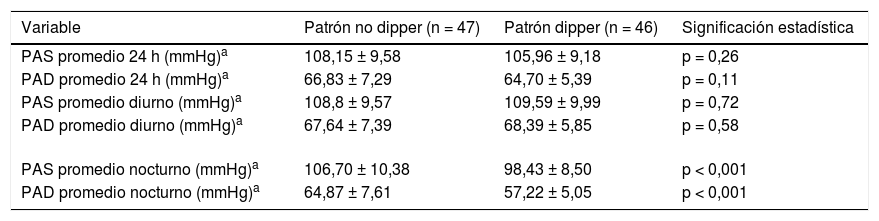
En relación con la MAPA, 47 (50,5%) pacientes presentaron patrón no dipper y 46 (49,5%) patrón dipper. Los promedios nocturnos fueron significativamente superiores en las pacientes con patrón no dipper respecto a las pacientes con patrón dipper. En cuanto a los parámetros tensionales diurnos y de 24h y el resto de variables clínicas y analíticas no se objetivaron diferencias significativas entre ambos grupos (tabla 3).
Análisis bivariante de la asociación existente entre la presencia de patrón dipper/no dipper en la MAPA con los parámetros tensionales analizados
| Variable | Patrón no dipper (n = 47) | Patrón dipper (n = 46) | Significación estadística |
|---|---|---|---|
| PAS promedio 24 h (mmHg)a | 108,15 ± 9,58 | 105,96 ± 9,18 | p = 0,26 |
| PAD promedio 24 h (mmHg)a | 66,83 ± 7,29 | 64,70 ± 5,39 | p = 0,11 |
| PAS promedio diurno (mmHg)a | 108,8 ± 9,57 | 109,59 ± 9,99 | p = 0,72 |
| PAD promedio diurno (mmHg)a | 67,64 ± 7,39 | 68,39 ± 5,85 | p = 0,58 |
| PAS promedio nocturno (mmHg)a | 106,70 ± 10,38 | 98,43 ± 8,50 | p < 0,001 |
| PAD promedio nocturno (mmHg)a | 64,87 ± 7,61 | 57,22 ± 5,05 | p < 0,001 |
Al analizar la relación del patrón circadiano con las distintas complicaciones obstétricas perinatales observamos que las pacientes con patrón no dipper en la MAPA presentaban menos semanas de gestación en el momento del parto con respecto a las de patrón dipper (38,67±1,60 versus 39,27±1,11, respectivamente; p=0,04). También se comprobó que los recién nacidos de madres con patrón no dipper presentaban menor peso al nacimiento con respecto a los recién nacidos de madres con MAPA normal (3.084,57±515,2 versus 3.323,7±457,9, respectivamente; p=0,021). No se encontraron diferencias estadísticamente significativas en el resto de resultados obstétricos ni perinatales.
Tampoco se observaron diferencias entre las pacientes con patrón no dipper y el desarrollo de HIE, cesárea, necesidad de ingreso del recién nacido en UCI o aparición de macrosomía.
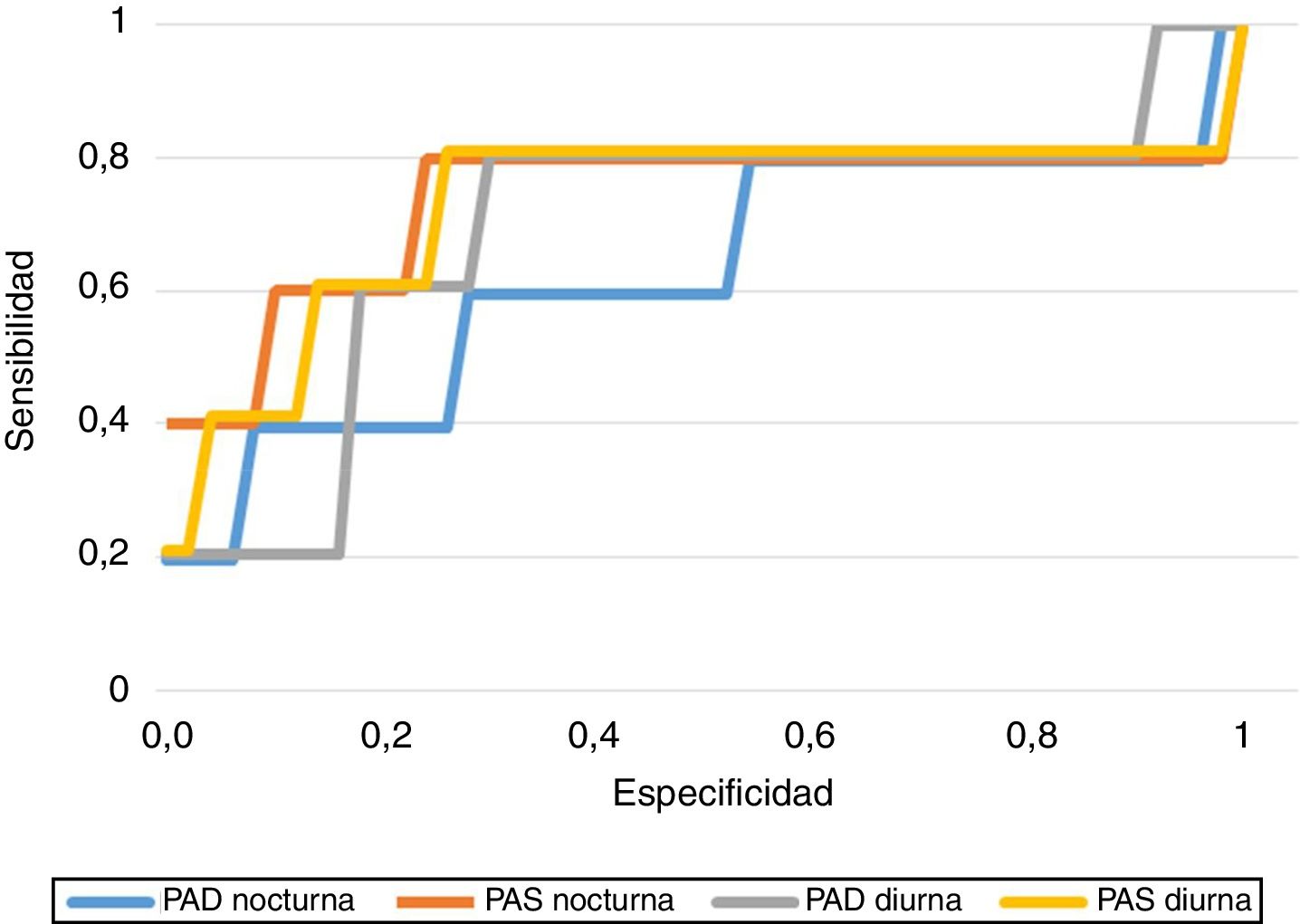
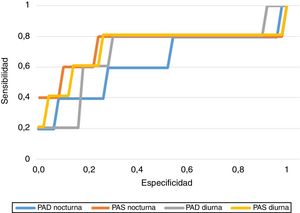
En cuanto a la capacidad de predicción de los resultados de PA obtenidos, hallamos los puntos de corte de PA con mayor sensibilidad (S) y especificidad (E) para predecir el desarrollo de HIE, obteniendo una PAS diurna de 113,5mmHg (S 80%, E 73,6%), PAD diurna de 70,5mmHg (S 80%, E 69%), PAS nocturna de 108,5mmHg (S 80%, E 77%) y PAD nocturna de 58,5mmHg (S 80%, E 43,7%). En la figura 1 se representan las curvas COR de cada uno de los tramos de PA.
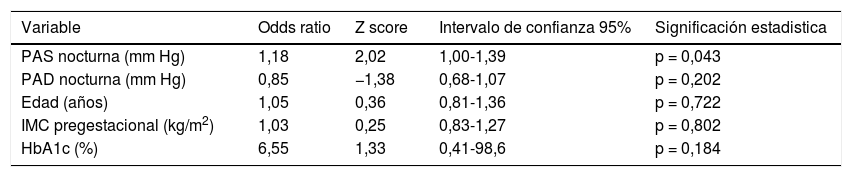
En el análisis de regresión logística para estudiar la asociación entre la MAPA (PAS y PAD nocturnas) y el desarrollo de HIE, incluyendo algunas variables analíticas y demográficas (edad, IMC y HbA1c), se confirmó que la PAS nocturna presenta una OR significativa de 1,18 (IC95%: 1,00-1,39; p=0,043), tal como se observa en la tabla 4. Este hallazgo de la OR se interpreta de manera similar a un riesgo relativo ajustado, es decir, en promedio, un aumento de 1mmHg en la PAS nocturna puede incrementar en un 18% la probabilidad o el riesgo de presentar HIE según este modelo, supuestas estables el resto de variables. El estadístico de Hosmer-Lemeshow (9,18 para 6g.l., p=0,16) indica un adecuado ajuste al modelo logístico.
Análisis de regresión logística para hipertensión inducida por el embarazo (n = 94)
| Variable | Odds ratio | Z score | Intervalo de confianza 95% | Significación estadistica |
|---|---|---|---|---|
| PAS nocturna (mm Hg) | 1,18 | 2,02 | 1,00-1,39 | p = 0,043 |
| PAD nocturna (mm Hg) | 0,85 | −1,38 | 0,68-1,07 | p = 0,202 |
| Edad (años) | 1,05 | 0,36 | 0,81-1,36 | p = 0,722 |
| IMC pregestacional (kg/m2) | 1,03 | 0,25 | 0,83-1,27 | p = 0,802 |
| HbA1c (%) | 6,55 | 1,33 | 0,41-98,6 | p = 0,184 |
PAD: presión arterial diastólica; PAS: presión arterial sistólica.
En el presente trabajo demostramos que las pacientes con DMG muestran alteraciones tensionales subclínicas detectadas mediante MAPA con un predominio de patrón no dipper y valores elevados de PAS y PAD nocturnos, y consideramos que estos hallazgos podrían ser predictores de HIE.
Tal y como se describe en la literatura, la edad es un factor de riesgo importante y no modificable tanto para el desarrollo de DMG12 como para el de HIE4; en nuestro estudio, el 60% de las pacientes que presentaron HIE tenían entre 36-40años (no se pudo demostrar diferencia significativa, debido probablemente al limitado tamaño muestral).
La obesidad es el factor de riesgo modificable más importante para la aparición de DMG13 y de HIE4,14. En esto último también coincide nuestro estudio, ya que, aunque el IMC más frecuente fue el correspondiente al rango de sobrepeso, el IMC que con mayor frecuencia (80%) se asoció al desarrollo de HIE fue el correspondiente con el rango de obesidad (IMC>30). Las pacientes que desarrollaron HIE presentaban un IMC más elevado, un mayor peso pregestacional y una mayor ganancia ponderal al final del embarazo.
Hay estudios publicados que afirman que los antecedentes familiares de HTA y DM suponen un mayor riesgo de presentar alteraciones tensionales durante la gestación4,14. Sin embargo, solo 33 (37,5%) de las pacientes estudiadas referían antecedentes de HTA y ninguna de ellas desarrolló HIE. Al contrario, cuatro de las cinco pacientes que desarrollaron HIE presentaban antecedentes familiares de DM.
En cuanto al valor del control glucémico, al igual que en otras publicaciones15, comprobamos que las cifras de HbA1c influyen de manera significativa en el desarrollo de HIE. En cuanto al potencial efecto del tratamiento insulínico, 4 (80%) pacientes que desarrollaron HIE estaban en tratamiento dietético, mientras que una (20%) recibía tratamiento con insulina; estas diferencias no resultaron ser significativas.
Diversos estudios han sugerido que la presencia de microalbuminuria podría considerarse como factor predictor de preeclampsia en etapas precoces del embarazo16. Su presencia se ha correlacionado con factores asociados a resistencia a la insulina y disfunción endotelial en pacientes con DM tipo117, DM tipo218 y DMG19. Estos hallazgos coinciden con los de nuestro estudio, donde observamos que los niveles de microalbuminuria estaban más elevados en las pacientes que desarrollaron HIE. A su vez, el cociente albúmina/creatinina también ha sido considerado como predictor de preeclampsia en etapas precoces del embarazo en gestantes con20 y sin DMG21.
Solo hallamos HIE en 5 (5,4%) de las pacientes con DMG, lo que supone menor incidencia a la descrita en la literatura22. Esta menor incidencia puede ser debida a que nuestro estudio está centrado en DMG de inicio tardío (nuestras pacientes fueron reclutadas en el tercer trimestre: 28-32 semanas), por lo que el porcentaje de mujeres con DM tipo2 larvada y diagnosticada en el embarazo como DMG representaría un porcentaje muy pequeño, lo que evita la posibilidad de reclutar gestantes con DM pregestacional que son incluidas como diabetes gestacional en muchos estudios y, por tanto, aumentan la incidencia de HIE y de las complicaciones cardiovasculares en el futuro. De hecho, en el estudio de Sullivan et al.22 se describe la prevalencia de preeclampsia del 5-8% de todos los embarazos, aumentando hasta el 20% en pacientes con diabetes pregestacional, siendo más baja y variable la prevalencia en DMG (<20%). No obstante, identificar posibles marcadores predictivos que contribuyan a aumentar el riesgo en gestante de HIE con DMG de comienzo tardío sería de gran valor para conocer el verdadero impacto sobre la morbilidad perinatal y futuros riesgos cardiovasculares.
La incidencia de HIE en las pacientes que mostraron un patrón circadiano no dipper fue menor de la que esperábamos encontrar, ya que en la literatura se ha descrito que dicho patrón se asocia con más frecuencia tanto al desarrollo de HIE como de preeclampsia, independientemente el valor promedio de la PA23,24. En nuestro estudio, la prevalencia del patrón no dipper fue mayor que la del patrón dipper, coincidiendo con lo descrito tanto en pacientes con DMG25, como en DM tipo126 y en DM tipo227.
De nuestros resultados es importante destacar que las pacientes con patrón no dipper mostraron cifras de PAS y PAD en el periodo nocturno significativamente más elevadas. A pesar de ello, al realizar el análisis multivariante es únicamente la PAS nocturna la variable que se identifica como variable predictora independiente. De igual modo, las pacientes en las que se registraron cifras de PAS promedio y PAD promedio elevadas (>120 y >70mmHg, respectivamente) presentaban de forma característica un patrón no dipper.
Nuestros resultados nos han permitido establecer puntos de corte de PA (108,5mmHg) con elevada especificidad y sensibilidad para la predicción de HIE, coincidiendo, en gran medida, con lo establecido en gestantes con DM tipo111.
De los recién nacidos, 24 (26,1%) mostraron bajo peso al nacer y 16 (17,4%) macrosomía. Aunque la asociación de estos hallazgos con la DMG es bien conocida28, no se sabe con certeza el potencial papel que las alteraciones subclínicas de PA podrían desempeñar en ellas, sobre todo en la primera29.
Entre las pacientes, 23 (25%) precisaron cesárea, cifra algo menor que las publicadas en la literatura30. Sin embargo, en nuestro estudio no hemos conseguido establecer una relación significativa entre la indicación de cesárea y la existencia de HIE, preeclampsia o patrones de MAPA alterados.
Los inconvenientes de nuestro estudio radican en que la reproducibilidad del MAPA es limitada, ya que se podrían obtener valores que infraestimen o sobreestimen las alteraciones tensionales detectadas; por otra parte, no existen valores de referencia de normalidad a los que referir nuestros hallazgos, y la incidencia de HIE en la población estudiada es menor de la esperada. No obstante, hemos observado tendencias que podrían adolecer de elevada significación clínica pero que habrían de avalarse en futuros estudios con mayor tamaño muestral (a pesar de todo, nuestro estudio es, de los realizados hasta la fecha, el de mayor tamaño muestral). Además, apenas existen trabajos publicados sobre alteraciones tensionales detectadas mediante MAPA en mujeres con DMG que desarrollan HIE. Sin embargo, consideramos este punto una fortaleza, debido a la importancia que tiene que hayamos identificado posibles marcadores predictivos que contribuyan al desarrollo de la HIE en gestantes con DMG, y que podrían ayudar a conocer su impacto sobre morbilidad perinatal y futuro riesgo de DM tipo2 y ECV, resultando de gran valor para el sistema sanitario.
ConclusionesEn la DMG existen alteraciones tensionales subclínicas que muestran, fundamentalmente, un predominio de patrón no dipper y valores más elevados de PAS y PAD nocturnos, pudiendo ser estas alteraciones predictoras de HIE. Se requieren estudios con mayor tamaño muestral para confirmar estos hallazgos y determinar la relación entre las alteraciones tensionales y las complicaciones maternas y perinatales.
AutoríaCLT y MAD diseñaron el estudio. BSL y ALB realizaron el trabajo de campo e introdujeron los datos para los análisis. AM y AA realizaron las extracciones de sangre y colocaron la MAPA. BSL recogió los datos obstétricos. JACD participó en el diseño de la estrategia de análisis de datos. CLT, MAD y BSL escribieron el primer borrador del manuscrito e incorporaron sugerencias de todos los coautores. Todos los autores han leído y aprobado la versión final de este artículo.
FinanciaciónPremio Fundación Sociedad Española de Endocrinología y Nutrición en investigación para jóvenes endocrinólogos 2016.
Plan Estatal 2013-2016, ISCIII, código de expediente: PI 2016 G72109168, y FEDER.
Instituto de Investigación Biomédica e Innovación de Cádiz (INIBICA).
Conflicto de interesesLos autores del presente artículo no presentan conflictos de intereses en relación con el objetivo ni los resultados del presente artículo.