La apnea obstructiva del sueño (AOS) tiene una elevada incidencia en obesos mórbidos candidatos a cirugía bariátrica (CB). Un screening adecuado reduciría el número de poligrafías (PR).
ObjetivoAnalizar la utilidad de un modelo secuencial con un cuestionario (Dixon modificado [DXM] vs. STOP-Bang) y pulsioximetría nocturna en pacientes candidatos a CB.
MétodosEstudio prospectivo, desde el 1 de julio de 2014 hasta el 1 de julio de 2015. Se incluyeron candidatos a CB, excluyéndose aquellos que ya se habían sometido a una PR. Variables: cuestionarios (Epworth, STOP-Bang y DXM), medidas antropométricas, PR y analítica de sangre y gases. Se dividió la muestra entre los que no tenían AOS o era leve (No AOS) y los que tuvieron una AOS moderada-grave (IAH>15).
ResultadosSe analizaron 70 pacientes, de los cuales 46 (65,7%) eran mujeres. Se diagnosticaron 26 (37,1%) de AOS moderada-grave. Comparamos STOP-Bang y DXM mediante curvas ROC con una mayor área bajo la curva (AUC) para este último (0,873 [0,74-0,930] vs. 0,781 [0,673-0,888]). La sensibilidad fue superior para el STOP-Bang con un 100% vs. 73,1% de DXM. El IDO3% presentó mayor rentabilidad diagnóstica AUC=0,982 (0,970-1). La aplicación del modelo secuencial con STOP-Bang>3, DXM>5 y DXM>3 hubiese evitado 41 (58,5%), 50 (71,4%) y 41 (58,5%) PR y 0, 7 (10%) y 0 falsos negativos, respectivamente.
ConclusiónLa aplicación de un modelo secuencial basado en el STOP-Bang y pulsioximetría nocturna es una herramienta útil para el screening de AOS en obesos mórbidos candidatos a CB, reduciendo el número de PR.
Obstructive sleep apnea (OSA) has a high incidence in patients with morbid obesity who are candidates for bariatric surgery (BS). Adequate screening would decrease the number of respiratory polygraphies (RPs).
ObjectiveTo analyze the value of a sequential model consisting of a questionnaire (modified Dixon [DXM] vs STOP-Bang) and nocturnal pulse oximetry in patients who were candidates for BS.
MethodsA prospective study was conducted from July 1, 2014 to July 1, 2015 on candidates for BS, excluding those who have already undergone RP. Variables: questionnaires (Epworth, STOP-Bang, and DXM), anthropometric measurements, RP, and blood and gas tests. The sample was divided into patients with no or mild OSA (no OSA) and those with moderate to severe OSA (AHI>15).
ResultsA total of 70 patients were analyzed, 46 (65.7%) of them females. Moderate to severe OSA was diagnosed in 26 (37.1%) patients. STOP-Bang and DXM were compared using ROC curves, and greater area under the curve (AUC) was found for the latter (0.873 [0.74 -0.930] vs 0.781 [0.673-0.888]). STOP-Bang had greater sensitivity, 100%, as compared to 73.1% for DXM. ODI3% showed greater diagnostic yield (AUC=0.982 [0.970-1]). Use of the sequential model with STOP-Bang>3, DXM>5, and DXM>3 would have avoided 41 (58.5%), 50 (71.4%), and 41 (58.5%) RPs and 0, 7 (10%), and 0 false negatives, respectively.
ConclusionUse of a sequential model based on the STOP-Bang and nocturnal pulse oximetry is a useful tool for screening OSA in patients with morbid obesity candidates for BS, decreasing the number of RPs.
La obesidad mórbida (OM), definida por un índice de masa corporal (IMC) >35kg/m2, es una enfermedad crónica que se caracteriza por el acúmulo desproporcionado de grasa. Las opciones terapéuticas son múltiples reservándose la cirugía bariátrica (CB) para los casos más graves (IMC>40kg/m2 o >35kg/m2 con una o más comorbilidades asociadas)1. Según la OMS, la prevalencia de la obesidad se ha triplicado a nivel mundial desde el año 1975 alcanzando un 13% (11% hombres y 15% mujeres) en el año 20162. En España el 18,2% de los varones y el 16,7% de las mujeres padecen obesidad según la Encuesta Nacional de Salud del año 20173.
La incidencia de apnea obstructiva del sueño (AOS) en pacientes con OM puede alcanzar el 90%4. Su coexistencia en pacientes candidatos a CB, más allá de aumentar el riesgo cardiovascular, incrementa el riesgo perioperatorio de complicaciones cardiorrespiratorias5. El tratamiento con presión positiva reduce el riesgo de estas complicaciones6 sin incrementar las quirúrgicas7. Se hace necesario, por tanto, un diagnóstico de la AOS en beneficio de los pacientes candidatos a CB.
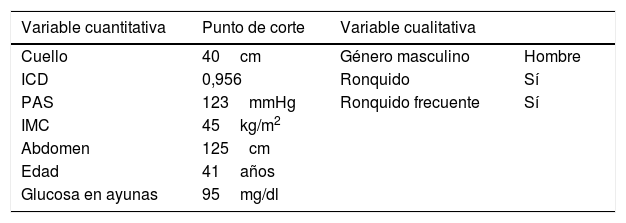
Se han descrito índices multicomponente para predecir el riesgo de presentar una AOS. El más conocido es el STOP-Bang8,9, que analiza la presencia de síntomas (roncopatía, apnea y excesiva somnolencia diurna), enfermedades asociadas (hipertensión arterial [HTA]) y otros factores relacionados (IMC, perímetro cervical, edad y género). Este cuestionario ha sido validado en individuos con obesidad y OM con una sensibilidad del 100% para AOS grave (índice de apnea/hipopnea del sueño [IAH]>30)10. Su hándicap es su baja especificidad: inferior al 20% en obesidad y 7% en OM. Las medidas antropométricas juegan un papel fundamental en la AOS, incluso en la OM, donde la localización del acúmulo de grasa determina el IAH11. El modelo de Dixon es el que incluye más variables relativas a la obesidad central. Descrito en el año 200312 y modificado en 201113, incluye 9 variables (presión arterial sistólica, índice de cintura cadera, perímetro cuello y abdominal, IMC, sexo, edad, roncopatía y glucosa en ayunas) (tabla 1).
Variables del modelo de Dixon modificado
| Variable cuantitativa | Punto de corte | Variable cualitativa | |
|---|---|---|---|
| Cuello | 40cm | Género masculino | Hombre |
| ICD | 0,956 | Ronquido | Sí |
| PAS | 123mmHg | Ronquido frecuente | Sí |
| IMC | 45kg/m2 | ||
| Abdomen | 125cm | ||
| Edad | 41años | ||
| Glucosa en ayunas | 95mg/dl |
ICD: índice cintura cadera; IMC: índice de masa corporal; PAS: pensión arterial sistólica.
La polisomnografía vigilada (PSG) es el gold standard para el diagnóstico de AOS. Una opción menos compleja, para su diagnóstico, es la poligrafía respiratoria domiciliaria (PR)14. La pulsioximetría nocturna (POX), un dispositivo que solamente analiza SatO2 y frecuencia cardiaca nocturna, también han sido estudiados y sugeridos para su uso como screening en pacientes candidatos a CB, reduciéndose hasta un 40% la realización de un estudio del sueño más complejo15. El parámetro con mayor concordancia con el IAH es el índice de desaturación >3% (IDO). La sensibilidad de este tipo de dispositivos llega al 100% con una especificidad próxima al 70%15. Planteamos por tanto un estudio prospectivo con el objetivo de estudiar el screening secuencial en pacientes OM candidatos a CB. Para ello en primer lugar comparamos la rentabilidad de los cuestionarios STOP-Bang, Dixon modificado (DXM) y los parámetros de la POX nocturna. En segundo lugar, aplicar el modelo secuencial (1.o cuestionario y 2.o POX) a nuestra cohorte de pacientes para dilucidar el número de PR que finalmente hubiesen sido necesarias realizar.
Material y métodosDiseñoEstudio de cohorte prospectivo, longitudinal, de no intervención de pacientes referidos de la Unidad de Cirugía Bariátrica (UCB) a la Unidad de Trastornos Respiratorios del Sueño (UTRS) del Hospital Royo Villanova de Zaragoza entre el 1/07/2014 y el 1/07/2015. El estudio fue aprobado por el Instituto Aragonés de Ciencias de la Salud (IACS) (CEICA número: 23/2014). Los resultados que aquí se presentan se obtuvieron siguiendo el protocolo del estudio Epigenetics dysfunction in Morbid Obesity with or without obstructive sleep apnoea: the EPIMOOSA study (ClinicalTrials.gov identifier: NCT03995836)16. De acuerdo con las recomendaciones del IACS y la Conferencia de Helsinki, se obtuvo el consentimiento informado antes de entrar en el estudio.
PoblaciónSe remitieron pacientes de entre 18 y 60años candidatos a CB bajo los criterios de selección que se muestran en la tabla 2. Los pacientes fueron manejados en la consulta de la UCB de forma habitual y sin que este estudio colateral alterara las decisiones terapéuticas en relación con el tratamiento de la enfermedad diana: la OM.
Criterios de selección
| Criterios de inclusión | Criterios de exclusión |
|---|---|
| Edad 18-60añosIMC>40kg/m2, mantenido durante 3-5 años, tras más de un año de tratamiento médico reglado sin éxitoIMC 35-40kg/m2, con comorbilidades asociadas a la OM susceptibles de mejorar con la pérdida de peso (HTA, DM, dislipemia, AOS…), tras más de un año de tratamiento médico reglado sin éxitoFirma del consentimiento informado | Trastorno respiratorio del sueño ya diagnosticado y/o tratamiento con dispositivos de presión positivaDiagnóstico de enfermedad inflamatoria sistémicaEnfermedades neoplásicas en los últimos 5añosEvento cardiovascular en los últimos 6mesesEmbarazo |
AOS: apnea obstructiva del sueño; DM: diabetes mellitus; HTA: hipertensión arterial; IMC: índice de masa corporal; OM: obesidad mórbida.
Evaluación clínica y cuestionarios. En la primera visita se registran las siguientes variables clínicas y pruebas complementarias: a) datos sociodemográficos, antecedentes médico-quirúrgicos y toma regular de fármacos; b) nivel de somnolencia diurna mediante escala de somnolencia epworth (ESE); c) peso (medido en kg), altura (medida en cm), IMC (peso (kg)/talla(m)2), perímetro de cuello (cm), abdomen (cm) y cadera (cm); d) presión arterial según el protocolo de la guía de práctica clínica europea, y e) espirometría posbroncodilatador. Para valorar la probabilidad de AOS se aplicaron los cuestionarios: STOP-Bang8 y DXM13, unificando las variables relativas a la roncopatía, quedando reducido a 9 variables.
Analítica sanguínea. En visita basal se realizó analítica sanguínea estándar, incluyendo bioquímica general, colesterol total, triglicéridos, lipoproteínas de alta (HDL) y baja densidad (LDL), hemoglobina glucosilada (HbG) y proteína C reactiva de alta sensibilidad (PCR). Alícuotas de suero, plasma y sangre entera de cada paciente fueron almacenadas a −80°C para futuras determinaciones.
Gasometría arterial. Al día siguiente de la PR se obtuvo una gasometría arterial respirando aire ambiente. Dicha prueba fue realizada en todas las ocasiones por la enfermera de la UTRS. Las muestras fueron analizadas en el mismo día, registrándose: pH, PaCO2, PaO2 (mmHg) y bicarbonato (mmol/l).
Estudio de sueño. Se utilizó el polígrafo ApneaLink vs10.20 (ResMed®, Sidney, Australia) de la UTRS, que incluye: registro continuo del flujo de aire mediante una cánula nasal, movimiento torácico, SatO2, ronquido y posición corporal. Un enfermero especializado explicó el uso del sistema y lo recogió al día siguiente. La lectura del registro fue realizada de forma manual por un técnico entrenado y desconocedor de la patología del sujeto. Se repitieron los estudios con una duración inferior a 180min tanto para la onda de pulso como para los eventos respiratorios. Definimos una apnea como la ausencia de flujo durante más de 10segundos; una hipopnea como la reducción discernible (>30% y <90%) de la amplitud de la señal respiratoria de >10segundos de duración o una disminución notoria del sumatorio toraco-abdominal que se acompaña de una desaturación (≥3%). Se calculó el IAH como la suma de apneas e hipopneas por hora del periodo de tiempo grabado. Se utilizó el análisis automático de la oximetría nocturna incluyéndose: IDO, SatO2 media y CT90%.
Análisis estadísticoSe dividió la muestra en dos grupos atendiendo: No AOS o AOS leve (IAH<15) y AOS moderada-grave (IAH>15). Los datos se presentan como media (desviación estándar) o porcentaje. No se ha asumido la normalidad, por lo que para la comparación de medias se usó un test no paramétrico: U de Mann-Whitney. Para la relación entre las distintas variables y el IAH (cuantitativa) y el diagnóstico de AOS se emplearon modelos de regresión lineal y logística. La rentabilidad diagnóstica se realizó mediante la curva receiver operating characteristic (ROC), los resultados se expresaron mediante el área bajo la curva (ABC) y sus intervalos de confianza. Para la elección de los puntos de corte óptimos para la sensibilidad y especificidad se utilizó el índice de Youden. La comparación de las curvas ROC se realizó utilizando el paquete estadístico Epidata 3.1. El análisis se llevó a cabo utilizando el paquete estadístico SPSS 20.0, Microsoft Excel 2016 y el GraphPad Prism 7. Se siguieron las recomendaciones de la guía STARD 2015 para pruebas diagnósticas17.
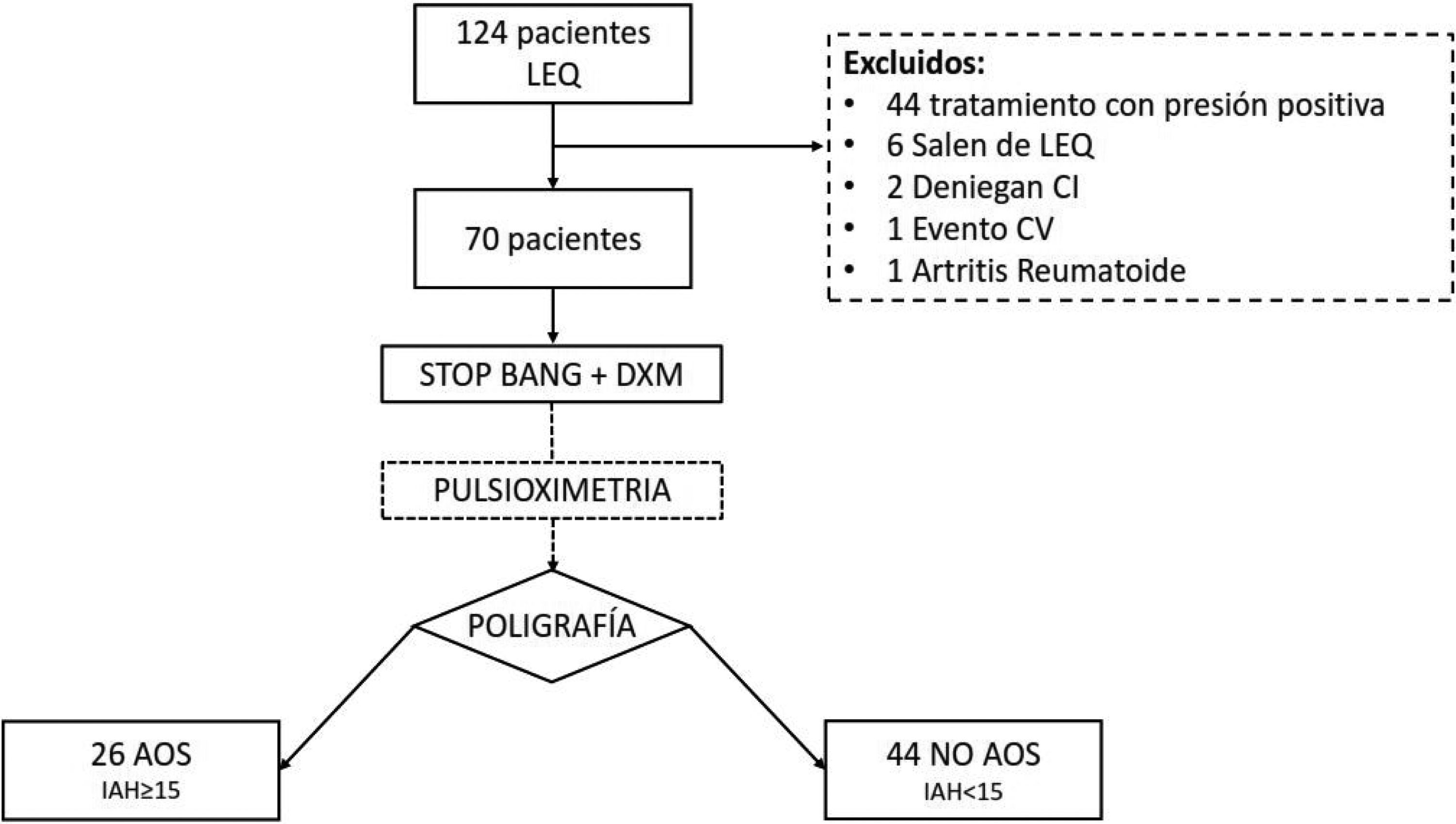
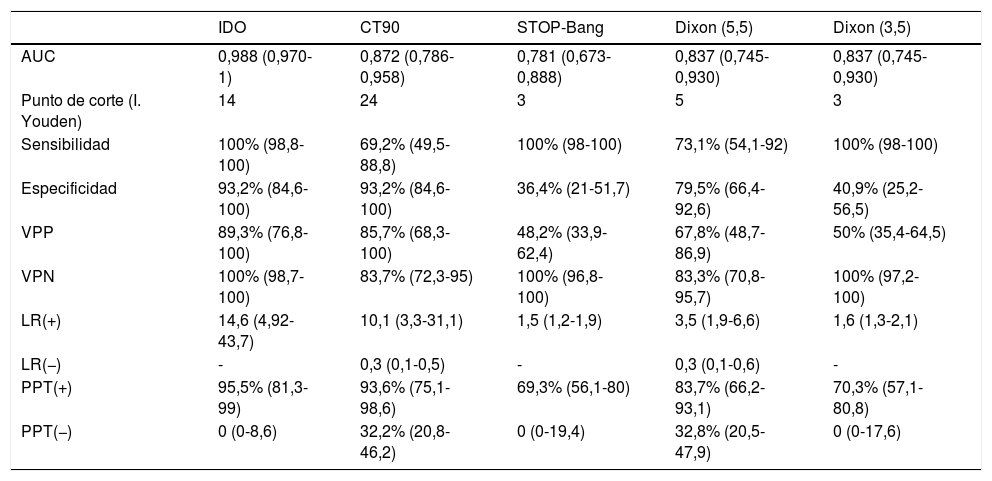
ResultadosSe remitieron 124 pacientes a la UTRS de los cuales 70 se analizaron finalmente (fig. 1). Las características del grupo se muestran en la tabla 3. Hubo 42 pacientes (60%) con un IAH>5. En 26 pacientes (37,1%) se diagnosticó una AOS moderada-grave (IAH>15). De los 70 estudios se tuvieron que repetir 8, 7 por error en el registro de cánulas nasales y uno por fallo de la POX.
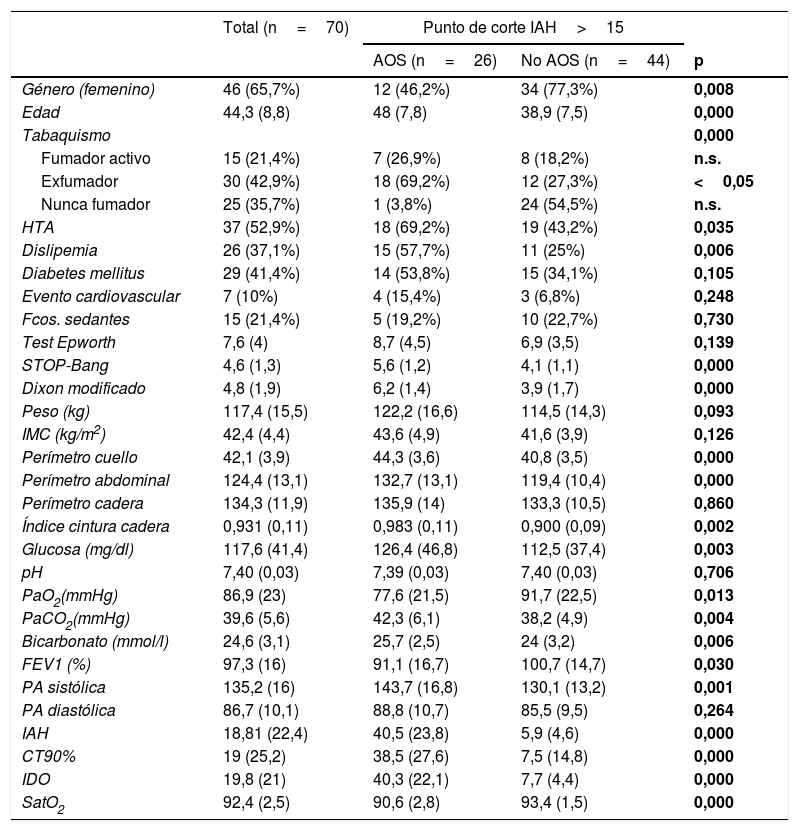
Descripción de la muestra
| Total (n=70) | Punto de corte IAH>15 | |||
|---|---|---|---|---|
| AOS (n=26) | No AOS (n=44) | p | ||
| Género (femenino) | 46 (65,7%) | 12 (46,2%) | 34 (77,3%) | 0,008 |
| Edad | 44,3 (8,8) | 48 (7,8) | 38,9 (7,5) | 0,000 |
| Tabaquismo | 0,000 | |||
| Fumador activo | 15 (21,4%) | 7 (26,9%) | 8 (18,2%) | n.s. |
| Exfumador | 30 (42,9%) | 18 (69,2%) | 12 (27,3%) | <0,05 |
| Nunca fumador | 25 (35,7%) | 1 (3,8%) | 24 (54,5%) | n.s. |
| HTA | 37 (52,9%) | 18 (69,2%) | 19 (43,2%) | 0,035 |
| Dislipemia | 26 (37,1%) | 15 (57,7%) | 11 (25%) | 0,006 |
| Diabetes mellitus | 29 (41,4%) | 14 (53,8%) | 15 (34,1%) | 0,105 |
| Evento cardiovascular | 7 (10%) | 4 (15,4%) | 3 (6,8%) | 0,248 |
| Fcos. sedantes | 15 (21,4%) | 5 (19,2%) | 10 (22,7%) | 0,730 |
| Test Epworth | 7,6 (4) | 8,7 (4,5) | 6,9 (3,5) | 0,139 |
| STOP-Bang | 4,6 (1,3) | 5,6 (1,2) | 4,1 (1,1) | 0,000 |
| Dixon modificado | 4,8 (1,9) | 6,2 (1,4) | 3,9 (1,7) | 0,000 |
| Peso (kg) | 117,4 (15,5) | 122,2 (16,6) | 114,5 (14,3) | 0,093 |
| IMC (kg/m2) | 42,4 (4,4) | 43,6 (4,9) | 41,6 (3,9) | 0,126 |
| Perímetro cuello | 42,1 (3,9) | 44,3 (3,6) | 40,8 (3,5) | 0,000 |
| Perímetro abdominal | 124,4 (13,1) | 132,7 (13,1) | 119,4 (10,4) | 0,000 |
| Perímetro cadera | 134,3 (11,9) | 135,9 (14) | 133,3 (10,5) | 0,860 |
| Índice cintura cadera | 0,931 (0,11) | 0,983 (0,11) | 0,900 (0,09) | 0,002 |
| Glucosa (mg/dl) | 117,6 (41,4) | 126,4 (46,8) | 112,5 (37,4) | 0,003 |
| pH | 7,40 (0,03) | 7,39 (0,03) | 7,40 (0,03) | 0,706 |
| PaO2(mmHg) | 86,9 (23) | 77,6 (21,5) | 91,7 (22,5) | 0,013 |
| PaCO2(mmHg) | 39,6 (5,6) | 42,3 (6,1) | 38,2 (4,9) | 0,004 |
| Bicarbonato (mmol/l) | 24,6 (3,1) | 25,7 (2,5) | 24 (3,2) | 0,006 |
| FEV1 (%) | 97,3 (16) | 91,1 (16,7) | 100,7 (14,7) | 0,030 |
| PA sistólica | 135,2 (16) | 143,7 (16,8) | 130,1 (13,2) | 0,001 |
| PA diastólica | 86,7 (10,1) | 88,8 (10,7) | 85,5 (9,5) | 0,264 |
| IAH | 18,81 (22,4) | 40,5 (23,8) | 5,9 (4,6) | 0,000 |
| CT90% | 19 (25,2) | 38,5 (27,6) | 7,5 (14,8) | 0,000 |
| IDO | 19,8 (21) | 40,3 (22,1) | 7,7 (4,4) | 0,000 |
| SatO2 | 92,4 (2,5) | 90,6 (2,8) | 93,4 (1,5) | 0,000 |
Los valores se han expresado en forma de media (desviación estándar) para las variables cuantitativas y número (porcentaje) para las cualitativas. Se han estudiado las diferencias con los estadísticos Chi cuadrado para las variables cualitativas y U de Mann-Whitney para la comparación entre medias.
AOS: apnea obstructiva del sueño; CT90%: porcentaje de tiempo con SatO2; HTA: hipertensión arterial; IAH: índice de apnea/hipopnea del sueño; IDO: índice de desaturación de oxígeno; IMC: índice de masa corporal; n.s.: no significativo; PA: presión arterial.
Las diferencias entre el grupo con/sin AOS se muestran en la tabla 3. En el grupo con AOS hubo una incidencia similar en ambos sexos, con un predominio en los varones con 14 pacientes (53,8%). En el grupo sin AOS el sexo femenino fue el mayoritario. La incidencia de factores de riesgo cardiovascular (FRCV) fue superior para los AOS, salvo para la diabetes mellitus (DM). En cuanto a las variables antropométricas, el grupo con AOS presentó un IMC superior, aunque sin diferencias estadísticas. Los parámetros relativos a la distribución central de la grasa (perímetro abdominal, cuello e índice de cintura cadera) fueron superiores en el grupo con AOS. Se obtuvo una gasometría en 63 pacientes (en 7 de ellos la muestra no pudo ser analizada). Hubo 7 pacientes con una PaCO2 superior a 45mmHg y que fueron diagnosticados de síndrome de hipoventilación obesidad (SHO) (fig. 2).
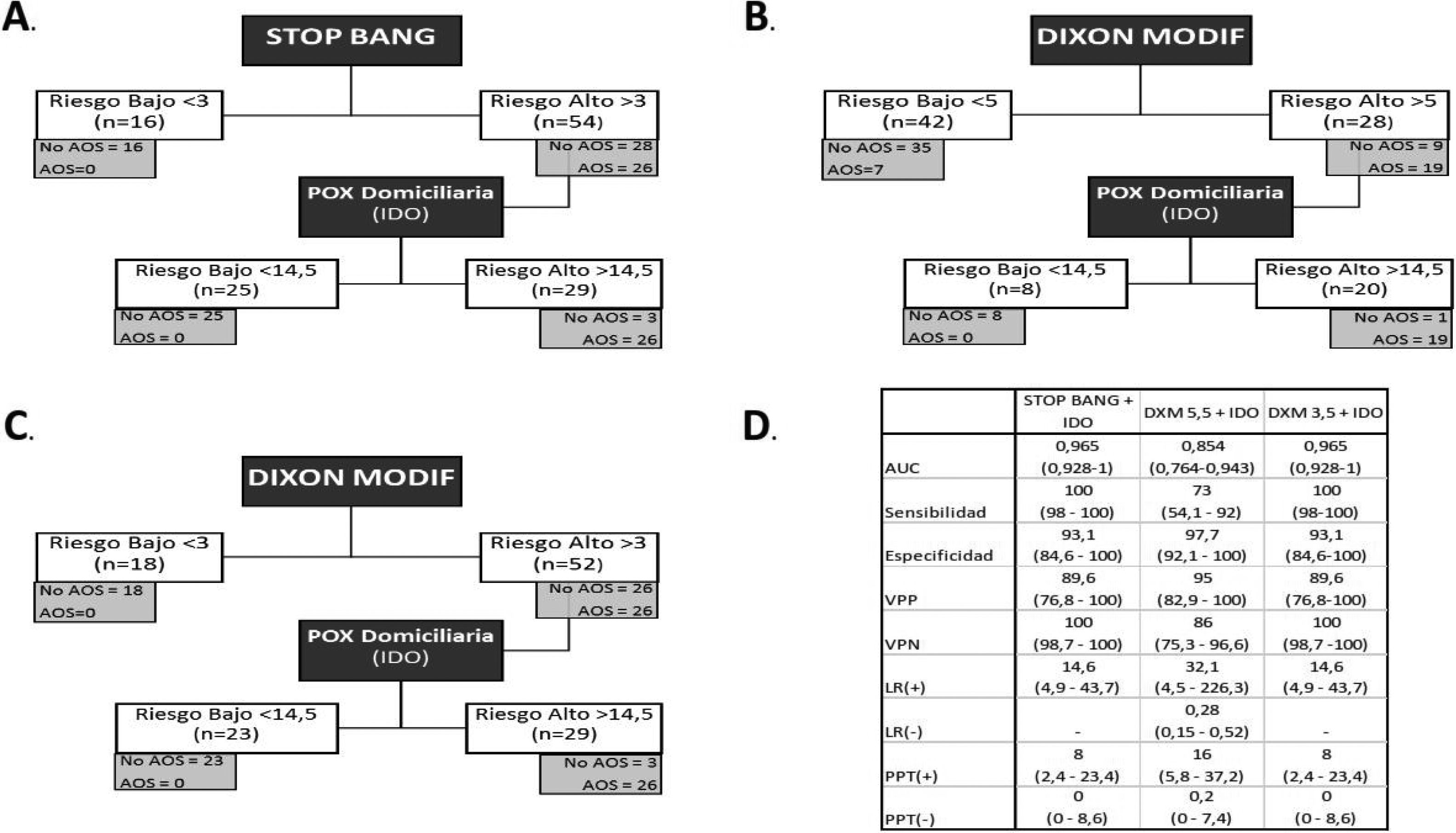
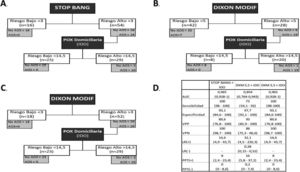
Análisis del modelo secuencial. A) Modelo secuencial con STOP-Bang y pulsioximetría. B) Modelo secuencial con Dixon modificado (punto de corte 5) y pulsioximetría. C) Modelo secuencial con Dixon modificado (punto de corte 3) y pulsioximetría. D) Análisis de pruebas diagnósticas de los distintos modelos secuenciales.
En la tabla 4 se muestra el análisis de la capacidad diagnóstica de cada uno de los parámetros de la POX y de los cuestionarios. Obtuvieron una mayor AUC los parámetros de la oximetría nocturna con unas diferencias estadísticamente significativas a favor del IDO frente al CT90 (p=0,0041) y a los cuestionarios STOP-Bang (p=0,0000) y DXM (p=0,0004). El DXM obtuvo mejor AUC que el STOP-Bang, si bien las diferencias no fueron estadísticamente significativas (p=0,212). El punto de corte óptimo para STOP-Bang (>3) arrojó una sensibilidad del 100%, mientras que DXM (>5) fue del 73%. Con DXM hubo que reducir el punto de corte hasta 3 para alcanzar el 100% de sensibilidad.
Análisis individualizado de las pruebas diagnósticas
| IDO | CT90 | STOP-Bang | Dixon (5,5) | Dixon (3,5) | |
|---|---|---|---|---|---|
| AUC | 0,988 (0,970-1) | 0,872 (0,786-0,958) | 0,781 (0,673-0,888) | 0,837 (0,745-0,930) | 0,837 (0,745-0,930) |
| Punto de corte (I. Youden) | 14 | 24 | 3 | 5 | 3 |
| Sensibilidad | 100% (98,8-100) | 69,2% (49,5-88,8) | 100% (98-100) | 73,1% (54,1-92) | 100% (98-100) |
| Especificidad | 93,2% (84,6-100) | 93,2% (84,6-100) | 36,4% (21-51,7) | 79,5% (66,4-92,6) | 40,9% (25,2-56,5) |
| VPP | 89,3% (76,8-100) | 85,7% (68,3-100) | 48,2% (33,9-62,4) | 67,8% (48,7-86,9) | 50% (35,4-64,5) |
| VPN | 100% (98,7-100) | 83,7% (72,3-95) | 100% (96,8-100) | 83,3% (70,8-95,7) | 100% (97,2-100) |
| LR(+) | 14,6 (4,92-43,7) | 10,1 (3,3-31,1) | 1,5 (1,2-1,9) | 3,5 (1,9-6,6) | 1,6 (1,3-2,1) |
| LR(−) | - | 0,3 (0,1-0,5) | - | 0,3 (0,1-0,6) | - |
| PPT(+) | 95,5% (81,3-99) | 93,6% (75,1-98,6) | 69,3% (56,1-80) | 83,7% (66,2-93,1) | 70,3% (57,1-80,8) |
| PPT(−) | 0 (0-8,6) | 32,2% (20,8-46,2) | 0 (0-19,4) | 32,8% (20,5-47,9) | 0 (0-17,6) |
Entre paréntesis se muestran los intervalos de confianza.
AUC: área bajo la curva; CT90: porcentaje de tiempo con SatO2; IDO: índice de desaturación de oxígeno; LR(+): tasa de verosimilitud positiva; LR(−): tasa de verosimilitud negativa; PPT(+): probabilidad postest positiva; PPT(−): probabilidad postest negativa; VPP: valor predictivo positivo; VPN: valor predictivo negativo.
El modelo secuencial que comienza con el STOP-Bang >3 hubiese excluido correctamente a 16 pacientes (22,8%). Los 54 restantes se hubiesen sometido a una POX, de los cuales 25 (46,2%) hubiesen sido clasificados como de riesgo bajo. Los 29 restantes (41,4%), de los 70 primeros, serían los candidatos finales para someterse a una PR/PSG, evitándose 41 (58,5%) (fig. 2).
Se analiza el modelo secuencial iniciado con DXM con los puntos de corte óptimos calculados según el índice de Youden (>5) y el que consigue una sensibilidad del 100% (>3,5). En el primero, tras la aplicación del modelo se etiquetó como de bajo riesgo a 42 pacientes (60%). De ellos, 7 (16,6%) fueron etiquetados erróneamente como de bajo riesgo, ya que realmente padecían una AOS. Tras aplicar el punto de corte de la POX nocturna, 20 pacientes (28,5%), de los 70 primeros, hubiesen precisado una PR/PSG, evitándose 50 (71,4%).
Utilizando el punto de corte 3 para el modelo DXM, en la primera fase se hubiese excluido a 18 pacientes (25,7%) al ser de bajo riesgo, quedando 52 a los que se hubiese realizado la POX. Dicha prueba hubiese excluido a 23 (44,2%) clasificándolos como de bajo riesgo, quedando 29 (41,4%) que serían los que se someterían finalmente a la PR/PSG, evitándose 41 (58,5%).
DiscusiónEn nuestra cohorte la aplicación de un modelo secuencial con un cuestionario seguido de una POX habría reducido considerablemente el número de PR. Hasta la fecha este es el primer estudio que analiza un modelo secuencial para el screening de AOS en una población con elevada prevalencia de la misma. El modelo de DXM, con un mayor número de variables antropométricas, obtiene una mejor AUC pero no es estadísticamente superior al cuestionario STOP-Bang como método de screening. El IDO es el que mayor rentabilidad diagnóstica posee y por tanto debería incluirse en el protocolo de screening de pacientes OM candidatos a CB.
La prevalencia de AOS en nuestra cohorte de pacientes es del 60%, similar a la descrita en otros estudios18,19, con un predominio claro del sexo femenino, si bien la incidencia de AOS es mayor en el sexo masculino. Los FRCV: HTA y dislipemia son superiores en el grupo con AOS moderada-grave. La DM y los antecedentes cardiovasculares, como ocurre en otros estudios20, no presentan diferencias significativas entre ambos grupos, posiblemente por la potente señal cardiovascular de la obesidad. La incidencia de SHO en nuestro estudio fue superior a la descrita en otros estudios21, aunque no es habitual que incluyan una gasometría para confirmarlo.
La AOS presenta una sintomatología fácilmente reconocible, como son la roncopatía, las apneas y la excesiva somnolencia diurna22. Este síntoma presenta una estrecha relación con la OM independientemente de la presencia de AOS23. Los síntomas nocturnos, en especial la roncopatía, son inespecíficos, y su etiología variable. Desde el punto de vista antropométrico también se han encontrado estrechas relaciones entre el IMC, los perímetros abdominal o cervical (entre otras) con el IAH24. Además, los pacientes que padecen AOS tienen un mayor riesgo de sufrir otros FRCV como la HTA, dislipemia o DM4.
Los cuestionarios demostraron relación con el IAH y el diagnóstico de AOS. El DXM presentó un mayor poder predictor frente al STOP-Bang, así como una mayor AUC, aunque sin diferencias significativas. La sensibilidad del STOP-Bang fue mayor que la del modelo de DXM para los puntos de corte óptimos indicados por el índice de Youden. Para obtener la misma sensibilidad en el DXM habría que reducir el punto de corte hasta 3, lo que supone un descenso considerable de la especificidad. El cuestionario STOP-Bang se recomienda como screening de AOS en CB7. Su sensibilidad para la discriminación de AOS moderada-grave oscila entre el 85 y 100% según el estudio10,25, aunque también ha sido puesta en duda por otros autores al obtener sensibilidades menores26. En nuestro análisis comparativo entre STOP-Bang y DXM tiene mayor AUC este último, aunque las diferencias no fueron significativas.
Se han analizado otros cuestionarios y modelos matemáticos como screening. Descartamos la ESE por la elevada incidencia de somnolencia diurna en pacientes con OM. La fórmula propuesta por Palla et al.20 incorpora la ESE junto a otras 3 variables (sexo, edad y SatO2 mínima), alcanzando sensibilidades próximas al 100%. En un análisis de 4 modelos matemáticos, donde se incorporaban variables como el IMC y el perímetro cervical, aumentaban la precisión diagnóstica, pero con una pobre especificidad27. Otros cuestionarios como el score multivariate apnea predictor (MAP), pese a tener una aceptable sensibilidad, se han descartado por su bajo valor predictivo negativo28.
Todos esos cuestionarios, realizados en su mayoría en población con obesidad, no incorporan factores determinantes en el desarrollo de AOS en pacientes con OM. Las medidas antropométricas son capaces de explicar el 20% del IAH, y dichas medidas deben incluir las referidas a obesidad central: perímetro cervical y abdominal junto con el índice de cintura cadera11. El único modelo encontrado que tenga en cuenta estos 3 parámetros es el modelo desarrollado por Dixon en 2003 y modificado por Kolotkin. El modelo de Kolotkin obtuvo un ABC=0,821 con una sensibilidad del 77% y 85% para IAH>15 e IAH>30, respectivamente. La sensibilidad del modelo de Dixon fue superior a la del modelo de Kolotkin, alcanzando el 89% para IAH>15 y el 96% para el IAH>30.
Las variables oximétricas utilizadas en este estudio fueron el IDO, CT90% y SatO2 media. El IDO fue el que mejor correlación y precisión diagnóstica demostró. Su utilidad como screening en una cohorte con OM ya ha sido demostrada15, alcanzando un ABC=0,950 para el IDO3% y ABC=0,910 para el CT90%, con una sensibilidad para ambas del 100%, pero con una especificidad muy baja. Los pulsioxímetros son de fácil lectura e interpretación y no requieren un análisis exhaustivo de los parámetros registrados, facilitando su uso como screening. El uso secuencial de la POX seguida de la PG ha sido estudiado en una cohorte de pacientes con sospecha clínica de AOS demostrando su utilidad29, si bien el inconveniente de dicha estrategia radica en que todos los pacientes deberían pasar por el laboratorio del sueño.
Por ello planteamos un modelo de aplicación en dos niveles: en la consulta con el cuestionario y en el domicilio del paciente con la POX nocturna. Su aplicación hubiese evitado un 59% de PR, por encima de lo publicado por de Vries et al.15. Este modelo ha sido estudiado en población general con los cuestionarios OSA-50 y Philips, alcanzando sensibilidades del 91 y 100% y reduciendo significativamente el número de PR a realizar30,31. Un análisis parecido se llevó a cabo en una cohorte de 141 pacientes candidatos a CB21, donde se escogió como punto de corte para el STOP-Bang>4. A aquellos pacientes con riesgo elevado se les realizó una POX, con lo que directamente se daba el diagnóstico de AOS. Este estudio presenta un importante sesgo metodológico ya que no se ha comprobado con el gold standard ni con una PR la incidencia de AOS. En nuestro estudio la aplicación del modelo secuencial soluciona el problema de la baja especificidad situándola por encima del 95%, manteniendo la sensibilidad del 100%. Según la literatura revisada, este es el primer estudio en analizar un modelo secuencial para screening de AOS en OM candidatos a CB.
Este estudio presenta limitaciones como su carácter unicéntrico afectando su validez externa. Los datos de la POX se han obtenido del registro de PR y no con un dispositivo independiente. No se ha contado con el gold standard para el diagnóstico de los trastornos respiratorios del sueño: la PSG. Otra de las limitaciones se encuentra en los criterios de exclusión, retirando del estudio a los pacientes a quienes ya se les había hecho un estudio del sueño. Comparando con otros estudios la incidencia de AOS es menor, lo que puede sobreestimar los resultados alcanzados.
ConclusiónEn definitiva, el modelo secuencial que combina el STOP-Bang en primer lugar seguido de la POX es el que mejores resultados ofrece para discriminar a los pacientes OM con AOS (IAH>15). Individualmente, ningún cuestionario fue superior a la POX para el screening de AOS. EL screening secuencial aumenta la especificidad manteniendo una elevada sensibilidad y reduciendo la necesidad de PR/PSG. Se hace necesario un estudio multicéntrico para la validación de este modelo secuencial, que incluya el cuestionario STOP-Bang y POX, como screening de AOS en OM candidatos a CB.
FinanciaciónEste Proyecto de investigación ha sido becado por FIS (15/01940), Sociedad Española de Patología del Aparato Respiratorio (SEPAR-2017) y Sociedad Aragonesa de Aparato Respiratorio (SADAR-2016).
AutoríaJL y JMM diseñaron el estudio; JL, PC, SS, CC y JF registraron los datos y analizaron las pruebas complementarias; JL y JMM realizaron el análisis final de los datos; JL y JMM escribieron el presente manuscrito, que ha sido revisado y aprobado por el resto de los autores.
Conflicto de interesesNi el autor principal ni el resto de autores declaran tener ningún conflicto de intereses con el presente artículo.
A mis compañeros del servicio de neumología del Hospital Royo Villanova.