Los feocromocitomas y paragangliomas son tumores poco frecuentes cuyos síntomas más conocidos son hipertensión arterial, palpitaciones, cefalea y diaforesis. Sin embargo, su identificación clínica no es fácil. Por ello, se utilizan pruebas bioquímicas que permitan un diagnóstico precoz, destacando las metanefrinas. El objetivo de este estudio fue evaluar el rendimiento diagnóstico de las metanefrinas libres plasmáticas (MLP) y verificar la transferibilidad de los valores de referencia utilizados.
MétodosLas MLP fueron cuantificadas mediante cromatografía líquida de alta resolución acoplada a espectrometría de masas. Otras pruebas bioquímicas evaluadas (catecolaminas en plasma, metanefrinas, catecolaminas y ácido vanilmandélico en orina) fueron analizadas por cromatografía líquida de alta resolución con detección electroquímica. Se revisaron las solicitudes de dichas pruebas del 01/09/2015 al 31/10/2017 y se estimaron los valores de referencia (documento EP28-A3c) y los parámetros de variabilidad biológica (método de Fraser) de las MLP.
ResultadosSe estudiaron 1.279 pacientes (61,3% mujeres), con edades entre 0-90 años, incluyendo 19 casos de feocromocitoma/paraganglioma. Las solicitudes bioquímicas fueron: MLP (n=662), catecolaminas urinarias (n=589), metanefrinas urinarias (n=586), ácido vanilmandélico urinario (n=513) y catecolaminas plasmáticas (n=228). Las pruebas con mayor sensibilidad fueron las metanefrinas fraccionadas urinarias (91,7%) y las MLP (82,4%). Cuando se comparó el rendimiento en pacientes con ambas pruebas (n=243), estas detectaron los mismos casos (90,9%), pero las MLP fueron más específicas (93,5 vs. 88,8%). Para la normetanefrina plasmática se observó una asociación significativa con la edad (rho=0,19; p<0,0001).
ConclusiónLas MLP y las metanefrinas fraccionadas urinarias son las pruebas bioquímicas que ofrecen un mayor rendimiento en el diagnóstico de los feocromocitomas/paragangliomas.
Pheochromocytoma and paraganglioma are uncommon tumors whose best known symptoms include high blood pressure, palpitations, headache, and sweating. Clinical identification is not easy, however, and requires biochemical tests that allow for early diagnosis, including measurement of metanephrines levels. The aim of this study was to assess the diagnostic performance of plasma free metanephrines (PMETs) and to verify the transferability of the reference values used.
MethodsPMETs levels were measured by liquid chromatography coupled to tandem mass spectrometry. Other biochemical tests evaluated (plasma catecholamine, urine metanephrine, catecholamine and vanilmandelic acid levels) were performed by liquid chromatography with electrochemical detection. Requests of these tests from 01/09/2015 to 31/10/2017 were reviewed, and both the reference values (document EP28-A3c) and the parameters of biological variation (Fraser method) for PMETs were estimated.
ResultsThe study sample consisted of 1,279 patients (61.3% females) aged 0-90 years, including 19 with pheochromocytoma/paraganglioma. Tests requested included: PMETs (n=662), catecholamines (n=589), metanephrines (n=586), and vanilmandelic acid (n=513) in urine, and plasma catecholamines (n=228). Tests with higher sensitivity were urinary fractionated metanephrines (91.7%) and PMETs (82.4%). When performance was compared in patients with both tests (n=243), they detected the same number of tumors (90.9%), but PMETs showed greater specificity (93.5% vs 88.8%). Plasma normetanephrine levels showed a significant association with age (rho=0.19, P<.0001).
ConclusionPMETs and urinary fractionated metanephrines are the biochemical tests with better performance in diagnosis of pheochromocytomas/paragangliomas.
Los feocromocitomas (FEO) y paragangliomas (PGL) son tumores poco frecuentes, entre 1 y 2 casos por 100.000 habitantes y año, que se forman mayoritariamente a partir de las células cromafines del sistema nervioso simpático1. Estos tumores están localizados en la médula suprarrenal (FEO, 80-85%) o en los ganglios del sistema nervioso simpático del tórax, abdomen y pelvis (PGL, 15-20%), y suelen producir cantidades anormalmente elevadas de catecolaminas y de sus metabolitos. Los PGL localizados en la cabeza y en la base del cráneo tienen un origen parasimpático2.
Los signos y síntomas típicos de los FEO/PGL son bien conocidos, aunque poco específicos. La secreción episódica de catecolaminas es la responsable de la mayoría de estos síntomas, incluyendo grandes fluctuaciones en los valores de presión arterial3,4 y la tríada clásica de palpitaciones (58%), cefalea (52%) y diaforesis (49%)5. Sin embargo, tan solo el 30-40% de los pacientes van a presentar estos 3 síntomas3,6. Además, la identificación clínica de un FEO/PGL no es fácil, ya que aproximadamente la mitad de los pacientes presentan hipertensión arterial (HTA) paroxística o normotensión7,8, y los estudios de autopsias muestran que aproximadamente un 0,05% de los fallecidos presentan un FEO/PGL no diagnosticado9. Actualmente, se considera que hasta un 40% de los FEO/PGL son hereditarios, siendo el 60% restante casos espontáneos10.
Los FEO/PGL se producen con mayor frecuencia en individuos con edades comprendidas entre los 40 y 50 años, con una incidencia ligeramente superior en mujeres (55%)11. Presentan una prevalencia diferente según la población estudiada. Así, en población general la prevalencia de FEO/PGL es inferior al 0,1%8, en pacientes con HTA aumenta hasta un 0,2-0,6%, y en pacientes con un incidentaloma suprarrenal suele ser de un 3-7%2, pudiendo llegar a un 20%12.
Las causas más comúnmente indicadas para el estudio bioquímico de un FEO/PGL son: la presencia de HTA y síntomas episódicos de exceso de catecolaminas, HTA resistente al tratamiento, determinar la funcionalidad de un incidentaloma adrenal, la predisposición genética, descartar la recurrencia de un tumor13, pacientes jóvenes con HTA, y pacientes con antecedentes de crisis hipertensivas durante la anestesia. Los métodos bioquímicos tradicionalmente utilizados han sido el análisis del ácido vanilmandélico (AVM), catecolaminas y metanefrinas (MN) totales urinarias, así como la determinación de las catecolaminas plasmáticas.
Sin embargo, en los últimos años varias publicaciones han mostrado que las MN fraccionadas en orina de 24h y las metanefrinas libres plasmáticas (MLP) son pruebas bioquímicas con un mayor rendimiento diagnóstico14–18.
De hecho, según las recomendaciones actuales de la Sociedad Americana de Endocrinología, el estudio bioquímico inicial de un FEO/PGL debe incluir la medida de una de estas 2 pruebas19.
Dado que los FEO/PGL son tumores potencialmente mortales, especialmente si el paciente desarrolla una crisis adrenérgica, el diagnóstico temprano es muy importante20. La disponibilidad de pruebas bioquímicas con un buen rendimiento diagnóstico, y en las que la extracción de la muestra sea rápida y sencilla, resultaría muy útil para conseguir este diagnóstico precoz. El laboratorio de Medicina del Servicio de Bioquímica Clínica del Hospital Universitario Central de Asturias (HUCA) ha sido, según nuestro conocimiento, el primer laboratorio de España en incorporar la determinación por espectrometría de masas de las MLP a su cartera de servicios. El objetivo del presente trabajo fue la validación clínica de la prueba de MLP, implantada en el año 2015, mediante la revisión del rendimiento diagnóstico de esta prueba a lo largo de sus 2 primeros años de utilización y comparación de dicho rendimiento con el obtenido con otras pruebas bioquímicas clásicas utilizadas con el mismo fin. Además, se verificó la transferibilidad de los valores de referencia utilizados para la MN y normetanefrina (NMN) plasmáticas y se estimaron sus parámetros de variabilidad biológica.
Materiales y métodosCondiciones preanalíticasLa extracción de la muestra para la determinación de las MN y catecolaminas plasmáticas se realizó en un tubo de tapón malva (conteniendo K3-EDTA). Para dicha extracción se solicita que el paciente no haya comido previamente chocolate, plátanos, vainilla, piña, nueces, café o té. Tampoco debe haber ingerido bebidas alcohólicas. Además, se solicita la supresión de medicamentos como levodopa, hidracina y sus derivados, inhibidores de la monoaminooxidasa y prodorperazina. La extracción se realizó con el paciente en posición supina tras un reposo mínimo de 15min.
La determinación de las MN, catecolaminas y AVM urinarios se realizó en orinas de 24h recogidas en envases específicos de 3L, color topacio, con toma de vacío, que contienen 10mL de HCl 6N como conservante estabilizador.
Métodos analíticosLas MLP fueron cuantificadas en un espectrómetro de masas de triple cuadrupolo, modelo QTRAP 5500 (AB Sciex), acoplado a un cromatógrafo de líquidos, modelo Ekspert ultra LC 100 (Eksigent). El método fue desarrollado y validado en nuestro laboratorio. Brevemente, incluye una separación inicial de las MN (500μL de plasma-EDTA) por medio de cartuchos de extracción en fase sólida (SampliQ WCX, 30mg, 1ml [Agilent]). Una vez extraídas, las MN son separadas cromatográficamente (en gradiente) mediante el uso de 2 fases móviles: formiato amónico con ácido fórmico al 0,2%, pH=3,2 (solución A) y metanol con ácido fórmico al 0,2% (solución B). Estas fases móviles se preparan con reactivos de alta pureza: metanol LiChrosolv® (Merck-Millipore), agua ultrapura Milli-Q®, ácido fórmico Suprapur® (Merck-Millipore) y formiato amónico, pureza≥99% (Fluka). La precolumna y columna cromatográfica utilizadas fueron: Pursuit 3 PFP MetaGuard 10×2mm y Pursuit 3 PFP, 2×150mm (Agilent), respectivamente. Los calibradores son preparados a partir de material de referencia certificado: Catecholamine Mix 2 (Metanephrines) solution (Sigma-Aldrich). Además, también se utilizan patrones internos marcados isotópicamente (deuterados) para la normalización de todos los pasos del proceso analítico: (±)-Metanephrine-D3 hydrochloride solution y (±)-Normetanephrine-D3 hydrochloride solution, 100μg/mL en metanol (Sigma-Aldrich). Para el manejo del espectrómetro de masas y el análisis de los resultados se utilizan los programas informáticos: Analyst® (versión 1.6.2) y MultiQuantTM (versión 2.1.1296.0).
La linealidad del método es de 20-2.000pg/mL, tanto para MN como NMN, con coeficientes de correlación (r2)>0,995. Los coeficientes de variación (CV) interensayo son≤4,1% y 6,2%, para MN y NMN, respectivamente. El límite de cuantificación fue establecido en 20pg/mL.
El resto de las pruebas bioquímicas evaluadas (catecolaminas en plasma y MN, catecolaminas y AVM en orina) fueron analizadas por medio de métodos analíticos comerciales previamente implantados en nuestro laboratorio. En concreto, estas pruebas son cuantificadas por medio de cromatografía líquida de alta resolución con detección electroquímica. El equipo utilizado es un cromatógrafo de líquidos, modelo 1200 series (Agilent) con detector electroquímico, modelo 1640 (Bio-Rad®). Los kits utilizados para la preparación y análisis de las muestras son de Bio-Rad®.
Los valores de referencia utilizados para todas estas pruebas son: <100 y <165pg/mL (para MN y NMN plasmáticas, respectivamente), 10-67 y 95-446pg/mL (para epinefrina y norepinefrina plasmáticas, respectivamente), 64-302 y 162-528μg/24h (para MN y NMN urinarias, respectivamente), 0,6-20 y 15-80μg/24h (para epinefrina y norepinefrina urinarias, respectivamente) y 1,8-6,7mg/24h (para AVM en orina).
PacientesSe llevó a cabo una revisión de las historias clínicas de los pacientes indicados a continuación, con la intención de determinar si presentaban o habían presentado un FEO/PGL, en base a los informes médicos, pruebas de imagen y resultados de anatomía patológica:
- Criterios de inclusión: pacientes con muestra de orina de 24horas y/o plasma recibida en el Servicio de Bioquímica Clínica del HUCA, entre el 1 de septiembre de 2015 y el 31 de octubre de 2017 (25 meses), y con solicitud de al menos una las siguientes pruebas: MLP, catecolaminas en plasma, MN, catecolaminas y AVM en orina.
- Criterios de exclusión: se excluyeron aquellos pacientes en los que no pudieron obtenerse datos de la historia clínica.
Para la revisión de las historias clínicas digitales se utilizaron los programas informáticos: PowerChart de Cerner Millennium®, para la revisión de las historias clínicas de los pacientes atendidos en el HUCA, y Cerner Selene®, para la revisión de las historias clínicas de los pacientes atendidos en otros hospitales comarcales del Servicio de Salud del Principado de Asturias que derivan estas pruebas a nuestro servicio por ser el hospital de referencia.
En el periodo de estudio se recibió solicitud de alguna de las pruebas bioquímicas seleccionadas de 1.794 pacientes. Sin embargo, solo se pudo acceder al 71,3% de las historias clínicas (1.279 pacientes), ya que el resto fueron pacientes atendidos en los hospitales comarcales y que no habían recibido atención sanitaria previa en el HUCA.
Esta situación hizo que no fuera posible tener acceso a sus historias clínicas digitales desde el PowerChart de Cerner Millennium®.
Los 1.279 pacientes con historia conocida tenían una edad comprendida entre los 0 y 90 años. La mediana fue de 60 años, con un rango intercuartílico entre 49 y 70 años. El 61,3% fueron mujeres. Las solicitudes de pruebas bioquímicas en estos pacientes fueron: MLP (n=662), catecolaminas urinarias (n=589), MN fraccionadas urinarias (n=586), AVM urinario (n=513) y catecolaminas plasmáticas (n=228). En aquellos pacientes a los que se les determinó alguna de estas pruebas más de una vez en el periodo de estudio, se utilizó el primero de los resultados bioquímicos.
Los motivos de estos estudios bioquímicos fueron: masa suprarrenal (n=445; 34,8%), HTA (n=234; 18,3%), sospecha o presencia de un tumor neuroendocrino (TNE) distinto de un FEO/PGL (n=186; 14,5%), «tríada» (cefalea, diaforesis y/o palpitaciones) (n=73; 5,7%), FEO/PGL (n=64; 5,0%), trastorno genético (n=44; 3,4%), y otros motivos (n=233; 18,3%). Por lo tanto, más de la mitad de las peticiones (53,1%) correspondieron a pacientes con una masa suprarrenal o HTA. Los principales motivos de estudio en los pacientes con HTA fueron: crisis hipertensiva, HTA de difícil control y/o resistente a fármacos, HTA en paciente joven y descartar una causa secundaria de HTA en pacientes con enfermedad renal crónica o cardiopatía. Los pacientes en los que el motivo de estudio ha sido un FEO/PGL, TNE o tumor carcinoide fueron en muchos casos pacientes con un tumor ya conocido y a seguimiento o simples sospechas clínicas que no se confirmaron posteriormente. Muchos de los pacientes con un posible TNE fueron estudiados en el contexto de una sospecha de tumor carcinoide, al presentar «flushing» y/o trastornos digestivos (fundamentalmente diarrea crónica y pérdidas de peso pronunciadas).
Finalmente, en el periodo de estudio se detectaron 19 casos de FEO/PGL (13 FEO y 6 PGL; 13 de estos casos fueron diagnosticados en mujeres y 6 en hombres), los cuales fueron diagnosticados mediante una combinación de resultados bioquímicos y de pruebas de imagen y posteriormente confirmados mediante estudio anatomopatológico (marcadores inmunohistoquímicos) tras ser intervenidos.
La variabilidad biológica para la MN y la NMN fue estimada utilizando muestras seriadas de plasma (n=25), correspondientes a 8 individuos (3 muestras por paciente a excepción de un individuo con 4 muestras), 7 hombres y una mujer, y con edades comprendidas entre los 19 y 82 años. Se trata de pacientes seguidos periódicamente por presentar una mutación en el gen RET (n=5) o una masa suprarrenal (n=3), sin crecimiento ni funcionalidad.
Cálculos estadísticosSe revisó la idoneidad de los valores de referencia utilizados para las MLP (<100pg/mL para MN y <165pg/mL para NMN), los cuales fueron valores establecidos internamente y utilizados por la Clínica Mayo de Rochester (https://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/81609) y publicados en la literatura21. Para ello, se utilizaron los resultados de todos los pacientes con solicitud de MLP en el periodo de estudio y sin presencia de FEO/PGL, y se aplicaron una serie de análisis estadísticos con MedCalc®, versión 12.5.
La búsqueda de valores aberrantes se realizó por medio del test de Reed. Para comprobar si las distribuciones de valores se ajustaban a una distribución normal se aplicó el test de Kolmogorov-Smirnov. Dado que los valores de MN y NMN no seguían una distribución normal, para el resto de los análisis se utilizaron pruebas no paramétricas. Así, para la comparación de 2 o más grupos de valores de variables independientes se utilizaron las pruebas U de Mann-Whitney y de Kruskal-Wallis, respectivamente. La asociación entre variables fue establecida mediante el coeficiente de correlación de Spearman. Finalmente, los valores de referencia fueron estimados según las recomendaciones del documento EP28-A3c del Clinical and Laboratory Standards Institute, guía que proporciona pautas metodológicas y procedimientos estadísticos para establecer y verificar valores e intervalos de referencia para métodos analíticos cuantitativos de pruebas clínicas22.
Los valores de referencia fueron calculados utilizando el método no paramétrico, para lo cual los datos deben ser ordenados de menor a mayor. A continuación, se definen los límites de referencia como los percentiles 2,5 y 97,5 de los datos previamente ordenados.
Es decir, si tenemos los datos (x=1…n) ordenados del 1 al n, el número de orden se obtiene según la siguiente fórmula:
El dato correspondiente a ese número de orden o al número entero más próximo es el límite de referencia obtenido. En este caso, para los MLP se utilizó únicamente el límite de referencia superior.
Por otro lado, se estimaron los parámetros de variabilidad biológica para MN y NMN, de acuerdo al método de Fraser23. Los CV intra- (CVI) e interindividuales (CVG) fueron calculados con las siguientes fórmulas:
donde S2A+I es la varianza experimental obtenida con los resultados de cada individuo, S2A es la varianza analítica, S2T es la varianza total obtenida con los resultados de todos los individuos y M es la concentración media.
El índice de individualidad (II), fue calculado según la siguiente fórmula24:
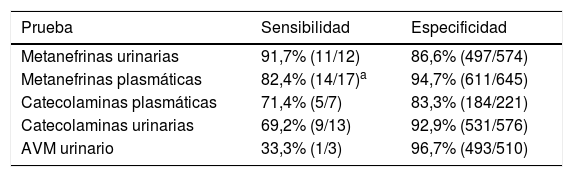
ResultadosRendimiento diagnóstico bioquímicoEl rendimiento diagnóstico de las diferentes pruebas bioquímicas, y por orden decreciente en sensibilidad, fue el descrito en la tabla 1. Las pruebas que presentaron una mayor sensibilidad fueron las MN fraccionadas urinarias (91,7%) seguidas de las MLP (82,4%). En cuanto a la especificidad, el AVM es el que presentó mejores resultados (96,7%), seguido de las MLP (94,7%). Al centrarse en los resultados obtenidos en orina de 24h, las MN presentaron una sensibilidad muy superior al resto de las pruebas (catecolaminas y AVM), aunque con una especificidad más baja. De forma similar, los resultados en plasma muestran que las MN presentaron mejor sensibilidad (82,4 vs. 71,4%) y especificidad (94,7 vs. 83,3%) que las catecolaminas.
Rendimiento diagnóstico de las diferentes pruebas bioquímicas
| Prueba | Sensibilidad | Especificidad |
|---|---|---|
| Metanefrinas urinarias | 91,7% (11/12) | 86,6% (497/574) |
| Metanefrinas plasmáticas | 82,4% (14/17)a | 94,7% (611/645) |
| Catecolaminas plasmáticas | 71,4% (5/7) | 83,3% (184/221) |
| Catecolaminas urinarias | 69,2% (9/13) | 92,9% (531/576) |
| AVM urinario | 33,3% (1/3) | 96,7% (493/510) |
AVM: ácido vanilmandélico.
Comparando únicamente los resultados obtenidos en las muestras de orina con solicitud simultánea de MN y catecolaminas, n=452, las MN urinarias seguían mostrando una mayor sensibilidad diagnóstica (90,9% [10/11] vs. 81,8% [9/11]) a pesar de presentar una peor especificidad (84,4% [372/441] vs. 91,4% [403/441]). De forma similar, al comparar únicamente los resultados obtenidos en las muestras de plasma con solicitud simultánea de MN y catecolaminas, n=129, se pudo confirmar que las MN seguían presentando mejores resultados de sensibilidad (85,7% [6/7] vs. 71,4% [5/7]) y especificidad (93,4% [114/122] vs. 78,7% [96/122]).
Dado que las MN fueron las pruebas que mostraron una mayor sensibilidad diagnóstica, se compararon los resultados obtenidos en los pacientes con esta determinación tanto en orina como en plasma, n=243. En estos pacientes ambas pruebas detectaron los mismos casos (90,9% [10/11]), pero las MLP fueron más específicas (93,5% [217/232] vs. 88,8% [206/232]). Es importante destacar que solo hubo 3 falsos positivos (FP) con resultado elevado de MN en ambos especímenes (plasma y orina), estando las metanefrinas en el resto de los casos elevadas solo en plasma o en orina.
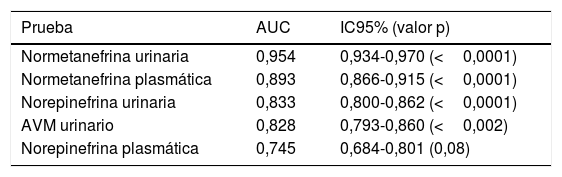
Al obtener las curvas de rendimiento diagnóstico para las diferentes pruebas bioquímicas analizadas en los 1.279 pacientes, y centrándose en las pruebas con mayor rendimiento (NMN, norepinefrina y AVM), la NMN urinaria fue la que presentó una mayor área bajo la curva (AUC=0,954), seguida de la NMN plasmática (AUC=0,893) (tabla 2). Además, se calculó el índice de Youden para la NMN plasmática, siendo este de 0,715 (sensibilidad=76,5%; especificidad=95,0%).
Curvas de rendimiento diagnóstico para algunas de las pruebas bioquímicas individuales
| Prueba | AUC | IC95% (valor p) |
|---|---|---|
| Normetanefrina urinaria | 0,954 | 0,934-0,970 (<0,0001) |
| Normetanefrina plasmática | 0,893 | 0,866-0,915 (<0,0001) |
| Norepinefrina urinaria | 0,833 | 0,800-0,862 (<0,0001) |
| AVM urinario | 0,828 | 0,793-0,860 (<0,002) |
| Norepinefrina plasmática | 0,745 | 0,684-0,801 (0,08) |
AUC: área bajo la curva; AVM: ácido vanilmandélico; IC95%: intervalo de confianza al 95%.
Este resultado se obtendría usando como punto de corte para la NMN plasmática un valor de 168pg/mL, muy similar al utilizado actualmente (165pg/mL).
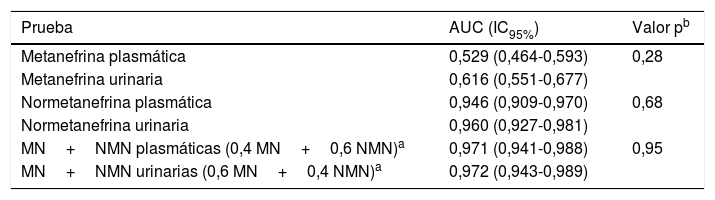
Al obtener las curvas de rendimiento diagnóstico para MN y NMN urinarias y plasmáticas en los pacientes con ambas determinaciones (n=243), el AUC de las pruebas urinarias fue superior al de las plasmáticas, aunque sin diferencias estadísticamente significativas (tabla 3). Además, cuando se combinaron MN y NMN, las AUC obtenidas en orina y plasma fueron prácticamente iguales (0,972 y 0,971, respectivamente).
Curvas de rendimiento diagnóstico en pacientes con determinación simultánea de metanefrinas urinarias y plasmáticas
| Prueba | AUC (IC95%) | Valor pb |
|---|---|---|
| Metanefrina plasmática | 0,529 (0,464-0,593) | 0,28 |
| Metanefrina urinaria | 0,616 (0,551-0,677) | |
| Normetanefrina plasmática | 0,946 (0,909-0,970) | 0,68 |
| Normetanefrina urinaria | 0,960 (0,927-0,981) | |
| MN+NMN plasmáticas (0,4 MN+0,6 NMN)a | 0,971 (0,941-0,988) | 0,95 |
| MN+NMN urinarias (0,6 MN+0,4 NMN)a | 0,972 (0,943-0,989) |
IC95%: intervalo de confianza al 95%
Los niveles plasmáticos de MN y NMN en los individuos de la población de estudio (n=645) en los que no se identificó un FEO/PGL, y con edades comprendidas entre los 9 y 90 años, fueron de 20 a 479pg/mL para MN, y de 20 a 3.626pg/mL para NMN, respectivamente. Se excluyó un valor de MN (479pg/mL) y otro de NMN (3.626pg/mL), tras ser identificados como valores aberrantes. Por lo tanto, el rango de resultados en las 644 muestras restantes fue de 20 a 165pg/mL para MN, con una mediana de 25pg/mL y de 20 a 612pg/mL para NMN, con una mediana de 67pg/mL.
Para la MN se observaron diferencias significativas (p<0,0001) entre hombres y mujeres, con mediana y rango intercuartílico de 29 (21-40)pg/mL para hombres (n=237), y de 24 (20-33)pg/mL para mujeres (n=407). Sin embargo, no se observó asociación entre las concentraciones de MN y la edad de los pacientes (rho=0,02; p=0,67).
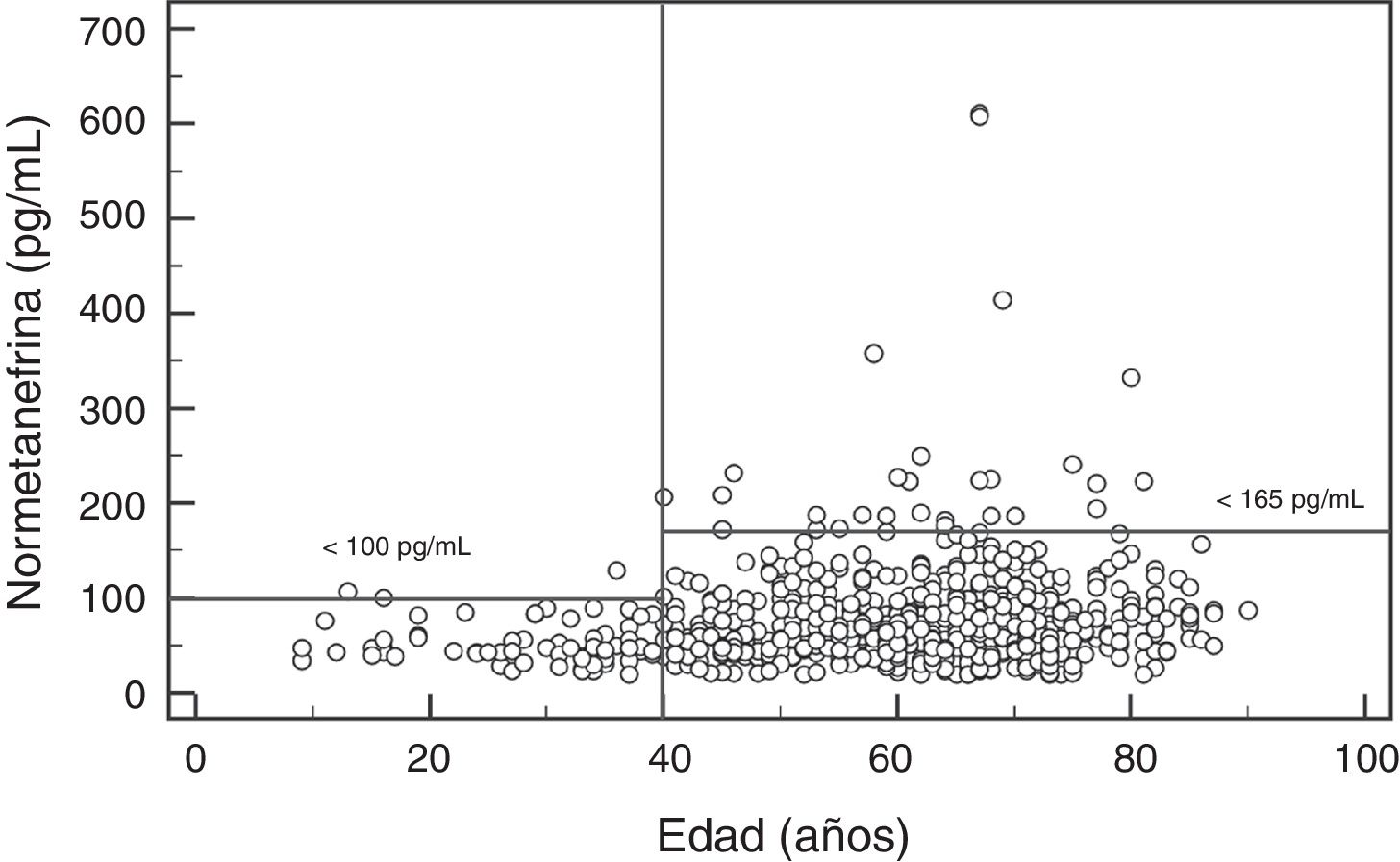
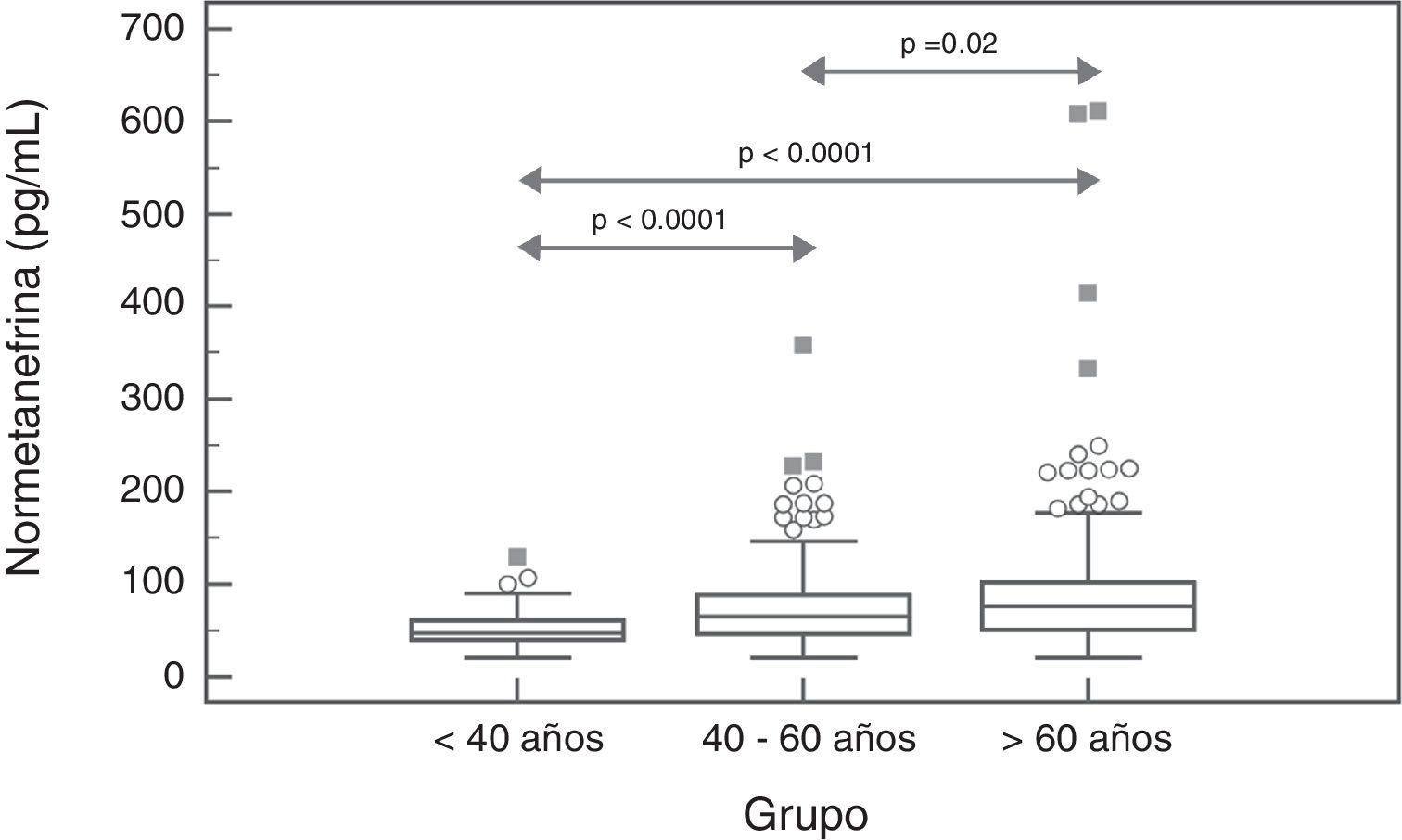
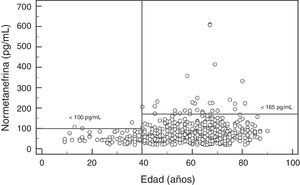
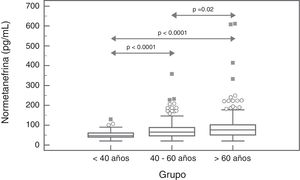
Para la NMN no se observaron diferencias significativas (p=0,95) entre hombres y mujeres, con mediana y rango intercuartílico de 68 (44-96)pg/mL para hombres (n=237), y de 67 (47-91)pg/mL para mujeres (n=407). Por el contrario, si se observó una asociación positiva significativa entre las concentraciones de NMN y la edad de los pacientes (rho=0,19; p<0,0001) (fig. 1). Al comparar los resultados de NMN en 3 grupos de pacientes según su edad (<40 años, 40-60 años, y>60 años), se observaron diferencias significativas (p<0,0001) entre los 3 grupos, con mediana y rango intercuartílico de 48 (40-61)pg/mL para<40 años (n=66), 65,5 (46-89)pg/mL para individuos de 40-60 años (n=250), y 76 (51-101,5)pg/mL para>60 años (n=328), respectivamente (fig. 2).
El valor de referencia obtenido para la MN según el método no paramétrico (Clinical and Laboratory Standards Institute, EP28-A3c) fue (valor e intervalo de confianza al 90%): 55 (53-60)pg/mL, para todos los individuos (n=644), independientemente de la edad o sexo.
Los valores de referencia obtenidos para la NMN fueron: 168 (146-187)pg/mL para todos los individuos (n=644), 97 (85-129)pg/mL para los individuos<40 años (n=66), 164 (134-188)pg/mL para los individuos entre 40 y 60 años (n=250), y 180 (157-223) pg/mL para los individuos mayores de 60 años (n=328).
En cuanto al estudio de la variabilidad biológica, la NMN presentó valores de entre 23 y 119pg/mL, con un valor medio de 72,4pg/mL. El CV analítico fue de un 8,2%. Los CVI y CVG obtenidos, según las fórmulas descritas previamente, fueron de un 32% y un 19,6%, respectivamente. Por lo tanto, el II obtenido fue 1,63. Al ser este índice mayor de 1,4, se considera que la individualidad de la prueba es baja, y no se recomienda utilizar el valor de referencia del cambio para detectar cambios significativos, sino que es más adecuado usar valores de referencia poblacionales. Los resultados obtenidos para la MN fueron similares, con un CVI>>CVG y, por lo tanto, un II>>1,4.
DiscusiónSegún nuestro conocimiento, este es el primer estudio en España que evalúa el rendimiento diagnóstico obtenido con la determinación rutinaria de las MLP por método de referencia (cromatografía líquida acoplada a espectrometría de masas en tándem) y otras pruebas bioquímicas clásicas. Los resultados obtenidos muestran que las MN, tanto plasmáticas como urinarias, son mejores marcadores de los FEO/PGL que el resto de los parámetros bioquímicos (catecolaminas plasmáticas y urinarias, y AVM urinario). Esto apoya la idea de que las catecolaminas y el AVM aportan poca información adicional a la ya aportada por las MN y que, por lo tanto, son pruebas que no deberían ser utilizadas en el diagnóstico de los FEO/PGL. Sin embargo, son muchos los clínicos que aún siguen solicitando estos análisis.
La determinación de las MLP permite disponer de una prueba con un buen rendimiento para el diagnóstico de estos tumores. Sin embargo, su cuantificación supone un reto analítico para el laboratorio dada su baja concentración plasmática. La espectrometría de masas es una tecnología que aporta excelentes resultados de sensibilidad y especificidad en la determinación de estos analitos y que se ha establecido como método de referencia.
Las MLP presentan algunas ventajas con respecto a las MN urinarias, como son una extracción relativamente fácil de la muestra, un control más sencillo de la influencia de la dieta y la medicación, y la posibilidad de ser usadas en pacientes con enfermedad renal crónica, donde las MN urinarias carecen de utilidad25. Sin embargo, una de sus principales limitaciones es la necesidad de controlar de forma muy estricta las condiciones preanalíticas en las que se produce la extracción de la muestra26,27. Un reciente metaanálisis concluyó que la sensibilidad de las MLP es significativamente superior cuando las muestras de sangre son obtenidas con el paciente en posición supina en lugar de sentado (95 vs. 89%; p<0,02). Asimismo, la especificidad de las MLP en posición supina es significativamente superior que la de las MN urinarias (95 vs. 90%; p<0,03)28. En el presente trabajo se obtuvieron resultados muy similares a estos, con ambas pruebas presentando la misma sensibilidad (91%) y las MLP una especificidad superior (94%) a las MN urinarias (89%), cuando se estudiaron los pacientes con ambas solicitudes.
Otro aspecto fundamental para obtener un rendimiento óptimo en la determinación de las MLP es la utilización de valores de referencia adecuados. Para ello, la población de referencia ideal está formada por pacientes que son estudiados por la sospecha de presentar un FEO/PGL y en los que finalmente se descarta dicha enfermedad2.
Los resultados del presente estudio muestran que las concentraciones plasmáticas de MN no presentan diferencias por edad pero sí por sexo, con niveles significativamente más altos aunque clínicamente irrelevantes en hombres. Por el contrario, las concentraciones de NMN aumentan significativamente a medida que se incrementa la edad de los pacientes. Así, en los pacientes más jóvenes (<40 años), el valor de referencia obtenido estaba próximo a 100pg/mL, en pacientes de entre 40 y 60 años fue de 164pg/mL (muy similar al utilizado actualmente), y en los pacientes de mayor edad (>60 años) fue de 180pg/mL. Por lo tanto, usar valores de referencia diferenciados por edad permitiría reducir el número de falsos negativos en los pacientes más jóvenes y FP en los pacientes de mayor edad. Otros autores han obtenido resultados similares, con concentraciones de MN estables en todo el rango de edades y de NMN que se incrementan con la edad29. En concreto, Lenders y Eisenhofer2 recomiendan la utilización de un valor de referencia único para la MN (88,8pg/mL) y variable para la NMN, según la edad del paciente: 86,1pg/mL (5-17 años); 106,3pg/mL (18-29 años); 128,2pg/mL (30-39 años); 144,7pg/mL (40-49 años); 159,4pg/mL (50-59 años); y 192,4pg/mL (>60 años). En base a nuestros resultados y a los descritos en la literatura parece claro que, con el objetivo de maximizar la sensibilidad de esta prueba sin reducir la especificidad significativamente, sería necesario bajar el valor de referencia de NMN en pacientes<40 años, de 165pg/mL a 100pg/mL (fig. 2).
En cuanto a la variabilidad biológica, dado que los CVI tanto para MN como NMN son superiores a los CVG, no resulta conveniente utilizar el valor de referencia del cambio para detectar cambios significativos individuales que puedan estar asociados a la presencia de un FEO/PGL, sino que es más adecuado utilizar valores de decisión clínica poblacionales.
Por otro lado, el mayor reto a la hora de interpretar los resultados bioquímicos de las MN se produce cuando se obtienen resultados próximos al límite de normalidad. En estos casos, es más probable que se trate de un FP, por tratamiento farmacológico o elevación fisiológica de catecolaminas, que de un verdadero positivo, dada la baja prevalencia de los FEO/PGL. Los resultados del presente estudio muestran que la combinación de las MLP con las MN fraccionadas urinarias es una estrategia adecuada para diferenciar un verdadero positivo de un FP, dado que la elevación de ambas pruebas es muy sugestiva de FEO/PGL.
En cuanto a las posibles causas de falsos negativos, es importante recordar que los PGL de cabeza y cuello son no secretores y, por lo tanto, estas pruebas no suelen ser útiles en estos casos2,13. En el presente trabajo, uno de los 3 casos de FEO/PGL no detectados con las MLP fue el de una paciente con un PGL yugular (no secretor).
Otro caso fue el de una paciente de 38 años y con valor de NMN de 110pg/mL (>100pg/mL propuestos como valor de referencia en<40 años). Por lo tanto, con valores de referencia ajustados por edad y excluyendo el tumor no secretor, la sensibilidad obtenida sería de un 94% (16/17 casos), con una disminución de la especificidad de tan solo un 0,4% (94,3%).
Algunas de las limitaciones del presente estudio son el bajo número de pacientes con determinación de catecolaminas plasmáticas y el bajo número de casos de FEO con determinación de AVM en orina. Esto es debido a que ante una determinación simultánea de catecolaminas plasmáticas y urinarias, nuestro laboratorio anula las primeras por no ofrecer una información complementaria a la aportada por las catecolaminas urinarias. Además, la determinación del AVM en orina se realiza de forma simultánea con el ácido homovanílico y el ácido 5-hidroxi-indolacético, por lo que muchas de las determinaciones de AVM fueron realizadas en pacientes con sospecha de TNE/carcinoide. Otra posible limitación es que los valores de referencia de las MLP han sido calculados teniendo en cuenta a todos los pacientes estudiados, población que probablemente incluya algunos pacientes con diferentes tratamientos farmacológicos y algunos otros en los que el resto de las condiciones preanalíticas y de extracción de la muestra puedan no haber sido las recomendadas. Sin embargo, creemos que el tamaño muestral utilizado y las pruebas estadísticas aplicadas hacen que los resultados obtenidos sean fidedignos y representativos de nuestra población.
En resumen, el presente trabajo valida la utilidad diagnóstica de las MLP en su uso clínico rutinario en un ambiente de trabajo real. El ajuste de los valores de decisión clínica para la NMN plasmática en los pacientes más jóvenes permite aumentar la sensibilidad de esta prueba. Todos los clínicos deberían centrar el diagnóstico bioquímico de los FEO/PGL en el análisis de las MLP y las MN fraccionadas urinarias, siempre que estén disponibles, evitando el resto de las pruebas bioquímicas clásicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.