La hiponatremia es el trastorno electrolítico más prevalente tanto en medio ambulatorio como hospitalario. A pesar de esta frecuencia, la hiponatremia, incluso la grave, es frecuentemente infravalorada e inadecuadamente tratada, lo que pone de manifiesto la necesidad de elaborar documentos de consenso y guías de práctica clínica orientadas a mejorar su abordaje diagnóstico y terapéutico de forma estructurada.
Material y métodosMiembros del Grupo Acqua de la Sociedad Española de Endocrinología y Nutrición (SEEN) se reunieron mediante una metodología de trabajo en red durante un periodo de 20 meses (entre octubre de 2019 y agosto de 2021), con la finalidad de discutir y elaborar una guía actualizada para el manejo de la hiponatremia. Se realizó una búsqueda bibliográfica de la evidencia científica disponible para cada apartado expuesto en el presente documento.
ResultadosSe ha elaborado un documento que a través de 8 secciones pretende resolver la mayoría de las preguntas en el manejo clínico de la hiponatremia. El manejo de la hiponatremia grave se basa en la administración de solución hipertónica al 3% i.v. Para el manejo de la hiponatremia crónica euvolémica se exponen algoritmos para el inicio del tratamiento con las dos opciones terapéuticas farmacológicas disponibles actualmente en nuestro medio: urea y tolvaptán.
ConclusionesEste documento pretende simplificar el manejo y tratamiento de la hiponatremia, permitiendo mejorar el abordaje clínico de la misma.
Hyponatremia is the most prevalent electrolyte disorder in the outpatient and inpatient settings. Despite this frequency, hyponatremia, including severe hyponatremia, is frequently underestimated and inadequately treated, thus highlighting the need to produce consensus documents and clinical practice guidelines geared towards improving the diagnostic and therapeutic approach to it in a structured fashion.
Material and methodsMembers of the Acqua Group of the Spanish Society of Endocrinology and Nutrition (SEEN) met using a networking methodology over a period of 20 months (between October 2019 and August 2021) with the aim of discussing and developing an updated guideline for the management of hyponatraemia. A literature search of the available scientific evidence for each section presented in this document was performed.
ResultsA document with 8 sections was produced, which sets out to provide updated guidance on the most clinically relevant questions in the management of hyponatraemia. The management of severe hyponatraemia is based on the i.v. administration of a 3% hypertonic solution. For the management of chronic euvolemic hyponatraemia, algorithms for the initiation of treatment with the two pharmacological therapeutic options currently available in Spain are presented: urea and tolvaptan.
ConclusionsThis document aims to simplify the management and treatment of hyponatremia, allowing for an improved clinical approach to hyponatremia.
La hiponatremia, definida como el descenso en la concentración sérica de sodio (NaS) por debajo de 135mmol/L, es el trastorno electrolítico más prevalente tanto en medio ambulatorio como hospitalario1, llegando a afectar al 19% de las personas hospitalizadas2 y al 7% en régimen ambulatorio3.
La hiponatremia aguda, instaurada por definición en menos de 48horas, es grave de por sí, capaz de inducir edema cerebral profundo, herniación cerebral y, por tanto, una elevada mortalidad. Por otro lado, la hiponatremia crónica, aquella que ocurre con más de 48horas de evolución o con un tiempo de instauración desconocido, aunque también puede ser grave, suele ser leve-moderada dado su desarrollo más larvado. No obstante, no es una entidad indolente, ya que se asocia con inestabilidad de la marcha y riesgo de caídas y fracturas4,5, así como con el incremento de la estancia hospitalaria, y la mortalidad tanto hospitalaria6,7 como ambulatoria en el periodo inmediatamente posterior al alta2. Dadas sus múltiples etiologías, con frecuencia la hiponatremia es el primer signo de patologías con importante repercusión pronóstica. Además, su presencia incrementa de forma notable los costes de la atención sanitaria8, no solo por sus efectos directos, sino por la importante asociación con una menor capacidad funcional y calidad de vida, especialmente en el paciente anciano.
Tras la corrección de una hiponatremia grave, ya sea aguda o crónica, o de la sobrecorrección de la misma, la recuperación neurológica completa puede tardar semanas, y algunos pacientes podrán presentar secuelas neurológicas permanentes9. Por lo tanto, un tratamiento precoz de la hiponatremia grave, con incremento del NaS de al menos 4-6mmol/L en las primeras 4-6horas es esencial y ha demostrado mejorar el pronóstico de supervivencia10. Así mismo, la corrección de la hiponatremia crónica, tras alcanzar cifras mantenidas de eunatremia (>135mmol/L), se ha asociado a una mejoría significativa en la estabilidad de la marcha11 y muy probablemente de la mortalidad, según sugieren Corona et al.12 en su último metaanálisis. Sin embargo, si el incremento del NaS es muy rápido y excede los límites establecidos, puede originar la aparición del síndrome de desmielinización osmótica (SDO), especialmente en pacientes con hiponatremia crónica y factores de riesgo asociado, como el alcoholismo, la malnutrición, el uso prolongado de diuréticos o la hipopotasemia13,14.
A pesar del impacto señalado y de las opciones terapéuticas disponibles en el momento actual, la hiponatremia, incluso la grave, es frecuentemente infravalorada e inadecuadamente tratada, lo que ha puesto de manifiesto la necesidad de elaborar documentos de consenso y guías de práctica clínica orientadas a mejorar su abordaje diagnóstico y terapéutico de forma estructurada.
Entre estos documentos figura una guía de consenso de un grupo multidisciplinar español15 compuesto por 2 especialistas en nefrología, uno en farmacia hospitalaria, 2 en medicina interna y 2 en endocrinología, elaborada en el año 2013, con el objetivo de disponer de una guía concreta y detallada del tratamiento de la hiponatremia inducida por el síndrome de secreción inadecuada de hormona antidiurética (SIADH).
Con la intención de dar continuidad a la referenciada guía, se ha elaborado por parte del grupo de trabajo de metabolismo del agua (Grupo Acqua) del Área de Conocimiento de Neuroendocrinología de la Sociedad Española de Endocrinología y Nutrición (SEEN), el presente documento de actualización.
Material y métodosMiembros del Grupo Acqua se reunieron mediante una metodología de trabajo en red durante un periodo de 20 meses (entre octubre de 2019 y agosto de 2021), con la finalidad de discutir y elaborar una guía actualizada para el manejo de la hiponatremia. Se realizó una búsqueda bibliográfica de la evidencia científica disponible para cada apartado expuesto en el presente documento.
Dada la falta de evidencia que caracteriza a muchos aspectos del tratamiento de la hiponatremia, los algoritmos que a continuación se desarrollan están basados en gran medida en recomendaciones ampliamente aceptadas en la práctica clínica habitual, opinión de expertos, guías previas de consenso, así como en la experiencia clínica de los autores. Como siempre es el caso en las situaciones de práctica clínica, la aplicación de las instrucciones del documento deberá ser flexible y adaptada a cada paciente y contexto sociosanitario.
Patogenia de la hiponatremiaFisiológicamente, para mantener el equilibrio hídrico y evitar estados de sobrehidratación, deshidratación y disminución de la perfusión tisular, la liberación plasmática de la hormona antidiurética (ADH), también conocida como arginina vasopresina (AVP) o argipresina, es regulada desde la neurohipófisis principalmente por dos vías: a través de los osmorreceptores del hipotálamo anterior y de los barorreceptores sistémicos. La ADH, una vez liberada al torrente sanguíneo, tiene un tiempo de vida media de aproximadamente 20minutos16. A través de su acción en los receptores V2 del túbulo colector de la nefrona, propiciará un aumento de la reabsorción de agua a través de los canales de aquaporina-2 en el túbulo colector con la consiguiente reducción de la excreción de agua libre, y el aumento del volumen y de la relación agua/sodio intravascular.
Vía osmorreceptores, los cambios en la osmolalidad plasmática (OsmP) regulan la liberación de ADH. Se ha observado que la liberación sanguínea de ADH se encuentra marcadamente inhibida con OsmP efectivas menores de 280mOsm/kg, mientras que sus máximas concentraciones se observan con OsmP efectivas ≥290mOsm/L17,18. Vía barorreceptores (a nivel de la aurícula izquierda, carótidas, cayado aórtico, capilares pulmonares o arteriola aferente de la nefrona) se pueden detectar cambios en el volumen circulante efectivo (VCE) —o volumen intravascular— que condicionarán la concentración de ADH en sangre. Pequeñas disminuciones del VCE, como las observadas con reducciones a partir del 5% de presión arterial19, pueden ser detectadas por los barorreceptores y originar un estímulo directo vía sistema simpático19, e indirecto vía sistema renina-angiotensina-aldosterona hacia los núcleos hipotalámicos para la síntesis y posterior liberación de ADH20. Por el contrario, un incremento del VCE inhibirá la liberación de ADH por estas vías. La sensibilidad de los osmorreceptores para originar cambios en la liberación de ADH es mayor que la de los barorreceptores, aunque la potencia del estímulo es mayor en los barorreceptores. No obstante, ambos estímulos son agudos y rápidamente inhibidos cuando las condiciones precipitantes son corregidas19.
La hiponatremia puede producirse por mecanismos dependientes (secreción no osmótica) o no dependientes de la liberación de ADH. El primer grupo es el más frecuente, e incluye situaciones clínicas en las que existe una marcada liberación de la ADH vía barorreceptores o por otros estímulos no osmóticos. En el segundo se encuentran situaciones como la polidipsia primaria y la sobrecarga hídrica iatrogénica, en las que existe una disminución del NaS y de la OsmP como consecuencia del exceso de agua intravascular. Esto ocurre debido a una incapacidad renal para eliminar el excedente de agua libre, por lo general, asociado a una ausencia del soluto suficiente para generar un adecuado gradiente osmótico en la médula renal21.
Además de los estímulos clásicos de ADH como el aumento de la osmolalidad plasmática y la hipovolemia, encontramos estímulos no osmóticos distintos a los de la vía barorreceptora, como el déficit de cortisol, la hipoglucemia16, estados sépticos-inflamatorios22,23, las náuseas o vómitos18 o el dolor24. Por otro lado, los mecanismos de acción de algunos fármacos (tabla 1), a través de su interacción con algunos neurotransmisores centrales (colinérgicos, serotoninérgicos, adrenérgicos, dopaminérgicos) y/o con la angiotensina-II, pueden estimular la liberación de ADH hipotalámica. Además, niveles inadecuadamente elevados de ADH pueden ser producidos ectópicamente por algunos tumores y originar hiponatremia (típicamente SIADH), siendo una situación comúnmente vista en el carcinoma microcítico de pulmón25.
Lista de fármacos que pueden causar o contribuir a la hiponatremia
| Diuréticos |
| Acetazolamida, del asa, tiazidas, amiloride |
| Fármacos que interfieren con la secreción/acción de la aldosterona |
| Heparina, amilorida, trimetroprim, pentamidina, AINE, ciclosporina, tacrolimus, espironolactona, eplerenona, IECA, ARAII |
| Psicotrópicos |
| Antidepresivos tricíclicos, inhibidores de la recaptación de serotonina |
| Antipsicóticos: fenotiazinas, butirofenonas |
| Antiepilépticos: carbamazepina, oxcarbacepina, valproato |
| Quimioterapia |
| Alcaloides de la vinca: vincristina, vinblastina |
| Alquilantes: ciclofosfamida, melfalán, ifosfamida |
| Cisplatino, carboplatino |
| Analgésicos |
| Antiinflamatorios no esteroideos, opioides |
| Otros |
| Metotrexato, interferón alfa y gamma, inhibidores de la bomba de protones |
AINE: antiinflamatorios no esteroideos; ARAII: antagonistas del receptor de angiotensina-II; IECA: inhibidores de la enzima convertidora de angiotensina
Fuente: Sterns26.
El SIADH es la etiología más frecuente de la hiponatremia27, tanto en medio hospitalario28 como ambulatorio29. En dicho cuadro existe una excesiva concentración de la orina para la baja OsmP existente, en ausencia de una disminución del VCE, conllevando una escasa eliminación de agua libre y la consiguiente hiponatremia. Su diagnóstico es por exclusión, debiendo descartar la existencia de insuficiencia suprarrenal, el uso de diuréticos y otros estímulos fisiológicos y no osmóticos de la ADH. Aunque el hipotiroidismo forma parte de las entidades a descartar antes de diagnosticar un SIADH, es importante señalar que es una entidad poco frecuente y que para ocasionar hiponatremia debe ser grave, y la hiponatremia asociada a este cuadro suele ser de rango leve30. Las características diagnósticas del SIADH se sintetizan en la tabla 2.
Criterios diagnósticos de SIADH
| Estado euvolémico |
| Osmolalidad plasmática efectiva<275mOsmol/kg |
| Osmolalidad urinaria>100mOsmol/kg con función renal conservada |
| Sodio urinario>30mmol/L con ingesta adecuada de sodio y agua |
| Descartar:Uso de diuréticos, hipocortisolismo, hipotiroidismo, y otras causas fisiológicas (náuseas/vómitos, dolor) |
SIADH: síndrome de secreción inadecuada de hormona antidiurética.
El diagnóstico de la hiponatremia debe realizarse de forma precoz y certera, ya que de él dependerá su tratamiento, y, por tanto, el éxito de su resolución. De forma esquemática, el diagnóstico se resume en 4 pasos de evaluación continua que deben repetirse en cada valoración del paciente (fig. 1):
- 1.
Confirmar el nivel real del NaS.
- 2.
Estadificar la gravedad de la hiponatremia.
- 3.
Clasificar la volemia.
- 4.
Identificar factores predisponentes y agravantes.
Algoritmo diagnóstico de la hiponatremia: Describe los factores a evaluar seriadamente en todo paciente con hiponatremia. El recuadro superior izquierdo evalúa los factores de aparición y progresión de la hiponatremia. El recuadro superior derecho evalúa los factores de gravedad: clínica neurológica de riesgo (obnubilación, convulsiones, deterioro de conciencia…), progresión en<48horas (permite también corrección más rápida de hiponatremia), factores de riesgo de gravedad (hipoxemia, cáncer diseminado, insuficiencia cardíaca o hepatopatía avanzadas) y de desmielinización (hepatopatía, alcoholismo, desnutrición, hipopotasemia, natremia<105mEq/L). El recuadro inferior derecho precisa las condiciones en que debemos corregir la medición de la natremia (hipoproteinemia, hipertrigliceridemia, hiperglucemia). Por último, el recuadro inferior izquierdo indica la clasificación volémica de los pacientes con hiponatremia, que debe hacerse seriadamente en todo paciente. Crea.S: creatinina sérica; Hto: hematocrito; ISRS: inhibidores de la recaptación de serotonina; NRL: neurológica; PVY: pulso de la vena yugular.
En presencia de un estado de hipotonicidad (baja osmolalidad efectiva), ha de corregirse el valor analítico del NaS en función de los niveles de glucemia31,32 (cuando es>140mg/dL), que es el factor más relevante y frecuente en la práctica clínica. Para corregir el NaS por la glucemia se debe incrementar en 1,6mmol/L el valor de NaS medido por cada 100mg/dL de glucemia por encima de 100mg/dL hasta valores de 400mg/dL (Na corregido=Na medido+0,016*Glucemia [mg/dL]–100). Con valores superiores, el incremento debe ser de 4mmol/L de NaS por cada 100mg/dL de glucemia31. Las correcciones del NaS con proteínas totales y triglicéridos no están claramente validadas; además, la modificación observada en las cifras de natremia con las fórmulas evaluadas no es clínicamente relevante, por lo que no recomendamos su aplicación rutinaria.
Clasificar la gravedad de la hiponatremiaDiversos factores, como la edad joven o el sexo femenino33,34, pueden aumentar la gravedad clínica de la hiponatremia; pero es la rapidez de instauración uno de los más determinantes. Un descenso de natremia>10mmol/L en 48horas debe considerarse como una hiponatremia grave.
Clásicamente la clasificación de la gravedad de la hiponatremia se ha basado en los niveles de NaS. Así, se considera que la hiponatremia es leve cuando el NaS está entre 130,1 y 134,9mmol/L; moderada, cuando están entra 120,1 y 130mmol/L; y grave cuando es ≤120mmol/L. Sin embargo, revisiones recientes sugieren cambiar el umbral del NaS a niveles <125mmol/L para definir la hiponatremia grave35–37, fundamentalmente si se acompaña de sintomatología neurológica, dado que a partir de esta cifra la repercusión clínica es mayor11. Además, se han observado mayores tasas de sobrecorrección cuando el NaS es <125mmol/L37, y por tanto, la necesidad de una monitorización más estricta del NaS para evitar la aparición de complicaciones asociadas38. No obstante, por encima de dichas cifras de NaS, se debe ser cauto en cuanto a atribuir manifestaciones neurológicas de grado moderado-grave a la hiponatremia.
Son precisamente las manifestaciones neurológicas, relacionadas con el grado de edema cerebral producido35, las que condicionan la clasificación de la gravedad de la hiponatremia. Se debe tener en cuenta que, aunque los síntomas/signos asociados a mayor gravedad en la hiponatremia son homogéneamente reconocidos en la literatura médica, existen discrepancias entre diversos autores para catalogar el cuadro como leve o moderado (tabla 3).
Clasificación de hiponatremia según clínica
| Clínica leve | Clínica moderada | Clínica grave | |
|---|---|---|---|
| Peri et al.48 | Dificultad para concentrarse, cefalea, náuseas, cambios de ánimo | Vómitos, inestabilidad en la marcha/caídas, confusión, somnolencia | Estupor, distrés respiratorio, convulsiones, coma |
| Broch et al.35 | Cefalea, anorexia, astenia, debilidad, déficit de atención, alteraciones de memoria o marcha, bradipsiquia | Náuseas, vómitos, desorientación, delirium, confusión, somnolencia | Estupor, convulsiones, coma, herniación cerebral, edema pulmonar no cardiogénico |
| Guías de práctica clínica:EE.UU.: Verbalis et al.42Europa: Spasovski et al.43 | Náuseas, confusión, cefalea | Vómitos, distrés respiratorio, convulsiones, somnolencia, estupor, coma | |
| Guías de práctica clínica:España: Runkle et al.15 | Cefalea, déficit de atención, alteraciones de la memoria, alteración de la marcha, bradipsiquia | Náuseas, vómitos, desorientación, somnolencia, confusión | Estupor, coma, convulsiones, distrés respiratorio |
Cuando la hiponatremia aparece de forma aguda, está asociada a mayor riesgo de desarrollo de edema cerebral39, presentándose frecuentemente con síntomas/signos neurológicos moderados-graves. Esta situación suele observarse fundamentalmente en el postoperatorio de intervenciones neuroquirúrgicas o cuando se produce una intoxicación aguda acuosa, como en la potomanía, polidipsia primaria, o por iatrogenia. En estos casos puede ser recomendable realizar la determinación de la natremia mediante gasometría arterial, ya que permitirá detectar más rápidamente los cambios en el NaS dada la velocidad de instauración de la hiponatremia, y así ajustar mejor el tratamiento40. Por otro lado, la hiponatremia crónica tiene un menor riesgo de edema cerebral41 y una presentación clínica más leve y larvada, aunque no exenta de riesgos, por lo que, dependiendo de la situación clínica, también podría manifestarse como grave.
Independientemente del criterio seguido para definir la gravedad de la hiponatremia, las diferencias en la evolución inmediata del paciente obligan a considerar una dirección terapéutica distinta, siendo más agresivos en la corrección de la hiponatremia cuando esta aparece de forma rápida, o es grave, ya sea clínica o bioquímicamente o se acompaña de factores predisponente a lesión neurológica permanente o muerte, tales como hipoxia, mujeres en edad fértil, niños o presencia de tumor intracraneal.
Clasificar la volemiaDesde una perspectiva fisiopatológica, la hiponatremia puede clasificarse en función de la volemia clínica. Distinguimos así entre hiponatremia hipovolémica, hipervolémica y euvolémica44. Una adecuada clasificación inicial de la volemia es crucial para el tratamiento correcto de la hiponatremia36,45–47. Tanto en la hiponatremia hipovolémica como en la hipervolémica, el VCE está disminuido48, por lo que la hiponatremia es consecuencia de una liberación no osmótica de la ADH vía barorreceptores. Por el contrario, en la hiponatremia euvolémica, el VCE es normal o relativamente elevado, y no existe un estímulo barorreceptor ni osmótico para la liberación de ADH. En este último grupo se encuentran situaciones en las que la concentración plasmática de ADH puede estar elevada (p.ej., SIADH) o disminuida/inhibida (p.ej., polidipsia primaria). Una forma de estimar si la hiponatremia depende o no de ADH es midiendo la osmolalidad urinaria (OsmU), la cual tiene una muy alta correlación directa con la actividad de la ADH en el túbulo colector, y con sus niveles en plasma. Así, en situaciones de un bajo VCE, o de una hiponatremia ADH-dependiente, la OsmU será habitualmente mayor que la OsmP; por el contrario, ante un VCE normal/elevado y si la hiponatremia no depende de la ADH, la OsmU esperada es de <100mOsm/kg49. En casos de una OsmU>100mOsm/kg pero inferior o igual a la OsmP, un doble componente (sobrecarga hídrica y un estímulo inadecuado de ADH) debe sospecharse.
Diferenciar entre hipovolemia leve y euvolemia puede ser un reto44,46,50–52, siendo necesario integrar el análisis de varios parámetros clínico-analíticos para realizar una clasificación volémica adecuada. No obstante, es importante señalar que la evaluación del estado volémico debe ser continua. Un mismo paciente puede tener una hiponatremia euvolémica y más adelante una hipovolémica, o al revés, dependiendo de la aparición y/o resolución de factores precipitantes o agravantes.
En la tabla 4 se detallan los parámetros clínicos y bioquímicos asequibles en la práctica clínica habitual, que ayudarán a diferenciar entre un estado hipovolémico y euvolémico. En base a nuestra experiencia, recomendamos tener al menos 3 parámetros sugerentes de hipovolemia positivos para una mayor certeza de una correcta clasificación de la volemia, ya que la especificidad individual de los parámetros para diferenciar entre hipovolemia y euvolemia puede ser baja según distintas situaciones clínicas.
Parámetros de ayuda diagnóstica para clasificar la hiponatremia como hipovolémica o euvolémica
| Clínicos | Hipovolemia | Euvolemia | Limitacionesa |
|---|---|---|---|
| Síntomas/signos ortostáticos | Presentes | Ausentes | Requiere entrenamiento/experiencia. Dificultades para diferenciar de síndrome vertiginoso en la anamnesis |
| Medición de la altura del pulso de la vena yugular interna | Por debajo del ángulo esternal (o de Louis) a una inclinación torácica ≤30° | 1-3cm por encima del ángulo de Louis a una inclinación torácica entre 30°-45° | Gran variabilidad interobservador, requiere entrenamiento, dependiente de experiencia |
| Frecuencia cardíaca | ≥90lpm | <90lpm | Baja sensibilidad ya que requiere pérdidas>15% de la volemiaFalsos positivos por ansiedad, fiebre, tirotoxicosis, arritmiasFalsos negativos por fármacos bradicardizantes o hipotiroidismo marcado |
| Presión arterial | ≤90/60mmHg | >90/60mmHg | Baja sensibilidad ya que requiere pérdidas de>30% de la volemiaPresiones elevadas pueden inducir a incorrecta presunción de euvolemia |
| Palpación ocular | Dureza, ausencia de rebote | Turgente, con rebote | Variabilidad interobservador, requiere entrenamiento, dependiente de experiencia, no hay parámetros claramente estudiadosMayor valor en niños |
| Retorno venoso distal de las extremidades superiores durante la sedestación | El llenado venoso distal se produce cuando el ángulo del codo está por debajo de la apófisis xifoides | El llenado venoso distal se produce cuando el ángulo del codo está entre la apófisis xifoides y la clavícula | Variabilidad interobservador, requiere entrenamiento, dependiente de experiencia, no hay parámetros claramente estudiados |
| Humedad de mucosas | Secas | Húmedas | Poco específico |
| Sodio urinario | <30mmol/L | >30mmol/L | Solo útil para el diagnóstico diferencial de hipovolemia: pérdidas extrarrenales vs. renales; mas no para el de euvolemia. Pacientes con pérdidas urinarias (diuréticos, tubulopatías, síndrome pierde sal cerebral, hipoaldosteronismo aislado o insuficiencia adrenal primaria) suelen cursar con valores elevadosFalsos positivos en caso de dilución urinaria, por lo que debe valorarse en presencia de una osmolalidad urinaria igual o mayor que la plasmática |
| Fracción de excreción de sodio | <1% | >1% | Solo útil para diagnóstico diferencial de hipovolemia: pérdidas extrarrenales vs. renales. Pacientes con pérdidas urinarias (diuréticos, tubulopatías, síndrome pierde sal cerebral, hipoaldosteronismo aislado o insuficiencia adrenal primaria) suelen cursar con valores elevadosFalsos positivos en caso de dilución urinaria, por lo que debe valorarse en presencia de una osmolalidad urinaria igual o mayor que la plasmática |
| Observación del cambio de la creatinina y/o urea séricas | La creatinina o urea aumentan durante la hiponatremia, comparada con niveles previos en eunatremia | La creatinina y/o urea se mantienen igual o disminuyen durante la hiponatremia, comparada con niveles previos en eunatremia | Requiere una analítica en eunatremia previaCambios de constitución muscular pueden alterar la interpretaciónLas hiponatremias hipervolémicas presentan la misma cinética que la hipovolémica |
lpm: latidos por minuto.
En caso de dudas, se puede realizar una prueba de respuesta a sueroterapia salina con NaCl 0,9%46,53. En base a ello, la administración de 25ml/kg de NaCl 0,9% en 24horas conllevaría un aumento mayor de 4mmol/L de natremia en pacientes con hiponatremia hipovolémica54. Sin embargo, se debe tener en cuenta que, además de no observarse dicha respuesta, algunos pacientes con hiponatremia euvolémica podrían mostrar un empeoramiento del NaS, especialmente si la osmolalidad urinaria (OsmU) es>500mOsm/kg55 ya que en ese caso la excreción de agua libre será menor que el aporte incluido en el NaCl 0,9%, por lo que se aconseja precaución con esta prueba.
Identificar factores predisponentes y agravantesLa hiponatremia puede exacerbarse o ser desencadenada por diversas situaciones clínicas. Por tanto, cada factor debe ser vigilado y abordado cuando corresponda. A continuación, describimos los factores etiológicos y agravantes de la hiponatremia más comunes en la práctica clínica.
- a.
Factores etiológicos: principalmente fármacos (tabla 1), patología respiratoria, renal, hepática, cardiovascular y/o neurológica, infecciones/sepsis, dolor, náuseas/vómitos y cirugía.
- b.
Factores agravantes: a menudo, aunque no exclusivamente, la repercusión pronóstica de la hiponatremia está vinculada a las patologías de base del paciente (cáncer, hepatopatía, enfermedades respiratorias, etc.) por múltiples mecanismos. Por ello el tratamiento de la hiponatremia debe incluirse en el enfoque global del paciente y sus factores de gravedad. Entre estos, la hipoxemia56 es el factor que más empeora el pronóstico de los pacientes con hiponatremia, fundamentalmente cuando esta es grave.
La hiponatremia grave es una urgencia médica, y como tal, debe tratarse siempre y a la mayor brevedad posible. La valoración del estado de volemia del paciente no debería condicionar la actitud terapéutica en el caso de la hiponatremia grave, ya que el objetivo prioritario en estos pacientes es la reducción del edema cerebral antes que el diagnóstico etiológico. La corrección rápida y activa de la hiponatremia grave mejora la supervivencia respecto a la corrección lenta, y además, reduce el riesgo de secuelas neurológicas57; mientras que una actitud expectante se asocia con un incremento de la morbimortalidad2.
Las manifestaciones clínicas en los pacientes con hiponatremia resultan de la interacción entre la gravedad de la alteración electrolítica, su velocidad de instauración y los factores predisponentes de gravedad. Esto dificulta clasificar adecuadamente el estado de gravedad de la misma. Recomendamos considerar y tratar como grave a toda aquella hiponatremia que acarrea una situación de alto riesgo de edema cerebral y/o herniación en caso de no tomar medidas activas, las cuales son: hiponatremia aguda (<48horas), NaS≤120mmol/L, manifestaciones clínicas neurológicas graves (independientemente de los niveles plasmáticos de NaS y del tiempo de instauración), y NaS<125mmol/L en pacientes pediátricos o mujeres en edad fértil.
El tratamiento de la hiponatremia grave se basa en tres pilares: aumentar la natremia para alcanzar el objetivo de corrección lo antes posible, frenar la subida una vez alcanzado el objetivo, y disminuir la natremia en caso de haber superado el objetivo. El tratamiento de elección de la hiponatremia grave es la administración de solución salina hipertónica al 3% (SSH3%), independientemente del tipo y etiología de la hiponatremia. Existen preparaciones comerciales de SSH3% listas para administrar por vía venosa periférica, aunque en su defecto también puede obtenerse mezclando soluciones salinas en diferentes proporciones (tabla 5). Debe evitarse la administración conjunta de otras medidas específicas para corregir la hiponatremia en las primeras 24horas tras el inicio de SSH3% para reducir el riesgo de hipercorrección. Las excepciones a esta regla son el uso de furosemida en los pacientes con insuficiencia cardíaca, el de hidrocortisona en los pacientes con insuficiencia suprarrenal y el de cloruro potásico en los pacientes con hipopotasemia.
Formas para preparar una solución salina hipertónica al 3% (NaCl 3%)
| 500ml de NaCl 3% | A)28ml NaCl 20%+472ml NaCl 2% |
| B)55ml NaCl 20%+445ml NaCl 0,9% | |
| C)a40ml NaCl 20%+250ml H2O destilada |
En la práctica habitual, se ha utilizado frecuentemente la infusión continua de SSH3% con controles analíticos seriados para el ajuste de la velocidad de la misma. Recientemente, un estudio prospectivo en 50 pacientes con hiponatremia grave por SIADH documentó que el uso de hasta dos bolos de 100ml de SSH3%, en comparación con la infusión continua de SSH3% a 20ml/h, logró una elevación más rápida del NaS a las 6horas de tratamiento, asociada a una mejora del nivel de conciencia58. Así mismo, los resultados del estudio SALSA59 evidencian una misma tasa de eficacia pero con menor necesidad de medidas correctoras con la utilización de bolos de SSH3% a dosis de 2-4ml/kg en 20-40minutos frente a la estrategia de infusión continua a dosis de 0,5-1ml/kg/h, en pacientes con NaS<125mmol/L. Por ello, aconsejamos el uso de SSH3% en bolos de 100-150ml administrados en 10-20minutos, repitiéndolos las veces necesarias hasta alcanzar la respuesta clínica y bioquímica deseada (fig. 2). No obstante, en pacientes con hipopotasemia, sería más conveniente el uso en infusión continua, al permitir la adición de 20mmol de cloruro potásico a cada 500ml de SSH3%.
Algoritmo de tratamiento de la hiponatremia grave.
*NaS<125mmol/L en presencia de síntomas neurológicos o en situaciones especiales: edad pediátrica, mujeres en edad fértil, saturación de oxígeno ≤90% y sepsis.
**En los casos de hiponatremia grave de instauración aguda, no suele ser necesario aplicar medidas correctoras por lo que este límite puede elevarse.
DDVP: desmopresina; h: hora; NaS: sodio sérico; SSH3%: suero salino hipertónico al 3%.
Al inicio del tratamiento con SSH3%, el NaS debe ser controlado estrechamente, solicitando controles analíticos frecuentes (habitualmente, cada 2horas) hasta alcanzar el objetivo de corrección individualizado en función del nivel de riesgo de SDO de cada paciente (tabla 6), pudiendo espaciarse posteriormente una vez estabilizado el cuadro clínico. También es muy importante vigilar la diuresis, ya que un aumento de la excreción de agua libre, detectado como un incremento significativo de la diuresis (>2ml/kg/h o>100ml/h43 y/o un descenso en la OsmU en relación con la previa al tratamiento, supondrá una incremento mayor del NaS, y puede servir como indicador de una potencial sobrecorrección (ver apartado de manejo específico).
Objetivos y límites de corrección en la hiponatremia crónica, en función de la presencia de factores de riesgo para SDO
| Objetivo antes de las primeras 6h | Objetivo a las 24h | Límite a las 24h | Límite a las 48h | |
|---|---|---|---|---|
| Sin factores de SDO | 4-6mmol/L | 4-8mmol/L | <10mmol/L | <18mmol/L |
| Con factores de SDO | 4-6mmol/L | 4-6mmol/L | <8mmol/L | <16mmol/L |
| Malnutricióna | ||||
| Hipopotasemiaa | ||||
| Hepatopatíaa | ||||
| Consumo de alcohola | ||||
| NaS bajo (≤120mmol/L) |
SDO: síndrome de desmielinización osmótica.
La hiponatremia leve-moderada a menudo es crónica, lo que facilita una mejor adaptación osmótica por parte del sistema nervioso central. A pesar de ello, un medio interno hipoosmolar repercute de forma clínicamente significativa en los pacientes, por lo que la homeostasis Na+/agua debe reinstaurarse.
La evaluación de la volemia de los pacientes es el punto determinante para la valoración etiológica de la hiponatremia, y, por tanto, para la adopción de medidas terapéuticas adecuadas (fig. 3). En la actualidad, disponemos de diferentes tratamientos farmacológicos para los distintos tipos de hiponatremia (tabla 7); no obstante, existe una notable falta de evidencia científica de calidad en la validación de sus usos.
Algoritmo de tratamiento de la hiponatremia leve-moderada.fcos: fármacos; FG: filtrado glomerular; GGTK: gradiente transtubular de potasio; Osm: osmolalidad; RL: restricción de líquidos; SIADH: síndrome de secreción inadecuada de ADH.
Fórmula de Furst: (cociente Na urinario+K urinario/Na plasma).
Opciones farmacológicas de tratamiento de la hiponatremia
| Vaptanes | Urea | i-SGLT2 | Diuréticos de asa | Solución salina isotónica | |
|---|---|---|---|---|---|
| Indicación | SIADHHiponatremia hipovolémica por ICC | SIADH | SIADH | SIADHHiponatremia hipervolémica por ICC | Hiponatremia hipovolémica |
| Posología diaria (a) | Tolvaptán: 7,5-60mg | 15-60mg | 10-25mg | Furosemida: 20-40mg/12hTorasemida: 2,5-10mg/24h | NaCl 0,9%: 23-30ml/kg |
| Filtrado glomerular para su uso | Hasta 15ml/min | Hasta 30ml/min | Hasta 60ml/min | Sin límite | Sin límite |
| Factores para respuesta ineficaz | Intoxicación acuosaAntidiuresis de origen nefrogénico | OsmU <350mOsm | |||
| Incremento de NaS esperado | 4mmol/L en 24h | 4mmol/L en 2-7 días60 | ¿? | Variable, habitualmente 2mmol/L en 1.ª 48h | ¿? |
| Riesgo sobrecorrección | <2%61 | ¿? | ¿? | ¿? | ¿? |
| Precauciones/Contraindicaciones | Evitar en embarazoPrecaución CYP3A4 | Insuficiencia renalHepatopatíaRiesgo deshidratación | Hipovolemia | Hipovolemia | Hipervolemia |
ICC: insuficiencia cardíaca congestiva; iSGLT2: inhibidores de simportador Sodio-Glucosa tipo 2; min: minuto; SIAHD: síndrome de secreción inadecuada de hormona antidiurética.
La hiponatremia hipovolémica resulta de la respuesta compensatoria de la ADH ante pérdidas de solutos y agua, ya sea por vía digestiva (vómitos, diarrea, etc.), renal (sobredosificación de diuréticos, tubulopatía, hipoaldosteronismo, insuficiencia suprarrenal primaria)62, o hemorragias. Es fundamental un tratamiento etiológico (p. ej., antieméticos, o interrupción de diuréticos) junto a una adecuada reposición de volumen, ya sea por vía intravenosa u oral.
- a)
Vía intravenosa: recomendamos utilizar suero fisiológico (NaCl al 0,9%), a dosis de 23-30ml/kg-día54, con lo cual se ha visto un alto índice de corrección dentro de los objetivos deseados, junto a un bajo riesgo de sobrecorrección. No obstante, en caso de inestabilidad/shock hemodinámico, primará la reposición masiva de volumen según las guías específicas, vigilando el aumento del NaS y corrigiéndolo cuando precise.
- b)
Vía oral: factible en pacientes clínica y hemodinámicamente estables, con capacidad de ingesta y absorción de líquidos. Se debe garantizar un aporte mínimo de sodio similar al que aportaría 1litro de NaCl 0,9% (equivale a un aporte de 9g de cloruro sódico vía oral), repartido en varias tomas diarias, junto con las comidas para mayor palatabilidad, y con una ingesta suficiente de líquidos.
Es importante mencionar que el tratamiento de la hiponatremia hipovolémica está asociado a riesgo de sobrecorrección, particularmente si se tratan eficazmente otros factores agravantes de la hiponatremia (p. ej., terapia del dolor y las náuseas en un paciente con gastroenteritis aguda e hiponatremia hipovolémica) que resuelvan la etiología del cuadro. Por ello, es importante vigilar la natremia en las primeras 6-8horas tras iniciar la corrección en las hiponatremias moderadas y en las primeras 24horas en las hiponatremias leves, y aplicar, si procede, las medidas necesarias para evitar la sobrecorrección (ver apartado de tratamiento de la sobrecorrección).
Hiponatremia leve-moderada, hipervolémicaLas causas de hiponatremia hipervolémica son fundamentalmente la insuficiencia cardíaca congestiva63, la hepatopatía avanzada64 y el síndrome nefrótico. En todos ellos, a pesar de un volumen de líquido extracelular aumentado, el VCE está disminuido debido al bajo gasto cardíaco (p. ej., insuficiencia cardíaca), a la redistribución de la circulación sanguínea (p. ej., hepatopatía) o a la pérdida de presión oncótica (p. ej., síndrome nefrótico). Es importante evaluar clínica y continuadamente la volemia en estos pacientes, ya que, igual que en los demás tipos de hiponatremia, pueden presentar hiponatremia de otro origen (p. ej., hipovolémica por sobredosificación de diuréticos o hemorragia digestiva), en cuyo caso el tratamiento deberá adaptarse.
El tratamiento de la hiponatremia hipervolémica se basa en la aplicación escalonada de las siguientes medidas:
- a.
Restricción de líquidos: aunque es la primera terapia en las guías de referencia de la patología, a menudo no puede emplearse en pacientes con hepatopatía o cardiopatía avanzadas por la desnutrición que suelen presentar. No obstante, es importante indicar que el paciente sólo debe tomar líquidos cuando tenga sed y monitorizar la ingesta de líquidos y diuresis.
- b.
Diuréticos de asa: inhiben el cotransportador de sodio-potasio-cloro en la rama ascendente del asa de Henle, lo cual reduce la osmolalidad de la médula renal, y por tanto el gradiente osmótico al que se enfrenta la orina en el túbulo colector. Este efecto reduce la reabsorción de agua mediada por la ADH. Por ello, los diuréticos de asa son eficaces para el tratamiento de la hiponatremia hipervolémica y euvolémica. Son la primera línea de tratamiento de la hiponatremia hipervolémica, a dosis de 20-40mg de furosemida cada 8-12horas. Son particularmente eficaces cuando la OsmU es>350mOsm/kg65 y cuando hay una ingesta de sal que garantice su acción (4-5g/día de cloruro sódico).
- c.
Tolvaptán: es un tratamiento indicado para la hiponatremia hipervolémica. El estudio EVEREST demostró eficacia en la hiponatremia hipervolémica por insuficiencia cardíaca, con aumento de natremia de 5-6mmol/L en 7 días66. La dosis necesaria para obtener eficacia es mayor que en SIADH, se inicia con la dosis de 15mg al día y no precisa de control intermedio a las 6horas por menor riesgo de sobrecorrección. No debe administrarse conjuntamente con furosemida en esta situación. Tolvaptán puede asociarse a hipertransaminasemia, por lo que está contraindicado en los pacientes con hepatopatía avanzada, salvo en situación de pretrasplante67, donde, aunque no existe un consenso unánime, se acepta el uso de tolvaptán en hiponatremias refractarias.
- d.
Albúmina: sólo tiene papel en el tratamiento de la hiponatremia hipervolémica por hepatopatía avanzada dentro del tratamiento multidisciplinar de estos pacientes66, dirigido por hepatólogos. La infusión de albúmina intravenosa puede tener un papel adyuvante en el tratamiento de la hiponatremia hipervolémica al restaurar —transitoriamente— la presión oncótica y aumentar el VCE, lo que disminuye el estímulo sobre la ADH. Para su eficacia, es importante mantener de forma constante unos niveles plasmáticos de albúmina cercanos al rango normal, por lo que deberá ser administrada cada 6-8horas, dada su corta vida media. También suele administrarse asociada a la paracentesis, a dosis de> 40g/día.
- e.
Urea: no existe un claro mecanismo de acción de la urea en el tratamiento de la hiponatremia. Se cree que su administración ejerce un efecto osmótico en el túbulo proximal que aumenta la excreción renal de agua libre. Se han descrito casos clínicos de hiponatremia hipervolémica leve-moderada por insuficiencia cardíaca tratada con éxito con urea60, a dosis de 15-60g/día. No obstante, no se trata de estudios aleatorizados por lo que recomendamos seleccionar esta opción de tratamiento de manera individualizada.
- f.
Inhibidores del simportador Sodio-Glucosa tipo 2 (iSGLT2): a pesar de que la diuresis osmótica que producen estos fármacos podría contribuir a corregir la hiponatremia hipervolémica por insuficiencia cardíaca, no hay datos actuales sobre eficacia y posología en esta situación clínica, por lo que su uso como tratamiento de este tipo de hiponatremia deberá quedar relevado a últimas instancias, cuando los tratamientos indicados por los algoritmos no han producido la respuesta deseada o están contraindicados, y en ningún caso como medida para el tratamiento de hiponatremias graves.
Considerando que la situación más frecuente de hiponatremia leve-moderada euvolémica es el SIADH, debemos considerar en primer lugar la necesidad de hacer un diagnóstico de exclusión de otras causas de hiponatremia euvolémica antes del inicio del tratamiento del SIADH. En caso de otras causas, deberemos afrontar el tratamiento etiológico desencadenante (hipocortisolismo, hipotiroidismo, elevación fisiológica de la ADH, uso de fármacos, paraneoplásico, enfermedades respiratorias, etc.) cuando sea factible. De persistir la hiponatremia, o de establecerse el diagnóstico de SIADH, existen distintas opciones de manejo terapéutico:
a) Restricción de líquidos: se basa en que la eliminación renal de agua libre supere el aporte oral y parenteral de líquidos. Aunque en las guías europeas y americanas de tratamiento de la hiponatremia es considerado como el primer tratamiento de la hiponatremia euvolémica42,43, su eficacia no es alta. En el Hyponatremia Registry55, la restricción de líquidos (RL) consiguió una corrección aceptable de natremia solo en el 44% de los pacientes, siendo las tasas de corrección similares entre los que recibieron RL y los que no recibieron tratamiento alguno. Recientemente, en el único ensayo clínico aleatorizado hasta la fecha que evaluó la RL frente el no tratamiento en pacientes con SIADH, se observó que casi un tercio de los pacientes con SIADH tratados con RL no lograron un NaS>130mmol/L después de 3 días de tratamiento68. Sin embargo, la educación en la ingesta de líquidos: «beber sólo con sed y cuando se come»69 parece ser efectiva como tratamiento. De hecho, es probable que esta medida por sí sola pueda ser suficiente para logar la eunatremia en pacientes con hiponatremia crónica leve por SIADH y elevada ingesta hídrica, como muestra una serie retrospectiva de 34 pacientes con SIADH con una edad media de 72 años y un NaS premedida de 130mmol/L, donde el empleo de esta medida por sí sola logró normalizar la natremia en el 76,5% de los casos70.
Se debe tener en cuenta que la RL corrige lentamente la hiponatremia cuando hay respuesta, a razón de 1-2mEq/L cada 24-48horas y por un máximo de 3-4 días, con una mediana de incremento de 3mmol/L al 4.o día, y de 4mmol/L al mes de tratamiento68. Así mismo, aquellos factores considerados como predictores para no eficacia de la RL42,54 (OsmU<500mOsm/kg, diuresis <1500ml/día y un índice de Furst>1) pueden ser vistos en casi el 60% de pacientes con SIADH71, limitando su aplicabilidad. Por ello, si el objetivo de tratamiento es lograr un aumento de NaS mayor de 4-5mmol/L, y es necesario mantenerlo en el tiempo, o si coexisten factores que puedan conducir a un rápido deterioro de la natremia (p. ej., procedimientos invasivos o inicio de tratamientos que requieran un gran aporte de líquidos por vía parenteral), la RL no debería ser la primera elección de tratamiento72. Además, diversos factores, que se detallan a continuación, deberán tenerse en consideración antes de iniciar un tratamiento con RL:
- •
La función renal debe estar preservada. Aunque con un filtrado glomerular>30ml/min puede mantenerse una capacidad de excreción de agua libre en personas sanas, la capacidad de mantener un completo equilibrio hídrico ya podría verse disminuida a partir de filtrados de <60ml/min73 en algunos individuos, fundamentalmente en adultos mayores.
- •
Debe existir capacidad para excretar agua libre. Para lo cual se utiliza el índice de Furst74 (cociente Na urinario+K urinario/Na plasma), cuya interpretación es la siguiente:
- i.
Índice de Furst>1: mínima o nula eliminación de agua libre urinaria, no se recomienda RL.
- ii.
Índice de Furst 0,5-1: escasa eliminación de agua libre urinaria. Si se procede a RL, debe ser <0,5L/día, algo clínicamente inviable y que atenta al estado nutricional. Por lo tanto, no recomendamos el empleo de RL.
- iii.
Índice de Furst <0,5: eliminación suficiente de agua libre urinaria. Se puede proceder a RL moderada de líquidos con aporte de hasta 1L/día. Valorar uso si existe viabilidad clínica.
- •
No debe existir una situación clínica que impida restringir el aporte de líquidos. La RL se encuentra contraindicada en las siguientes situaciones:
- iv.
Imposibilidad de colaboración del paciente.
- v.
Desnutrición, ya que dificultaría la recuperación del estado nutricional.
- vi.
Necesidad de aporte de fluidoterapia parenteral indispensable que en conjunto equiparen o superen el 1L/día.
- vii.
Situaciones climatológicas adversas: altas temperaturas, baja humedad.
b) Diuréticos de asa: por el mecanismo de acción referido anteriormente (ver apartado hiponatremia hipervolémica), los diuréticos de asa son eficaces para el tratamiento de la hiponatremia euvolémica, particularmente cuando la OsmU es>350mOsm/kg65. A día de hoy, no existen ensayos clínicos aleatorizados que documenten la eficacia, seguridad y la evolución de los pacientes con hiponatremia euvolémica tratados con diuréticos de asa específicamente por esta indicación.
c) Tolvaptán: los inhibidores del receptor V2 aumentan la excreción de agua libre y la natremia75. Actualmente, son los fármacos con mayor evidencia para el tratamiento de la hiponatremia euvolémica leve-moderada, basada en resultados de ensayos clínicos y de estudios en vida real de hasta 4 años de tratamiento64. Así mismo, ha mostrado resultados de eficacia en su utilización en el SIADH transitorio tras cirugía neuroquirúrgica76. No obstante, su uso debe ser dirigido por personal entrenado en el campo de la hiponatremia y con las condiciones hospitalarias adecuadas que permitan una actuación a domicilio en caso de sobrecorrección. A continuación, detallamos adaptado el protocolo de inicio de tratamiento con tolvaptán del Servicio de Endocrinología y Nutrición del Hospital Clínico San Carlos, basado en un régimen de monitorización de 2 días seguidos, el cual ha demostrado una tasa de éxito para lograr eunatremia en 48horas del 66,7%, con una tasa de sobrecorrección del 0%77.
Protocolo de inicio de tolvaptán- i.
Día 1.o de tratamiento. Se extrae analítica basal pretratamiento. Comenzar dosis de 7,5mg a primera hora de la mañana, 20 minutos antes del desayuno, indicando al paciente beber libremente según la sed. Monitorizar parámetros analíticos en sangre y orina a las 6, 24 y 48horas (fig. 4).
- ii.
Si el NaS a las 6horas aumenta <5mmol/L, no es precisa ninguna actuación y se espera hasta el segundo control analítico a las 24horas. Si la corrección fue ≥5mmol/L se instaura el protocolo de «frenado»: administrar 2μg de desmopresina subcutánea si el incremento solo fue de 5mmol/L, y además una infusión intravenosa de dextrosa/glucosa 5% a razón de 2ml/kg/h durante 2horas en caso de un incremento de 6mmol/L en el NaS o de 3ml/kg/h durante 3horas en caso de un incremento de NaS>8mmol/L.
- iii.
Día 2.o de tratamiento. Se extrae analítica para control de 24horas. Si el paciente había logrado una corrección de NaS≤8mmol/L, se aumentará la dosis de tolvaptán a 15mg en las mismas condiciones de administración que el día anterior. Aquellos pacientes que superen el umbral señalado, continuarán con la dosis de 7,5mg. En caso de que el paciente hubiera requerido del protocolo de «frenado», la dosis de tolvaptán a administrar sería de 7,5mg, igualmente si el paciente tiene bajo peso (<45kg) se recomienda mantener dicha dosis en el segundo día.
- iv.
Día 3.o de tratamiento. Se extrae analítica para control a las 48horas. Si el paciente logra el objetivo de eunatremia, continuará con dosis previa. En caso de no alcanzar el objetivo, se duplicará la dosis respecto al día previo.
- v.
Día 4.o o 7.o de tratamiento. Se extrae analítica para control y ajuste de tratamiento de cara al seguimiento.
- i.
Control analítico y clínico en una semana tras el inicio de tratamiento, indicando siempre beber libremente según sed.
- ii.
Si eunatremia, mantener mínima dosis de tolvaptán en función de la presencia de aumento de sed o diuresis referida por el paciente.
- i.
Inicialmente se recomienda hacer un seguimiento estrecho (p. ej. a la semana del alta, después cada mes, y a largo plazo cada 3 meses) del paciente tratado de forma ambulatoria con tolvaptán, en el que se debe valorar analítica y clínicamente al paciente, considerando reducciones de dosis de un 50% según tolerancia hasta la retirada completa de ser posible (fig. 5).
Figura 5.Protocolo de ajuste del tratamiento ambulatorio de tolvaptán en pacientes con síndrome de secreción inadecuada de ADH (SIADH)65.
NaS: natremia sérica; SG: suero glucosado; TV: tolvaptán.
- ii.
Es imprescindible una precaución especial ante posibles situaciones de hipovolemia intercurrente (diarrea, enfermedad, falta de acceso al agua, etc.) que obligan a suspender el tratamiento y a una actitud vigilante y proactiva de tratamiento de la hipovolemia. Debe informarse al paciente y sus familiares de la actitud proactiva en estas situaciones y del riesgo de hipernatremia en caso de pérdidas de líquidos o intolerancia oral.
d) Urea: La suplementación con urea produce un incremento en la uremia que condiciona diuresis osmótica. Pese a su uso como alternativa clásica en el manejo de la hiponatremia por SIADH, disponemos de escasa evidencia que avale su eficacia y seguridad, siendo habitualmente retrospectiva y sin grupo placebo78. Los análisis de series de casos disponibles sugieren una menor frecuencia de sobrecorrección, y no se han descrito casos de desmielinización osmótica asociados al tratamiento con urea79,80.
No existen estudios comparativos entre urea y tolvaptán, salvo un estudio con importantes limitaciones de 12 pacientes que entrecruza la utilización de urea y vaptanes (solo 2 pacientes tratados con tolvaptán, el resto con satavaptán), mostrando aparentemente una eficacia similar en ambos grupos81.
Por la limitación de falta de evidencia con metodología sólida, su uso no sería de primera elección en el tratamiento de la hiponatremia si se dispone de vaptanes, excepto en el síndrome de inadecuada antidiuresis nefrogénica, en el cual una mutación activante de los receptores V2 haría de poca utilidad el tratamiento con vaptanes, pero la respuesta a urea se mantendría82. Mención aparte merece el abordaje de la polidipsia primaria, donde el tratamiento con urea se ha mostrado como una opción terapéutica eficaz en casos refractarios83.
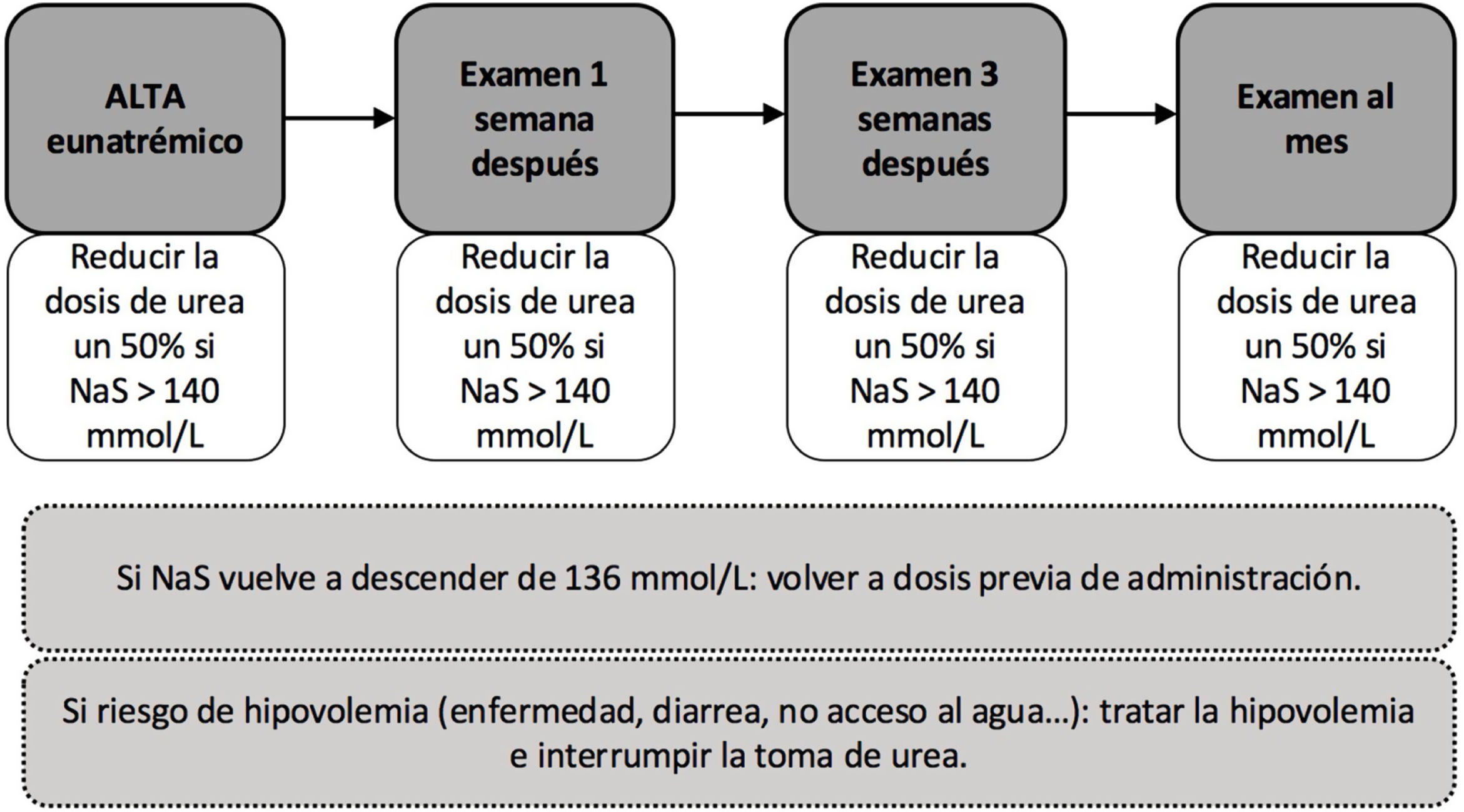
Para el tratamiento con urea, se debería plantear iniciar tratamiento con dosis de 15g/día84, y, posteriormente, valorar aumentar o reducir dosis en función de los controles de NaS. En nuestro conocimiento, no existe un protocolo validado para su inicio ni para el seguimiento posterior. En base a nuestra experiencia, así como al frecuente inicio de tratamiento de forma ambulatoria y al efecto más diferido de la urea en el incremento de la natremia frente al tolvaptán, recomendamos monitorizar a las 24 y 48horas de su inicio, y en función del incremento de natremia, valorar ajustar la dosis de urea.
Protocolo de inicio de urea- i.
Día 1.o de tratamiento. Se extrae analítica basal pretratamiento. Comenzar dosis de 15g a primera hora de la mañana (fig. 6).
- ii.
Día 2.o de tratamiento. Se extrae analítica para control de 24horas. Si se superan los límites de corrección, se debe omitir la dosis, de lo contrario, continuar con dosis de 15g.
- iii.
Día 3.o de tratamiento. Se extrae analítica para control a las 48horas. Si el paciente logra el objetivo de eunatremia, continuará con la dosis previa. En caso contrario, se aumentará a 30g/día.
- iv.
Día 7.o de tratamiento. Se extrae analítica para control y ajuste de tratamiento de cara al seguimiento.
Al igual que con el tolvaptán, se debe realizar un seguimiento inicialmente estrecho e intentar reducir la dosis progresivamente hasta su retirada. Así mismo, ante estados de hipovolemia, su retirada o disminución de dosis sería necesaria (fig. 7).
e) Inhibidores iSGLT2: recientemente en un ensayo clínico se ha demostrado que empaglifozina a dosis de 25mg/día fue más eficaz en el tratamiento de la hiponatremia por SIADH en comparación con placebo, con una proporción de pacientes con diabetes del 14% en ambas ramas85, observándose a los 4 días de tratamiento una mediana de incremento de 10mmol/L en el NaS en la rama con empagliflozina versus 7mmol/L en el grupo control. No obstante, aunque el futuro de este fármaco parece ser prometedor en este campo, no existe mayor evidencia para poder ser recomendado actualmente como un tratamiento específico del SIADH, por lo que su uso para esta indicación debería restringirse a situaciones clínicas individualizadas en las que otras medidas no sean eficaces o disponibles.
f) Otras medidas accesorias en el manejo de la hiponatremia euvolémica:
- •
Aporte de Na: aunque la hiponatremia es un trastorno por exceso relativo de agua, para restablecer la eunatremia debemos asegurar que haya un adecuado aporte de sal. De forma general, recomendamos añadir 1-2g de sal común en cada comida o administrar una infusión compuesta por 20ml de NaCl al 20% diluidos en 500ml de NaCl 0,9% en 24horas.
- •
Aporte de potasio: el potasio es el principal agente osmótico intracelular. Dado su intercambio con el sodio, tanto a nivel tisular como en el túbulo renal, el aporte de potasio, sobre todo en hipopotasemia, facilita el incremento de la natremia. En caso de necesitarse aporte intravenoso, es recomendable aportar los requerimientos en forma de cloruro potásico. No recomendamos el aporte de bicarbonato potásico, salvo situaciones de hipopotasemia asociada a acidosis metabólica (p. ej., acidosis tubular renal tipo 2 o el uso de acetazolamida), ya que el bicarbonato puede excretarse por la orina unido a sodio, pudiendo inducir hipovolemia y dificultando la recuperación de la hiponatremia y de la hipopotasemia debido a su intercambio en la nefrona distal con el sodio, así como generar un estado alcalótico que también dificultará la corrección de los niveles de potasio.
En los pacientes con nutrición artificial, la prevalencia de hiponatremia es superior a la descrita en población hospitalaria general, objetivándose una frecuencia de un 23% en pacientes con nutrición enteral86 y un 30% en pacientes con nutrición parenteral87. A su vez, se ha identificado el SIADH como la etiología más frecuente, justificando el 46% de las hiponatremias de los pacientes con nutrición parenteral88 y el 67% de los pacientes con nutrición enteral89. Respecto a sus consecuencias, la hiponatremia asocia una elevada morbimortalidad en estos pacientes, sobre todo la hiponatremia persistente90, por lo que es conveniente instaurar el tratamiento de forma precoz. Al igual que en los pacientes sin nutrición artificial, el tratamiento del SIADH debe ser individualizado, teniendo en cuenta las particularidades de cada tipo de soporte nutricional.
En el caso de los pacientes con nutrición parenteral, en la selección del tratamiento no influirá su capacidad renal para eliminar agua libre. Según el subanálisis de un estudio multicéntrico sobre la etiología de la hiponatremia en nutrición parenteral, en el 80% de los pacientes con SIADH a los que se les pautó un incremento del aporte de sodio junto a restricción hídrica, el aporte medio de volumen recibido fue de 2,5L90. Este hallazgo pone de manifiesto la dificultad de restringir el aporte de líquidos a menos de 1L en estos pacientes, por lo que esta medida no es recomendada. A su vez, el 70% presentaron una OsmU>350mOsmol/kg, lo que indica una probable respuesta acuarética a la furosemida65, por lo que la administración inicial de furosemida sería una opción acertada. El uso de furosemida debe acompañarse de un aporte mínimo de unos 136mEq de sodio/día, para garantizar su acción terapéutica, así como de una restricción parcial de los líquidos innecesarios, es decir, concentrar la medicación intravenosa, y si es posible, la fórmula de nutrición parenteral. Ante una escasa/nula respuesta a la pauta previa (elevación del NaS≤2mmol/L/día), podría administrarse tolvaptán en pacientes con el primer tramo del tubo digestivo funcionante. La dosis de inicio de tolvaptán será de 7,5mg y se acompañará de una infusión de suero glucosado, según se muestra en el esquema adjunto (fig. 8)91. El tratamiento se mantendrá hasta que se solvente la etiología del SIADH.
En cuanto a los pacientes con nutrición enteral, recomendamos reducir el aporte total de líquidos a <1L/día si fuera factible. En su defecto, y en los pacientes con un índice de Furst>0,5, se recomienda añadir furosemida si la OsmU es>350mOsmol/kg, acompañada de un aporte mínimo de sodio de 136mEq/día para garantizar su acción terapéutica. Si a pesar de ello no se logra la eunatremia, se recomienda iniciar tolvaptán o urea por la sonda nasogástrica o por la gastrostomía. En el caso de tolvaptán, se iniciaría siguiendo el mismo protocolo que para los pacientes con nutrición artificial por vía parenteral (fig. 8). Por el contrario, si se utiliza urea, se recomienda comenzar con 15g/día, realizando un control de natremia cada 24horas. Si el incremento del NaS es <8mEq/día y persiste la hiponatremia, se recomienda aumentar la dosis a 30g/día. Si persiste la hiponatremia a las 48horas, se recomienda incrementar la dosis a 45g/día. Al igual que en los pacientes con nutrición parenteral, el tratamiento con tolvaptán o con urea se mantendrá hasta el cese de la causa del SIADH.
En los pacientes con hiponatremia que reciben nutrición artificial, tanto si se trata de nutrición enteral como parenteral, es preciso monitorizar estrechamente el NaS durante su hospitalización (p. ej., cada 72horas), adaptando el tratamiento a las múltiples situaciones clínicas que acontezcan. Por el contrario, a nivel ambulatorio, sería prudente disponer de un control de NaS a la semana del alta, mensualmente durante los 3 primeros meses y posteriormente cada 3 meses si hay estabilidad clínica. En los pacientes con SIADH crónico, se recomienda evitar el uso de furosemida como tratamiento de mantenimiento, dado que requiere un mayor aporte de sodio para mantener su efecto terapéutico, además del riesgo de hipopotasemia al que se puede asociar91.
Tratamiento de la sobrecorrección de la hiponatremiaLa sobrecorrección se define como un aumento de la natremia superior a los límites establecidos inicialmente como seguros en cada caso individual (tabla 6). De forma general, no suele ser necesario adoptar medidas de reajuste en los pacientes con hiponatremia aguda. Sin embargo, en los pacientes con hiponatremia crónica, es preciso, de forma habitual, contrarrestar el cambio rápido de la natremia debido al potencial riesgo de un desequilibrio osmótico que pueda condicionar la aparición del SDO. Para ello, las guías recomiendan disminuir el NaS mediante el uso de agua por vía enteral, suero glucosado 5% (2-3ml/kg/h) y/o desmopresina (2-4μg i.v. o s.c.)43.
En nuestra experiencia, recomendamos adoptar medidas de prevención de sobrecorrección con la administración aislada de desmopresina en el caso de una elevación del NaS superior a 5mmol/L en las primeras 6horas. En caso de que el incremento del NaS supere el objetivo planteado para las primeras 24horas (tabla 6), una medida terapéutica de re-descenso de la natremia, compuesta del aporte de desmopresina y/o suero glucosado, debe ser instaurada. La desmopresina puede ser administrada en dosis de 1-3μg subcutánea o intravenosa, y en intervalos de 8-12horas, y el suero glucosado será del 5% a una dosis de 3-4ml/kg de peso/h por 4horas, realizando una medición posterior de la natremia. La infusión se puede repetir hasta que se recupere el nivel inferior al límite terapéutico de las primeras 24horas, o entrar en el límite terapéutico de las 48horas42. Cabe señalar que las terapias dirigidas para la corrección de la hiponatremia (suero fisiológico, furosemida, tolvaptán, urea, SSH 3%) deben ser detenidas cuando se inicie la terapia de re-descenso de la natremia.