El carcinoma anaplásico de tiroides (CAT) es un tumor indiferenciado que deriva del epitelio folicular, infrecuente y extremadamente agresivo. Presenta una incidencia anual de uno a dos casos por cada millón de habitantes y representa 1-2% de todos los cánceres de tiroides1. Se manifiesta generalmente entre la sexta y séptima década de la vida, con una mayor incidencia en mujeres. Los factores de riesgo para el diagnóstico de CAT son, por un lado, el bajo nivel educativo y la presencia de bocio previo (ambos factores probablemente relacionados con el déficit de yodo), el grupo sanguíneo B y la obesidad2,3.
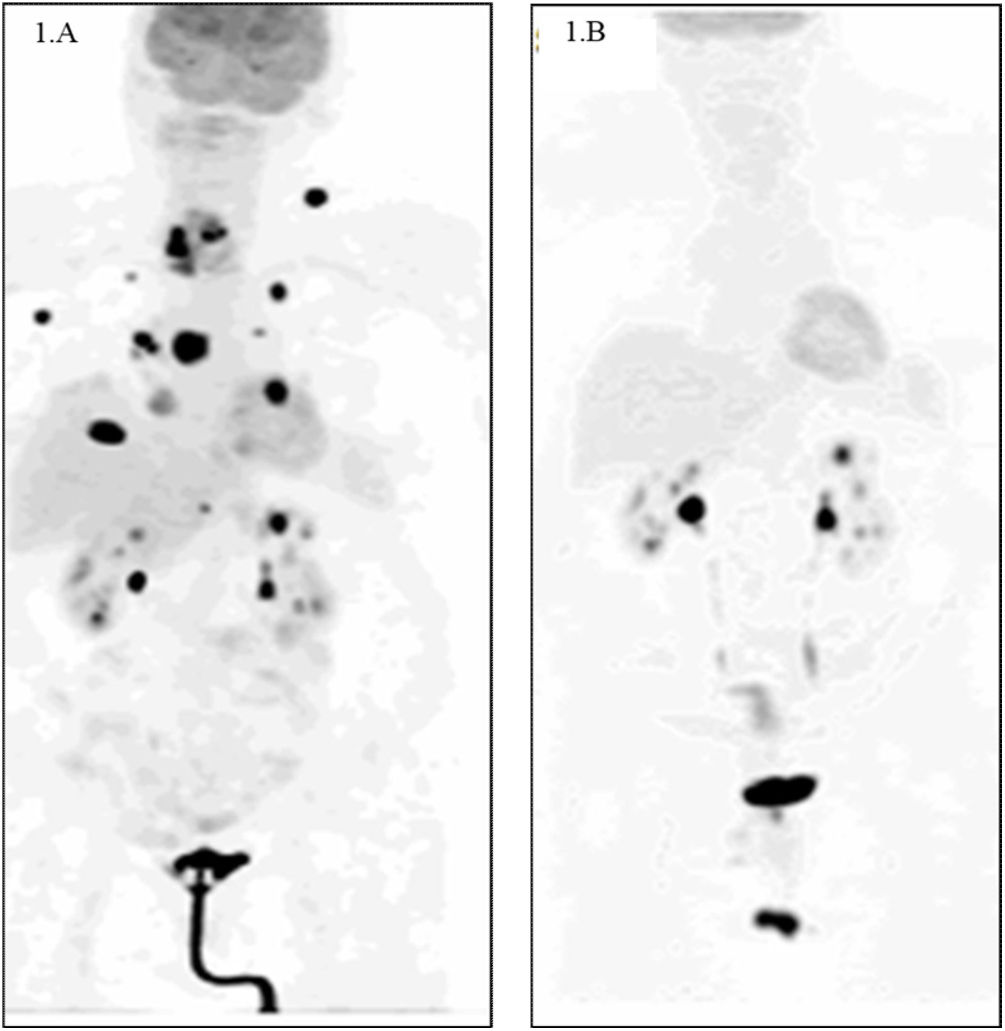
Presentamos el caso de una mujer de 76 años con hernia de hiato por deslizamiento y reflujo gastroesofágico como antecedentes personales de interés, que ingresa en junio del año 2020 en la Unidad de Cuidados Intensivos por cuadro de disnea progresiva de 15 días de evolución asociada a tos no productiva y disfagia para sólidos. Las constantes vitales en el momento del ingreso eran tensión arterial 190/120 mmHg, frecuencia cardiaca 135 lpm y saturación de oxígeno basal 65%, por lo que precisó intubación orotraqueal y conexión a sistema de ventilación mecánica. Tras descartar infección por SARS-CoV-2, se realizó angiotomografía computarizada excluyendo tromboembolismo pulmonar, evidenciándose la presencia de una masa hipodensa que parecía depender del lóbulo tiroideo derecho sugerente de proceso neoformativo. Se completó el estudio con tomografía computarizada (TC) de cuello observándose una masa sólida, hipodensa, heterogénea, con calcificaciones de 43 x 34 x 44 mm que provocaba invasión de la luz traqueal por infiltración de la pared posterolateral derecha de la tráquea sin adenopatías laterocervicales de tamaño significativo. Ante la sospecha clínica de CAT, se decidió realizar biopsia con aguja gruesa (BAG), obteniéndose fragmentos de tejido compuesto predominantemente por necrosis avascular, con pequeños focos de células tumorales de hábito plasmocitoide, con abundante citoplasma y núcleo desplazado a la periferia. En el estudio inmunohistoquímico se observó expresión positiva nuclear débil para PAX-8 y TTF 1 y expresión débil para CD56, con ausencia de expresión para tiroglobulina, calcitonina, sinaptofisina y cromogranina. El índice de proliferación Ki-67 era bajo, pero la interpretación resultó dudosa por la presencia de intensa necrosis en la muestra. Con estos hallazgos se emitió el diagnóstico de CAT. Se realizó tomografía por emisión de positrones con 18F-fluorodesoxiglucosa (PET/FDG) en el que se observaba masa cervical derecha con incremento de la actividad metabólica con una SUVmáx de 28,5 e imágenes sugestivas de metástasis pulmonares bilaterales múltiples, ganglionares (en zona supraclavicular derecha y axilar izquierda), musculares y en aurícula derecha (fig. 1A).
A) Tomografía por emisión de positrones con 18F-fluorodesoxiglucosa (PET/FDG) al diagnóstico. Se observa masa cervical derecha con incremento de la actividad metabólica con una SUVmáx de 28,5 e imágenes sugestivas de metástasis pulmonares bilaterales múltiples, ganglionares (en zona supraclavicular derecha y axilar izquierda), musculares y en aurícula derecha. B) PET/FDG tras 11 meses de tratamiento con inhibidores de BRAF/MEK (drabefenib-trametinib). Se observa involución morfometabólica de la masa cervical derecha, con desaparición de las lesiones metastásicas a todos los niveles.
Tras el diagnóstico de CAT y en espera del estudio molecular para detectar la presencia de la mutación del gen BRAFV600, que resultó positiva, en junio de 2020 la paciente recibió dos ciclos de quimioterapia sistémica con carboplatino y paclitaxel y dos ciclos de radioterapia (RT) paliativa sobre la lesión tiroidea añadiendo un margen de 1 cm por sangrado activo por la traqueostomía, con una dosis total de 16 Gy. Asimismo, recibió soporte nutricional por gastrostomía endoscópica percutánea (PEG). En julio de 2020 se inició tratamiento con drabafenib 300 mg diarios + trametinib 20 mg diarios en fórmula líquida adaptada por PEG, con respuesta clínica favorable. Tras 11 meses de tratamiento con inhibidores de BRAF/MEK, en el PET-FDG de control se observó una involución morfometabólica de la masa cervical derecha con desaparición de las lesiones metastásicas a todos los niveles (fig. 1B). En agosto de 2021 se realizó tiroidectomía total sin complicaciones con resultado anatomopatológico de pieza de tiroidectomía total con áreas de fibrosis sin evidencia de neoplasia residual. En el momento actual la paciente se encuentra estable, sin datos de recidiva de su proceso de base y no precisa PEG ni traqueostomía.
El CAT es un tumor que clásicamente tenía muy mal pronóstico, con una supervivencia global de 20% al año del diagnóstico4, y que ocasionaba más de la mitad de las muertes asociadas al cáncer de tiroides a pesar de su baja incidencia. La supervivencia a los dos años del diagnóstico es muy infrecuente, aunque hay series de casos publicadas previas a la utilización de inhibidores de BRAF/MEK, en las que se describe una supervivencia a 10 años que oscila entre 3-10% en pacientes sin enfermedad metastásica, a diferencia de nuestro caso5,6.
Los grandes avances producidos en el conocimiento del CAT han propiciado un cambio de paradigma en el manejo de esta enfermedad que ha quedado reflejado en las guías publicadas en los últimos años7,8. En primer lugar, en los estadios IVa y IVb, si el tumor se considera resecable, se debe realizar un abordaje quirúrgico llevando a cabo una tiroidectomía total con linfadenectomía central-lateral profiláctica o terapéutica7,8, teniendo en cuenta que cirugías más agresivas que incluyan laringuectomía o resecciones traqueales o esofágicas no están recomendadas de manera rutinaria8. En CAT estadio IVc, la cirugía paliativa puede considerarse en casos seleccionados tales como procedimientos preventivos en los que exista un compromiso inminente de la vía área, resecciones de enfermedad locorregional por enfermedad metastásica sintomática o en casos con metástasis a distancia en número escaso8. Por último, en aquellos casos con CAT irresecable durante la evaluación inicial, si tras la administración de RT, quimioterapia sistémica o inhibidores de BRAF/MEK, existe una posibilidad de cirugía, se debe replantear el tratamiento quirúrgico8, tal y como sucedió en nuestro caso, en el que inicialmente el tumor se consideró irresecable por la amplia afectación locorregional y metastásica, realizando una tiroidectomía total tras 13 meses de tratamiento sistémico por la excelente respuesta clínica de la paciente. Este esquema terapéutico de inicio de terapia sistémica con inhibidores BRAF/MEK y posterior cirugía se ha asociado con aumento de la supervivencia global9.
En el CAT estadio IVc, la quimioterapia sistémica con doxorrubicina, taxanos (entre los que se incluye el paclitaxel) y derivados de platino se ha considerado el tratamiento de elección, bien de manera aislada o bien asociada a la RT de intensidad modulada8. En nuestro caso, en espera del resultado del estudio genético, se inició tratamiento con quimioterapia sistémica y se administró RT paliativa por sangrado del tumor. Antes de iniciar el tratamiento sistémico, en todos los pacientes con CAT se debe evaluar la presencia de la mutación BRAFV600, que está presente en más de 70% de los casos10, para así poder plantear una terapia dirigida con inhibidores de BRAF/MEK (drabafenib y trametinib), aprobada desde 2018 por la Food and Drug Administration (FDA) de EE. UU. para el tratamiento de aquellos pacientes con CAT con presencia de mutación BRAFV600. Tal y como recogen las Guías de Práctica Clínica publicadas en 2021 por la American Thyroid Association8, este tratamiento está indicado como primera elección en pacientes con CAT con presencia de mutación BRAFV600 estadio IVc y estadio IVb irresecable y que rechazan la RT con un nivel de recomendación fuerte.
Como conclusión, el abordaje multidisciplinar y los avances terapéuticos de los últimos años en el manejo de los pacientes con CAT han contribuido a mejorar la supervivencia global en estos casos, incluso en pacientes con estadios avanzados de la enfermedad.