According with the principles of “green” chemistry, asymmetric organocatalysis aims to become a sustainable strategy to catalyze a wide range of chemical transformations. Furthermore, during the last decade the application of solvent-free methodologies has transformed asymmetric organocatalysis into an even “greener” alternative, avoiding the use of volatile, toxic and expensive reaction media. In this article, we review some recent salient examples of solvent-free strategies that have converted asymmetric organocatalysis into a more sustainable synthetic methodology.
Desde el renacimiento de la organocatálisis a inicios de la década pasada, esta área ha experimentado un crecimiento vertiginoso que la ha convertido en uno de los campos de trabajo con mayor desarrollo dentro de la química orgánica. Actualmente, la organocatálisis junto a la catálisis mediante metales y a la biocatálisis constituyen los tres pilares de la catálisis asimétrica (figura 1).
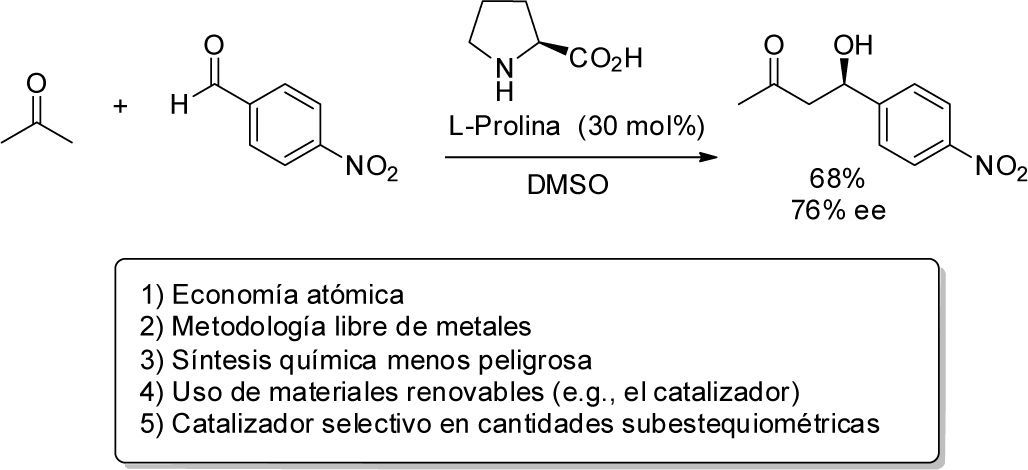
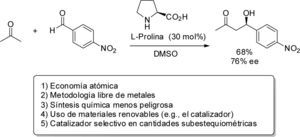
El hecho de que los procesos organocatalíticos empleen moléculas orgánicas para favorecer la activación de sustratos sin que se involucre un átomo metálico en el núcleo activo del catalizador, convierte a la organocatálisis en una opción “verde” para llevar a cabo transformaciones químicas. Es así, como desde el primer ejemplo reportado por List, Barbas y Lerner (2000) de una reacción aldólica intermolecular organocatalizada por L-prolina, fue evidente que además de la novedad de usar una molécula orgánica como catalizador, este descubrimiento también correspondía a un proceso “verde”. Por una parte, la economía atómica de la reacción aldólica directa se ve incrementada en un proceso organocatalítico debido a que no requiere del uso de enolatos preformados. Además, la ausencia de metales en las reacciones organocatalizadas las convierte en metodologías menos tóxicas o riesgosas, y en muchos casos más económicas debido a que en comparación con los metales preciosos o de transición, compuestos orgánicos como la L-prolina son usualmente más estables, menos costosos, más seguros y fáciles de aplicar a una gran cantidad de sustratos. Todos estos aspectos sumados al hecho de que la L-prolina fue usada por List, Lerner y Barbas (2000) como catalizador quiral en cantidades subestequiométricas demuestran que la reacción aldólica asimétrica satisface varios de los atributos esenciales asociados con la química “verde” (esquema 1).
Sin embargo, durante los últimos diez años se han realizado grandes esfuerzos para convertir las reacciones organocatalizadas en procesos mucho más sostenibles. En su mayoría las mejoras han estado dirigidas hacia el desarrollo de organocatalizadores más selectivos, el diseño de técnicas de activación más eficientes, la aplicación de reacciones multicomponente, la implementación de procesos en flujo continuo, la inmovilización de organocatalizadores para facilitar su recuperación y reuso, la optimización de los protocolos de purificación y la búsqueda de medios de reacción (ej. disolventes) más seguros. En relación con esta última estrategia, destacan los trabajos empleando como medio de reacción líquidos iónicos, fluidos supercríticos, agua o carbonatas cíclicos. Sin embargo, a pesar de las bondades asociadas a cada uno de estos medios de reacción todos presentan desventajas relacionadas con su proceso de síntesis, reciclaje, toxicidad, o costo, entre otras (Hernández y Juaristi, 2012a).
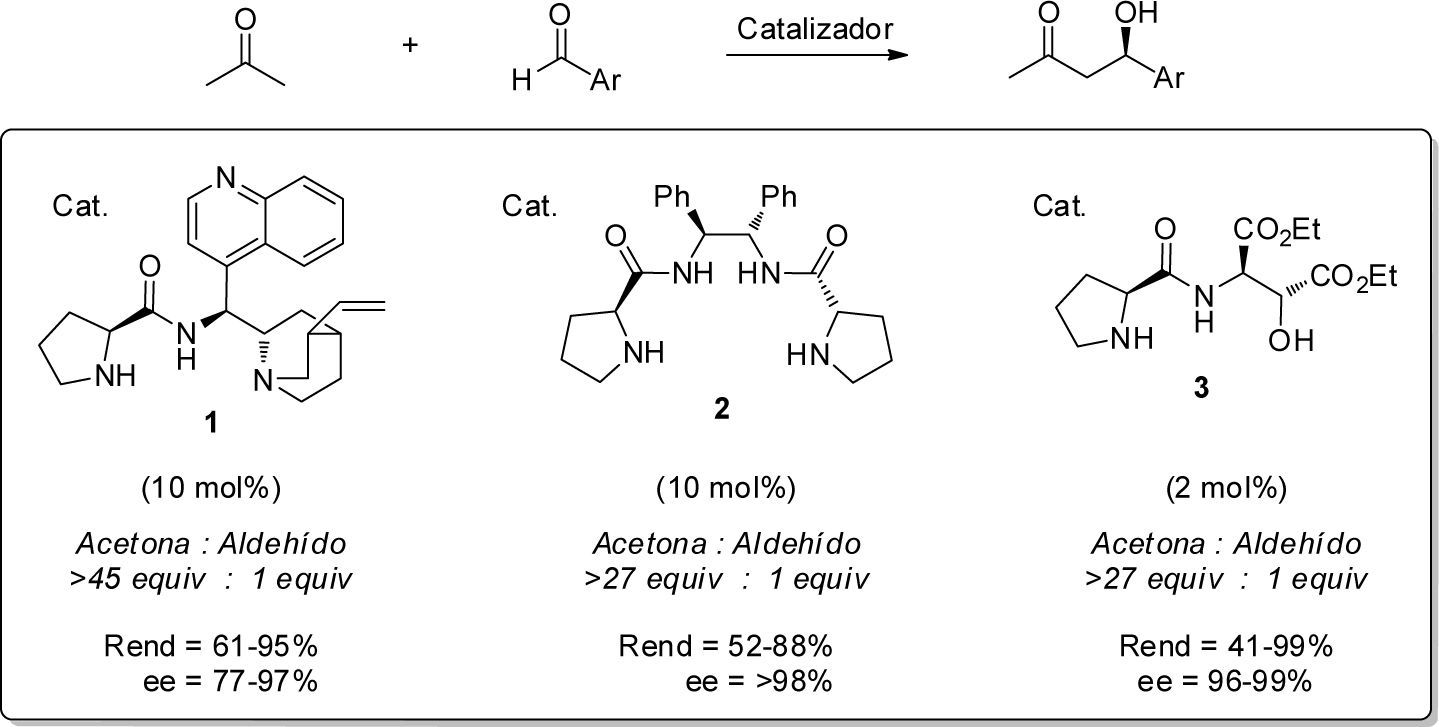
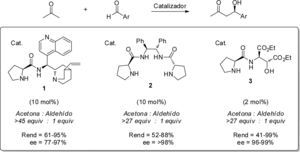
Reacciones asimétricas organocatalizadas en ausencia de disolventeUna manera de evitar los inconvenientes relacionados con el uso de disolventes orgánicos u otros medios de reacción ha sido el desarrollo de metodologías en ausencia de disolvente. En ese sentido, se sabe que en las reacciones aldólicas organocataüzadas entre cetonas y aldehidos es posible eliminar el disolvente orgánico al emplear un gran exceso de cetona, que actúa entonces simultáneamente como nucleófilo y como medio de reacción. En particular, Samanta et al. (2005), Tang et al. (2005) y Chen et al. (2008) reportaron la reacción aldólica entre aldehidos aromáticos y acetona (27-45 equiv.) en ausencia de disolvente. Bajo estas condiciones de reacción, los organocatalizadores 1-3 generaron los productos aldólicos con buen rendimiento y excelente enantioselectividad. Inclusive, en el caso de la prolinamida (1) la reacción en ausencia de disolvente superó los resultados de ensayos empleando disolventes tradicionales como CHC13, CH2C12, THF, DMF o agua (esquema 2).
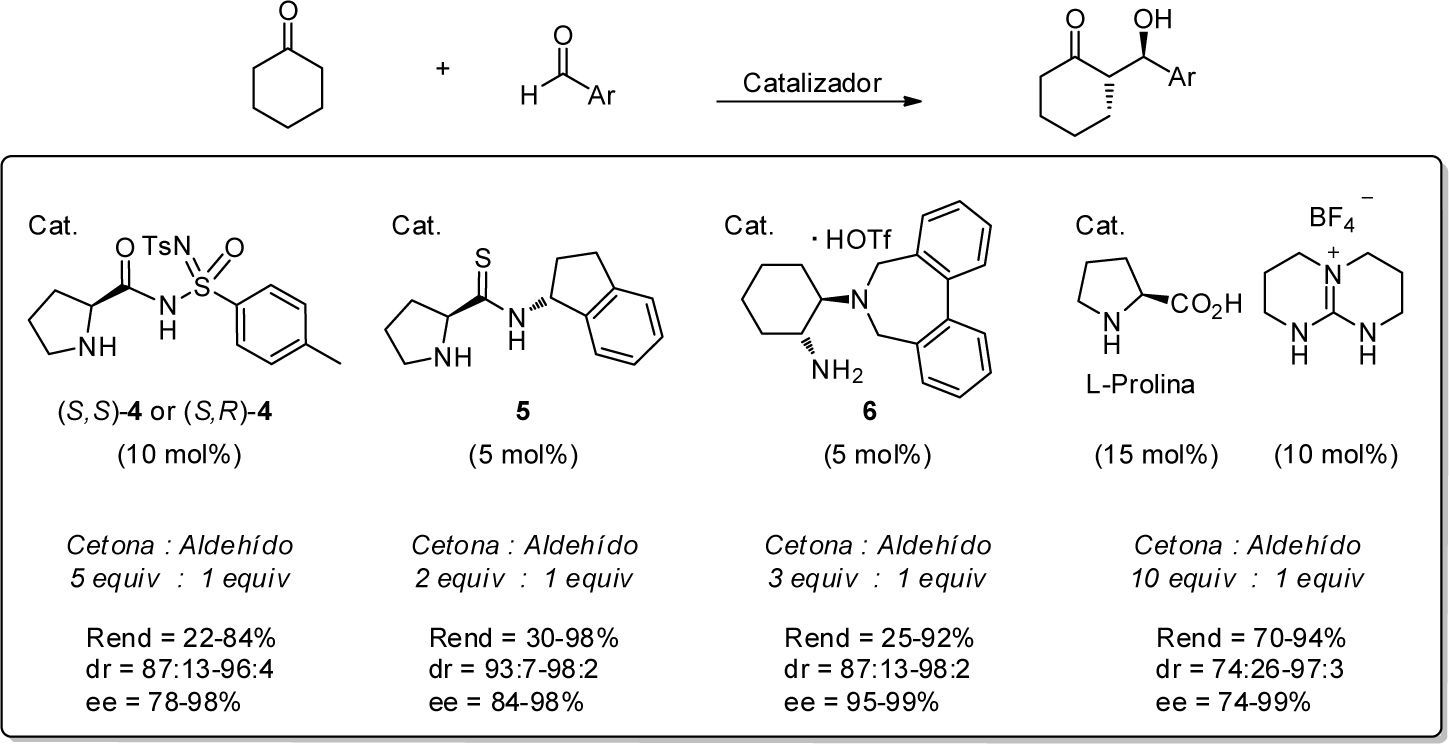
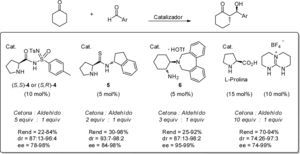
Una alternativa mucho más “verde” consiste en el uso de cantidades casi equimolares de los reactivos de partida en la reacción aldólica. Uno de los primeros ejemplos fue reportado por Worch et al. (2009) cuando las (S,S)- y (S,R)-sulfonimidamidas (4) catalizaron la reacción aldólica en ausencia de disolvente, empleando únicamente cinco equivalentes de ciclohexanona. La reacción generó los aductos aldólicos con muy buenos rendimientos y con buena a excelente estereoselectividad. Asimismo, Almşi y colaboradores (2009) evaluaron una serie de prolinamidas y prolinatioamidas como organocatalizadores de la reacción entre aldehidos aromáticos y varias cetonas. En particular, la prolinatioamida (5) demostró ser un excelente catalizador cuando se emplearon sólo dos equivalentes de ciclohexa-nona. Recientemente, Lygo et al. (2011) y Castañeda-Martínez et al. (2011) también reportaron reacciones aldólicas en ausencia de disolvente, usando tres y 10 equivalentes de nucleófilo, respectivamente. Ambos procesos generaron los productos aldólicos anti con buena diastereo- y enantioselectividad al usar como organocatalizadores la diamina (6) o la L-prolina (esquema 3).
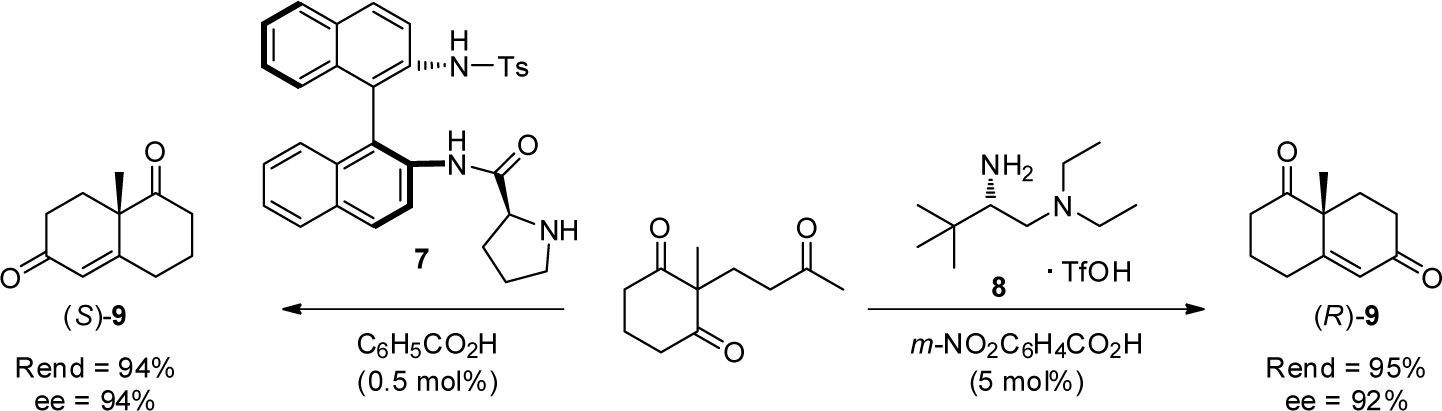
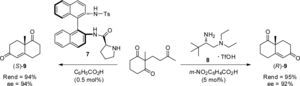
Asimismo, la versión intramolecular de la reacción aldó-lica conocida como anulación de Robinson y hoy considerada como la referencia histórica de los procesos organocatalizados (Hajos, 1971, 1974; Eder, 1971), también ha sido estudiada en ausencia de disolvente. Por ejemplo, Bradshaw et al. (2009, 2011) y Zhou et al. (2012) reportaron la reacción aldólica intramolecular usando como organocatalizadores la binam-prolinamida (7) (2 mol%) y la diamina quiral (8) (10 mol%), respectivamente. Ambos procedimientos generaron las cetonas cíclicas con buen rendimiento y notable enantioselectividad. En particular, estas metodologías fueron aplicadas exitosamente en la obtención de la cetona de Wieland-Miescher (9), un reconocido sintón en la síntesis total de productos naturales (Bradshaw y Bonjoch, 2012) (esquema 4).
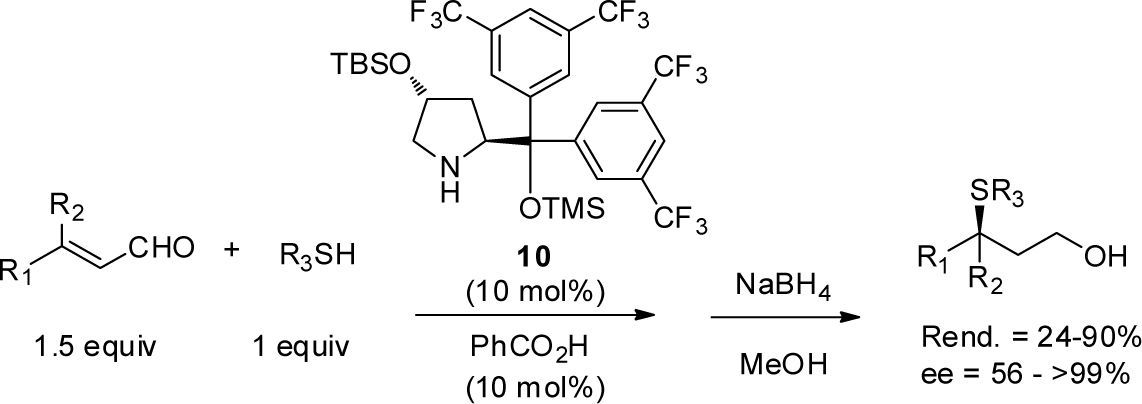
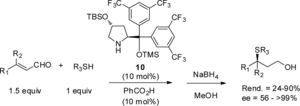
Además de la reacción aldólica, otras reacciones asimétricas organocatalizadas han sido llevadas a cabo en ausencia de disolvente. Éste es el caso de la adición conjugada de tioles a aldehidos α,β-insaturados organocatalizada por el compuesto 10 (10 mol%). La reacción usando sólo un pequeño exceso de los aldehidos (1.5 equiv) generó los correspondientes sulfuros quirales con excelente enantioselectividad (>99% ee), (Ishino y Oriyama, 2007) (esquema 5).
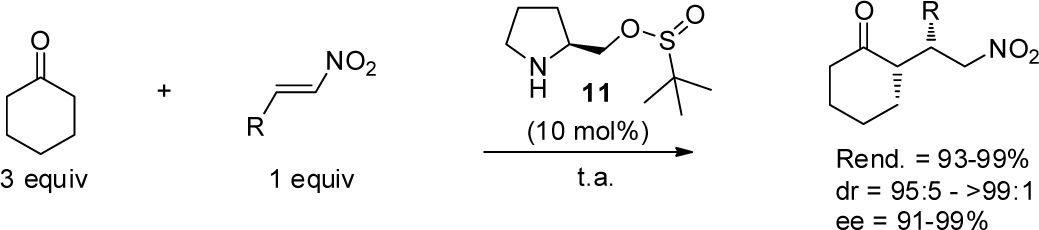
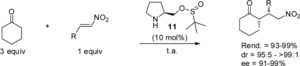
Más recientemente se han reportado adiciones de Michael en ausencia de disolvente. Por una parte, Zeng y Zhong (2009) emplearon el organocatalizador 11 en la reacción entre la ciclohexanona y diferentes nitroolefinas. Luego de examinar diferentes disolventes, se observó que la adición transcurre en menor tiempo y con mayor rendimiento al llevar a cabo la reacción sin disolvente. En particular, usando sólo un ligero exceso del nucleófilo (3.0 equiv) y 10 mol% del catalizador 11 la reacción generó los aductos de Michael con excelente rendimiento y con alta diastereo- y enantioselectividad (esquema 6).
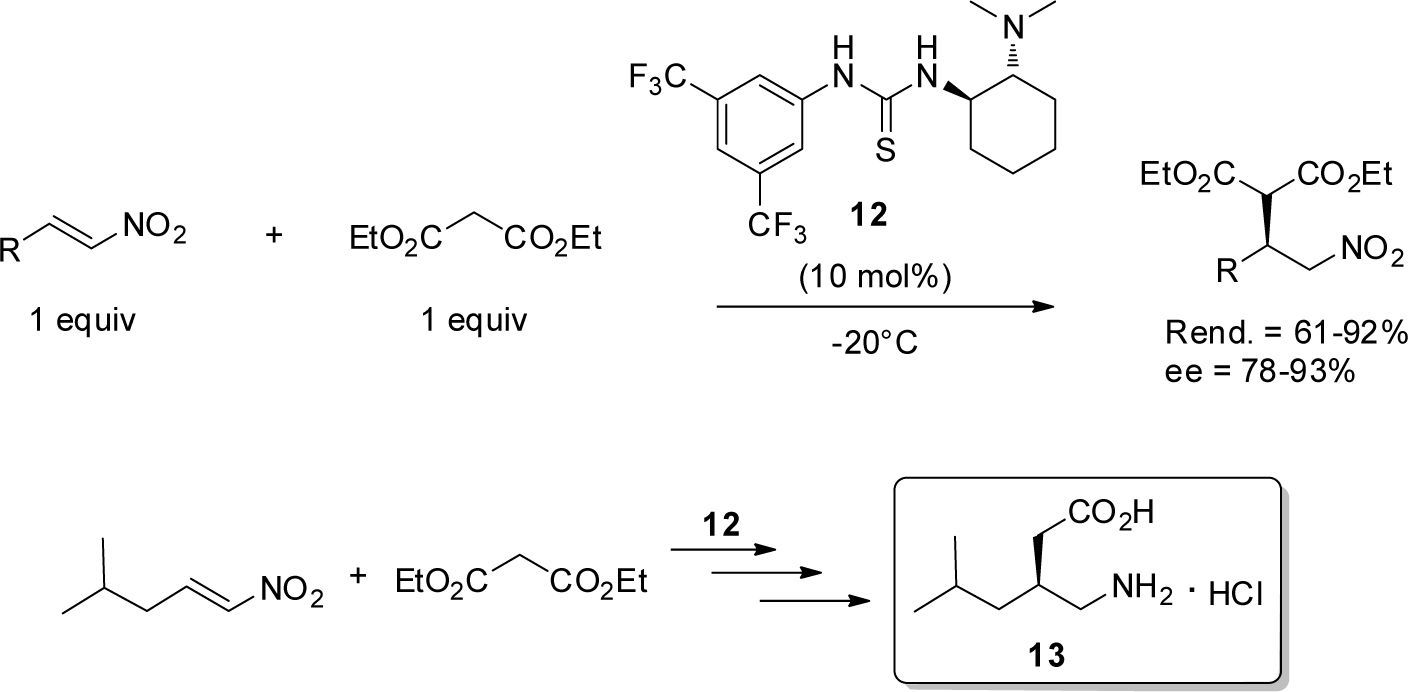
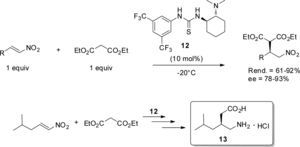
Asimismo, en 2011 Liu et al. reportaron la adición asimétrica tipo Michael del malonato de dietilo a nitroalquenos, organocatalizada por la tiourea 12 (10 mol%). La reacción se llevó a cabo en ausencia de disolvente mediante agitación mecánica tradicional, y empleando cantidades equimolares de los sustratos. Luego de 24 h a −20°C se obtuvieron los correspondientes productos de la adición con buenos rendimientos y alta enantioselectividad. La versatilidad de esta metodología fue puesta de manifiesto en la etapa clave de la síntesis de la pregabalina, un derivado del ácido ä-aminobutírico, el cual es valioso como un medicamento anticonvulsivo en el tratamiento del dolor neuropático. En particular, la reacción permitió la formación del clorhidrato de la pregabalina (13) con alta enantioselectividad (ee 98%) (esquema 7).
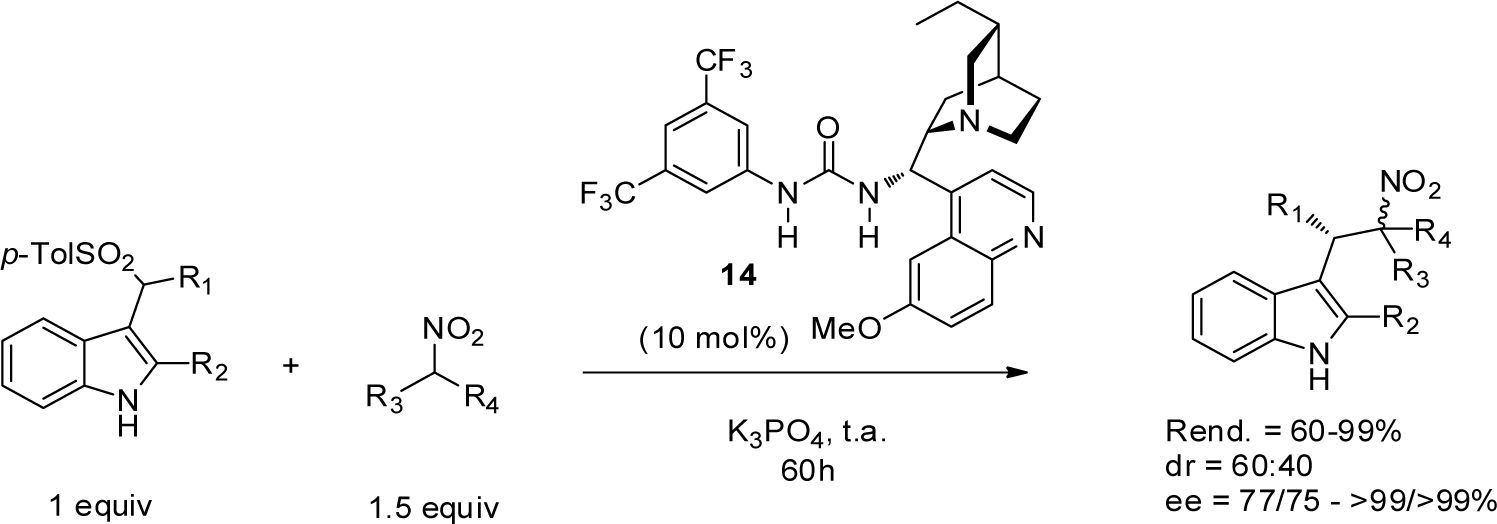
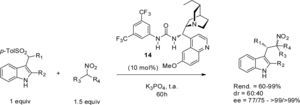
Todos los ejemplos descritos anteriormente corresponden a reacciones organocatalizadas en donde la principal activación ocurre a través de la formación de un enlace covalente entre el catalizador quiral y uno de los sustratos (organocatálisis covalente) (Berkessel y Groeger, 2005). Sin embargo, recientemente Fochi et al. (2012) reportaron la primera reacción organocatalizada en ausencia de disolvente, en donde la activación transcurre a través de la formación de enlaces de hidrógeno entre el organocatalizador quiral y los sustratos (organocatálisis no covalente). En ese trabajo, el organocatalizador bifuncional 14 permitió la formación de derivados de la triptamina con buenos rendimientos y con alta estereoselectividad, mediante la adición asimétrica de nitroalcanos a arilsulfonilindoles (esquema 8).
Reacciones organocatalizadas en ausencia de disolvente usando la molienda de bolas de alta velocidadEn los años recientes, el avance vertiginoso en el campo de las reacciones en ausencia de disolvente se ha alcanzado en gran parte gracias a una técnica de activación mecanoquímica conocida como molienda de bolas de alta velocidad (HSBM) por sus siglas en inglés (High-Speed Ball Milling). Esta técnica es realizada en molinos de bolas y se limitó inicialmente a la maceración y pulverización de muchos minerales y otros materiales. Sin embargo, actualmente la técnica HSBM se aplica como estrategia de activación de muchas reacciones químicas, incluidos los procesos organocatalíticos asimétricos.
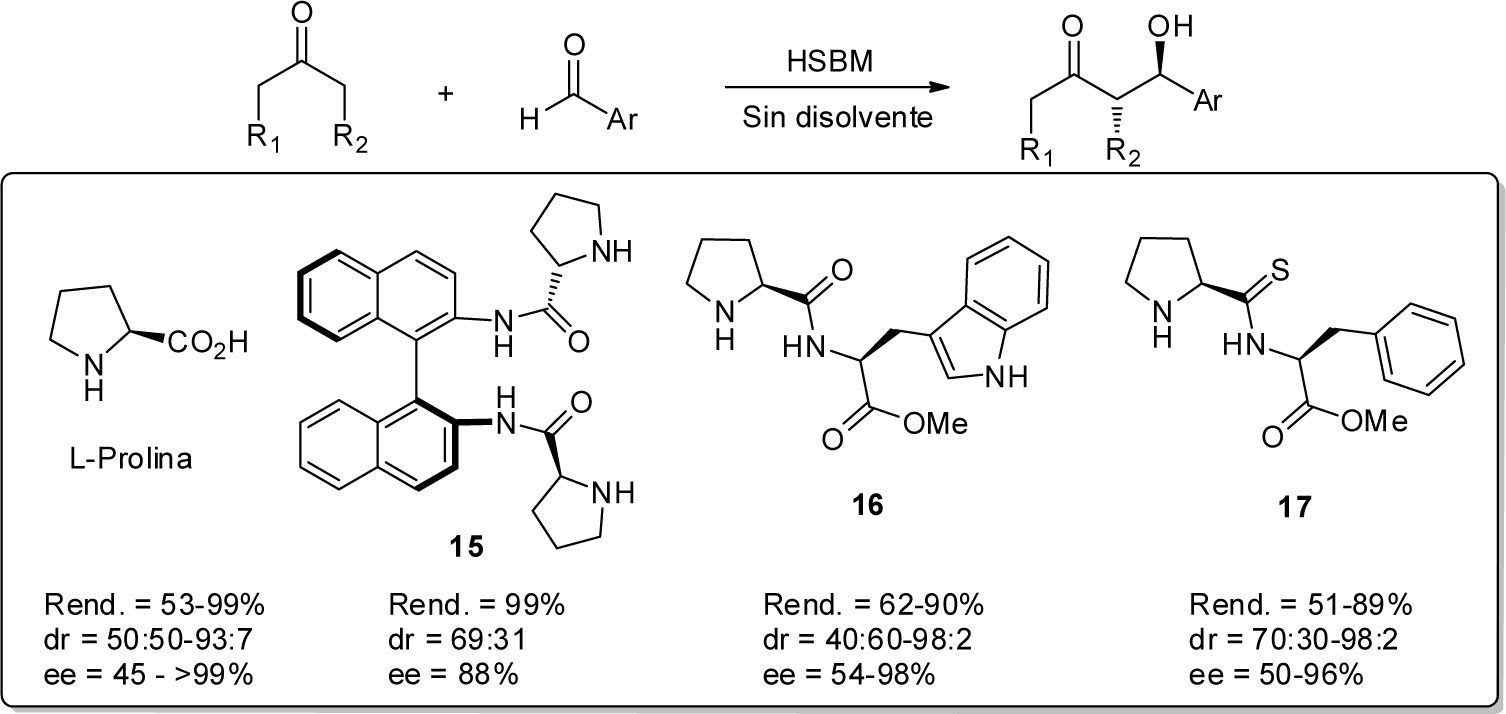
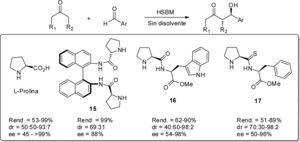
La aplicación de la técnica HSBM en procesos organocatalizados fue introducida por Rodríguez y colaboradores (2006, 2007) cuando se demostró que la reacción aldólica catalizada por L-prolina podía llevarse a cabo en un molino planetario de bolas en ausencia de disolvente y empleando una relación prácticamente equimolar entre cetona y aldehido (esquema 9). En comparación con la misma reacción usando agitación mecánica tradicional, el proceso fue mucho más rápido y procedió con mejor estereoselectividad. De igual manera, Guillena et al. (2007, 2008) han reportado que prolinamidas derivadas de (Sa)-binam 15 catalizan la reacción aldólica enantioselectiva en ausencia de disolvente empleando la técnica de activación HSBM (esquema 9). Más recientemente, Hernández y Juaristi (2011a, 2011b, 2012b) reportaron la reacción aldólica en ausencia de disolvente entre cetonas y varios aldehidos aromáticos catalizada por el (S,S)-dipéptido 16 y el (S,S)-tiodipéptido 17. En general, la reacción en el molino de bolas procedió eficientemente generando los aductos aldólicos con buena diastereo- y enantioselectividad (esquema 9).
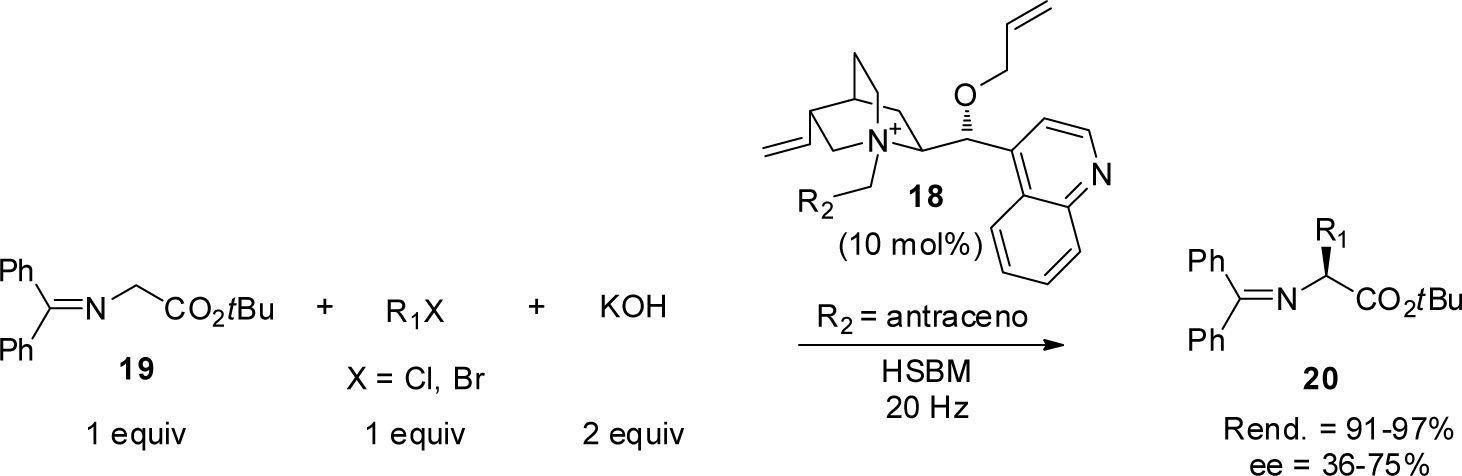
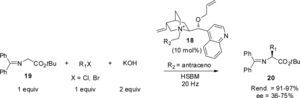
Además de la reacción aldólica, otros procesos organocatalizados también han sido llevados a cabo usando la técnica HSBM. Por ejemplo, en el año 2012 Nun et al. desarrollaron una alquilación enantioselectiva en ausencia de disolvente usando como organocatalizador la sal de amonio quiral (18) (10 mol%). Específicamente, la reacción entre la base de Schiff derivada de la glicina (19) y diferentes electrófilos generó los productos alquilados 20, derivados de á-aminoácidos, con excelentes rendimientos y con enantioselectividad moderada (esquema 10).
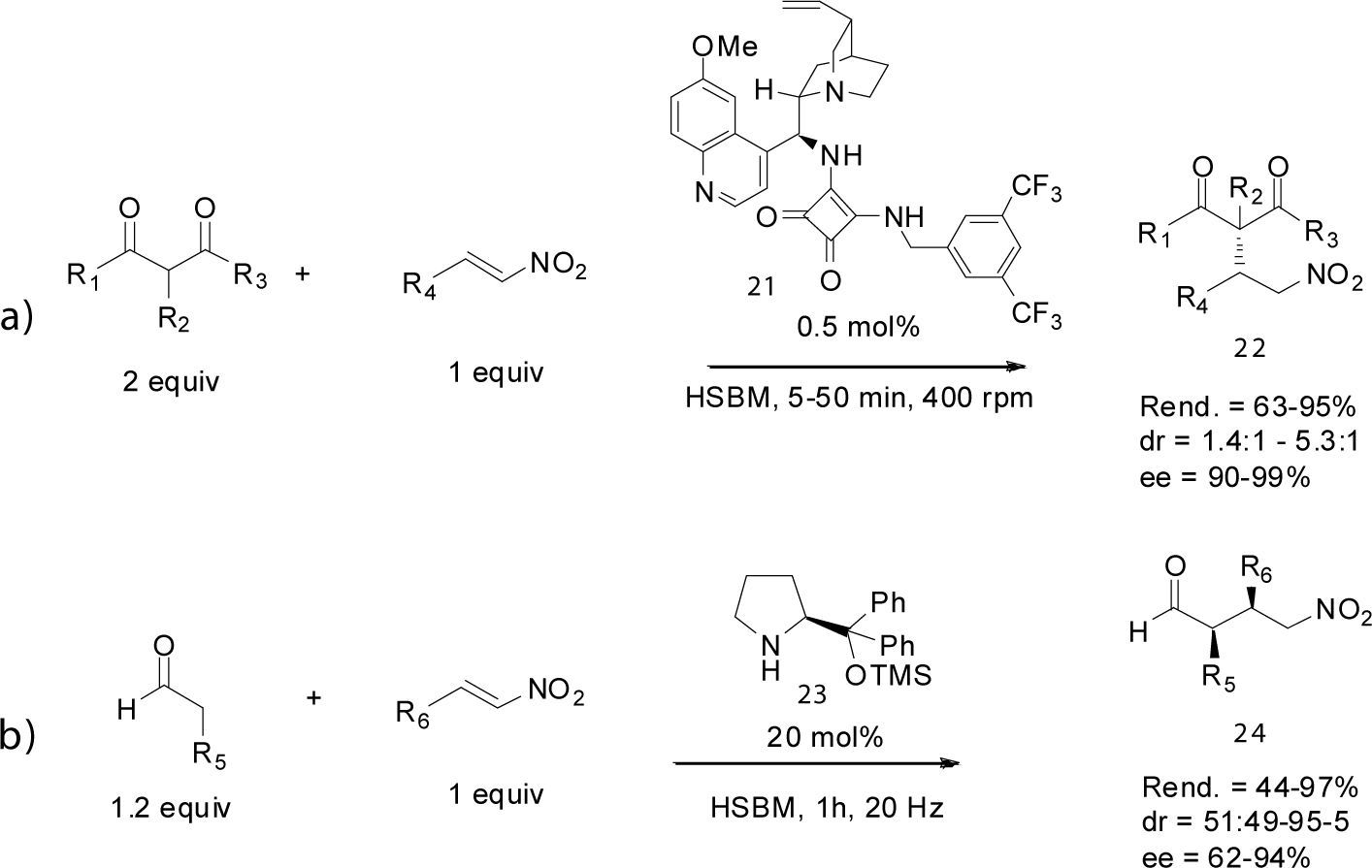
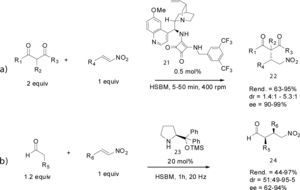
Asimismo, la versión asimétrica de la reacción de Michael organocatalizada también ha sido descrita usando la técnica de activación mecanoquímica HSBM. Recientemente Wang et al. (2012) reportaron la adición de compuestos dicarbonílicos a nitroolefinas usando como organocatalizador una pequeña cantidad de la escuaramida (21) (0.5 %mol). La reacción en ausencia de disolvente generó los correspondientes aductos (22) con buenos rendimientos y con alta estereoselectividad (esquema 11a). De manera independiente, Veverková y colaboradores (2012) emplearon el á,á-difenilprolinol silil éter (23) (20 mol%) como organocatalizador de la reacción de Michael entre aldehidos alifáticos y nitroalquenos en ausencia de disolvente. Luego de evaluar el proceso usando agitación mecánica tradicional y un molino de bolas, se determinó que la reacción empleando la técnica HSBM genera los productos de adición en menor tiempo de reacción y con mejor rendimiento y selectividad (esquema 11b).
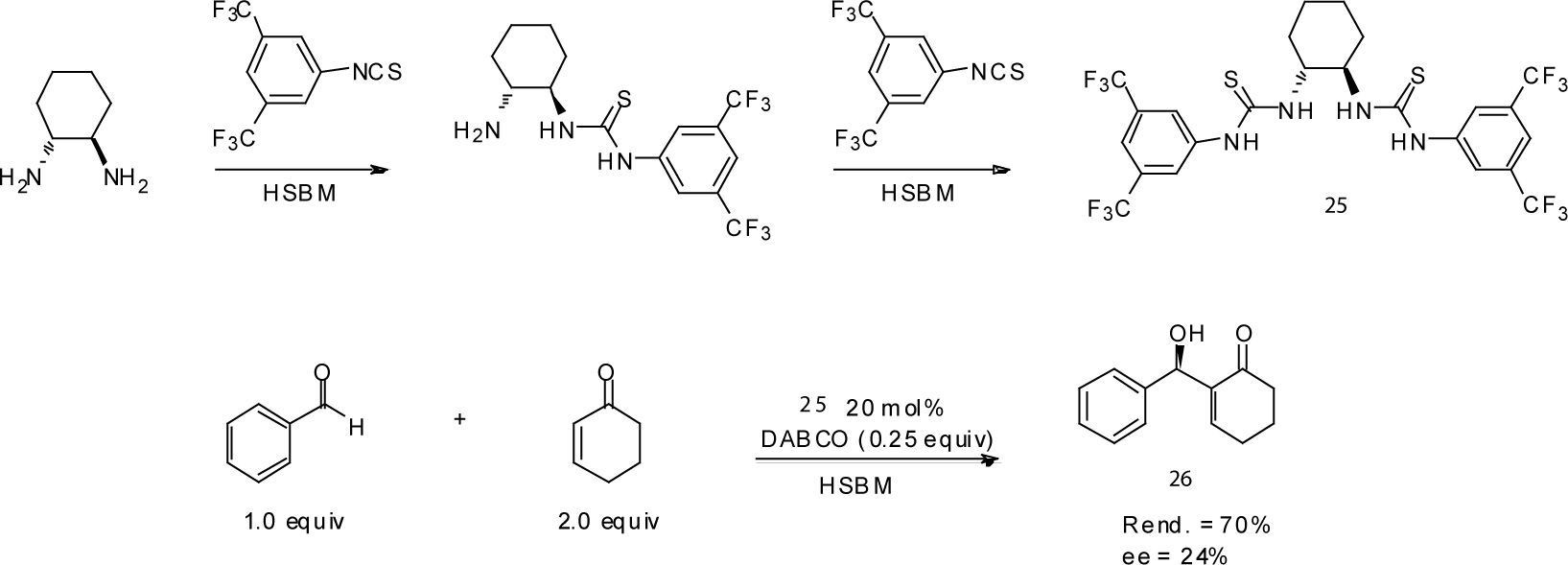
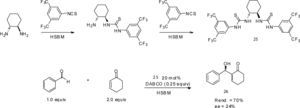
Recientemente, Štrukil et al. (2012) reportaron la síntesis cuantitativa de mono- y bis-tioureas a partir de la reacción de diaminas con isotiocianatos usando un molino de bolas. En particular, la bis-tiourea quiral (25) obtenida con esta metodología fue evaluada como organocatalizador en la reacción de Morita-Baylis-Hillman empleando la técnica de activación HSBM. A pesar de que la enantioinducción alcanzada con el catalizador 25 fue baja, éste es el primer reporte de una metodología que emplea la molienda de bolas de alta velocidad durante la preparación del catalizador, para la posterior evaluación de su actividad organocatalítica.
ConclusiónSin lugar a dudas, la química verde y la organocatálisis representan avances notables en la química del siglo xxi. A pesar del hecho de que estas dos áreas aún se encuentran en su “infancia”, ambas han contribuido ya significativamente en el progreso de la ciencia y en particular de la síntesis orgánica durante la última década. En particular, los procesos organocatalíticos son considerados alternativas “verdes” principalmente con base en que evitan del uso de metales peligrosos y en cambio usan como catalizadores moléculas orgánicas más seguras. Es pues indiscutible que las reacciones organocatalizadas en ausencia de disolventes tóxicos, volátiles, corrosivos y costosos son una manera sencilla y contundente de contribuir al desarrollo de la organocatálisis asimétrica de una manera sostenible.