Comparar la efectividad del mononitrato de isosorbide con la del misoprostol vaginal en la maduración cervical en embarazos a término.
MétodoSe seleccionaron y asignaron al azar pacientes para ser tratadas con 40mg de mononitrato de isosorbide (grupo A) o 100 μg de misoprostol (grupo B) que asistieron para maduración cervical e inducción del parto. Se evaluaron la tasa de eficacia, el tiempo entre el inicio de la maduración y la obtención del recién nacido, las complicaciones neonatales y los efectos adversos.
ResultadosNo se encontraron diferencias estadísticamente significativas entre los grupos con relación a las características generales (p=ns). Las pacientes tratadas con misoprostol presentaron un período significativamente menor desde la administración de la primera dosis hasta la obtención del recién nacido que las pacientes tratadas con isosorbide (p<0,05). No se encontraron diferencias significativas con relación al número de partos vaginales entre ambos grupos (p=ns). Los recién nacidos de las pacientes del grupo B presentaron valores promedio significativamente más bajos de Apgar al minuto y a los 5min al compararlos con el grupo A (p<0,05). El efecto adverso más común en el grupo A fue la cefalea (16 casos, 53,3%), mientras que en el grupo B fue la diarrea (5 casos, 16,7%).
ConclusionesEl misoprostol y el mononitrato de isosorbide vaginal tienen una efectividad similar en la maduración cervical en embarazos a término cuando son administrados.
To compare the effectiveness of vaginal isosorbide mononitrate or misoprostol in cervical ripening in term pregnancies.
MethodsPatients undergoing cervical ripening and induction of labor were selected and randomly assigned to receive 40mg isosorbide mononitrate (group A) or 100 mcg misoprostol (group B). The efficacy rate, time between cervical ripening and delivery, neonatal outcome and adverse effects were evaluated.
ResultsThere were no significant differences between the groups in general characteristics (p=ns). Patients treated with misoprostol showed a shorter period from first dose administration to newborn delivery than those treated with isosorbide (p<0.05). There were no significant differences in the number of vaginal births between the two groups (p=ns). Newborns in group B had significantly lower mean Apgar scores at 1 and 5min than those in group A (p<0.05). The most common adverse effect in group A was headache (16 cases, 53.3%) and diarrhea (five cases, 16.7%) in group B.
ConclusionThe effectiveness of vaginal misoprostol and isosorbide mononitrate is similar in cervical ripening in term pregnancy.
La maduración cervical se diagnostica clínicamente por el borramiento, la dilatación y la pérdida de consistencia del cuello uterino y es estimulada farmacológicamente por el uso de prostaglandinas administradas por vía vaginal1. La primera prostaglandina utilizada clínicamente para fines obstétricos, y específicamente para la maduración cervical, fue la prostaglandina F2alfa2. Su uso fue abandonado debido a los efectos colaterales, como náuseas, vómitos y diarrea.
En la década de 1970 se hicieron varios estudios con la misma finalidad utilizando la prostaglandina E2 (dinoprostona) por distintas vías de administración y dosis, mostrando su efectividad en la inducción a la actividad uterina1–4. La dinoprostona fue aprobada para conseguir la maduración del cuello. Además del costo elevado, tenía un tiempo de vida media corto, es necesario almacenarla a bajas temperatura (2–8°C) e introducirla en forma de gel dentro del canal del cuello, a intervalos regulares3,5–7.
A mediados de la década de 1980, un metil-análogo sintético de la prostaglandina E1, el misoprostol, pasó a ser utilizado en obstetricia. Por su estabilidad térmica, puede ser almacenado en forma segura a temperatura ambiente y presenta menor riesgo de efectos colaterales7. Al ser comparado con las prostaglandinas naturales, su costo es aproximadamente 100 veces menor que cualquier otra prostaglandina, tiene un tiempo de vida media prolongado y es de fácil administración8. Con todas estas ventajas, el misoprostol se convirtió en la droga de elección para la preparación del cuello y la inducción del trabajo de parto9. Sin embargo, las prostaglandinas pueden causar efectos adversos maternos y fetales, principalmente debido a su acción estimulante sobre las contracciones uterinas. Se ha estimado que más del 10% de las pacientes desarrolla hipertonía uterina después de la administración de prostaglandinas para la inducción de la maduración cervical3,6,8. La hipertonía uterina generalmente produce dolor abdominal y ansiedad, pero también puede producir complicaciones circulatorias que pueden ser fatales para el feto y/o el recién nacido3,8.
Un agente ideal para la maduración cervical sería aquel que indujera una maduración adecuada sin efectos adversos maternos, fetales o neonatales1,7. Se ha descrito que la aplicación vaginal de agentes donantes del óxido nítrico, como el mononitrato de isosorbide y el gliceril-trinitrato, induce maduración cervical en las embarazadas durante el primer trimestre antes de la culminación quirúrgica del embarazo10. Sobre la base de estos estudios se ha sugerido que los donadores de óxido nítrico pueden producir maduración cervical para la inducción del parto, sin causar graves efectos adversos. Thomson et al9 reportaron que el mononitrato de isosorbide era más efectivo que el gliceril-trinitrato, ya que estaba asociado a menos complicaciones y a mayor efectividad clínica. Además, el pretratamiento con mononitrato de isosorbide ha probado tener menor cantidad de efectos colaterales que el análogo de las prostaglandinas gemeprost10.
El objetivo de la investigación fue comparar la efectividad del mononitrato de isosorbide con la del misoprostol vaginal en la maduración cervical en embarazos a término.
MétodoSe seleccionaron y asignaron al azar pacientes embarazadas para recibir por vía vaginal 40mg de mononitrato de isosorbide (grupo A) o 100μg de misoprostol (grupo B). Los números para la asignación a cada grupo de tratamiento fueron generados con la ayuda de tablas de números al azar. Se usó un sistema de sobres sellados que contenían la ubicación en los grupos de tratamiento. Los sobres fueron abiertos al momento del inicio de la terapia hormonal. La investigación fue aprobada por el Comité de Ética e Investigación del hospital y se obtuvo autorización por escrito de las pacientes.
Se incluyó a todas las pacientes con embarazos simples a término, que no se encontraran en trabajo de parto (menos de 2 cm de dilatación, menos del 60% de borramiento y menos de 3 contracciones uterinas dolorosas por hora) y sin antecedentes de intervenciones uterinas previas. Se excluyeron aquellas pacientes con puntaje de Bishop mayor de 7, con ruptura de membranas, corioamnionitis, sangrado vaginal, diagnóstico de placenta previa o desprendimiento prematuro de la placenta, alteraciones de la contractilidad uterina, alteraciones hepáticas, renales o cardiovasculares, con contraindicaciones para el uso de alguno de los medicamentos en estudio o que se negaran a participar en la investigación.
Antes de la administración del tratamiento se realizó un examen físico inicial en el cual se evaluaron en forma digital el borramiento y la dilatación cervical, escala de Bishop, y presión arterial y frecuencia cardíaca materna. El mononitrato de isosorbide (40mg) fue administrado después de tratar de reducir la mayor cantidad posible de las tabletas comerciales en polvo y fue aplicado en el fondo de saco vaginal posterior. En el grupo de pacientes que recibieron misoprostol (100μg) se procedió a partir la tableta comercial en 2 partes y se colocó en el fondo vaginal. Ambos medicamentos se administraron cada 4h por un período de 24h, basada su efectividad en investigaciones previas.
Las alteraciones de la contractilidad uterina se definieron como hiperestimulación (una contracción con una duración mayor de 90min) o taquisistolia uterina (más de 6 contracciones en un período de 10min). La incidencia de las alteraciones neonatales se realizó por las mediciones del Apgar al minuto y a los 5min del recién nacido.
Durante el período de tratamiento se determinó cada uno de los parámetros iniciales. El desarrollo de potenciales efectos adversos que pudiesen aparecer con la administración de ambos medicamentos (por ejemplo, náuseas, vómitos, diarrea, cefalea, hipotensión, hemorragia, dolor torácico y palpitaciones) se determinó inmediatamente antes de la administración de la dosis de cada uno de los tratamientos. Las pacientes recibieron tratamiento para los efectos adversos sobre la base de sus necesidades y, dependiendo de su severidad, la paciente fue o no retirada de la investigación.
La tasa de eficacia, el tiempo entre el inicio de la maduración y la obtención del recién nacido, las complicaciones neonatales y los efectos adversos se analizaron con la prueba t de Student para muestras no relacionadas y la prueba exacta de Fischer. Se fijó la significancia estadística en p<0,05.
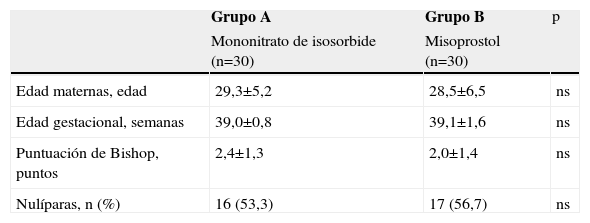
ResultadosSe seleccionaron 60 pacientes para la investigación, las cuales fueron asignadas al azar para recibir mononitrato de isosorbide (grupo A, n=30) o misoprostol (grupo B, n=30). Las características demográficas de ambos grupos se muestran en la tabla 1. No se encontraron diferencias estadísticamente significativas entre los grupos con relación a edad materna, edad gestacional, puntuación de Bishop al momento de la administración de los fármacos y porcentaje de pacientes nulíparas (p=ns).
Características generales de los grupos en estudio
| Grupo A | Grupo B | p | |
| Mononitrato de isosorbide (n=30) | Misoprostol (n=30) | ||
| Edad maternas, edad | 29,3±5,2 | 28,5±6,5 | ns |
| Edad gestacional, semanas | 39,0±0,8 | 39,1±1,6 | ns |
| Puntuación de Bishop, puntos | 2,4±1,3 | 2,0±1,4 | ns |
| Nulíparas, n (%) | 16 (53,3) | 17 (56,7) | ns |
ns: no significativo.
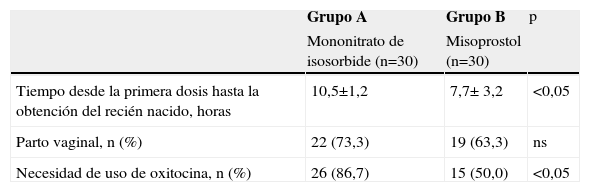
Con respecto a la efectividad del tratamiento (tabla 2), las pacientes tratadas con misoprostol presentaron un intervalo desde la administración de la primera dosis hasta la obtención del recién nacido significativamente menor que las pacientes tratadas con isosorbide (7,7 ± 3,2h para el grupo A comparado con 10,5 ± 1,2h para el grupo B; p<0,05). No se encontraron diferencias significativas con relación al número de partos vaginales entre ambos grupos de tratamiento (p=ns). Veintiséis (86,7%) de las 30 pacientes del grupo A necesitaron del uso de oxitocina comparadas con 11 pacientes (36,7%) del grupo B (p<0,05).
Indicadores de la efectividad del tratamiento
| Grupo A | Grupo B | p | |
| Mononitrato de isosorbide (n=30) | Misoprostol (n=30) | ||
| Tiempo desde la primera dosis hasta la obtención del recién nacido, horas | 10,5±1,2 | 7,7± 3,2 | <0,05 |
| Parto vaginal, n (%) | 22 (73,3) | 19 (63,3) | ns |
| Necesidad de uso de oxitocina, n (%) | 26 (86,7) | 15 (50,0) | <0,05 |
ns: no significativo.
Al analizar las anomalías de la contractilidad (tabla 3), se observó que todos los casos de alteraciones de la contractilidad uterina (6 casos de hipersistolia [20,0%], 5 casos de taquisistolia [16,7%] y 5 casos de hipertonía [16,7%]) se observaron en el grupo de pacientes tratadas con misoprostol. No se encontró ninguna alteración de la contractilidad en las pacientes tratadas con isosorbide (p<0,05).
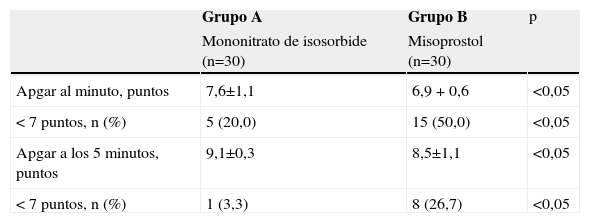
Las variables neonatales se muestran en la tabla 4. Los recién nacidos de las pacientes del grupo B presentaron valores promedio significativamente más bajos de Apgar al minuto y a los 5min (6,9±0,6 y 8,5±1,1 puntos, respectivamente) al compararlos con las pacientes del grupo A (7,6 ± 1,1 puntos al minuto y 9,1 ± 0,3 puntos a los 5min; p<0,05). También se observó un mayor número de recién nacidos con valores de Apgar menores de 7 puntos a los 5min en las pacientes del grupo B comparados con las pacientes del grupo A (p<0,05).
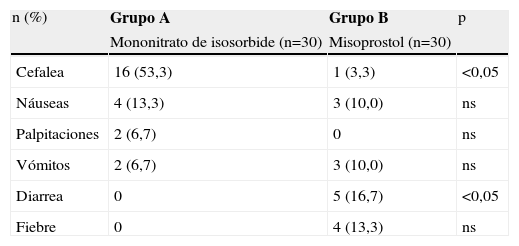
Con relación a los efectos adversos (tabla 5), el efecto adverso más común en el grupo de isosorbide fue la cefalea (16 casos, 53,3%), mientras que en el grupo B sólo se observó 1 caso (3,3%; p<0,05). En el grupo B, el efecto adverso más común fue la diarrea (5 casos, 16,7%). En el grupo A no se observó ningún caso (p<0,05). Se observaron otros efectos como palpitaciones, náuseas, vómitos y fiebre en ambos grupos; pero su incidencia fue muy baja y no se observaron diferencias estadísticamente significativas al comparar la frecuencia de estos efectos adversos entre ambos grupos de tratamiento (p=ns).
DiscusiónLos resultados de esta investigación demuestran que el mononitrato de isosorbide tiene una efectividad comparable con la del misoprostol para la inducción del parto, con una menor frecuencia de alteraciones de la contractilidad uterina, pero con una alta incidencia de efectos adversos, y de forma específica, la presencia de cefalea en más de la mitad de las pacientes tratadas.
Uno de los hallazgos en la administración de isosorbide en esta investigación está asociado con un tiempo más largo de la primera fase del parto, lo cual también ha sido reportado por Chanrachakul et al11 y Habib et al12. Los primeros utilizaron glicerol-trinitrato y los segundos, una dosis similar a la utilizada en la presente investigación. Otro estudio donde utilizaron glicerol-trinitrato más dinoprostona se asoció con un intervalo más corto desde la administración del tratamiento hasta el inicio de la fase activa del trabajo de parto13. A pesar de las diferencias en los tiempos desde la administración hasta el parto en los grupos de la presente investigación, la tasa de partos no mostró diferencias significativas entre ambos.
Wölfler et al14 no encontraron una mayor efectividad del isosorbide en la inducción del parto, proponiendo que la administración de isosorbide ejercía sus efectos sobre el cuello y el fondo del útero, llevando a dilatación cervical con una pérdida de la sincronización de las contracciones uterinas, lo que podría alterar la progresión del parto, por lo cual sugirieron una eficacia diferente dependiendo de la edad gestacional. Se ha propuesto que la administración de donadores de óxido nítrico en embarazadas a término coincide con la fase de acondicionamiento fisiológico en la cual existe un incremento natural de las concentraciones de óxido nítrico en el cuello uterino.
La necesidad del uso de oxitocina fue significativamente mayor en las pacientes que recibieron isosorbide comparado con aquéllas a las que se les administró misoprostol. Esto puede ser debido a que los donadores de óxido nítrico activan las metaloproteinasas de la matriz y enzimas como las colagenasas, que suavizan el cuello15. El óxido nítrico también estimula la producción de prostaglandinas a través de la activación de la cicloxigenasa inducible y esto podría no ser suficiente para producir contracciones efectivas en la mayoría de las pacientes11,16,17. Además, existe una relación entre las concentraciones de óxido nítrico y la maduración cervical. En estudios previos, la administración de mononitrato de isosorbide aumentaba las concentraciones tisulares de guanosín-monofosfato cíclico. Se piensa que este segundo mensajero del óxido nítrico promueve la relajación del cuello uterino, un proceso que está involucrado en la maduración cervical18,19. Luego de la administración vaginal de isosorbide, se produce el primer paso uterino, en el cual la droga es transportada primero al cuello uterino y después al cuerpo uterino20,21. Los efectos de este primer paso uterino pueden estar incrementados durante el embarazo a término debido a la máxima perfusión uterina20, por lo cual los efectos pueden ser mayores en el cuello que en el cuerpo uterino. Esto demuestra que los efectos de los donadores de óxido nítrico ejercen sus efectos en el cuello uterino por un transporte directo de la vagina al cuello uterino. En contraste, los efectos adversos (en especial la cefalea y la taquicardia) están probablemente relacionados con las concentraciones de isosorbide en la circulación sistémica22.
La administración de donadores de óxido nítrico y de mononitrato de isosorbide, como se realizó en la presente investigación, puede promover la maduración cervical y la inducción del parto. La repetición de la dosis de isosorbide permitiría el logro de un mayor efecto cuando se administra por vía vaginal. El isosorbide es un donador de óxido nítrico de acción lenta. Cuando se coloca en la vagina al final del tercer trimestre, las concentraciones pico de isosorbide no se alcanzan antes de las 6h21. El uso de 40 mg de isosorbide ha demostrado previamente la estimulación de la maduración cervical luego de un intervalo de tratamiento de 3 a 4h e induce un rearreglo de la ultraestructura cervical similar a la observada en la maduración cervical espontánea23. Se ha sugerido que las bajas concentraciones de óxido nítrico cervical son la causa de la prolongación del embarazo, por lo que se presume que una disminución en la cantidad de óxido nítrico cervical contribuye a prolongar el embarazo24.
Otro de los datos suministrados por esta investigación y confirmado por observaciones previas es la eficacia similar del isosorbide y el misoprostol. Aunque el isosorbide demostró una tasa de eficacia más alta, ésta no mostró tener una diferencia estadísticamente significativa con el misoprostol. Quizás la tasa del misoprostol haya sido más baja por las alteraciones de la contractilidad observadas en el grupo de pacientes tratadas. En la práctica clínica se han utilizado diferentes métodos para la maduración del cuello uterino, siendo el uso de las prostaglandinas y sus análogos uno de los más populares12,25. Sin embargo, su uso está asociado con varios efectos adversos, entre ellos, síntomas gastrointestinales, fiebre y lo más importante: una alta incidencia de taquisistolia e hiperestimulación uterina26,27. La tasa de taquisistolia para el uso de análogos de las prostaglandinas se encuentra entre el 9 y el 15%, mientras que la tasa para los diferentes estudios con glicerol-trinitrato es de aproximadamente el 4% y, en estos casos, se ha asociado con dinoprostona11,13. Habib et al12 sólo reportaron un caso de taquisistolia en las pacientes tratadas con isosorbide. Estos hallazgos también concuerdan con investigaciones previas en las cuales no se encontraron alteraciones cardíacas fetales después del tratamiento con isosorbide en 199 embarazadas a término27. La presencia de alteraciones en la contractilidad uterina entre los grupos de tratamiento fue estadísticamente significativa en esta investigación. Todos los casos se observaron en las pacientes que recibieron misoprostol. La distocia dinámica resultante del uso de misoprostol probablemente conllevó a que los recién nacidos de ese grupo presentaran un puntaje promedio de Apgar al minuto y a los 5min más bajo que las pacientes que recibieron isosorbide, y también a la frecuencia de recién nacidos con menos de 7 puntos en ambos períodos.
La incidencia de cefalea en el grupo de pacientes tratadas con isosorbide en la presente investigación fue alta. Esto también ha sido reportado por otros investigadores11–13. La posible explicación para que ocurra este efecto son los cambios hemodinámicos que produce el isosorbide administrado por vía vaginal en la circulación materna. Nicoll et al22 reportaron incremento en la frecuencia cardíaca y disminución de la presión arterial sistémica, estas modificaciones no fueron estadísticamente significativas. Estos efectos adversos también fueron descritos con una frecuencia similar en una investigación previa en la cual se utilizó glicerol-trinitrato11. Thomson et al9 reportaron una incidencia de los otros efectos adversos similar a la encontrada en el presente estudio.
Se concluye que el misoprostol y el mononitrato de isosorbide vaginal tienen una efectividad similar en la maduración cervical en embarazos a término.