Estudiar la función sexual en mujeres que tienen miomas, de forma prospectiva durante un año, en no deseo sexual, no excitación, no orgasmo, dispareunia y dolor pélvico, comparando con controles.
Diseño y métodoDurante el año 2009, en la consulta del autor, se recogen 172 mujeres con miomas de 3–5cm en el diámetro mayor, y 80 mujeres con miomas > 5cm en el diámetro mayor. Se comparan con grupos control pareados por edad. También se comparan los 2 grupos de miomas entre sí. Con entrevista personal se preguntan los datos sexuales.
ResultadosSeñalamos las diferencias estadísticamente significativas más importantes. En el grupo de miomas de 3–5cm, en antecedentes médicos, p<0,01; en no deseo sexual, p<0,01; en sequedad vaginal, p<0,05; en miomas subserosos, p<0,001, y en igual tamaño del mioma al año, p<0,001. En el grupo de miomas > 5cm, en no relaciones sexuales, p=0,02; en miomas intramurales, p<0,001; en aumento de tamaño del mioma al año, p<0,001, y en dolor, p=0,02. No hay diferencias significativas en los parámetros sexuales (deseo sexual, excitación, orgasmo, dispareunia, ni en sequedad vaginal) entre cada grupo y sus controles.
Conclusiones1) En los miomas de 3–5cm, hay diferencias significativas en no deseo sexual, p<0,01, y en sequedad vaginal, p<0,05. 2) En los miomas de > 5cm, hay diferencias significativas en no relaciones sexuales, p=0,02; en aumento de tamaño del mioma al año, p<0,001, y en dolor pélvico crónico, p=0,02.
To prospectively study sexual function in women with myomas over a 1-year period. Absence of sexual desire, absence of arousal, anorgasmia, dyspareunia and pelvic pain were compared in women with myomas versus controls.
Design and methodA total of 172 women with myomas (largest diameter: 3-5cm) and 80 women (largest diameter > 5cm) were examined in the author's consulting rooms in 2009. Both groups were compared with control groups paired by age. The two myoma groups were also compared between each other. Sexual data were gathered through personal interviews.
ResultsThe most statistically significant differences were the following: in the group of women with myomas measuring 3-5cm, differences were found in medical history (P<.001), absence of sexual desire (P<.01), vaginal dryness (P<.05), subserosal myomas (P<.001) and in equal size of the myoma at 1 year (P<0,001); in the group of myomas measuring > 5cm, differences were found in the absence of sexual relations (P=.02), intramural myomas (P<.001), increased size of the myoma at 1 year (P<.001), and in pain (P=.02). No significant differences were found in sexual parameters (sexual desire, arousal, orgasm, dyspareunia, and vaginal dryness) between each group or their controls.
Conclusions1) In women with myomas measuring 3-5cm, statistically significant differences were found in the absence of sexual desire (P<.01) and in vaginal dryness (P<.05). 2) In myomas measuring > 5cm, statistically significant differences were found in the absence of sexual intercourse (P=.02), in increased size of the myoma at 1 year (P<.001) and in chronic pelvic pain (P=.02).
El mioma es el tumor sólido más frecuente en la pelvis de la mujer1. Se da en el 20–40% en los años reproductivos. Se practican 600.000 histerectomías al año en EE. UU., y el mioma es la indicación más frecuente de histerectomía.
El mioma es un tumor benigno monoclonal de la célula muscular lisa del miometrio2. Es de causa desconocida, pero hay factores: anomalías intrínsecas del miometrio, aumento de receptores estrogénicos congénitos en el miometrio, cambios hormonales y respuesta a la isquemia en las menstruaciones. En 40% hay anomalías cromosómicas: translocación cromosomas 12–14, deleción cromosoma 7 y trisomía cromosoma 12. Y en el 60% hay mutaciones no detectadas. Más de 100 genes intervienen en la regulación de los miomas.
La incidencia a los 35 años es del 60% en la mujer afroamericana y del 40% en la mujer blanca. A los 50 años, las incidencias son 80 y 70%, respectivamente. Los miomas son diferentes entidades patológicas genéticas3. La norma sería tener miomas.
Son raros antes de la pubertad (la más joven con 13 años)4, se dan más en los años reproductivos y regresan con la menopausia.
En los miomas influyen factores genéticos, hay familias con predisposición5; factores hormonales, aumento de receptores a estradiol (E2) y progesterona (Pg) en el mioma; y factores de crecimiento varios.
Hay diferentes tipos de miomas: intramural, submucoso y subseroso. En el 40–50% son asintomáticos6. La clínica que producen es: menorragias (más en submucosos e intramurales); dolor pélvico crónico (dismenorrea, dispareunia y presión en la pelvis); dolor agudo, puede haber por torsión de mioma pediculado, o con infarto y degeneración roja, y en el parto del mioma por el cérvix, y síntomas urinarios (polaquiuria, tenesmo, obstrucción ureteral). Puede haber retención urinaria con incarceración pélvica del mioma7.
Con hiperrespuesta a los estrógenos se produce el crecimiento del mioma. La progesterona en la fase secretora también aumenta las mitosis. Los estrógenos, vasodilatadores, aumentan el flujo del mioma y incrementa el volumen. Los miomas intramurales crecen más, y más los grandes y medianos que los pequeños. Con crecimiento rápido en la posmenopausia, pensar en leiomiosarcoma. Aun sin otros síntomas (dolor, hemorragia) es sospechoso de malignidad, y tiene indicación quirúrgica. Se da en el 0,1%.
Puede haber diferentes tipos de degeneración en el mioma (el mioma crece en exceso en relación con la vascularización): hialina (65%); mixomatosa (15%); calcificación (4–10%); quística (4%); grasa (rara) y carnosa o roja. Las degeneraciones son asintomáticas, excepto la carnosa o roja, que puede dar dolor, sobre todo en el embarazo.
Se han contado más de 200 miomas en un útero. Y como se da más en nulíparas e infértiles, Jeffcoate8 dice que el útero privado de embarazos se consuela con los miomas. O esta otra frase: «Los miomas son la recompensa de la virtud; los bebés, el fruto del pecado».
El diagnóstico de los miomas se puede hacer clínicamente al tacto bimanual, pero sobre todo con la ecografía vaginal. Con miomas submucosos, puede utilizarse la sonohisterografía o la histeroscopia. En los grandes miomas, conviene hacer también ecografía abdominal, para delimitar sus márgenes. La resonancia magnética nuclear (RMN) evalúa el tamaño, el número y la posición de los miomas; en miomas submucosos puede ver la penetración del mioma en el miometrio, y diferencia de adenomiosis, pero como es una técnica más cara, solo para casos dudosos.
El tratamiento es conservador en miomas pequeños; basta con el seguimiento ecográfico para ver si hay o no crecimiento. En los grandes miomas, si son sintomáticos está indicada la cirugía: histerectomía o miomectomía. Los síntomas para indicación serían: menorragias, hipermenorreas anemizantes, crecimiento tras la menopausia o sospecha de malignidad pélvica, dolor o síntomas de presión que interfieren la calidad de vida, abortos recurrentes e infertilidad, con distorsión de la cavidad uterina.
El tratamiento siempre1 según: edad, paridad, deseo de gestación, síntomas, tamaño, número y localización de los miomas, condiciones médicas de la mujer, proximidad de la menopausia, deseo de conservar el útero y posibilidad de malignidad. Manejo según las necesidades individuales, no hay 2 pacientes iguales.
En este trabajo, estudiamos los miomas en relación con la función sexual, tema poco tratado en la literatura médica; solo hemos encontrado 2 referencias que traten el tema en profundidad. Hacemos un estudio prospectivo a un año, diferenciando 2 grupos de miomas, de 3–5cm y > 5cm.
Material y métodosA lo largo de todo el año 2009, en el CE de Monteolivete-Valencia, en la consulta de Ginecología del autor, hemos recogido todos los casos de miomas que consultaron por motivo de revisión o por sintomatología clínica, y a los que se ha practicado ecografía transvaginal, con el aparato Toshiba Nemio XG Istyle, modelo SSA-580 A. Llevamos a cabo un estudio prospectivo de un año de duración para ver la relación existente entre los miomas uterinos y la función sexual de las mujeres. Para ello hicimos una entrevista personal para los datos sexológicos. Preguntamos sobre no relaciones sexuales y sus causas, sobre no deseo sexual, no excitación, no orgasmo y dispareunia. Preguntamos sobre frecuencia de coito y sequedad vaginal, y sobre las que fumaban, bebían o tenían depresión.
Dividimos los miomas en 2 grupos: A) los que miden entre 3 y 5cm en el diámetro mayor, y B) los que miden > 5cm en el diámetro mayor. Consideramos el tipo de mioma: intramural, submucoso, subseroso. Si es único o múltiple. En caso de tener varios miomas, solo hemos considerado el mayor, para los cálculos.
El grupo A (miomas de 3–5cm) consta de 172 casos. Lo comparamos con un grupo control también de 172 casos, pareados por edad pero sin miomas. El grupo B (miomas > 5cm) consta de 80 casos. Lo comparamos con un grupo control de 80 casos, pareados por edad pero sin miomas. En total, la serie son 252 casos. Sobre 5.229 consultas en 2009 suponen el 4,81%.
Hemos registrado gráficamente cada caso con una o más tomas, para guardar tamaño, localización y posición (respecto al eje uterino), y número de miomas. En las figuras 1–7 se presentan ejemplos de miomas de 3–5cm. En las figuras 8–14 se presentan ejemplos de miomas > 5cm, incluyendo miomas calcificados y casos con degeneración quística.
Calculamos el volumen del mioma, a partir de 3 medidas A, B y C, considerando cada una de ellas como los radios de un elipsoide (el que forma hipotéticamente el mioma de cada paciente). A continuación, mediante la fórmula: 4/3 (A x B x C), se calcula el volumen de dicho elipsoide, y por tanto el volumen del mioma. La misma sistemática que hemos empleado en otros trabajos nuestros anteriores sobre miomas, en el embarazo y parto, y con tratamiento hormonal sustitutivo (THS) de la menopausia.
Hemos comparado, en la mayoría de los casos, con el tamaño del mioma reflejado en una visita anterior, para ver el aumento, la disminución o la igualdad de tamaño, al año. Y hemos considerado también las influencias clínicas del mioma, en menor frecuencia de coito, dolor pélvico crónico, dispareunia, dismenorrea o molestias urinarias.
En el estudio estadístico, se calculan rangos, medias y desviaciones estándar para los datos cuantitativos, y porcentajes para los datos cualitativos. Los cálculos estadísticos y las comprobaciones gráficas se han realizado con el software Excel de Microsoft instalado en un ordenador personal con procesador Pentium. Para la significación estadística se considera la p<0,05, tanto al comparar datos cuantitativos con la t de Student como para datos cualitativos con la χ2, chi cuadrado, de Pearson.
ResultadosLa serie de estudio son 252 casos; sobre 5.229 consultas en 2009 suponen el 4,81%. Los miomas son 172 casos de 3-5cm, grupo A, y 80 casos, > 5cm, grupo B. Se comparan cada uno con su correspondiente grupo control, pareados por edad, pero sin miomas, y con el mismo número de casos.
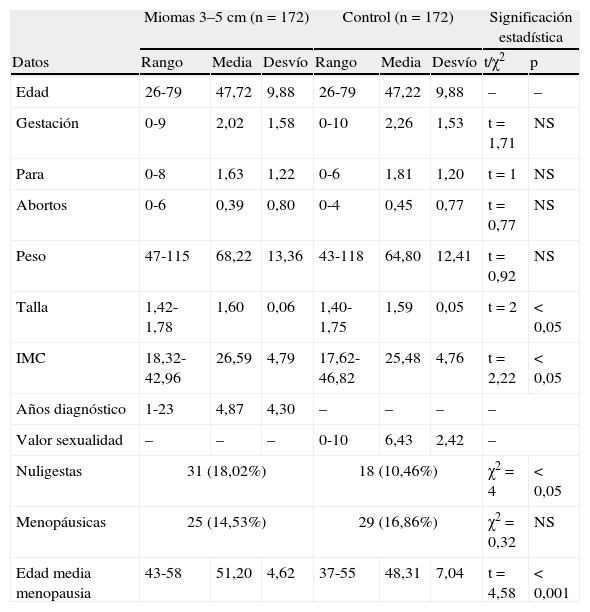
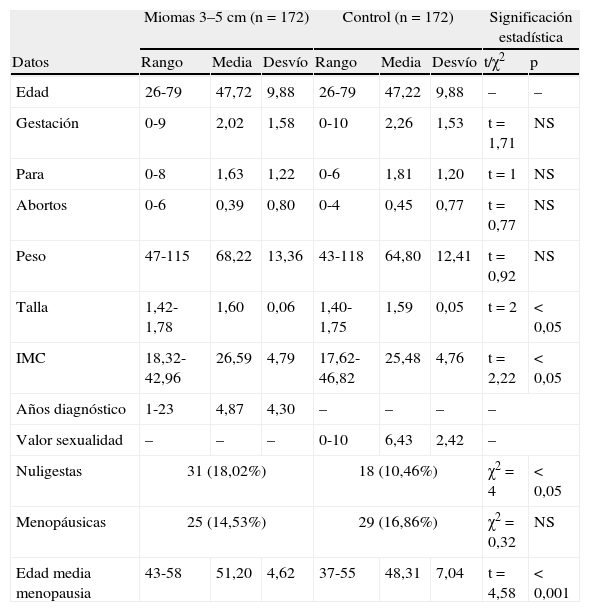
En la tabla 1A se presentan los datos numéricos cuantitativos de la serie: edad, gestaciones, partos y abortos, peso, talla e índice de masa corporal (IMC), los años desde el diagnóstico del mioma, el número de nuligestas y de menopáusicas, y la edad media a la menopausia. También el valor que dan las mujeres a su sexualidad con una cifra de 0 a 10. La tabla 1B se dedica específicamente al IMC.
Serie miomas. Datos cuantitativos.
| Miomas 3–5cm (n=172) | Control (n=172) | Significación estadística | ||||||
| Datos | Rango | Media | Desvío | Rango | Media | Desvío | t/χ2 | p |
| Edad | 26-79 | 47,72 | 9,88 | 26-79 | 47,22 | 9,88 | – | – |
| Gestación | 0-9 | 2,02 | 1,58 | 0-10 | 2,26 | 1,53 | t=1,71 | NS |
| Para | 0-8 | 1,63 | 1,22 | 0-6 | 1,81 | 1,20 | t=1 | NS |
| Abortos | 0-6 | 0,39 | 0,80 | 0-4 | 0,45 | 0,77 | t=0,77 | NS |
| Peso | 47-115 | 68,22 | 13,36 | 43-118 | 64,80 | 12,41 | t=0,92 | NS |
| Talla | 1,42-1,78 | 1,60 | 0,06 | 1,40-1,75 | 1,59 | 0,05 | t=2 | < 0,05 |
| IMC | 18,32-42,96 | 26,59 | 4,79 | 17,62-46,82 | 25,48 | 4,76 | t=2,22 | < 0,05 |
| Años diagnóstico | 1-23 | 4,87 | 4,30 | – | – | – | – | |
| Valor sexualidad | – | – | – | 0-10 | 6,43 | 2,42 | – | |
| Nuligestas | 31 (18,02%) | 18 (10,46%) | χ2=4 | < 0,05 | ||||
| Menopáusicas | 25 (14,53%) | 29 (16,86%) | χ2=0,32 | NS | ||||
| Edad media menopausia | 43-58 | 51,20 | 4,62 | 37-55 | 48,31 | 7,04 | t=4,58 | < 0,001 |
| Miomas > 5cm (n=80) | Control (n=80) | Significación estadística | ||||||
| Datos | Rango | Media | Desvío | Rango | Media | Desvío | t/χ2 | p |
| Edad | 28-78 | 47,52 | 8,71 | 28-78 | 47,57 | 8,71 | – | – |
| Gestación | 0-9 | 1,87 | 1,57 | 0-10 | 2,26 | 1,68 | t=1,62 | NS |
| Para | 0-5 | 1,42 | 1,13 | 0-6 | 1,75 | 1,11 | t=2,35 | 0,02 |
| Abortos | 0-6 | 0,45 | 0,97 | 0-8 | 0,52 | 1,21 | t=0,5 | NS |
| Peso | 48-120 | 67,90 | 13,19 | 45-92 | 65,05 | 9,97 | t=1,54 | NS |
| Talla | 1,42-1,75 | 1,60 | 0,07 | 1,48-1,74 | 1,60 | 0,07 | t=0 | NS |
| IMC | 18,95-45,80 | 26,36 | 4,96 | 15,57-39,82 | 25,47 | 4,48 | t=1,20 | NS |
| Años diagnóstico | 1-20 | 5,78 | 4,61 | – | – | – | – | |
| Valor sexualidad | – | – | – | 0-10 | 6,56 | 1,87 | – | |
| Nuligestas | 15 (18,75%) | 8 (10,00%) | χ2=2,46 | NS | ||||
| Menopáusicas | 11 (13,75%) | 14 (17,50%) | χ2=0,42 | NS | ||||
| Edad media menopausia | 45-52 | 48,00 | 21,30 | 35-52 | 50,88 | 362,25 | t=0,026 | NS |
IMC: índice de masa corporal; NS: no significativo.
Índice de masa corporal.
| Miomas 3–5cm (n=172) | Control (n=172) | Significación estadística | ||||||
| Datos | Rango | Media | Desvío | Rango | Media | Desvío | t/χ2 | p |
| Edad | 26-79 | 47,72 | 9,88 | 26-79 | 47,22 | 9,88 | – | – |
| Gestación | 0-9 | 2,02 | 1,58 | 0-10 | 2,26 | 1,53 | t=1,71 | NS |
| Para | 0-8 | 1,63 | 1,22 | 0-6 | 1,81 | 1,20 | t=1 | NS |
| Abortos | 0-6 | 0,39 | 0,80 | 0-4 | 0,45 | 0,77 | t=0,77 | NS |
| Peso | 47-115 | 68,22 | 13,36 | 43-118 | 64,80 | 12,41 | t=0,92 | NS |
| Talla | 1,42-1,78 | 1,60 | 0,06 | 1,40-1,75 | 1,59 | 0,05 | t=2 | < 0,05 |
| IMC | 18,32-42,96 | 26,59 | 4,79 | 17,62-46,82 | 25,48 | 4,76 | t=2,22 | < 0,05 |
| Años diagnóstico | 1-23 | 4,87 | 4,30 | – | – | – | – | |
| Valor sexualidad | – | – | – | 0-10 | 6,43 | 2,42 | – | |
| Nuligestas | 31 (18,02%) | 18 (10,46%) | χ2=4 | < 0,05 | ||||
| Menopáusicas | 25 (14,53%) | 29 (16,86%) | χ2=0,32 | NS | ||||
| Edad media menopausia | 43-58 | 51,20 | 4,62 | 37-55 | 48,31 | 7,04 | t=4,58 | < 0,001 |
| Miomas > 5cm (n=80) | Control (n=80) | Significación estadística | ||||||
| Datos | Rango | Media | Desvío | Rango | Media | Desvío | t/χ2 | p |
| Edad | 28-78 | 47,52 | 8,71 | 28-78 | 47,57 | 8,71 | – | – |
| Gestación | 0-9 | 1,87 | 1,57 | 0-10 | 2,26 | 1,68 | t=1,62 | NS |
| Para | 0-5 | 1,42 | 1,13 | 0-6 | 1,75 | 1,11 | t=2,35 | 0,02 |
| Abortos | 0-6 | 0,45 | 0,97 | 0-8 | 0,52 | 1,21 | t=0,5 | NS |
| Peso | 48-120 | 67,90 | 13,19 | 45-92 | 65,05 | 9,97 | t=1,54 | NS |
| Talla | 1,42-1,75 | 1,60 | 0,07 | 1,48-1,74 | 1,60 | 0,07 | t=0 | NS |
| IMC | 18,95-45,80 | 26,36 | 4,96 | 15,57-39,82 | 25,47 | 4,48 | t=1,20 | NS |
| Años diagnóstico | 1-20 | 5,78 | 4,61 | – | – | – | – | |
| Valor sexualidad | – | – | – | 0-10 | 6,56 | 1,87 | – | |
| Nuligestas | 15 (18,75%) | 8 (10,00%) | χ2=2, 46 | NS | ||||
| Menopáusicas | 11 (13,75%) | 14 (17,50%) | χ2=0,42 | NS | ||||
| Edad media menopausia | 45-52 | 48,00 | 21,30 | 35-52 | 50,88 | 362,25 | t=0,026 | NS |
IMC: índice de masa corporal; NS: no significativo.
En el grupo A, hay diferencias significativas con su grupo control, en la talla, p<0,05, y en el IMC medio, p<0,05, a favor del grupo A. Hay diferencias también en nuligestas, p<0,05, más en el grupo A. Y en la edad media a la menopausia, p<0,001, mayor en las mujeres con miomas. En el grupo B, hay diferencias significativas únicamente, p=0,02, en la paridad, mayor en el grupo control.
En la tabla 1B se expresa el IMC. En el grupo A, hay diferencias significativas, en los casos de IMC normal, p=0,02, más en el grupo control; en sobrepeso I, p<0,001, más en el grupo A, y en obesidad I, p<0,05, más en el grupo A. En el grupo B no hay diferencias significativas en ninguna categoría.
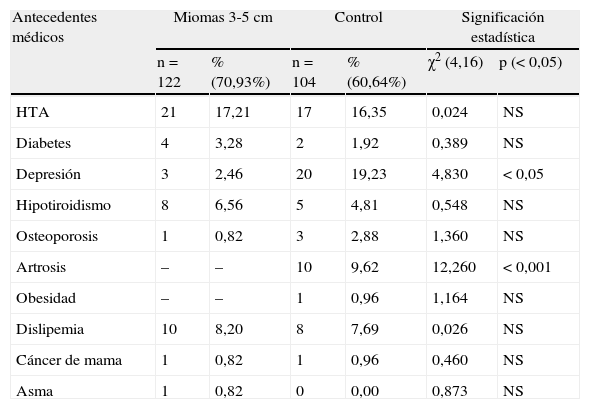
En la tabla 2 se presentan los antecedentes médicos. Hay diferencias significativas, p<0,05, en el grupo A, en 122 casos, 70,93%. Y hay diferencias, p<0,05 en depresión, más en el grupo control, y en artrosis, p<0,001, también en el grupo control. En el grupo B, hay diferencias significativas únicamente en osteoporosis, p=0,02, en el grupo control.
Antecedentes médicos.
| Antecedentes médicos | Miomas 3-5cm | Control | Significación estadística | |||
| n=122 | % (70,93%) | n=104 | % (60,64%) | χ2 (4,16) | p (< 0,05) | |
| HTA | 21 | 17,21 | 17 | 16,35 | 0,024 | NS |
| Diabetes | 4 | 3,28 | 2 | 1,92 | 0,389 | NS |
| Depresión | 3 | 2,46 | 20 | 19,23 | 4,830 | < 0,05 |
| Hipotiroidismo | 8 | 6,56 | 5 | 4,81 | 0,548 | NS |
| Osteoporosis | 1 | 0,82 | 3 | 2,88 | 1,360 | NS |
| Artrosis | – | – | 10 | 9,62 | 12,260 | < 0,001 |
| Obesidad | – | – | 1 | 0,96 | 1,164 | NS |
| Dislipemia | 10 | 8,20 | 8 | 7,69 | 0,026 | NS |
| Cáncer de mama | 1 | 0,82 | 1 | 0,96 | 0,460 | NS |
| Asma | 1 | 0,82 | 0 | 0,00 | 0,873 | NS |
| Antecedentes médicos | Miomas > 5cm | Control | Significación estadística | |||
| n=41 | % (51,25%) | n=39 | % (48,75%) | χ2 (0,1) | p (NS) | |
| HTA | 8 | 19,51 | 9 | 23,08 | 0,046 | NS |
| Diabetes | 3 | 7,32 | 3 | 7,69 | 0,000 | NS |
| Depresión | 2 | 4,88 | 1 | 2,56 | 0,326 | NS |
| Hipotiroidismo | 2 | 4,88 | 1 | 2,56 | 0,326 | NS |
| Osteoporosis | – | – | 6 | 15,38 | 6,220 | 0,02 |
| Artrosis | – | – | – | – | – | – |
| Obesidad | 1 | 2,44 | – | – | 1,006 | NS |
| Dislipemia | – | – | – | – | – | – |
| Cáncer de mama | – | – | – | – | – | – |
| Asma | 1 | 2,44 | 2 | 5,13 | 0,326 | NS |
NS: no significativo.
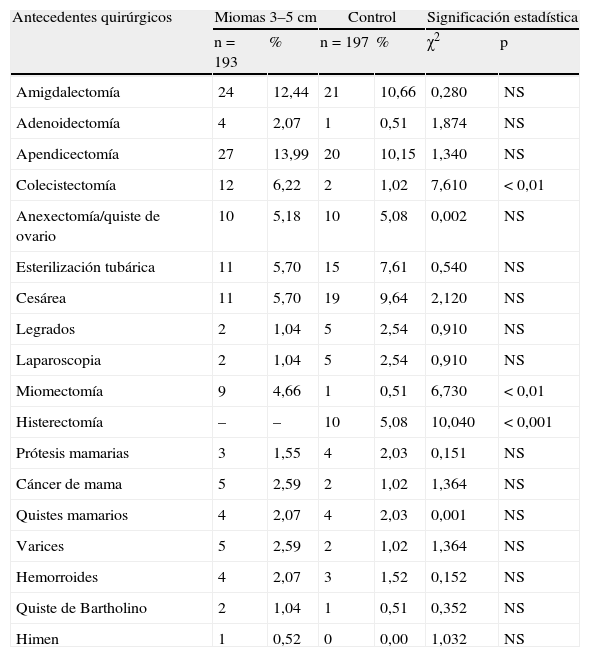
En la tabla 3 se presentan los antecedentes quirúrgicos (puede haber varios en la misma paciente). En el grupo A hay diferencias significativas en colecistectomía, p<0,01, respecto al grupo control; en miomectomía, p<0,01(solo un caso tuvo miomectomía en el grupo control frente a 9 casos en el grupo miomas). Y en histerectomía, p<0,001, en el grupo control son 10 casos frente a ninguno en el grupo miomas. En el grupo B, solo hay diferencias significativas en histerectomía, p<0,05, 5 casos en el grupo control frente a ninguno en el grupo miomas.
Antecedentes quirúrgicos.
| Antecedentes quirúrgicos | Miomas 3–5cm | Control | Significación estadística | |||
| n=193 | % | n=197 | % | χ2 | p | |
| Amigdalectomía | 24 | 12,44 | 21 | 10,66 | 0,280 | NS |
| Adenoidectomía | 4 | 2,07 | 1 | 0,51 | 1,874 | NS |
| Apendicectomía | 27 | 13,99 | 20 | 10,15 | 1,340 | NS |
| Colecistectomía | 12 | 6,22 | 2 | 1,02 | 7,610 | < 0,01 |
| Anexectomía/quiste de ovario | 10 | 5,18 | 10 | 5,08 | 0,002 | NS |
| Esterilización tubárica | 11 | 5,70 | 15 | 7,61 | 0,540 | NS |
| Cesárea | 11 | 5,70 | 19 | 9,64 | 2,120 | NS |
| Legrados | 2 | 1,04 | 5 | 2,54 | 0,910 | NS |
| Laparoscopia | 2 | 1,04 | 5 | 2,54 | 0,910 | NS |
| Miomectomía | 9 | 4,66 | 1 | 0,51 | 6,730 | < 0,01 |
| Histerectomía | – | – | 10 | 5,08 | 10,040 | < 0,001 |
| Prótesis mamarias | 3 | 1,55 | 4 | 2,03 | 0,151 | NS |
| Cáncer de mama | 5 | 2,59 | 2 | 1,02 | 1,364 | NS |
| Quistes mamarios | 4 | 2,07 | 4 | 2,03 | 0,001 | NS |
| Varices | 5 | 2,59 | 2 | 1,02 | 1,364 | NS |
| Hemorroides | 4 | 2,07 | 3 | 1,52 | 0,152 | NS |
| Quiste de Bartholino | 2 | 1,04 | 1 | 0,51 | 0,352 | NS |
| Himen | 1 | 0,52 | 0 | 0,00 | 1,032 | NS |
| Antecedentes quirúrgicos | Miomas > 5cm | Control | Significación estadística | |||
| n=71 | % | n=80 | % | χ2 | p | |
| Amigdalectomía | 15 | 21,13 | 10 | 12,50 | 2,000 | NS |
| Adenoidectomía | – | – | – | – | – | – |
| Apendicectomía | 4 | 5,63 | 8 | 10,00 | 0,960 | NS |
| Colecistectomía | 4 | 5,63 | 3 | 3,75 | 0,293 | NS |
| Anexectomía/quiste de ovario | 4 | 5,63 | 6 | 7,50 | 0,203 | NS |
| Esterilización tubárica | 3 | 4,23 | 4 | 5,00 | 0,042 | NS |
| Cesárea | 6 | 8,45 | 2 | 2,50 | 2,630 | NS |
| Legrados | 2 | 2,82 | 3 | 3,75 | 0,103 | NS |
| Laparoscopia | 1 | 1,41 | 0 | 0,00 | 1,116 | NS |
| Miomectomía | 2 | 2,82 | 0 | 0,00 | 2,260 | NS |
| Histerectomía | 0 | 0,00 | 5 | 6,25 | 4,600 | < 0,05 |
NS: no significativo.
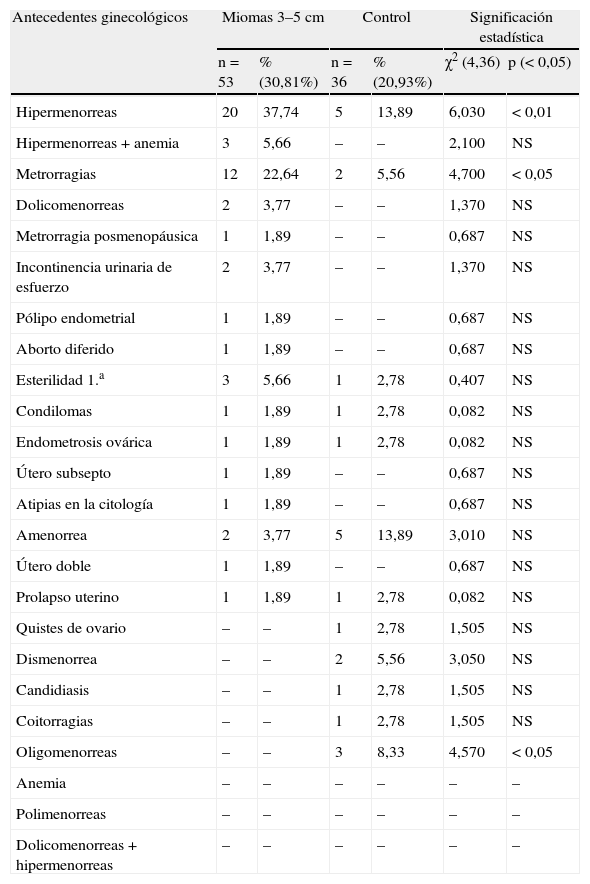
En la tabla 4 se presentan los antecedentes ginecológicos. En el grupo A, hay diferencias significativas en hipermenorreas, p<0,01, frente al grupo control, en metrorragias, p<0,05, también más. En cambio, hay más oligomenorreas, p<0,05, en el grupo control. En el grupo B hay diferencias significativas, también en hipermenorreas, p<0,001, lógicamente con miomas más grandes. En cambio, en el grupo control, hay más quistes de ovario, p<0,05, y más oligomenorreas, p=0,02.
Antecedentes ginecológicos.
| Antecedentes ginecológicos | Miomas 3–5cm | Control | Significación estadística | |||
| n=53 | % (30,81%) | n=36 | % (20,93%) | χ2 (4,36) | p (< 0,05) | |
| Hipermenorreas | 20 | 37,74 | 5 | 13,89 | 6,030 | < 0,01 |
| Hipermenorreas+anemia | 3 | 5,66 | – | – | 2,100 | NS |
| Metrorragias | 12 | 22,64 | 2 | 5,56 | 4,700 | < 0,05 |
| Dolicomenorreas | 2 | 3,77 | – | – | 1,370 | NS |
| Metrorragia posmenopáusica | 1 | 1,89 | – | – | 0,687 | NS |
| Incontinencia urinaria de esfuerzo | 2 | 3,77 | – | – | 1,370 | NS |
| Pólipo endometrial | 1 | 1,89 | – | – | 0,687 | NS |
| Aborto diferido | 1 | 1,89 | – | – | 0,687 | NS |
| Esterilidad 1.a | 3 | 5,66 | 1 | 2,78 | 0,407 | NS |
| Condilomas | 1 | 1,89 | 1 | 2,78 | 0,082 | NS |
| Endometrosis ovárica | 1 | 1,89 | 1 | 2,78 | 0,082 | NS |
| Útero subsepto | 1 | 1,89 | – | – | 0,687 | NS |
| Atipias en la citología | 1 | 1,89 | – | – | 0,687 | NS |
| Amenorrea | 2 | 3,77 | 5 | 13,89 | 3,010 | NS |
| Útero doble | 1 | 1,89 | – | – | 0,687 | NS |
| Prolapso uterino | 1 | 1,89 | 1 | 2,78 | 0,082 | NS |
| Quistes de ovario | – | – | 1 | 2,78 | 1,505 | NS |
| Dismenorrea | – | – | 2 | 5,56 | 3,050 | NS |
| Candidiasis | – | – | 1 | 2,78 | 1,505 | NS |
| Coitorragias | – | – | 1 | 2,78 | 1,505 | NS |
| Oligomenorreas | – | – | 3 | 8,33 | 4,570 | < 0,05 |
| Anemia | – | – | – | – | – | – |
| Polimenorreas | – | – | – | – | – | – |
| Dolicomenorreas+hipermenorreas | – | – | – | – | – | – |
| Antecedentes ginecológicos | Miomas > 5cm | Control | Significación estadística | |||
| n=32 | % (40,00%) | n=21 | % (26,25%) | χ2 (3,4) | p (NS) | |
| Hipermenorreas | 15 | 46,88 | 1 | 4,76 | 10,640 | < 0,001 |
| Hipermenorreas+anemia | 4 | 12,50 | – | – | 2,830 | NS |
| Metrorragias | 5 | 15,63 | 3 | 14,29 | 0,015 | NS |
| Dolicomenorreas | 2 | 6,25 | – | – | 1,371 | NS |
| Metrorragia posmenopáusica | – | – | – | – | – | – |
| Incontinencia urinaria de esfuerzo | – | – | – | – | – | – |
| Pólipo endometrial | – | – | – | – | – | – |
| Aborto diferido | – | – | – | – | – | – |
| Esterilidad 1.a | – | – | – | – | – | – |
| Condilomas | – | – | – | – | – | – |
| Endometrosis ovárica | – | – | – | – | – | – |
| Útero subsepto | – | – | – | – | – | – |
| Atipias en la citología | – | – | – | – | – | – |
| Amenorrea | 1 | 3,13 | – | – | 0,661 | NS |
| Útero doble | – | – | – | – | – | – |
| Prolapso uterino | – | – | 1 | 4,76 | 1,570 | NS |
| Quistes de ovario | – | – | 3 | 14,29 | 4,260 | < 0,05 |
| Dismenorrea | – | – | – | – | – | – |
| Candidiasis | – | – | 2 | 9,52 | 3,160 | NS |
| Coitorragias | – | – | 1 | 4,76 | 1,570 | NS |
| Oligomenorreas | 1 | 3,13 | 5 | 23,81 | 5,400 | 0,02 |
| Anemia | 2 | 6,25 | – | – | 1,371 | NS |
| Polimenorreas | 1 | 3,13 | 4 | 19,05 | 3,750 | NS |
| Dolicomenorreas+hipermenorreas | 1 | 3,13 | – | – | 0,661 | NS |
NS: no significativo.
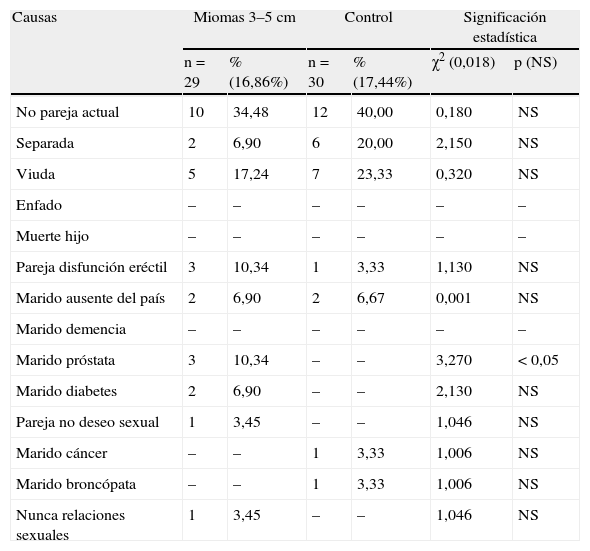
En la tabla 5 se presentan los casos que no tienen relaciones sexuales. No hay diferencias significativas en ningún grupo con sus controles, globalmente. La causa más frecuente es no tener pareja actual, en ambos grupos, así como la mujer tener estado civil de viuda. Únicamente hay diferencias significativas en el grupo A, p<0,05, en el caso del marido enfermo de próstata.
No relaciones sexuales.
| Causas | Miomas 3–5cm | Control | Significación estadística | |||
| n=29 | % (16,86%) | n=30 | % (17,44%) | χ2 (0,018) | p (NS) | |
| No pareja actual | 10 | 34,48 | 12 | 40,00 | 0,180 | NS |
| Separada | 2 | 6,90 | 6 | 20,00 | 2,150 | NS |
| Viuda | 5 | 17,24 | 7 | 23,33 | 0,320 | NS |
| Enfado | – | – | – | – | – | – |
| Muerte hijo | – | – | – | – | – | – |
| Pareja disfunción eréctil | 3 | 10,34 | 1 | 3,33 | 1,130 | NS |
| Marido ausente del país | 2 | 6,90 | 2 | 6,67 | 0,001 | NS |
| Marido demencia | – | – | – | – | – | – |
| Marido próstata | 3 | 10,34 | – | – | 3,270 | < 0,05 |
| Marido diabetes | 2 | 6,90 | – | – | 2,130 | NS |
| Pareja no deseo sexual | 1 | 3,45 | – | – | 1,046 | NS |
| Marido cáncer | – | – | 1 | 3,33 | 1,006 | NS |
| Marido broncópata | – | – | 1 | 3,33 | 1,006 | NS |
| Nunca relaciones sexuales | 1 | 3,45 | – | – | 1,046 | NS |
| Causas | Miomas > 5cm | Control | Significación estadística | |||
| n=24 | % (30,00%) | n=20 | % (25,00%) | χ2 (1,09) | p (NS) | |
| No pareja actual | 14 | 58,33 | 12 | 60,00 | 0,011 | NS |
| Separada | 2 | 8,33 | 4 | 20,00 | 1,250 | NS |
| Viuda | 4 | 16,67 | – | – | 3,065 | NS |
| Enfado | 1 | 4,17 | – | – | 0,858 | NS |
| Muerte hijo | – | – | 1 | 5,00 | 1,230 | NS |
| Marido disfunción eréctil | 3 | 12,50 | 1 | 5,00 | 0,720 | NS |
| Marido ausente del país | – | – | 1 | 5,00 | 1,230 | NS |
| Marido demencia | – | – | 1 | 5,00 | 1,230 | NS |
NS: no significativo.
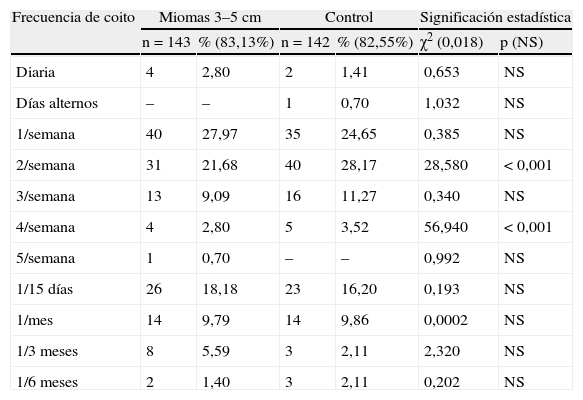
En la tabla 6 se presenta la frecuencia de coito. Globalmente, no hay diferencias significativas en ningún grupo con sus controles. En el grupo A hay diferencias significativas, p<0,001, en 2 coitos/semana y en 4 coitos/semana, respectivamente, más en el grupo control. En el grupo B, hay diferencias significativas, en 3 coitos/semana, p=0,02, más en el grupo miomas, y en un coito/3 meses, p<0,05, en el grupo miomas.
Frecuencia de coito.
| Frecuencia de coito | Miomas 3–5cm | Control | Significación estadística | |||
| n=143 | % (83,13%) | n=142 | % (82,55%) | χ2 (0,018) | p (NS) | |
| Diaria | 4 | 2,80 | 2 | 1,41 | 0,653 | NS |
| Días alternos | – | – | 1 | 0,70 | 1,032 | NS |
| 1/semana | 40 | 27,97 | 35 | 24,65 | 0,385 | NS |
| 2/semana | 31 | 21,68 | 40 | 28,17 | 28,580 | < 0,001 |
| 3/semana | 13 | 9,09 | 16 | 11,27 | 0,340 | NS |
| 4/semana | 4 | 2,80 | 5 | 3,52 | 56,940 | < 0,001 |
| 5/semana | 1 | 0,70 | – | – | 0,992 | NS |
| 1/15 días | 26 | 18,18 | 23 | 16,20 | 0,193 | NS |
| 1/mes | 14 | 9,79 | 14 | 9,86 | 0,0002 | NS |
| 1/3 meses | 8 | 5,59 | 3 | 2,11 | 2,320 | NS |
| 1/6 meses | 2 | 1,40 | 3 | 2,11 | 0,202 | NS |
| Frecuencia de coito | Miomas > 5cm | Control | Significación estadística | |||
| n=56 | % (70,00%) | n=60 | % (75,00%) | χ2 (0,48) | p (NS) | |
| Diaria | 1 | 1,79 | – | – | 1,078 | NS |
| Días alternos | 1 | 1,79 | 3 | 5,00 | 0,880 | NS |
| 1/semana | 11 | 19,64 | 17 | 28,33 | 1,160 | NS |
| 2/semana | 14 | 25,00 | 20 | 33,33 | 0,950 | NS |
| 3/semana | 9 | 16,07 | 2 | 3,33 | 5,620 | 0,02 |
| 4/semana | 3 | 5,36 | – | – | 3,320 | NS |
| 5/semana | 1 | 1,79 | – | – | 1,078 | NS |
| 1/15 días | 6 | 10,71 | 9 | 15,00 | 0,460 | NS |
| 1/mes | 6 | 10,71 | 8 | 13,33 | 0,170 | NS |
| 1/3 meses | 4 | 7,14 | – | – | 4,420 | < 0,05 |
| 1/6 meses | – | – | – | – | – | NS |
NS: no significativo.
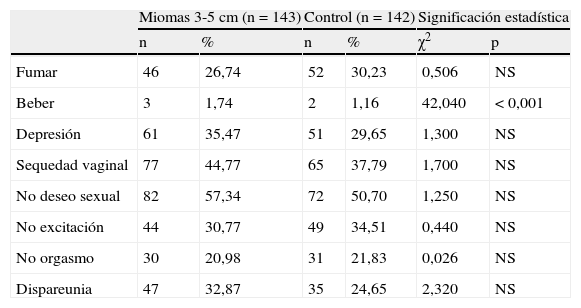
La tabla 7 habla de fumar, beber y depresión, y de los parámetros sexuales. Hay diferencias significativas en beber, p<0,001, en el grupo A, respecto a su control. No hay diferencias significativas en depresión, entre ambos grupos y sus controles, siendo respectivamente en los grupos de miomas 35,46 y 33,75%.
Fumar, beber, depresión y parámetros sexuales.
| Miomas 3-5cm (n=143) | Control (n=142) | Significación estadística | ||||
| n | % | n | % | χ2 | p | |
| Fumar | 46 | 26,74 | 52 | 30,23 | 0,506 | NS |
| Beber | 3 | 1,74 | 2 | 1,16 | 42,040 | < 0,001 |
| Depresión | 61 | 35,47 | 51 | 29,65 | 1,300 | NS |
| Sequedad vaginal | 77 | 44,77 | 65 | 37,79 | 1,700 | NS |
| No deseo sexual | 82 | 57,34 | 72 | 50,70 | 1,250 | NS |
| No excitación | 44 | 30,77 | 49 | 34,51 | 0,440 | NS |
| No orgasmo | 30 | 20,98 | 31 | 21,83 | 0,026 | NS |
| Dispareunia | 47 | 32,87 | 35 | 24,65 | 2,320 | NS |
| Miomas > 5cm (n=56) | Control (n=60) | Significación estadística | ||||
| n | % | n | % | χ2 | p | |
| Fumar | 25 | 31,25 | 18 | 22,50 | 1,520 | NS |
| Beber | – | – | 1 | 1,25 | 1,006 | NS |
| Depresión | 27 | 33,75 | 26 | 32,50 | 0,026 | NS |
| Sequedad vaginal | 24 | 30,00 | 30 | 37,50 | 0,980 | NS |
| No deseo sexual | 19 | 33,93 | 25 | 41,67 | 0,720 | NS |
| No excitación | 20 | 35,71 | 18 | 30,00 | 0,410 | NS |
| No orgasmo | 12 | 21,43 | 9 | 15,00 | 0,790 | NS |
| Dispareunia | 19 | 33,93 | 18 | 30,00 | 0,190 | NS |
NS: no significativo.
La sequedad vaginal, en 44,76 y 30%, respectivamente, sin diferencias significativas con los controles.
Respecto a la función sexual, descontando los casos que no tienen relaciones sexuales (tabla 5), los grupos se quedan con 143 casos (grupo A) y 56 casos (grupo B). Pues bien, no hay diferencias significativas en ningún parámetro sexual (no deseo sexual, no excitación, no orgasmo, dispareunia), en ningún grupo y sus controles.
Preguntadas las mujeres sobre la valoración de su vida sexual entre 0 y 10 puntos, los valores medios fueron 6,43 y 6,56 (tabla 1), en los grupos control, simplemente aprobado. Los años desde el diagnóstico por primera vez del mioma hasta la actualidad fueron de media 4,87 años en el grupo A, y 5,78 años en el grupo B (tabla 1).
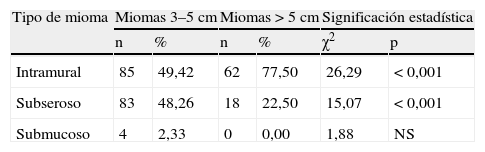
En la tabla 8 estudiamos los miomas, de ambos grupos. Hay diferencias significativas en el tipo de mioma, p<0,001, respectivamente, en miomas intramurales (más en el grupo B, 77,5%) y miomas subserosos (más en el grupo A, 48,25%). Solo hay 4 casos de miomas submucosos en el grupo A (2,33%).
Características de los miomas.
| Tipo de mioma | Miomas 3–5cm | Miomas > 5cm | Significación estadística | |||
| n | % | n | % | χ2 | p | |
| Intramural | 85 | 49,42 | 62 | 77,50 | 26,29 | < 0,001 |
| Subseroso | 83 | 48,26 | 18 | 22,50 | 15,07 | < 0,001 |
| Submucoso | 4 | 2,33 | 0 | 0,00 | 1,88 | NS |
| Volumen mioma (cm3) | Rango | Media | Desvío | Rango | Media | Desvío | Significación estadística | |
| χ2 | p | |||||||
| 26,10-308,10 | 103,05 | 53,61 | 122,52-2951,35 | 481,09 | 384,63 | |||
| Único | 125 | 72,67 | 65 | 81,25 | 2,14 | NS | ||
| Múltiple | 47 | 27,33 | 15 | 18,75 | 2,14 | NS | ||
| Tamaño | ||||||
| Aumento | 71 | 41,28 | 54 | 67,50 | 1,50 | < 0,001 |
| Disminución | 22 | 12,79 | 8 | 10,00 | 0,40 | NS |
| Igual | 79 | 45,93 | 18 | 22,50 | 12,65 | < 0,001 |
| Influencias del mioma | ||||||
| Menor frecuencia coito | – | – | 1 | 1,25 | 2,21 | NS |
| Dolor | 37 | 21,51 | 29 | 36,25 | 6,12 | 0,02 |
| Dispareunia | 13 | 7,56 | 9 | 11,25 | 0,91 | NS |
| Dismenorrea | 4 | 2,33 | – | – | 1,88 | NS |
| Molestias urinarias | 1 | 0,58 | 2 | 2,50 | 1,71 | NS |
NS: no significativo.
No hay diferencias significativas entre ambos grupos, en miomas únicos, 72,67 y 81,25%, respectivamente; y miomas múltiples, 27,33 y 18,75%.
Hemos calculado el volumen de los miomas en cm3 y fue de media: 103,05cm3 en el grupo A, y 481,09cm3 en el grupo B. Respecto a los cambios de tamaño del mioma, en relación con la última medida conocida del año anterior, ha habido diferencias significativas, p<0,001 en aumento de tamaño (en el grupo B), y p<0,001 en igualdad de tamaño (más en el grupo A).
Respecto a las influencias clínicas del mioma en la mujer, se han señalado: menor frecuencia de coito, dolor pélvico crónico, dispareunia, dismenorrea, molestias urinarias (polaquiuria, nicturia). Pues bien, solo hubo diferencias significativas, p=0,02, en dolor pélvico crónico, más, lógicamente, en los grandes miomas (grupo B).
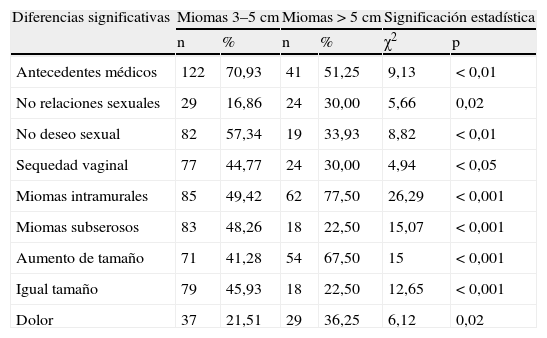
Finalmente, en la tabla 9, comparativa entre los miomas para ver los datos significativos. Señalamos, en el grupo A, diferencias significativas a su favor, en antecedentes médicos, p<0,01; en no deseo sexual, p<0,01; en sequedad vaginal, p<0,05; en miomas subserosos, p<0,001, y en miomas al año con igual tamaño, p<0,001. En el grupo B hay diferencias significativas a su favor, en no relaciones sexuales, p=0,02; en miomas intramurales, p<0,001; en aumento de tamaño del mioma al año de control, p<0,001, y en dolor pélvico crónico, p=0,02.
Comparativa miomas. Significación.
| Diferencias significativas | Miomas 3–5cm | Miomas > 5cm | Significación estadística | |||
| n | % | n | % | χ2 | p | |
| Antecedentes médicos | 122 | 70,93 | 41 | 51,25 | 9,13 | < 0,01 |
| No relaciones sexuales | 29 | 16,86 | 24 | 30,00 | 5,66 | 0,02 |
| No deseo sexual | 82 | 57,34 | 19 | 33,93 | 8,82 | < 0,01 |
| Sequedad vaginal | 77 | 44,77 | 24 | 30,00 | 4,94 | < 0,05 |
| Miomas intramurales | 85 | 49,42 | 62 | 77,50 | 26,29 | < 0,001 |
| Miomas subserosos | 83 | 48,26 | 18 | 22,50 | 15,07 | < 0,001 |
| Aumento de tamaño | 71 | 41,28 | 54 | 67,50 | 15 | < 0,001 |
| Igual tamaño | 79 | 45,93 | 18 | 22,50 | 12,65 | < 0,001 |
| Dolor | 37 | 21,51 | 29 | 36,25 | 6,12 | 0,02 |
En los miomas de 3-5cm, grupo A, en 85 mujeres hubo 122 antecedentes médicos (70,93%); y en 117 mujeres hubo 193 procedimientos quirúrgicos (112,20%). El diagnóstico actual, en la misma visita, fue en 27 casos (15,69%), y en los 6 meses previos en 5 casos (2,90%). En 13 casos había calcificaciones, 7,55%. En el caso n.° 40 se veía en la radiografía simple de abdomen el mioma calcificado. En el caso n.° 50 también se diagnosticó un quiste de aspecto endometriósico de 42,8 x 35,9mm. En los casos n.° 56 y n.° 99 se diagnosticaron sendos quistes de ovario. En el caso n.° 163 había un pólipo endometrial. Se remitieron a intervención 2 casos (1,16%): el n.° 77, por dolor, dispareunia y molestias urinarias, y el n.° 98, por dolor, dispareunia y aborto diferido una semana antes, tenía 2 miomas.
En los miomas > 5cm, grupo B, en 29 mujeres hubo 41 antecedentes médicos (51,25%); y en 46 mujeres hubo 71 procedimientos quirúrgicos (88,75%). En 7 casos eran úteros polimiomatosos (8,75%). Había 4 miomas calcificados (5%), un mioma ístmico (1,25%), un mioma pediculado subseroso (1,25%), y 2 casos de degeneración quística del mioma (2,50%). El diagnóstico actual, en la misma visita, fue en 9 casos (11,25%). En 2 casos se había hecho en los 6 meses previos (2,5%). Se remitieron a intervención 3 casos, n.° 24, 29 y 34, todos por dolor y dispareunia. Otros 7 casos (8,75%), a los que se propuso intervención, la rechazaron. En 4 casos (5%), se trataron con dispositivo intrauterino de Pg (DIU-Mirena), por las hipermenorreas. Y en un caso (1,25%) se trató con análogos de la Gn-RH.
Al ver en ambos grupos de miomas los que cursaban con dolor y dispareunia y el aumento de tamaño del mioma o no; con 3-5cm, dolor en 37 casos, aumento de tamaño en 17 (45,94%); y dispareunia en 13 casos, aumento de tamaño en 5 casos (38,46%). Con miomas > 5cm, dolor en 29 casos, y aumento de tamaño en 20 (68,96%); dispareunia, en 9 casos, y aumento de tamaño en 5 (55,55%). Pues bien, al compararlos, no hay diferencias significativas ni en dolor ni en dispareunia.
Como conclusiones de los resultados:
- 1.
Con los miomas de 3-5cm, hay diferencias significativas en no deseo sexual, p<0,01, y en sequedad vaginal, p<0,05.
- 2.
Con los miomas > 5cm, hay diferencias significativas en no relaciones sexuales, p=0,02; en aumento de tamaño del mioma al año de control, p<0,001, y en dolor pélvico crónico, p=0,02.
Los miomas en el 50% son asintomáticos9. Los miomas submucosos son sintomáticos, dan menorragia o sangrado intermenstrual. Los miomas subserosos pediculados son asintomáticos, salvo con torsión que da dolor agudo. Los miomas intramurales distorsionan la cavidad y dan menorragias. Los grandes dan sensación de hinchazón abdominal y aumento de peso. Muchos miomas se diagnostican accidentalmente.
En el grupo A, el diagnóstico actual, en la misma visita, fue en 27 casos (15,69%), y en 5 casos (2,90%) se había hecho en los 6 meses previos. En el grupo B, el diagnóstico actual, en la misma visita, fue en 9 casos (11,25%), y en 2 casos (2,5%), se había hecho en los 6 meses previos.
También ocurre que hay un mioma y muchos síntomas, y muchos miomas y pocos síntomas. O hay mioma y menorragias, y la mujer lo considera normal, porque siempre ha sangrado mucho. O también, y con síntomas urinarios por el mioma, como incontinencia urinaria de urgencia, y la mujer no lo considera síntomas, sino debido a la edad.
Los miomas causan ansiedad a la mujer: por la posibilidad de malignidad, por la necesidad de histerectomía, por la afectación de la fertilidad y el resultado del embarazo, por el crecimiento y la terapia de frenado, o porque en la espera le causa dolor.
Nosotros tenemos experiencia en la clínica de los miomas. Hemos publicado distintos casos interesantes: gran mioma uterino causante de hiperfibrinólisis primaria10, leiomiomas en parasalpinge11, torsión de mioma gigante subseroso pediculado como causa de abdomen agudo12, parto de gran mioma submucoso13 o leiomioma subseroso gigante con degeneración quística14.
En nuestra serie, en el grupo A, eran sintomáticos 38/172 casos (22,09%), y en el grupo B, eran sintomáticos 30/80 casos (37,5%). En el grupo A, el síntoma más frecuente fue la hipermenorrea en 37,74%, seguido de las metrorragias en 22,64%, con diferencias significativas respecto a su grupo control, p<0,01 y p<0,05, respectivamente. En el grupo B, igual, también con diferencias significativas en las hipermenorreas, p<0,001, que se dan en 46,88%. Y en cambio, los miomas submucosos fueron 4 casos (2,33%) en el grupo A, y ninguno en el grupo B.
Las menorragias o hipermenorreas anemizantes se dan en 30%, en miomas intramurales (58%) o miomas submucosos (21%)15,16. Los miomas > 5cm dan más sangrados y más días de sangrado fuerte. Los motivos son: aumento del área endometrial, aumento de la vascularidad del útero, interferencia en la contractilidad, ulceración endometrial submioma submucoso y compresión del plexo venoso del miometrio.
Los leiomiomas son proliferaciones de leiomiocitos en medio de estroma fibrosa con escasos vasos sanguíneos17. Son de consistencia semiblanda y elástica. A más colágeno en la estroma, mayor dureza. A más celularidad, más blando, y con edema, degeneración mixoide o necrosis.
Son tumores bien circunscritos, seudoencapsulados y sólidos. De 1mm a 30cm18. Sus células musculares con poco pleomorfismo y actividad mitótica<de 5 mitosis/10 cga (campos de gran aumento). Son heterogéneos en el crecimiento. El crecimiento medio es 1, 2cm/2,5 años. La Pg es más importante que el E2 en el crecimiento del mioma. El mioma crece en la periferia (que es la zona biológica más activa) en la fase secretora.
Nosotros hemos estudiado el crecimiento de los grandes miomas en el embarazo19, encontrando que lo hacían en el 35,71%. Y el crecimiento de los miomas con THS de la menopausia20, y en 23/59 casos (39%) aumentó el volumen del mioma.
En nuestra serie, estudiando el aumento de tamaño en las medidas ecográficas en el último año, hubo crecimiento en 71/172 casos (41,28%) en el grupo A, y en 54/80 casos (67,5%) en el grupo B, diferencia significativa, p<0,001. Los grandes miomas crecen más que los pequeños.
Respecto al dolor, que las mujeres prácticamente no lo han referido como síntoma, sí al preguntarles expresamente, en el grupo A, tienen 37/172 casos (21,51%), y en el grupo B tienen 29/80 casos (36,25%), diferencia significativa, p=0,02. Con los grandes miomas hay más dolor.
La dispareunia se señala en 32,87% en el grupo A, y en 33,93% en el grupo B. No hay diferencias significativas con sus controles.
Con miomas hay más dispareunia, odds ratio (OR)=2,8, y más dolor pélvico, OR=2,621. Pero no más dismenorrea. La dispareunia y el dolor pélvico crónico interfieren con la actividad sexual, empeorando la calidad de vida.
Entre las causas de dispareunia profunda se señalan los miomas. Los miomas grandes hacen presión en las estructuras anexas y en el cérvix, y producen dolor22. Pero para otros autores no hay diferencias de prevalencia ni en la intensidad del dolor.
Nosotros estudiamos prospectivamente durante 4 años causas físicas de dispareunia, y en 80 casos, ninguno tenía miomas23.
En nuestra serie, hemos estudiado los miomas por ecografía vaginal (que es el gold standard) por su disponibilidad, fácil uso y bajo coste24. Pero los miomas pequeños y algunos subserosos pueden pasar desapercibidos. La RMN es mejor técnica para detectar, localizar y caracterizar los miomas, y tiene interés en el preoperatorio para optimizar la cirugía25. Interesa en úteros polimiomatosos, con miomas > 5cm y más grandes.
Comparando la ecografía vaginal y la RMN en el diagnóstico de miomas26, en 106 mujeres premenopáusicas con indicación de histerectomía de causa benigna, haciendo ambas exploraciones en cada paciente, hubo igual nivel de precisión. Con la RMN, sensibilidad, S=0,99, y especificidad, E=0,86. Con la ecografía vaginal, S=0,99 y E=0,91. Hubo igual seguridad con 1-4 miomas. Pero la RMN fue mejor en grandes miomas, con volumen > 375ml, y con múltiples miomas, > 4. La sorpresa fue que hubo más falsos positivos con RMN que con ecografía. La RMN se reserva para casos dudosos.
Nosotros solo la aplicamos en esta serie, en un caso del grupo A, n.° 100, una mujer de 59 años, que no había tenido relaciones sexuales nunca, y cuya ecografía abdominal era dudosa al ver tumoración en Douglas mal delimitable. La RMN confirmó mioma, y además tenía otros múltiples<1cm. Y en un caso del grupo B, n.° 66, en una mujer de 63 años, con un mioma subseroso pediculado, calcificado, alejado del útero. La RMN lo confirmó.
Los 2 trabajos que hablan de función sexual y miomas son el de Ferrero et al y el de Ertunc et al.
Ferrero et al27 estudian la dispareunia profunda y la vida sexual en la mujer con miomas. En 2000–2005, 307 mujeres premenopáusicas para cirugía por mioma. La dispareunia profunda y la intensidad del dolor no estaba en relación con el número, la posición y el tamaño del mioma. La dispareunia profunda era mayor en mujeres con miomas anteriores y fúndicos. No había diferencias en la vida sexual. Con los miomas no aumenta la prevalencia y severidad de la dispareunia profunda. La función sexual no empeora. Pero su grupo control solo era de 24 casos.
Ertunc et al28, en cambio, con 80 miomas y 75 controles, encuentran que con miomas hay peor función sexual por más dolor en el coito. La miomectomía mejora el dolor y la función sexual. Los miomas de fondo y cara posterior se asocian con el dolor. Tampoco hay relación con el volumen del mioma. Con síntomas, la mujer se siente diferente y menos atractiva. No hay diferencias en la función sexual, excepto en el dolor, p<0,001.
Finalmente, en nuestra serie, no hay diferencias significativas en la función sexual en ningún parámetro: no deseo sexual, no excitación, no orgasmo y dispareunia, ni en los miomas de 3-5cm y su grupo control ni en los miomas de > 5cm y su grupo control. Ni en la dispareunia entre ambos grupos de miomas.
Y recapitulando sobre nuestros hallazgos, encontramos diferencias significativas en los miomas de 3-5cm, en no deseo sexual (p<0,01) y en sequedad vaginal (p<0,05). Y en los miomas > 5cm: en no relaciones sexuales (p=0,02), en aumento del tamaño del mioma al año de control (p<0,001) y en dolor (p=0,02).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.