El diagnóstico definitivo del cáncer de ovario precisa de confirmación histológica. En determinadas situaciones, para evitar la morbilidad de la resección quirúrgica, es posible hacer una biopsia guiada por ecografía para obtener el diagnóstico anatomopatológico. El objetivo de esta revisión sistemática fue evaluar la adecuación, fiabilidad, precisión y perfil de seguridad de la biopsia guiada por ecografía de masas ováricas. Siguiendo el modelo PRISMA 2020, se hizo una búsqueda bibliográfica en PubMed, Embase y Scopus y se recopilaron un total de 10.245 artículos, de los cuales 24 fueron finalmente incluidos. Los trabajos incluían de forma mayoritaria pacientes con tumores inoperables avanzados, pobre performance status y otros factores de mal pronóstico, con masas de contenido sólido y márgenes irregulares, generalmente accesibles por vía transvaginal. En la mayoría de los artículos las pacientes presentaban historia previa de malignidad o tumores inoperables en estadios avanzados. Las masas ováricas biopsiables se definían en la ecografía como malignas o potencialmente malignas, con la presencia destacada de un componente sólido o mixto con márgenes irregulares o heterogéneos. La técnica más utilizada en los estudios incluidos fue la biopsia con aguja gruesa o tru-cut, con altos valores de adecuación, fiabilidad, precisión y rendimiento, así como un buen perfil de seguridad y bajas tasas de complicaciones. En conclusión, la biopsia con aguja gruesa de las masas anexiales guiada por ecografía, en pacientes subsidiarios de tratamiento neoadyuvante, es una técnica con altas tasas de adecuación, fiabilidad, precisión y buen perfil de seguridad.
The definitive diagnosis of ovarian cancer requires histological confirmation. In certain situations, to avoid the morbidity of surgical resection, it is possible to perform an ultrasound-guided biopsy to obtain the pathological diagnosis. The aim of this systematic review was to assess the adequacy, reliability, accuracy, and safety profile of ultrasound-guided biopsy of ovarian masses. Following the PRISMA 2020 model, a bibliographic search was carried out in PubMed, Embase and Scopus, collecting a total of 10,245 articles, of which 24 were finally included. The studies mainly included patients with advanced inoperable tumors, poor performance status and other poor prognostic factors, with masses of solid content and irregular margins, generally accessible through the transvaginal route. In most of the articles, the patients had a previous history of malignancy or had inoperable tumors in advanced stages. Biopsiable ovarian masses were defined ultrasonographically as malignant or potentially malignant, mainly highlighting the presence of a solid or mixed component and irregular or heterogeneous margins. The most widely used technique in the included studies was core needle or tru-cut biopsy, presenting high values of adequacy, reliability, precision and performance, as well as a good safety profile with low complication rates. In conclusion, ultrasound-guided core needle biopsy of adnexal masses in patients eligible for neoadjuvant treatment is a technique with high adequacy, reliability, and precision rates, as well as a good safety profile.
El cáncer de ovario se conoce como el «asesino silencioso» debido a su diagnóstico tardío en estadios avanzados en muchos casos por la escasez de síntomas que presenta. Ante una masa ovárica, la técnica de elección para el diagnóstico es la ecografía, específicamente por vía transvaginal dada su mejor resolución, que permite visualizar su arquitectura interna y llegar a un diagnóstico diferencial mediante la aplicación de las simple rules desarrolladas por el grupo IOTA en 20081. Sin embargo, la ecografía es una técnica que puede estar sesgada por la subjetividad del explorador, por lo que se han desarrollado diversos modelos matemáticos, como el Risk of Malignancy Index (RMI), el Risk of Ovarian Malignancy Algorithm (ROMA) y el Logistic Regresion Model (LR2), entre otros modelos de regresión logística. Estos modelos no han demostrado una mejora de la rentabilidad diagnóstica de la ecografía, sin embargo, resultan útiles ante masas difíciles de clasificar2.
No obstante, aunque la ecografía puede resultar útil para establecer un diagnóstico de sospecha de malignidad, el diagnóstico definitivo precisa de confirmación histológica3. Si bien es habitual que el diagnóstico histológico se realice sobre la pieza quirúrgica, existen determinadas situaciones en las que podría evitarse la morbilidad de la resección quirúrgica con una biopsia guiada por ecografía4. Esta alternativa podría plantearse cuando no exista un riesgo potencial de diseminación yatrogénica por la salida de material a la cavidad peritoneal, como son aquellos quistes funcionales con bajo riesgo de malignización a priori, o bien aquellos carcinomas ováricos en estadios avanzados (en principio, no quirúrgicos) en los que se precisa confirmación histológica previa a la administración de neoadyuvancia4,5. De ese modo, la ecografía adquiere un papel relevante en este perfil de paciente y sirve de guía para la obtención de muestras mediante punción-aspiración o biopsias dirigidas en aquellas pacientes que se beneficiarían de evitar una cirugía1. Esta toma de muestra puede llevarse a cabo mediante punción-aspiración con aguja fina (PAAF) o mediante una biopsia con aguja gruesa (BAG) o tru-cut; esta última es la de elección por su mayor precisión6. Por ello, el objetivo de esta revisión sistemática fue evaluar la adecuación, fiabilidad, precisión y perfil de seguridad de la biopsia guiada por ecografía de masas ováricas.
Material y métodosEsta revisión sistemática se ha llevado a cabo de acuerdo con la declaración PRISMA 2020, con registro en PROSPERO número 421132. Se ha realizado una búsqueda sistemática de diferente documentación bibliográfica en PubMed y Embase, desde el 1 de enero de 1990 hasta el 1 de marzo de 2023.
La búsqueda se hizo en PubMed y Embase con la siguiente terminología médica (MeSH): (Adnexal Diseases OR Ovarian Neoplasms OR Ovarian Cysts OR Pelvic Neoplasms) AND (Ultrasonography OR Ultrasonography, Interventional OR Image-Guided Biopsy OR Biopsy, Needle OR Punctures OR Biopsy, Fine-Needle OR Biopsy, Large-Core Needle/methods). No se utilizaron restricciones de idioma.
Para la búsqueda en Scopus se utilizó la siguiente terminología médica (MeSH): (Pelvic masses OR Adnexal masses) AND Ultrasound-guided AND biopsy, acotando los estudios desde el 1 de enero de 2015 hasta el 1 de marzo de 2023, ya que en ese periodo es en el que se concentran la mayoría de los artículos relevantes en Embase y Scopus. Dado que esta revisión sistemática se basa en estudios publicados previamente, no se requiere la aprobación del Comité de Ética.
Selección de estudiosPara la selección de los estudios se aplicaron los siguientes criterios de inclusión:
- -
Estudios sobre el uso de la biopsia guiada por ecografía para el diagnóstico definitivo de benignidad o malignidad de masas ováricas según la histología obtenida, realizada en función de los aspectos ecográficos de estas.
- -
Estudios en seres humanos.
- -
Estudios transversales, prospectivos o retrospectivos.
- -
Puede haber comparaciones del uso de ecografía y otras pruebas diagnósticas siempre que el objetivo planteado sea el uso de la biopsia guiada por ecografía para el diagnóstico de masas anexiales.
En cuanto a los criterios de exclusión, se aplicaron los siguientes:
- -
Ser consensos, protocolos, clasificaciones, guías clínicas, cartas, comentarios o revisiones.
- -
Hablar de las consecuencias, de tener masas ováricas y de su tratamiento, pero no de su diagnóstico.
- -
Estudiar la prevalencia de masas ováricas.
- -
Ser un estudio con menos de 5 pacientes debido a que, pese a ser un tema en auge, aún se han desarrollado pocos análisis, por lo que estudios de pocos pacientes se consideran una muestra suficientemente representativa: el punto de corte se determina en 5 casos.
- -
Tener bibliografías en las que no es posible obtener el artículo completo.
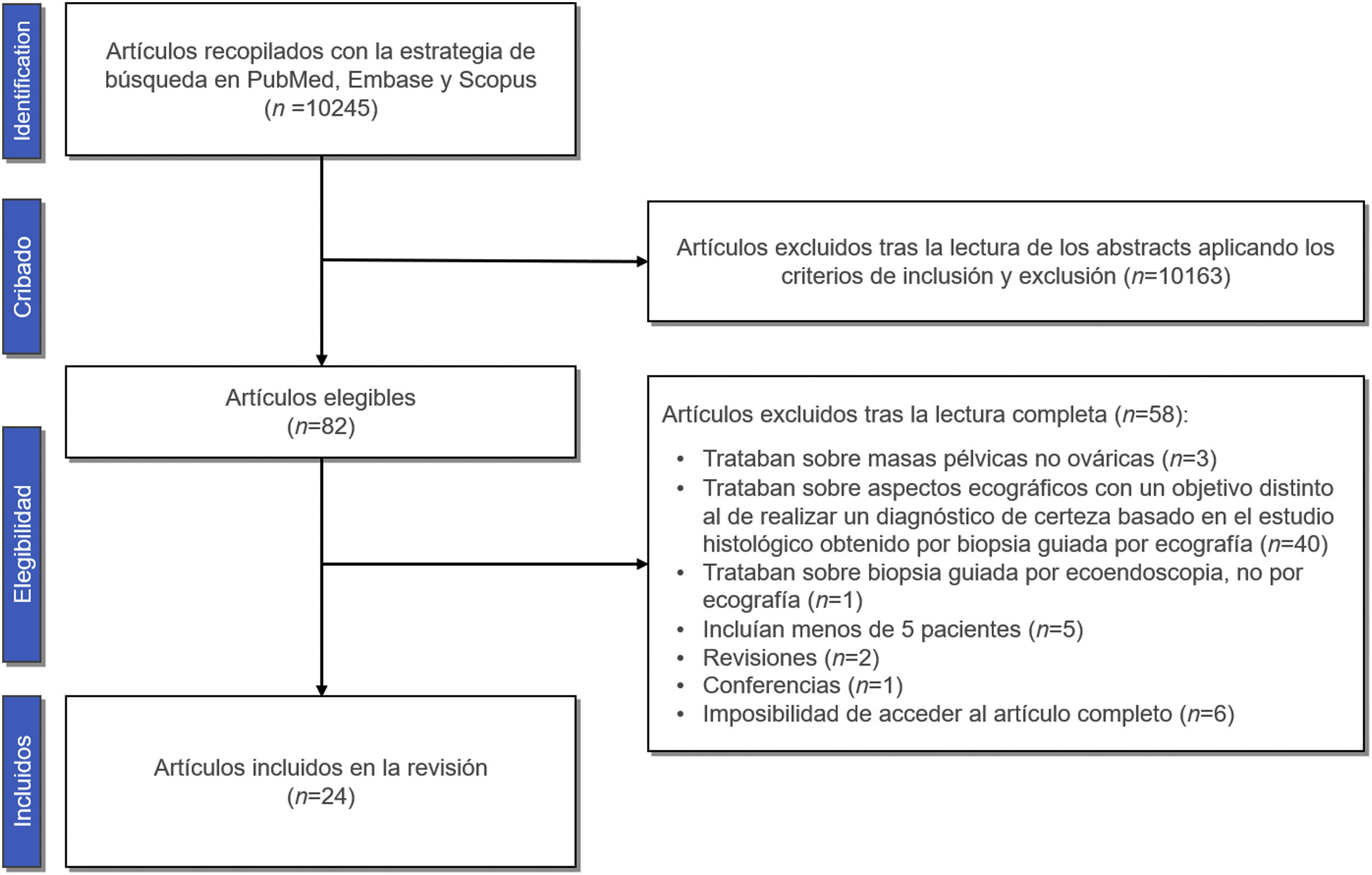
El total de los artículos recopilados con la estrategia de búsqueda fue 10.245 (fig. 1), incluyendo el periodo entre el 1 de enero de 1990 y el 1 de marzo de 2023. Tras la lectura de los resúmenes aplicando los criterios de inclusión y exclusión y tras la exclusión de 19 artículos que se encontraban simultáneamente en varias de las bases de datos consultadas, se obtuvo un total de 82 artículos. Tras la completa lectura de los artículos seleccionados, se excluyeron un total de 58 trabajos por los siguientes motivos:
- -
Artículos que trataban sobre masas pélvica no ováricas (n = 3).
- -
Artículos que trataban sobre aspectos ecográficos con un objetivo distinto al de realizar un diagnóstico de certeza basado en el estudio histológico obtenido por biopsia guiada por ecografía (n = 40).
- -
Artículos sobre biopsia guiada por ecoendoscopia, no por ecografía (n = 1).
- -
Artículos que incluían menos de 5 pacientes (n = 5).
- -
Revisiones (n = 2).
- -
Conferencias (n = 1).
- -
Imposibilidad de acceder al artículo completo (n = 6).
De esta forma, de acuerdo con los criterios de inclusión y exclusión establecidos, un total de 24 artículos fueron incluidos en esta revisión sistemática (fig. 1).
ResultadosLa búsqueda incluyó un total de 10.245 que coincidían con los criterios MeSH de búsqueda, 24 de los cuales cumplían con los criterios de inclusión y exclusión y fueron incorporados a la revisión (fig. 1).
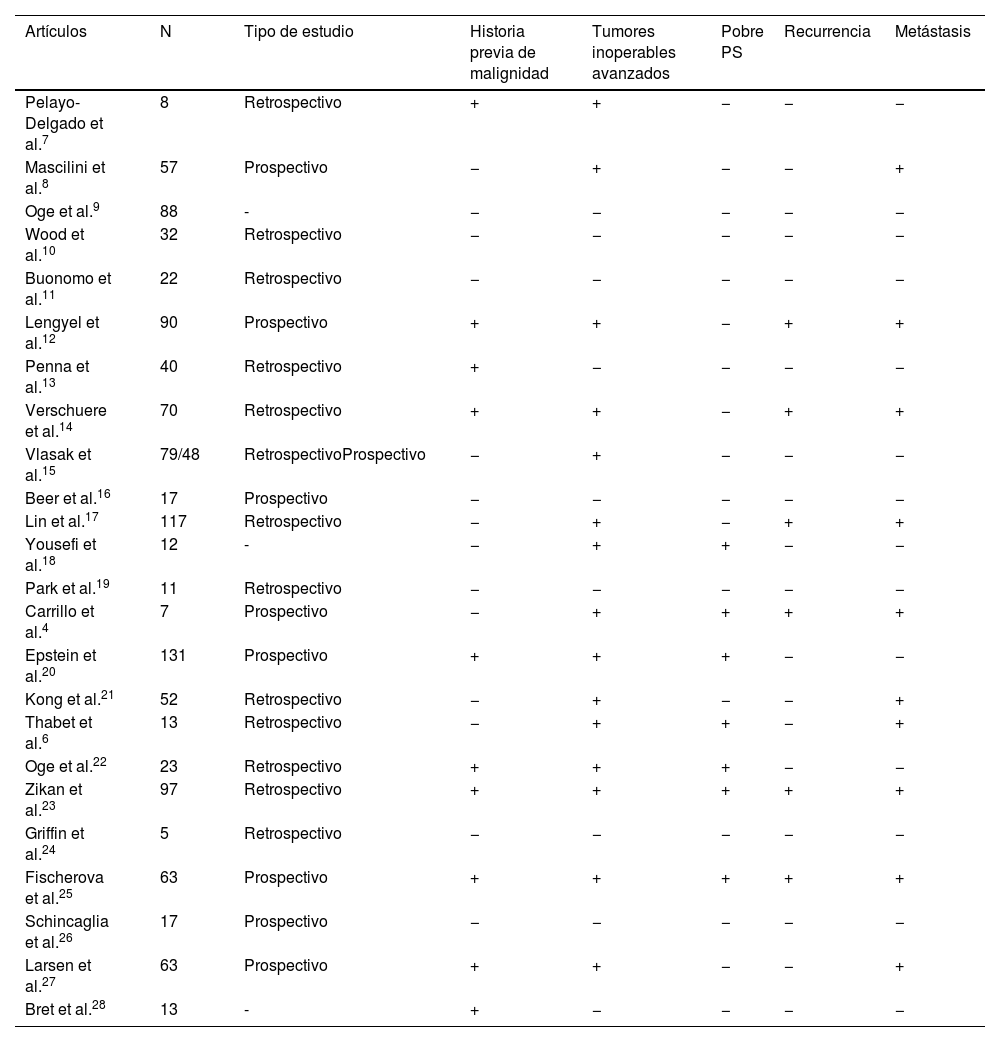
En la mayoría de los artículos (tabla 1), las pacientes presentaban historia previa de malignidad7,12-14,20,22,23,25,27,28 o tumores inoperables en estadios avanzados4,6-8,12,14,15,17,18,20-23,25,27. Algunos estudios4,6,18,20,22,23,25 incluyeron a pacientes con un pobre performance status, que se define como la capacidad de autocuidado y el nivel de actividad que puede llevar a cabo el individuo con relación a su calidad de vida (tabla 1). Por último, también se tuvieron en cuenta factores como las recurrencias4,12,14,17,23,25 o la presencia de metástasis4,6,8,12,14,17,21,23,25 (tabla 1).
Características de las pacientes
| Artículos | N | Tipo de estudio | Historia previa de malignidad | Tumores inoperables avanzados | Pobre PS | Recurrencia | Metástasis |
|---|---|---|---|---|---|---|---|
| Pelayo-Delgado et al.7 | 8 | Retrospectivo | + | + | − | − | − |
| Mascilini et al.8 | 57 | Prospectivo | − | + | − | − | + |
| Oge et al.9 | 88 | - | − | − | − | − | − |
| Wood et al.10 | 32 | Retrospectivo | − | − | − | − | − |
| Buonomo et al.11 | 22 | Retrospectivo | − | − | − | − | − |
| Lengyel et al.12 | 90 | Prospectivo | + | + | − | + | + |
| Penna et al.13 | 40 | Retrospectivo | + | − | − | − | − |
| Verschuere et al.14 | 70 | Retrospectivo | + | + | − | + | + |
| Vlasak et al.15 | 79/48 | RetrospectivoProspectivo | − | + | − | − | − |
| Beer et al.16 | 17 | Prospectivo | − | − | − | − | − |
| Lin et al.17 | 117 | Retrospectivo | − | + | − | + | + |
| Yousefi et al.18 | 12 | - | − | + | + | − | − |
| Park et al.19 | 11 | Retrospectivo | − | − | − | − | − |
| Carrillo et al.4 | 7 | Prospectivo | − | + | + | + | + |
| Epstein et al.20 | 131 | Prospectivo | + | + | + | − | − |
| Kong et al.21 | 52 | Retrospectivo | − | + | − | − | + |
| Thabet et al.6 | 13 | Retrospectivo | − | + | + | − | + |
| Oge et al.22 | 23 | Retrospectivo | + | + | + | − | − |
| Zikan et al.23 | 97 | Retrospectivo | + | + | + | + | + |
| Griffin et al.24 | 5 | Retrospectivo | − | − | − | − | − |
| Fischerova et al.25 | 63 | Prospectivo | + | + | + | + | + |
| Schincaglia et al.26 | 17 | Prospectivo | − | − | − | − | − |
| Larsen et al.27 | 63 | Prospectivo | + | + | − | − | + |
| Bret et al.28 | 13 | - | + | − | − | − | − |
PS: performance status.
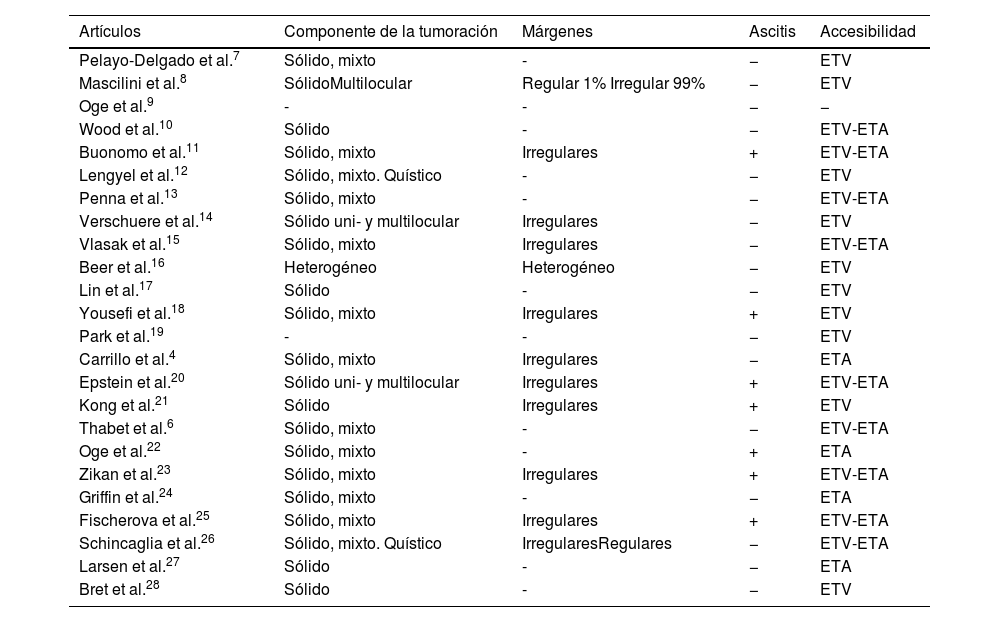
En la tabla 2 se muestran las características ecográficas de las masas ováricas de los estudios incluidos. De forma general, la característica más consistente entre los estudios es la presencia de componente sólido en la masa6,10-19,22-26 o mixto con componente quístico4,6,7,11-13,15,18,22-26. En 12 estudios destaca la presencia de márgenes irregulares o heterogéneos4,8,11,14-16,18,20,21,23,25,26, mientras que en 2 estudios también se incluyeron masas con bordes regulares, aunque de forma minoritaria8,26. De los 24 estudios incluidos, solo 7 presentaban casos con ascitis11,18,20-23,25. La accesibilidad por ecografía transvaginal fue posible en la mayoría de los estudios incluidos6,10-21,23,25,26,28 y en 9, además, lo fue mediante ecografía transabdominal6,10,11,13,15,20,23,25,26. En 4 trabajos, solo se pudo acceder por vía transabdominal4,22,24,27. En concreto, Wood et al10., específicamente evaluaron la distancia de la lesión a la sonda transvaginal con respecto a la TC, con una disminución del 84,9% de la distancia a la lesión (p < 0,0001).
Características ecográficas de las masas ováricas
| Artículos | Componente de la tumoración | Márgenes | Ascitis | Accesibilidad |
|---|---|---|---|---|
| Pelayo-Delgado et al.7 | Sólido, mixto | - | − | ETV |
| Mascilini et al.8 | SólidoMultilocular | Regular 1% Irregular 99% | − | ETV |
| Oge et al.9 | - | - | − | − |
| Wood et al.10 | Sólido | - | − | ETV-ETA |
| Buonomo et al.11 | Sólido, mixto | Irregulares | + | ETV-ETA |
| Lengyel et al.12 | Sólido, mixto. Quístico | - | − | ETV |
| Penna et al.13 | Sólido, mixto | - | − | ETV-ETA |
| Verschuere et al.14 | Sólido uni- y multilocular | Irregulares | − | ETV |
| Vlasak et al.15 | Sólido, mixto | Irregulares | − | ETV-ETA |
| Beer et al.16 | Heterogéneo | Heterogéneo | − | ETV |
| Lin et al.17 | Sólido | - | − | ETV |
| Yousefi et al.18 | Sólido, mixto | Irregulares | + | ETV |
| Park et al.19 | - | - | − | ETV |
| Carrillo et al.4 | Sólido, mixto | Irregulares | − | ETA |
| Epstein et al.20 | Sólido uni- y multilocular | Irregulares | + | ETV-ETA |
| Kong et al.21 | Sólido | Irregulares | + | ETV |
| Thabet et al.6 | Sólido, mixto | - | − | ETV-ETA |
| Oge et al.22 | Sólido, mixto | - | + | ETA |
| Zikan et al.23 | Sólido, mixto | Irregulares | + | ETV-ETA |
| Griffin et al.24 | Sólido, mixto | - | − | ETA |
| Fischerova et al.25 | Sólido, mixto | Irregulares | + | ETV-ETA |
| Schincaglia et al.26 | Sólido, mixto. Quístico | IrregularesRegulares | − | ETV-ETA |
| Larsen et al.27 | Sólido | - | − | ETA |
| Bret et al.28 | Sólido | - | − | ETV |
ETA: ecografía transabdominal; ETV-TA: Ecografía transvaginal y transabdominal; ETV: ecografía transvaginal.
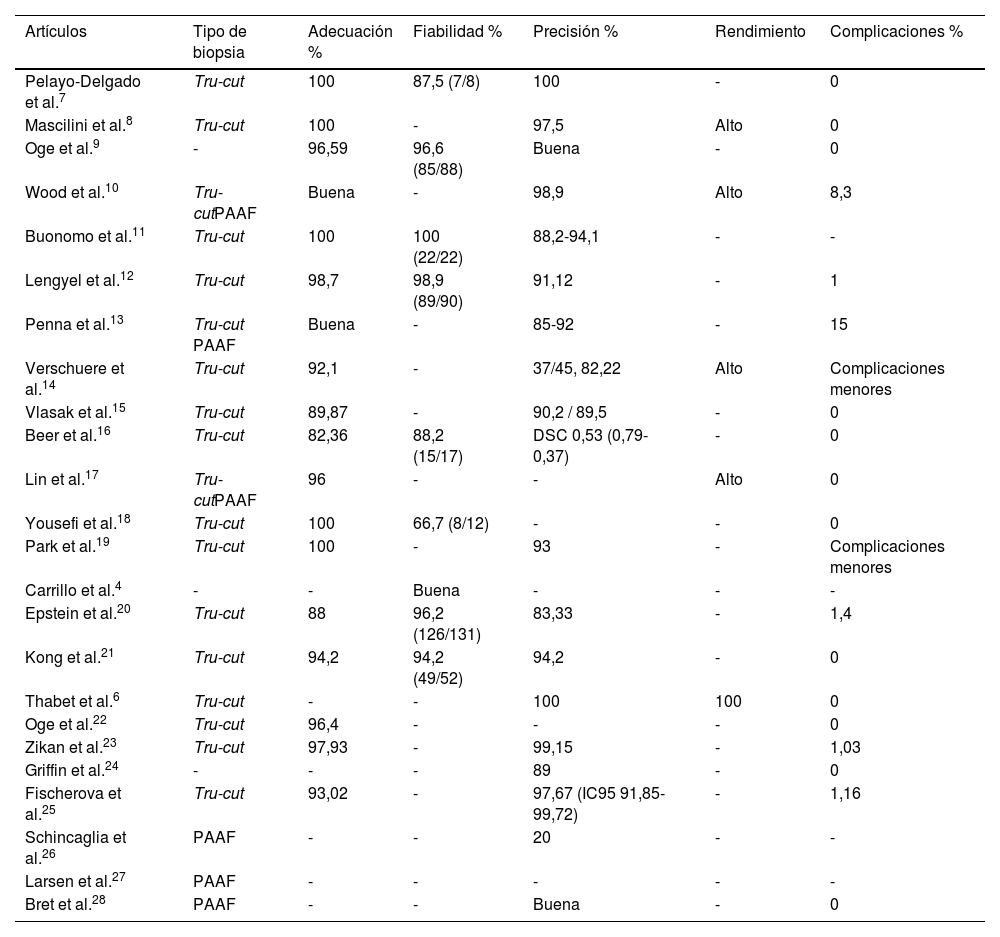
En cuanto a las características de la biopsia dirigida por ecografía, los resultados de los estudios incluidos se encuentran en la tabla 3. En la mayoría de los estudios la biopsia era de tipo tru-cut6,11,12,14-16,18-23,25 y se utilizó una PAAF en 3 estudios26-28, mientras que en otros 3 se utilizaron ambos tipos10,13,17.
Características de la biopsia guiada por ecografía
| Artículos | Tipo de biopsia | Adecuación % | Fiabilidad % | Precisión % | Rendimiento | Complicaciones % |
|---|---|---|---|---|---|---|
| Pelayo-Delgado et al.7 | Tru-cut | 100 | 87,5 (7/8) | 100 | - | 0 |
| Mascilini et al.8 | Tru-cut | 100 | - | 97,5 | Alto | 0 |
| Oge et al.9 | - | 96,59 | 96,6 (85/88) | Buena | - | 0 |
| Wood et al.10 | Tru-cutPAAF | Buena | - | 98,9 | Alto | 8,3 |
| Buonomo et al.11 | Tru-cut | 100 | 100 (22/22) | 88,2-94,1 | - | - |
| Lengyel et al.12 | Tru-cut | 98,7 | 98,9 (89/90) | 91,12 | - | 1 |
| Penna et al.13 | Tru-cut PAAF | Buena | - | 85-92 | - | 15 |
| Verschuere et al.14 | Tru-cut | 92,1 | - | 37/45, 82,22 | Alto | Complicaciones menores |
| Vlasak et al.15 | Tru-cut | 89,87 | - | 90,2 / 89,5 | - | 0 |
| Beer et al.16 | Tru-cut | 82,36 | 88,2 (15/17) | DSC 0,53 (0,79-0,37) | - | 0 |
| Lin et al.17 | Tru-cutPAAF | 96 | - | - | Alto | 0 |
| Yousefi et al.18 | Tru-cut | 100 | 66,7 (8/12) | - | - | 0 |
| Park et al.19 | Tru-cut | 100 | - | 93 | - | Complicaciones menores |
| Carrillo et al.4 | - | - | Buena | - | - | - |
| Epstein et al.20 | Tru-cut | 88 | 96,2 (126/131) | 83,33 | - | 1,4 |
| Kong et al.21 | Tru-cut | 94,2 | 94,2 (49/52) | 94,2 | - | 0 |
| Thabet et al.6 | Tru-cut | - | - | 100 | 100 | 0 |
| Oge et al.22 | Tru-cut | 96,4 | - | - | - | 0 |
| Zikan et al.23 | Tru-cut | 97,93 | - | 99,15 | - | 1,03 |
| Griffin et al.24 | - | - | - | 89 | - | 0 |
| Fischerova et al.25 | Tru-cut | 93,02 | - | 97,67 (IC95 91,85-99,72) | - | 1,16 |
| Schincaglia et al.26 | PAAF | - | - | 20 | - | - |
| Larsen et al.27 | PAAF | - | - | - | - | - |
| Bret et al.28 | PAAF | - | - | Buena | - | 0 |
DSC: coeficiente de similitud de Dice; PAAF: punción-aspiración con aguja fina.
Respecto a la adecuación, es decir, la obtención de una muestra suficiente para un correcto estudio histopatológico e inmunohistoquímico, 19 de los 24 estudios incluidos informaron al respecto7,25. Mientras que 5 estudios reportaron una adecuación del 100%7,8,11,18,19, el resto9,12,14-17,20-23,25 presentaban porcentajes que oscilan entre el 82,3610 y el 98,7%12. En 2 estudios10,13 se informa de una adecuación buena, sin especificar valores cuantitativos. Para ello la gran mayoría de los autores considera que deben tomarse entre una y 3 muestras de la misma paciente para asegurar que se obtiene suficiente material para estudio.
En cuanto a la fiabilidad de la biopsia, solo 8 estudios informan de ella4,7,9,11,12,16,18,20,21. En la mayoría de ellos, los valores eran altos (entre el 88,216 y el 100%11), con la excepción del de Yousefi et al.18, que presentó una fiabilidad del 66,7%.
La precisión de la biopsia con respecto al diagnóstico histológico definitivo de la pieza quirúrgica es mencionada en 19 artículos6,19-21,23-26,28. La mayoría de los estudios reportan unas buenas tasas de precisión diagnóstica, por encima del 90%, y algunas entre el 80 y el 90%. La excepción es el estudio realizado por Schincaglia et al.26, en el que destaca la mala precisión diagnóstica de la biopsia por aspiración de aguja fina, con un 20%. En la misma línea, Penna et al.13 mencionan que la precisión aumenta del 85% al 92% en función de si se realiza una PAAF o una BAG, respectivamente. Por su parte, Vlasak et al.15 desarrollaron un estudio dividido en 2fases, una primera retrospectiva seguida de una prospectiva, con resultados similares en ambas, con unas tasas de precisión del 90,2% y del 89,5%, respectivamente. En cuanto al estudio de Beer et al.16, evaluaron el beneficio de realizar un estudio previo de la radiofrecuencia de las distintas áreas con TC para así obtener los hábitats tumorales (zonas donde la punción va a conllevar una mayor precisión diagnóstica y una mejor adecuación de la muestra), que se refleja mediante un coeficiente de similitud de Dice de 0,53 (IC 95%: 0,37-0,79).
En cuanto al rendimiento, solo queda reflejado en 5 estudios6,8,10,14,17, con un 100% informado por Thabet et al.6 y el resto con un rendimiento alto8,10,14,17.
Por último, en cuanto al perfil de seguridad, la tasa de complicaciones es informada por la mayoría de estudios6,12-25,28, que presentan una tasa del 0% en la mayoría6,15-18,21,22,24,28. El resto de los estudios presentan tasa bajas de complicaciones, en torno al 1%12,20,23,25, las más elevadas de las cuales son las de Wood et al.10 y Penna et al.13, con el 8,3% y el 15%, respectivamente. Por su parte, Verschuere et al.14 y Park et al.19 solo mencionan la presencia de complicaciones menores, como son dolor o sangrado relacionados con el procedimiento sin necesidad de tratamiento. Solo 2 estudios23,25 mencionan la presencia de un hemoperitoneo por biopsiar la superficie del tumor Krukenberg, que es un tumor muy vascularizado, que llevó a una trombocitopenia y requirió una posterior cirugía (laparotomía en ambos casos).
DiscusiónTodos los estudios incluidos en esta revisión sistemática coinciden en las características ecográficas de dichas masas ováricas, malignas y potencialmente malignas, entre las que destacan, sobre todo, las masas anexiales con componente sólido o mixto y márgenes irregulares o heterogéneos, aunque Floriana Mascilini et al.8 y Schincaglia et al.26 también mencionan la posibilidad de hacer la biopsia en masas anexiales con márgenes regulares. Otros artículos11,18,20-23,25 recogen la presencia de ascitis. Por su parte, Griffin et al. no incluyen a la ascitis como característica ecográfica para la indicación de biopsia guiada por ecografía de la masa anexial, pero sí mencionan que la ascitis de gran volumen debe drenarse antes de la biopsia para minimizar el riesgo de hemorragia posterior a la biopsia. No obstante, admiten a su vez que, de acuerdo con otros autores, la presencia de ascitis de bajo volumen podría ser de utilidad en este procedimiento diagnóstico20.
La mayoría de los trabajos presentan altas tasas de adecuación; no obstante, de acuerdo con los resultados en varios de los estudios incluidos6,7,12,13,22,25 la BAG o tru-cut es mejor en el diagnóstico histológico de dichas masas que la PAAF, puesto que la biopsia tru-cut permite obtener más material con la arquitectura tisular conservada y realizar tinciones inmunohistoquímicas, además de obtener perfiles moleculares, lo que da más información acerca del pronóstico y posible tratamiento. Unos resultados fallidos en la adecuación de la muestra también podrían estar relacionados con componentes quístico o necrótico. Algunos investigaron sobre las posibles variables que influían en la adecuación. Penna et al.13 destacaban la profundidad de la masa y la presencia de complicaciones menores, mientras que Lin et al.17 mencionan el tamaño de la lesión y el lugar de la biopsia. Verschuere et al.14 señalan que un mayor número de cilindros obtenidos aumentaban la adecuación. Epstein et al.20 informan de la influencia del nivel de Ca-125, la muerte durante el seguimiento y el antecedente de neoplasia previa, así como la edad, mientras que Zikan et al.23 observan que la edad no afectaba a la adecuación, aunque sí lo hacían los niveles de Ca-125, la sospecha a priori de tumor primario subóptimo operable, el operador, el diagnóstico histólogico (seroso epitelial o carcinomatosis), el sitio de la biopsia, la ascitis y el acceso transvaginal. Varios autores coincidían en que el IMC no afectaba a la adecuación14,20,23, ni tampoco el tipo de masa14,17, la vascularización ni la presencia de ascitis17.
Por otro lado, en aquellos estudios en los que las pacientes fueron intervenidas después de la biopsia guiada por ecografía, se obtuvo la precisión diagnóstica de este procedimiento, la mayoría con una alta tasa de precisión diagnóstica. Fischerova et al.25 fueron uno de los primeros en demostrar la precisión diagnóstica (97,67%), seguidos de otros autores como Zikan et al. (99,15%), Verscheure et al. (82,22%) y Buonomo et al. (94,1%)11,14,23. El estudio de Schincaglia et al.26 es el único que presenta una mala precisión diagnóstica. En dicho estudio se realizó biopsia con aguja de aspiración fina y muchas de las muestras obtenidas de pacientes que luego fueron intervenidas resultaron inadecuadas o incompletas, lo que influyó de forma negativa sobre la precisión diagnóstica.
Por último, es importante la evaluación del perfil de seguridad de este procedimiento diagnóstico debido a las características previamente comentadas de las pacientes tratadas. La mayoría de los artículos coinciden en un alto perfil de seguridad, o lo que es lo mismo, una tasa de complicaciones muy baja6,12-25,28. Las tasas de complicaciones registradas en la literatura son de poca importancia y muy escasas, de ahí la importancia de la desinfección vaginal, que los primeros autores no hacían y resultaba en una mayor tasa de infecciones posteriores. No obstante, es importante tener en cuenta el estado general de las pacientes y la presencia de trombocitopenia, puesto que la complicación más frecuente es la hemorragia vaginal posprocedimiento transvaginal o el hemoperitoneo tras procedimiento transabdominal. Es por esto por lo que, según Vlasak et al.15, se requiere un examen hematológico completo (trombocitos al menos de 80×109 y valor máximo de INR <1,5). Además, aquí también destaca la distinción entre biopsia de aguja central y biopsia de aguja por aspiración ya que, según Lin et al.17, con la aguja central el corte es más grande, por lo que el riesgo de hemorragia es mayor. El riesgo de siembra tumoral es una de las posibles complicaciones que se podría plantear, pero según los autores, dicho riesgo es mínimo, al contrario de lo que ocurre con el lugar del puerto laparoscópico, que presenta incidencias de hasta el 20%.
Nuestra revisión tiene varias fortalezas, entre las que destaca su carácter sistemático, al haber realizado una amplia búsqueda bibliográfica que incluyó aspectos importantes, como la adecuación, precisión y seguridad de la técnica de biopsia guiada por ecografía. A su vez, también tiene ciertas limitaciones: una de las principales es que, entre los estudios seleccionados, hay mayor número de retrospectivos, con los sesgos de selección y de información inherentes que esto conlleva. En los estudios prospectivos la adecuación, precisión y seguridad del procedimiento se comprenden mejor por la ausencia del sesgo de selección de los estudios retrospectivos.
ConclusionesLa biopsia de masas anexiales guiada por ecografía, mediante biopsia con aguja gruesa o tru-cut para obtener un diagnóstico anatomopatológico en pacientes subsidiarias de tratamiento neoadyuvante, es una técnica con altas tasas de adecuación, fiabilidad, precisión y buen perfil de seguridad.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.