Editado por: Meritxell Gracia
Última actualización: Enero 2023
Más datosEl sangrado uterino anómalo se define como cualquier variación del patrón normal de sangrado en aquellas mujeres en edad reproductiva, no gestantes, con repercusión en su calidad de vida. Se han descrito diferentes mecanismos y situaciones clínicas en las que se puede padecer un episodio o varios de sangrado uterino anómalo.
En este artículo realizamos una revisión sobre los mecanismos fisiopatológicos implicados en los episodios de sangrado uterino anómalo que nos permita comprender los posibles tratamientos para esta dolencia.
Abnormal uterine bleeding is defined as any variation in the normal pattern of bleeding in non-pregnant women of reproductive age with an impact on their quality of life. Different mechanisms and clinical situations have been described to explain the origin of abnormal uterine bleeding episodes.
In this article we conduct a review of the pathophysiological mechanisms involved in episodes of abnormal uterine bleeding to understand potential treatments for this pathology.
El sangrado uterino anómalo (SUA) se define como cualquier variación del patrón normal de sangrado en mujeres en edad reproductiva, no gestantes, con repercusión en su calidad de vida1. Por la tanto, la definición del SUA ya incluye un factor determinante para los clínicos, que es la afectación de la calidad de vida de la mujer que lo padece.
Se considera que un patrón menstrual es normal cuando se producen ciclos regulares que acontecen cada 24-38 días, con una duración máxima de 8 días, en una cantidad considerada aceptable (5-80ml/ciclo)2 (tabla 1).
Parámetros que se consideran para la definición del patrón de sangrado menstrual
| Parámetros | |
|---|---|
| Frecuencia | Amenorrea |
| Infrecuente (>38 días) | |
| Normal (24-38 días) | |
| Frecuente (<24 días) | |
| Duración | Prolongado (>8 días) |
| Normal (≤8 días) | |
| Regularidad | Regular (variación<7-9 días entre ciclos) |
| Irregular (>8-10 días) | |
| Volumen | Escaso |
| Normal | |
| Abundante | |
De esta forma, consideramos como SUA todas aquellas alteraciones en la regularidad, en la frecuencia, en la cantidad y en la duración del sangrado3 (tabla 2). También se considera como SUA todo aquel sangrado que ocurre fuera del ciclo menstrual, como un sangrado irregular no menstrual, un sangrado fuera de la edad reproductiva (menstruación precoz o sangrado posmenopáusico), el sangrado uterino agudo o crónico, o el sangrado debido a terapias hormonales. Se estima que su prevalencia oscila entre un 3-30%4, por lo tanto, se trata de un síntoma frecuente que acapara un número no desdeñable de consultas tanto en atención primaria como en servicios de urgencias.
Condiciones clínicas incluidas en el sangrado uterino anómalo
| Alteraciones en la regularidad | Sangrado con periodicidad<24 días o>38 días |
| Alteraciones en la frecuencia | Sangrado menstrual infrecuente (menos de 3 episodios de sangrado en un periodo de referencia de 90 días)Sangrado menstrual frecuente (más de 5 episodios de sangrado en un periodo de referencia de 90 días) |
| Alteraciones en la cantidad | Sangrado menstrual abundante (>80cc)Sangrado menstrual escaso |
| Alteraciones en la duración del sangrado | Sangrado menstrual prolongado (>14 días de sangrado) |
En este artículo hemos realizado una revisión bibliográfica sobre los mecanismos fisiopatológicos implicados en el origen del SUA.
Fisiología de la menstruaciónEl sangrado cíclico se debe al desprendimiento de los dos tercios superiores del endometrio, el estrato funcional superficial, el cual se encuentra bajo la influencia hormonal del eje gonadotropo (participando principalmente estrógenos y progesterona)5. Al inicio del ciclo, durante la fase folicular o proliferativa, el endometrio se regenera a partir de las células del estrato basal gracias a la estimulación hormonal estrogénica. Con la ovulación se inicia la fase secretora o lútea y el endometrio se estabiliza debido al aumento de progesterona producida por el cuerpo lúteo. Cuando este desaparece, debido a la disminución de los niveles hormonales de progesterona, el estrato funcional se desprende. La hemostasia endometrial es la responsable del cese del sangrado e implica agregación plaquetaria, deposición de fibrina y formación de trombos. Además, se postula que existen contracciones miometriales, desencadenadas en respuesta a la producción endometrial de prostaglandinas, que pueden desempeñar un papel en el vaciado de la cavidad uterina y también pueden tener cierto papel hemostático por compresión de la vasculatura endometrial6.
Por lo tanto, se trata de un complejo proceso que engloba acciones endocrinas, paracrinas y hemostáticas, cuyo desorden puede originar una alteración en el patrón de sangrado2.
Distintas investigaciones sobre la etiología del sangrado menstrual abundante (SMA) no han evidenciado diferencias en los niveles de hormonas esteroideas circulantes7, ni en la expresión endometrial de receptores de estrógenos ni de progesterona8, ni diferencias histológicas en el tejido endometrial9 entre mujeres con SMA o con patrón menstrual normal. Sin embargo, sí hay evidencia de la implicación de mediadores locales, en particular prostaglandinas, las cuales están implicadas en el control y la limitación del sangrado menstrual, pudiendo provocar vasoconstricción o vasodilatación y aumentar o disminuir la agregación plaquetaria6. Por lo tanto, se ha visto que modificaciones en la síntesis de prostaglandinas pueden provocar un aumento del sangrado uterino tanto en ciclos ovulatorios como anovulatorios.
En mujeres con SMA se han encontrado niveles aumentados de prostaglandina E (PGE2) y prostaglandina F2α (PGF2α) en comparación con mujeres con ciclos menstruales normales6,10. También se han encontrado trastornos de la hemostasia por elevación de la ratio PGE2/PGF2α y de la ratio prostaciclinas y tromboxanos A2. De hecho, uno de los tratamientos del SMA son los antiinflamatorios no esteroideos, los cuales inhiben la enzima ciclooxigenasa y reducen la biosíntesis de prostaglandinas y tromboxanos a partir del ácido araquidónico. Todo esto prueba que la etiología del SMA puede ser la alteración de los niveles de prostaglandinas, aunque los mecanismos que subyacen a la causa del SMA aún son desconocidos.
Definición de sangrado uterino anómaloCon el objetivo de unificar los términos y mejorar la comunicación entre las distintas sociedades científicas e investigadores, la Federación Internacional de Ginecología y Obstetricia (FIGO) creó en 2007 un sistema de terminología y definiciones conocido como FIGO System 111 para definir el sangrado uterino normal con base en una serie de parámetros establecidos. Asimismo, años más tarde, en 2011, desarrolló la clasificación de causas del SUA o FIGO System 23, donde quedarían recogidas por categorías las distintas etiologías atribuibles al SUA.
En 2007, la FIGO estableció una serie de recomendaciones para lograr estandarizar la terminología en relación con el sangrado uterino. Así, se relegaron términos como menorragia, metrorragia u oligomenorrea por su significado ambiguo y poco específico. Estos fueron reemplazados por conceptos como sangrado menstrual abundante, sangrado intermenstrual y sangrado no programado.
El sangrado menstrual debe quedar caracterizado por los siguientes parámetros: regularidad, frecuencia, duración y volumen. Por ello, un sangrado menstrual se considera normal cuando existen ciclos regulares que acontecen cada 24-38 días, con una duración máxima de 8 días, en una cantidad considerada aceptable.
Nuevos conceptos y definiciones:
- •
Sangrado menstrual abundante: se define como un sangrado menstrual excesivo que interfiere con una normal actividad física, emocional, social y que empeora la calidad de vida de la mujer.
- •
Sangrado intermenstrual: hace referencia a un episodio de sangrado irregular, habitualmente escaso y poco duradero, que ocurre entre menstruaciones espontáneas y predecibles.
- •
Sangrado no programado: ocurre al coexistir con tratamientos hormonales.
Parámetros que definen el sangrado menstrual:
- •
Frecuencia:
- ∘
Amenorrea: ausencia de menstruación.
- ∘
Sangrado menstrual frecuente: cuando ocurre con un intervalo inferior a 24 días.
- ∘
Sangrado menstrual infrecuente: cuando ocurre con un intervalo superior a 38 días.
- •
Sangrado menstrual prolongado: la duración de la menstruación supera los 8 días.
- •
Volumen: La cantidad ha de ser determinada por la mujer en abundante, normal o escasa.
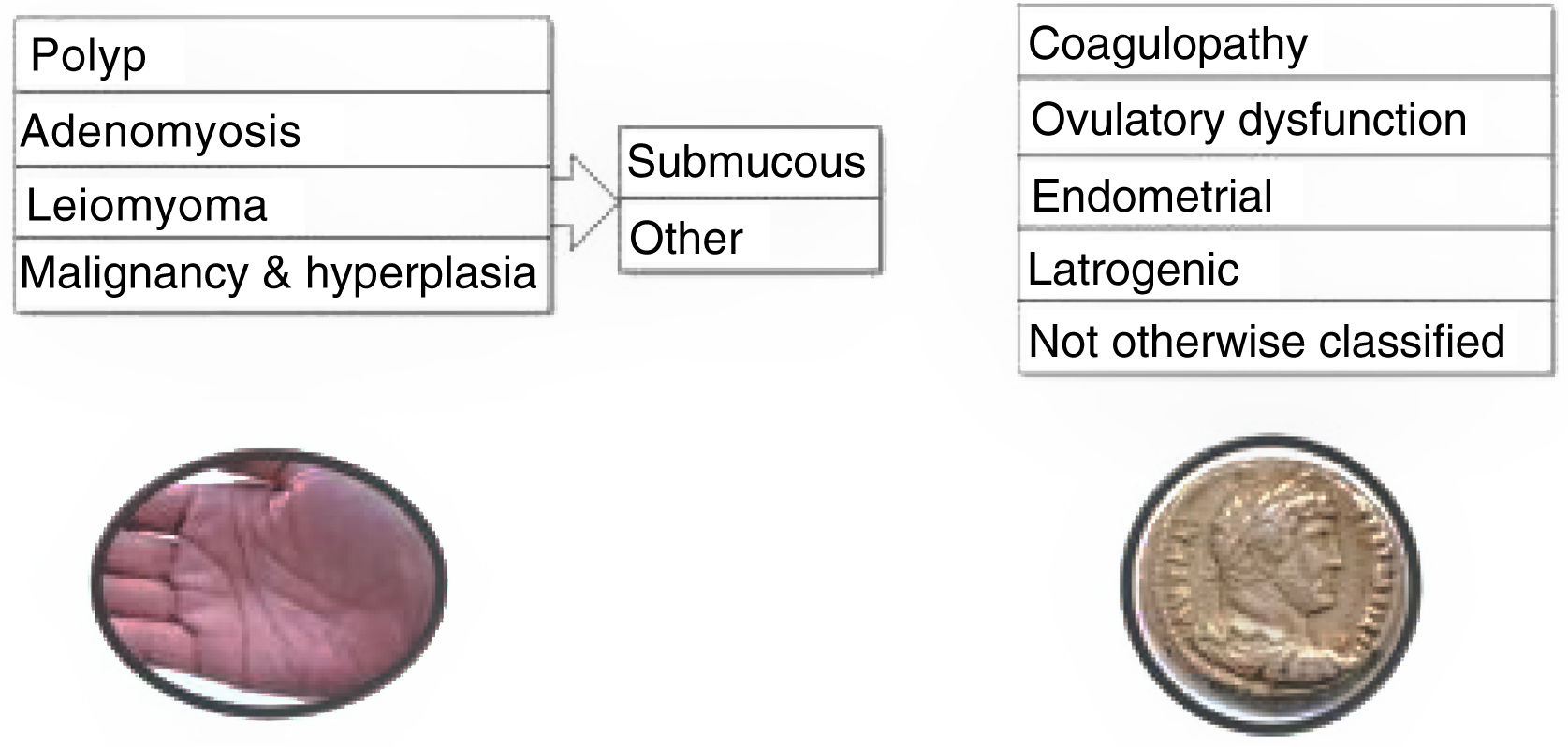
La clasificación de causas de SUA de la FIGO recoge las etiologías más frecuentes en el acrónimo PALM-COEIN12 (pueden tener un origen estructural, como: Pólipos, Adenomiosis, Leiomioma, Malignidad; y no estructural: Coagulopatía, disfunción Ovulatoria, desórdenes Endometriales, Iatrogénico y No clasificado) (fig. 1).
Sistema PALM-COEIN para la clasificación de las causas de SUA. Modificada de FIGO SUA System 2, Munro et al.12.
En primer lugar, se ha de tener en cuenta que las causas de SUA mencionadas hacen referencia a mujeres no gestantes, por lo tanto, es de importancia en el abordaje de esta dolencia realizar el despistaje de gestación mediante un test de embarazo. No se debe olvidar prestar atención a posibles lesiones en vulva, vagina o cérvix como posibles causas de sangrado no uterino. Además, también es importante descartar causas de sangrados de origen no ginecológico, bien urinario, bien digestivo.
A continuación se desarrolla la clasificación PALM-COEIN.
PóliposLos pólipos endometriales se definen como un crecimiento anormal de células del estroma endometrial y constan de componente vascular, glandular y tejido fibromuscular y conectivo. Aunque estas proliferaciones epiteliales muchas veces son asintomáticas, también son causa frecuente de SUA o sangrado intermenstrual13. También existen los pólipos endocervicales, que pueden ser responsables de sangrados anómalos14. El mecanismo exacto por el cual los pólipos se asocian a SUA no está claramente establecido, aunque se cree que se debe a la presencia de una microvasculatura aberrante presente en los pólipos y a un desprendimiento incompleto del endometrio5.
La mayoría de los pólipos son benignos y pueden ser diagnosticados mediante una ecografía transvaginal, histerosonografía o histeroscopia15. Aun así, requieren de estudio histológico, ya que una pequeña minoría podría tener características atípicas o malignas. La incidencia de malignidad en mujeres premenopáusicas es de un 1,7%, y de un 5,4% en posmenopáusicas16. Algunos de los factores de riesgo implicados en su desarrollo son: la edad, el uso de tamoxifeno, el incremento de los niveles estrogénicos, la obesidad o el síndrome de Lynch16.
La clasificación PALM-COEIN no hace referencia al tamaño o el número de pólipos, aunque es importante excluir el endometrio polipoideo, ya que es considerado una variante de la normalidad12.
AdenomiosisSe trata de una dolencia frecuente caracterizada por la presencia de glándulas endometriales en el miometrio17. La prevalencia no ha sido bien establecida, oscilando entre un 5-70% de las mujeres18. Suele aparecer entre la cuarta y la quinta décadas de la vida. En un tercio de las ocasiones es una entidad asintomática, mientras que en otras puede cursar con SUA, dismenorrea o dispareunia. El diagnóstico definitivo es anatomopatológico, sin embargo, existen criterios que nos pueden ayudar a sospecharla mediante técnicas de imagen (ecografía o resonancia magnética nuclear). Algunos de los hallazgos ecográficos que nos pueden orientar a adenomiosis según los criterios MUSA19 son los siguientes: estriaciones ecogénicas, quistes miometriales, grosor miometrial asimétrico, pobre definición de la interfaz miometrio-endometrial, aumento de la vascularización Doppler. La causa de SUA en la adenomiosis es desconocida. Algunos de los mecanismos fisiopatológicos que podemos encontrar como responsables de SUA son una alteración en la contractilidad miometrial, localización superficial de la adenomiosis y número de glándulas endometriales20.
LeiomiomaLos miomas son tumores benignos que se desarrollan a partir del músculo liso uterino durante la edad reproductiva21. Tienen una prevalencia elevada de un 70% en la raza blanca y mayor del 80% en la raza negra22. Algunos de los síntomas más frecuentes son SUA o clínica compresiva como presión pélvica o alteraciones de la frecuencia urinaria, infertilidad o complicaciones obstétricas. El diagnóstico se lleva a cabo mediante examen ginecológico y ecografía transvaginal. En algunos casos puntuales puede ser de utilidad la realización de una histeroscopia o resonancia magnética. Existe evidencia limitada sobre los mecanismos implicados en el SUA asociado a los miomas; aparte de la localización de los mismos, algunas de las razones propuestas son las siguientes: el aumento de la superficie uterina, el aumento de la vascularización y del flujo en los vasos, así como una disminución de la contractilidad uterina23.
La FIGO propuso una clasificación de los miomas basada en su localización y relación con la cavidad endometrial y el miometrio que se utiliza ampliamente12. Dentro de los diferentes tipos de miomas, aquellos que se definen como submucosos son los que más frecuentemente se asocian a SUA. El mecanismo subyacente para el SUA en presencia de miomas submucosos se relaciona con la dilatación anormal de los vasos endometriales24. La distensión venosa endometrial asociada con miomas submucosos se denominó más tarde ectasia vascular endometrial. Los miomas subserosos podrían causar ectasia vascular endometrial y sangrado si comprimen el plexo venoso arcuato25.
Malignidad e hiperplasiaEl carcinoma de endometrio es el más frecuente de los cánceres del aparato genital26. Entre los subtipos histológicos del carcinoma de endometrio, el carcinoma endometrioide es el más frecuente, mientras que otros, como el carcinoma seroso, el carcinoma de células claras o el carcinosarcoma, son raros, menos frecuentes y más agresivos27. Algunos de los factores de riesgo asociados son: hipertensión, diabetes, tamoxifeno, obesidad o el síndrome de Lynch28. El Colegio Americano de Obstetras y Ginecólogos recomienda la toma de una muestra endometrial en mujeres mayores de 45 años con SUA o menores si presentan factores de riesgo29. El origen de la transformación maligna a nivel endometrial se debe a una alteración en el balance de los niveles hormonales entre estrógenos y progesterona; mientras los estrógenos estimulan la proliferación endometrial, la progesterona la contrarresta y estimula la apoptosis. Por lo tanto, los mecanismos por los que tiene lugar el SUA pueden ser por la falta de balance hormonal fisiológico, asociado a un incremento de la vasculatura en un endometrio hiperestimulado de mayor grosor al habitual por el estímulo estrogénico no contrarrestado30.
CoagulopatíaLa presencia de un trastorno de la coagulación debe ser sospechado cuando existe un sangrado anómalo desde la menarquia o cuando asocia sangrados en otras localizaciones (epistaxis, sangrado de encías, etc.), ante hemorragias posparto o historia familiar de trastornos hemostáticos31. La forma más frecuente, que afecta al 5-20% de las mujeres con sangrado menstrual abundante, es la enfermedad de Von Willebrand32. Otras enfermedades de la médula ósea, como leucemias o anemias aplásicas, tienen una baja prevalencia. También hay una parte de los trastornos relacionados con deficiencias de factores de la coagulación. Es importante identificar aquellos sangrados clasificados como coagulopatías y hacer una derivación pertinente al servicio de Hematología. El cese del sangrado viene determinado por la interrelación de diferentes factores o sistemas hemostáticos, como son la agregación plaquetaria y la formación de coágulos. El daño de las células endoteliales provoca la secreción del factor de Von Willebrand que inicia ambos procesos. Posteriormente, ocurrirá la fibrinólisis del coágulo y sellado del extremo del vaso abierto, mediado por activadores del plasminógeno. La conversión del plasminógeno a plasmina inicia la fibrinólisis del coágulo, proceso que puede ser interrumpido por factores inhibidores (PAI-1). Es necesario un equilibrio entre la activación y la inhibición del sistema fibrinolítico. Un aumento de los factores activadores del plasminógeno puede conllevar una disolución temprana del coágulo y, con ello, un SUA33.
Disfunción ovulatoriaConsiste en una alteración del patrón regular de ovulación que conlleva en muchas ocasiones sangrados irregulares, aunque también puede derivar en amenorrea. Cualquier alteración en la secuencia del eje hormonal puede derivar en SUA. Esta situación es frecuente en los primeros años tras la menarquia y los años que engloban la perimenopausia34. También está relacionada con el síndrome de ovario poliquístico, alteraciones de las hormonas tiroideas, hiperprolactinemia, obesidad, delgadez extrema, etc.35. Es importante identificar posibles causas tratables de disfunción ovárica.
Alteraciones endometrialesEl SUA se origina por un problema de hemostasia a nivel endometrial. Las mujeres tienen menstruaciones regulares, pero en cantidad abundante. Su etiología no está completamente establecida, se cree que se debe a una deficiencia de factores vasoconstrictores (endotelina-1 y PGF2a) y un exceso en la producción de plasminógeno36. Otras teorías describen cómo a nivel endometrial tiene lugar un proceso de angiogénesis, en la capa basal y el estrato funcional, mediado posiblemente por VEGF37. Una formación de vasos anormales, es decir, frágiles, puede ser la causante de un SUA.
IatrogénicoEn este grupo se engloban aquellos SUA asociados a la toma de tratamiento hormonal en cualquiera de sus formas de administración (vía oral, anillo vaginal, transdérmica, implante, dispositivos intrauterinos, etc.). También existen otros fármacos que pueden interferir en el patrón/cantidad de sangrado, como: anticoagulantes, antidepresivos, etc.
El mecanismo implicado en el sangrado anormal en usuarias de métodos anticonceptivos hormonales está relacionado con la atrofia y decidualización endometrial típica de este tipo de tratamientos38.
No clasificadoEste apartado recoge un grupo de anormalidades uterinas poco frecuentes. Así, quedan incluidas en esta categoría las malformaciones arteriovenosas, la endometritis crónica, la hipertrofia miometrial y el itsmocele secundario a una cicatriz tras cesárea, entidades todas ellas que pueden originar un SUA.
Sangrado posmenopáusicoSe define como el sangrado que ocurre más allá de un año de la última menstruación. Es un síntoma importante por el que se debe empezar estudio con el objetivo de descartar enfermedad maligna.
Sangrado uterino agudo vs. crónicoEl sangrado uterino agudo hace referencia al episodio de sangrado en una mujer en edad reproductiva, no gestante, que es de suficiente entidad para requerir una intervención que evite una mayor pérdida sanguínea. Por crónico se entiende aquel sangrado uterino anormal en duración, volumen y/o frecuencia que tiene lugar en los últimos 6 meses.
ConclusiónEl SUA es un motivo de consulta frecuente con múltiples etiologías que afecta a la calidad de vida de las mujeres. Para un correcto abordaje del SUA es necesaria una terminología estandarizada que permita recoger de forma adecuada el patrón de sangrado. El acrónimo PALM-COEIN permite agrupar la mayoría de las etiologías existentes para un diagnóstico más exacto y con la menor variabilidad interpersonal posible. Asimismo, son necesarios más estudios sobre la fisiopatología del SUA que permitan establecer mejor su causa para poder ofrecer tratamientos más eficaces. Hoy en día, el conocimiento acerca del SUA continúa siendo limitado, ya que muchos de los mecanismos que participan en su fisiopatología permanecen aún por descubrir. Por ello, es necesario promover la investigación en este ámbito para poder ofrecer alternativas terapéuticas más específicas y eficaces.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLos autores declaran no tener financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado con este artículo.