Editado por: Meritxell Gracia
Última actualización: Enero 2023
Más datosEl sangrado uterino anormal (SUA) se define como cualquier variación del ciclo menstrual, incluyendo cambios en la regularidad, frecuencia, duración o volumen del sangrado menstrual. El sangrado menstrual abundante (SMA) es el tipo más frecuente de SUA y se define como una pérdida excesiva de sangre menstrual que interfiere con una normal actividad física, emocional o social, o bien, empeora la calidad de vida de la mujer. El SMA puede llegar a afectar al 8-27% de las mujeres en edad reproductiva, siendo uno de los motivos de consulta ginecológica más frecuentes, y un problema que tiene un gran impacto en la calidad de vida de la mujer y comporta un gasto de recursos significativo para el sistema sanitario.
El tratamiento del SMA tiene como objetivo disminuir la cantidad del sangrado menstrual, corregir la anemia, prevenir su recurrencia y mejorar la calidad de vida. Entre los diferentes tratamientos disponibles que han demostrado algún tipo de eficacia en el control del SMA destacan el tratamiento médico no hormonal (AINE, antifibrinolíticos), el tratamiento hormonal (DIU-LNG, anticonceptivos hormonales combinados, gestágenos) y el tratamiento quirúrgico. Cualquiera de estos tratamientos debe combinarse con ferroterapia en caso de presentar anemia o ferropenia asociada.
El objetivo del presente artículo es realizar una revisión de los diferentes tratamientos hormonales disponibles para el manejo del SMA.
Abnormal uterine bleeding (AUB) is defined as any variation in the menstrual cycle, including changes in the regularity, frequency, duration, or volume of menstrual bleeding. Heavy menstrual bleeding (HMB) is the most common type of AUB and is defined as excessive menstrual blood loss that interferes with normal physical, emotional, and social activity and impairs a woman's quality of life. HMB can affect up to 8–27% of women of reproductive age, and is one of the most frequent reasons for gynaecological consultations and a problem that has a great impact on women's quality of life, involving significant resource expenditure for the health system. Treatment of HMB aims to reduce the amount of menstrual bleeding, correct anaemia, prevent recurrence, and improve quality of life. Among the different treatments available that have shown some efficacy in the control of HMB are non-hormonal medical treatment (NSAIDs, antifibrinolytics), hormonal treatment (LNG-IUDs, combined hormonal contraceptives, gestagens), and surgical treatment. Any of these treatments should be combined with ferrotherapy in case of anaemia or associated iron deficiency. The aim of this article is to review the different hormonal treatments available for the management of HMB.
El sangrado menstrual abundante (SMA) se define como una pérdida excesiva de sangre menstrual que interfiere con una normal actividad física, emocional o social, o bien, empeora la calidad de vida de la mujer1. El SMA puede llegar a afectar al 8-27% de las mujeres en edad reproductiva, siendo uno de los motivos de consulta ginecológica más frecuentes, y un problema que tiene un gran impacto en la calidad de vida de la mujer, tanto a nivel social cómo económico, ya que es una causa frecuente de absentismo laboral y escolar, y comporta un gasto de recursos significativo para el sistema sanitario1–4.
La Federación Internacional de Ginecología y Obstetricia (FIGO) propuso en el año 2011 una terminología estandarizada para unificar y simplificar los términos que hacen referencia al sangrado uterino, y eliminar algunos términos como menorragia, metrorragia o sangrado uterino disfuncional. Los estudios de Hallberg et al. permitieron establecer el patrón de normalidad del sangrado menstrual considerando normal una frecuencia del ciclo de 24-38 días, un volumen de 5-90ml, ciclos regulares con una variación de ±2-20 días y una duración del sangrado de 4,5-8 días5. El sangrado uterino anormal (SUA) se define como cualquier variación del ciclo menstrual, incluyendo cambios en la regularidad, frecuencia, duración o volumen del sangrado menstrual6. El SMA es el tipo más frecuente de SUA según la OMS7.
Respecto a las causas que pueden originar un SUA, la FIGO aprobó un sistema de clasificación basado en el acrónimo PALM-COEIN que engloba todas las causas en 2 categorías, la enfermedad orgánica y la no orgánica8. La SEGO adaptó el acrónimo al castellano como PALMA-ÍNDICE (pólipo, adenomiosis, leiomioma, malignidad-inespecífica, disovulación, iatrogenia, coagulopatía, endometrial)9.
Es importante tener en consideración que para iniciar un estudio del SMA y valorar un determinado tratamiento es suficiente con que la mujer informe sobre un aumento de la cantidad del sangrado menstrual. Su diagnóstico se fundamenta en una correcta historia clínica, exploración física, analítica sanguínea, ecografía transvaginal y, en algunos casos, la realización de una biopsia endometrial e histeroscopia.
El tratamiento del SMA tiene como objetivo disminuir la cantidad del sangrado menstrual, corregir la anemia, prevenir su recurrencia y mejorar la calidad de vida. Algunos factores a tener en cuenta para decidir el tratamiento más adecuado son: deseo gestacional o anticonceptivo, etiología orgánica o no orgánica, enfermedad de base de la paciente, sintomatología asociada (acné, hirsutismo, dismenorrea…), intensidad y tiempo de evolución, entre otros factores10. Entre los diferentes tratamientos disponibles que han demostrado algún tipo de eficacia en el control del SMA destacan el tratamiento médico no hormonal (antiinflamatorios no esteroideos [AINE], antifibrinolíticos), el tratamiento hormonal (DIU-LNG, anticonceptivos hormonales combinados, gestágenos) y el tratamiento quirúrgico. Cualquiera de estos tratamientos debe combinarse con ferroterapia en caso de presentar anemia o ferropenia asociada10.
Es esencial que la paciente sea adecuadamente informada de las diferentes opciones, ventajas y posibles efectos adversos a la hora de elegir un determinado tratamiento. Debe ser una decisión libre consensuada entre el médico y la paciente. El objetivo del presente artículo es realizar una revisión de los diferentes tratamientos hormonales disponibles para el manejo del SMA
Anticoncepción hormonal combinadaLos anticonceptivos hormonales combinados, que contienen estrógeno y gestágeno, pueden administrarse por vía oral, vaginal o transdérmica.
El componente estrogénico regula la secreción de la hormona estimulante del folículo (FSH) y el consiguiente desarrollo del folículo dominante. Así mismo, también proporciona estabilidad y crecimiento endometrial y modula el impacto del gestágeno. El componente gestagénico impide el incremento de la hormona luteinizante (LH) y la ovulación, y condiciona un efecto antiproliferativo endometrial reduciendo la pérdida hemática durante el periodo de sangrado por deprivación11.
La pauta cuatrifásica de valerato de estradiol y dienogest (VE2/DNG) es el único preparado combinado que tiene indicación para el tratamiento del SMA según ficha técnica12. La eficacia de VE2/DNG en el manejo del SMA se basa en 2 ensayos clínicos fase 3, aleatorizados con placebo, realizados en Norteamérica13, y en Europa y Australia14. Ambos estudios tuvieron un diseño similar, incluyendo a unas 200 mujeres cada uno, evidenciando que la proporción de «respondedoras completas», mujeres con menstruaciones consideradas como normales y con ausencia de otros síntomas, fue significativamente superior en el grupo de VE2/DNG en comparación con las que recibieron placebo. Así mismo, la reducción media en la pérdida de sangre menstrual con VE2 y DNG tras 28 semanas de tratamiento respecto a la basal fue del 64,213 y del 69,4%14. Igualmente, se observaron mejorías significativas en los niveles sanguíneos de hemoglobina, el hematocrito y la ferritina con VE2/DNG, pero no con placebo.
Existe evidencia científica limitada sobre la eficacia del resto de preparados combinados en el tratamiento del sangrado menstrual abundante. En varios estudios se ha observado que los anticonceptivos hormonales combinados disminuyen la cantidad de sangrado menstrual entre un 35 y un 79% en función del preparado a los 12 meses del inicio del tratamiento15,16.
Las pautas continuas de preparados combinados o con periodos cortos libres de hormona de 4 o menos días, se asocian con una mayor supresión del eje hipotálamo-hipofisaria-gonadal en comparación con su uso clásico, con 7 días libres de hormona17. El uso continuo de anticonceptivos hormonales combinados por vía oral sin el intervalo libre de hormonas induce amenorrea en 80-100% de las mujeres a 10-12 meses de tratamiento18. Por tanto, las pautas continuas podrían ser superior a las clásicas en cuanto a la reducción del sangrado menstrual en pacientes con SMA.
La Sociedad Española de Ginecología y Obstetricia (SEGO) recomienda el VE2/DNG como primera línea de tratamiento médico cuando se decide iniciar un tratamiento combinado9, considerando el tratamiento con el resto de preparados combinados como tratamientos de segunda línea10.
Métodos de solo gestágenoLos anticonceptivos hormonales de solo gestágeno pueden administrarse por vía oral, subdérmica, intramuscular o intrauterina.
El dispositivo intrauterino de levonorgestrel de 52mg (DIU-LNG 52mg) es el único método de solo gestágeno con indicación en ficha técnica en el tratamiento del SMA durante 5 años tras su inserción19,20. Andersson et al. objetivaron una reducción significativa del volumen de sangrado menstrual abundante del 86, del 91 y del 97% a los 3, 6 y 12 meses de la inserción del DIU-LNG 52mg21. Así mismo, Kaunitz et al. observaron un incremento de los niveles sanguíneos de hemoglobina y ferritina a los 6 y 12 meses de uso del DIU-LNG 52mg22.
Existen pocos estudios comparativos del DIU-LNG 52mg valorando su eficacia en el tratamiento del SMA23. Kilic et al. compararon el DIU-LNG 52mg con placebo en mujeres diagnosticadas de SMA en tratamiento anticoagulante por antecedente de cirugía valvular cardíaca y observaron una reducción de las puntuaciones del pictograma menstrual (PBAC) y valores más altos de hemoglobina, hematocrito y ferritina en el grupo del DIU, significativamente superior respecto al grupo control en el tercer mes de tratamiento24. Por su parte, Ashraf et al. compararon el DIU-LNG 52mg con noretisterona, resultando el DIU más eficaz para reducir la pérdida de sangre menstrual en el 94,7% de las pacientes, en comparación con el 73,7% de las pacientes tratadas con noretisterona después de 6 meses de tratamiento25. En otro ensayo clínico, Kaunitz et al. compararon el DIU-LNG 52mg con acetato de medroxiprogesterona (10mg diarios/durante 10 días a partir del día 16 de cada ciclo) durante 6 ciclos. Al final del estudio, la reducción de la pérdida de sangre menstrual fue significativamente mayor en el grupo del DIU en comparación con acetato de medroxiprogesterona, y la proporción de mujeres con tratamiento exitoso fue significativamente mayor para el DIU (84,8%) que para el acetato de medroxiprogesterona (22,2%)26. Endrikat et al., Sayed et al. y Shabaan et al. compararon el DIU-LNG 52mg con un anticonceptivo hormonal combinado oral. En los 3 estudios, las usuarias del DIU reportaron una reducción de la cantidad de sangrado menstrual de entre el 83 y el 90,9%, significativamente superior a las reportadas entre las usuarias de la píldora combinada tras 12 meses de tratamiento (13,4-68%).
Respecto al resto de métodos de solo gestágeno, la evidencia científica de su uso en mujeres con SMA es limitada. Respecto al uso de progesterona natural micronizada en pauta continua o de forma cíclica durante la segunda fase de ciclo, su efectividad es limitada, reduciendo la cantidad del sangrado menstrual entre un 50 y un 30%, respectivamente10.
Antes de iniciar un anticonceptivo hormonal combinado, un método de solo gestágeno u otro tipo de terapia hormonal deberíamos valorar su idoneidad de uso. Los criterios médicos de elegibilidad de la OMS o los de otras sociedades científicas son guías ampliamente utilizadas. No obstante, debemos tener en consideración que el balance riesgo-beneficio puede ser diferente al usar un fármaco no solo con fines anticonceptivos sino como tratamiento de una determinada enfermedad. Formará parte del criterio clínico valorar el riesgo-beneficio de forma individual27.
La SEGO recomienda el uso del DIU-LNG 52mg como primera línea de tratamiento cuando se decide iniciar un tratamiento con solo gestágeno10. Otras guías y sociedades internacionales, como la National Institute for health and Care Excellence (NICE) y la American College of Obstetricians and Gynecologists (ACOG) recomiendan el uso del DIU-LNG 52mg como la opción de elección en el tratamiento del SMA entre todas las disponibles al ser la más coste-efectiva28. En la misma línea, Calaf et al. compararon la efectividad y los costes asociados a los tratamientos médicos más usados en el manejo del SMA crónico en España y concluyeron que el DIU-LNG 52mg es el tratamiento más coste-efectivo para el control del SMA en España29.
Estrógenos solosEl uso de estrógenos solos en el tratamiento del SUA crónico no está indicado, debido a su efecto directo sobre el endometrio induciendo su crecimiento desordenado e incrementando el riesgo de cáncer de endometrio.
En el SUA agudo sin enfermedad uterina asociada, el uso de estrógeno solo parenteral, de un régimen de anticonceptivos orales combinados multidosis o de un régimen multidosis de gestágeno solo son opciones viables. No obstante, la evidencia científica que respalda su uso es más bien limitada en algunos casos30.
Los estrógenos equinos conjugados intravenosos fueron aprobados por la FDA en noviembre 2009 para el tratamiento de SUA agudo. Las dosis altas de estrógeno tratan rápidamente el SUA agudo al causar crecimiento rápido del epitelio y estroma endometriales; al estimular el vasoespasmo de las arterias uterinas; al promover la agregación plaquetaria y la coagulación a nivel capilar aumentando los niveles de fibrinógeno, factor V y factor XI; y al aumentar la producción de receptores de estrógeno y progesterona a nivel local30.
Moduladores selectivos del receptor de progesteronaLa elevada concentración de receptores de estrógenos y progesterona en las células de miomas uterinos es crucial para la patogénesis de la miomatosis uterina31,32. La evidencia creciente del papel predominante de los receptores de progesterona en el crecimiento celular y de matriz extracelular sentó la base para el uso de moduladores selectivos del receptor de progesterona (Selective progesterone receptor modulators [SPRMs]) para el tratamiento de la sintomatología de los miomas uterinos, especialmente el SMA-M32–35. Los SPRM ejercen una triple acción: una acción directa sobre las células de miomas, inhibiendo la proliferación celular e induciendo apoptosis celular, una acción a nivel endometrial, disminuyendo el sangrado menstrual y una acción a nivel de la glándula pituitaria, induciendo amenorrea al mismo tiempo que se mantienen los niveles de estrógenos equivalentes a los de la fase folicular media36. Diversos SPRM han sido evaluados para el manejo de los miomas uterinos, entre ellos mifepristona, asprisnil, telapristona, vilaprisan o acetato de ulipristal (AUP). Todos ellos han demostrado una reducción del volumen uterino y del SMA-M de forma dosis-dependiente37.
En estudios comparativos con placebo, AUP en dosis de 5mg o 10mg/cada 24h demostró ser efectivo para el control de SMA debido a miomas uterinos en un 91 y 92%, respectivamente comparado con 19% de las pacientes que recibieron placebo38. Asimismo, en estudios comparativos con acetato de leuprolida (3,75mg inyección mensual), AUP 5mg demostró tasas equivalentes de control de sangrado (89 vs. 90%), pero esta reducción de sangrado se consiguió de forma más rápida y con menor tasa de efectos secundarios en aquellas pacientes que recibieron AUP39. Estudios a largo plazo con ciclos repetidos de 12 semanas de tratamiento diario con AUP demostraron que el control del sangrado asociado a miomas uterinos mejoraba ciclo tras ciclo de tratamiento y que los efectos persisten una vez suspendido el tratamiento40,41.
AUP también se ha utilizado con éxito para el tratamiento del SMA asociado a adenomiosis (con o sin miomas coexistentes) o del SMA de causa no orgánica42–44.
A pesar de que más de 900.000 mujeres a nivel mundial recibieren tratamiento con AUP con buena respuesta y seguridad, durante los años 2018 y 2019 se notificaron 6 casos de daño hepático severo inducido por fármacos que requirieron trasplante hepático en mujeres que estaban en tratamiento con este fármaco45. La Agencia Europea del medicamento (EMA) y su comité de farmacovigilancia Pharmacological assesment review comitee (PRAC) suspendieron temporalmente la comercialización e iniciaron diversos estudios de seguridad. La recomendación final de esta evaluación de la EMA restringe el uso de acetato de ulipristal tan solo a aquellas pacientes premenopáusicas en las que el tratamiento quirúrgico o la embolización de arterias uterinas están contraindicados o hayan fallado. Por lo tanto, en la actualidad, AUP presenta una gran limitación en su uso por motivos de seguridad, evidenciando la necesidad de una alternativa terapéutica segura para el tratamiento del SMA-L a largo plazo46.
Agonistas y antagonistas del receptor de GnRHEl bloqueo de los receptores de GnRH en la glándula pituitaria permite un control del SMA, principalmente cuando es causado por miomas (SMA-L) o adenomiosis (SMA-A). Este bloqueo genera una inhibición de la síntesis y liberación de gonadotropinas, consiguiendo una disminución de niveles sanguíneos de LH, FSH y, secundariamente, de esteroides ováricos47. Este estado hipoestrogénico genera una atrofia endometrial que permite una disminución del sangrado menstrual, pero también conlleva la aparición de efectos adversos cómo sintomatología vasomotora, sequedad vaginal, incremento del riesgo cardiovascular, cefaleas, mareos, pérdida de masa ósea o disminución de la calidad de vida30,48. Tales efectos secundarios limitan el uso de estos tratamientos más allá de 6 meses. La adición de la llamada terapia add-back (TAB) con tibolona o estroprogestágenos a bajas dosis permiten mantener niveles circulantes de estrógenos entre 20 y 50pg/ml49. Estos niveles parecen suficientes para mantener los efectos beneficiosos del bloqueo de los receptores y disminuye la sintomatología hipoestrogénica, evitando la pérdida de masa ósea y permitiendo terapias prolongadas (>6 meses)48,50,51.
Los agonistas de la GnRH (aGnRH) són análogos sintéticos de la GnRH que producen un bloqueo reversible de los receptores de GnRH. Existen diversos preparados en el mercado con diferentes vías de administración (tabla 1), aunque las pautas preferidas para el control de SMA son aquellas presentaciones depot que permiten una liberación gradual e ininterrumpida del fármaco durante 4 a 12 semanas47. Los aGnRH han demostrado su efectividad en el control de la sintomatología de los miomas uterinos consiguiendo tasas de amenorrea cercanas al 90% de las pacientes, reducciones entre 35-65% del volumen de los miomas y elevadas tasas de recuperación de la anemia52–54. Estos efectos beneficiosos se pueden observar ya en las primeras semanas y son máximos a los 3-6 meses de tratamiento continuo53. A pesar de estos buenos resultados, este efecto es temporal y una vez suspendido el tratamiento, la sintomatología reaparecerá en los primeros 3 meses postratamiento55. Asimismo, debe tenerse en cuenta que el estímulo inicial de los receptores de GnRH producirá un pico inicial de LH y esteroides ováricos que puede traducirse en un episodio de sangrado uterino alrededor de los 10 días después del inicio del tratamiento (efecto flare-up)37,47. Existen pocos estudios y de baja calidad sobre el efecto de aGNRH en el SMA producido por adenomiosis56,57, por lo que su tratamiento se reserva como segunda línea en esta enfermedad58.
Agonistas de la GnRH y vías de administración
| Preparado | Vía de administración | Posología |
|---|---|---|
| Buserelina | Subcutánea | 300μg/3 veces al día |
| Pulverización nasal | 300μg/3 veces al día | |
| Implante subcutáneo (depot) | 6,3mg (bimestral)/9,45mg (trimestral) | |
| Goserelina | Implante subcutáneo (depot) | 3,6mg (mensual)/10,8mg (trimestral) |
| Nafarelina | Pulverización nasal | 200μg/2 veces al día |
| Leuprorelina | Implante subcutáneo | 3,75mg (mensual)/11,25mg (trimestral) |
| Intramuscular (depot) | 3,75mg (mensual)/11,25mg (trimestral) | |
| Triptorelina | Intramuscular (depot) | 3,75mg (mensual)/11,25mg (trimestral)/22,5mg (semestral) |
El mecanismo de acción de los antagonistas orales de la GnRH (antGnRH) se basa en el bloqueo reversible de los recGnRH sin estimulación inicial. Esta acción se traduce en una inhibición rápida y dosis-dependiente de los niveles circulantes de estrógenos, sin la aparición del efecto flare-up inicial de los aGnRH. La principal limitación de estos fármacos en sus primeros años era la ausencia de presentaciones de liberación prolongada (cetrorelix, ganirelix), que obligaban a realizar pautas con diversas administraciones diarias por vía subcutánea59–61. El reciente desarrollo de antGnRH no peptídicos (elagolix, relugolix, linzagolix) nos ofrece la posibilidad de administrar estos fármacos por vía oral en diferentes pautas según su vida media plasmática (tabla 2)62–64. La vía de administración oral ofrece una mayor facilidad de uso respecto a las presentaciones depot o subcutáneas, al mismo tiempo que posibilita una rápida reversibilidad de los efectos y retorno a ciclos espontáneos una vez suspendido el tratamiento65.
Recientes estudios han demostrado la efectividad de estos preparados en el control del SMA-L. En estudios fase 2, elagolix (600mg/cada 24h) con o sin TAB demostró superioridad frente a placebo en reducción de sangrado menstrual, recuperación de niveles de Hb, reducción del volumen uterino y mejora de la calidad de vida en mujeres con SMA-L66. Relugolix (40mg/cada 24h) también ha demostrado una eficacia no inferior al tratamiento con leuprorelina mensual en la mejora del SMA-L, ofreciendo una mayor rapidez en la consecución de dicho control67. En la misma línea, linzagolix (200mg/cada 24h) también ha demostrado efectividad en el control del SMA, consiguiendo tasas de amenorrea cercanas al 80%68. La principal limitación de estos preparados, al igual que con los aGnRH, son los derivados del hipoestrogenismo secundario que obliga a la administración concomitante de TAB para aquellos tratamientos a largo plazo. Debido a este hecho, los estudios fase 3 realizados con estos 3 fármacos se han realizado asociando TAB de baja dosis hormonal (etinilestradiol 1mg + acetato de noretisterona 0,5mg/cada 24h), demostrando excelentes resultados en el control del SMA-L a largo plazo (hasta un año de tratamiento consecutivo)69–72. Por lo que respecta al perfil de seguridad de los antGnRH, la adición de TAB ofrece una reducción considerable de los efectos secundarios, al mismo tiempo que mantiene la pérdida de masa ósea a un nivel equivalente a placebo aún en tratamientos a largo plazo. Los efectos secundarios más frecuentemente asociados son: cefalea, náuseas y sofocaciones. No se han reportado elevaciones significativas de enzimas hepáticos o alteraciones endometriales con ningún antGnRH70,72,73.
Series de casos aisladas han evaluado la efectividad de linzagolix (200mg/cada 24h/durante 12 semanas y 100mg/cada 24h/durante 12 semanas) en el tratamiento del SMA-A, demostrando reducciones significativas del volumen uterino y de los síntomas asociados a adenomiosis65,74,75. Elagolix y relugolix también han demostrado su eficacia en el manejo del SMA en aquellas pacientes con miomas uterinos y adenomiosis coexistentes76,77.
ConclusionesLas opciones médicas que nos permiten reducir la cantidad del sangrado menstrual son diversas. Es recomendable hablar con la mujer sobre sus necesidades y preferencias para decidir correctamente el tratamiento del SMA. Esto incluye diferentes circunstancias entre las que destacan el deseo genésico, las causas del SMA y los síntomas asociados. Debemos garantizar a la mujer la estrategia de manejo más adecuada.
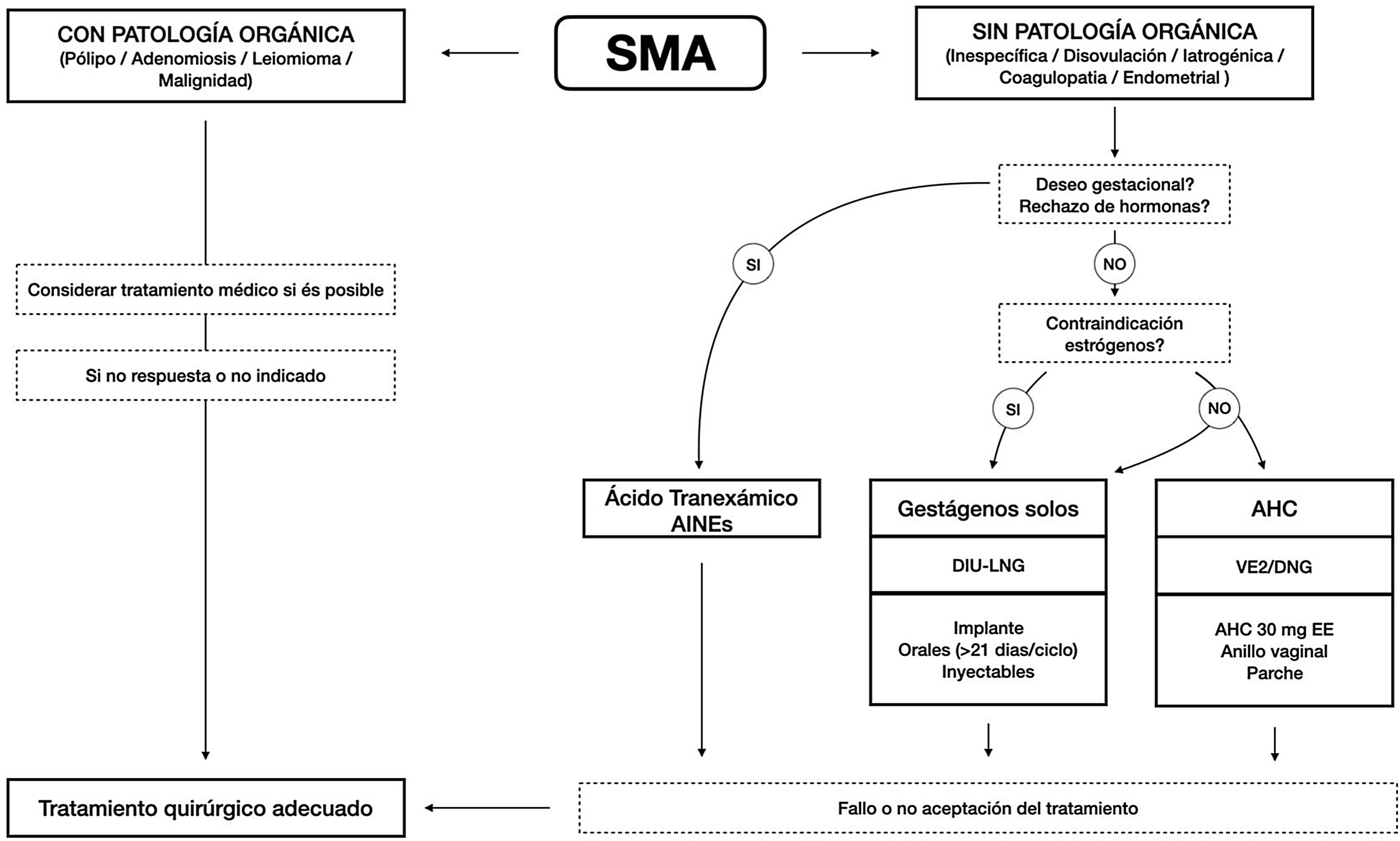
Los anticonceptivos hormonales han demostrado, con diferente evidencia científica, ser eficaces en el manejo del SMA. La pauta cuatrifásica oral de VE2/DNG y el DIU-LNG 52mg son considerados por la SEGO como las opciones de primera línea, siendo considerados el resto de los anticonceptivos hormonales como tratamientos de segunda línea. El DIU-LNG 52mg es el tratamiento más coste-efectivo en el control del SMA. Por este motivo, el DIU-LNG 52mg es considerado como la mejor opción de tratamiento por la mayoría de las guías internacionales como la NICE y la ACOG (fig. 1).
Algoritmo de manejo del SMA.
Fuente: Adaptado de Sociedad Española de Ginecología y Obstetricia10.
El AUP se ha utilizado con éxito para tratar el SMA asociado a miomas, a adenomiosis y de causa no orgánica, pero actualmente su uso está limitado por motivos de seguridad por la EMA a pacientes premenopáusicas que presenten contraindicación para el tratamiento quirúrgico o no responden al tratamiento con embolización de las arterias uterinas. Los aGnRH consiguen altos porcentajes de amenorrea, elevadas tasas de recuperación de la anemia, reducción del volumen de los miomas, pero producen sintomatología hipoestrogénica que puede contrarrestarse mediante la terapia add-back en los tratamientos a largo plazo. Los antGnRH no peptídicos se administran vía oral, estudios recientes han demostrado su efectividad y seguridad en el control del SMA producido por miomas y también por adenomiosis, y el tratamiento a largo plazo requiere de la administración de la terapia add-back.
En la última revisión realizada por Cochrane y publicada el 31 de mayo de 2022 sobre cuál es el mejor tratamiento del SMA, se analizaron 9 revisiones que incluían 104 estudios, y un total de 11.881 participantes23). Las intervenciones médicas que se fueron evaluadas fueron los AINE, antifibrinolíticos (ácido tranexámico), anticonceptivos orales combinados, anillo vaginal, gestágenos vio oral en pauta larga y lútea, DIU-LNG 52mg, etamsilato y danazol, comparados con placebo. Las intervenciones quirúrgicas incluidas son histerectomía vía laparotómica, laparoscópica o vaginal, y la ablación endometrial. Los autores concluyeron que el DIU-LNG 52mg es el mejor tratamiento para reducir el SMA, los antifibrinolíticos son probablemente el segundo mejor y los gestágenos en pauta larga son probablemente el tercero mejor. Aunque la evidencia de algunos estudios es moderada, la mayoría de los estudios es baja o muy baja.
Ante un SMA de causa orgánica, se deberá individualizar el tratamiento en función de la causa. El tratamiento quirúrgico se considera de elección para el SMA causado por pólipos o malignidad. Para el SMA causado por adenomiosis o hiperplasia endometrial puede valorarse como 1.ª opción el uso de métodos de solo gestágenos1). Ante un SMA de causa miomatosa debemos consensuar con la paciente la mejor opción de tratamiento. El reciente desarrollo de antagonistas orales de la GnRH abren la posibilidad de tratamiento médico a largo plazo de miomas uterinos70–72.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesJosep Estadella ha recibido fondos de investigación y fondos por ponencias de Bayer Hispania y Gedeon Richter.
Josep Perelló ha recibido fondos de investigación y fondos por ponencias de Bayer Hispania, Gedeon Richter, Theramex, Exeltis, Gynea-Kern Pharma, Organon, Adamed, Bailleul y MSD.
Raquel Muñoz no declara ningún conflicto de interés.