El porcentaje de gestantes infectadas por VIH que demandan embarazo ha aumentado en los países desarrollados debido a la estabilidad de la infección y la disminución de la transmisión vertical por los tratamientos antirretrovirales (TAR) y las medidas preventivas. Sin embargo, existe poca información respecto al efecto del TAR sobre el embarazo.
MétodosEstudio retrospectivo de las gestantes infectadas por VIH con TAR controladas en el Hospital La Paz entre los años 2000-2017. Se estudiaron las complicaciones maternofetales.
ResultadosSe recogieron 141 gestaciones en 112 mujeres infectadas por VIH. El TAR más utilizado fue la combinación de 2 inhibidores de la transcriptasa inversa análogos nucleosídicos+1 inhibidor de la proteasa (58,1%), con diferencias significativas entre los distintos tratamientos en cuanto a la carga viral plasmática, siendo indetectable en mayor medida con 2 inhibidores de la transcriptasa inversa análogos nucleosídicos +1 inhibidor de la transcriptasa inversa no nucleosídico, segunda pauta más utilizada. Las tasas de neonatos a término de bajo peso (<2.500g) (11,3%), partos pretérmino (11,1%) y rotura prematura de membranas pretérmino (5,6%) fueron mayores que en la población general. Aunque no hubo asociación, estas complicaciones fueron más frecuentes en gestantes con un inhibidor de la proteasa/ritonavir. No se relacionaron con la carga viral plasmática. No se encontró aumento en la tasa de interrupciones gestacionales, malformaciones ni diabetes gestacional.
ConclusiónEn las gestantes infectadas por VIH con TAR está aumentada la tasa de neonatos a término de bajo peso, prematuridad y rotura prematura de membranas pretérmino en comparación con la población general, relacionándose especialmente con el tratamiento con un inhibidor de la proteasa, aunque sin asociación significativa.
The percentage of HIV-infected pregnant women seeking pregnancy has increased in developed countries due to the stability of the infection and the decrease in vertical transmission due to antiretroviral treatment (ART) and preventive measures. However, there is little information regarding the effect of ART on pregnancy.
MethodsRetrospective study of HIV-infected pregnant women on ART monitored at Hospital La Paz between 2000-2017. Maternal-foetal complications were studied.
ResultsOne hundred and forty-one gestations were collected in 112 HIV-infected women. The most commonly used ART was the combination of 2 nucleoside reverse transcriptase inhibitor analogues+1 protease inhibitor (58.1%), with significant differences between the different treatments in terms of plasma viral load being undetectable to a greater extent with 2 nucleoside reverse transcriptase inhibitor analogues+1 non-nucleoside reverse transcriptase inhibitor, the second most used regimen. The rates of low birth weight (<2,500g) term neonates (11.3%), preterm delivery (11.1%) and preterm premature rupture of membranes (5.6%) were higher than in the general population. Although there was no association, these complications were more frequent in pregnant women with a protease inhibitor/ritonavir. They were not related to plasma viral load. No increase in the rate of gestational terminations, malformations or gestational diabetes was found.
ConclusionHIV-infected pregnant women on ART have an increased rate of low birth weight, prematurity, and preterm premature rupture of membranes at term compared to the general population, especially related to treatment with protease inhibitor, although without significant association.
Aunque se han hecho grandes progresos, la infección por VIH sigue siendo una enfermedad incurable. Incluso bajo las mejores circunstancias, la mayoría de los pacientes con VIH que reciben tratamiento antirretroviral (TAR) tienen una supervivencia menor en comparación con la población general debido a un mayor riesgo de desarrollar comorbilidades distintas del sida, como enfermedades cardiovasculares y cáncer1–3. En los países en vías de desarrollo la infección por VIH infantil tiene unas dimensiones alarmantes; en más del 90% de los niños infectados por VIH la vía de transmisión fue la maternofetal1. Por otra parte, también en estos países, solo una parte de las mujeres infectadas tienen acceso a programas de prevención de transmisión vertical (TV), oscilando su cobertura entre un 15 y un 75%, según los distintos países1,2.
Sin embargo, en los países desarrollados, el porcentaje de gestantes infectadas por VIH que demandan un embarazo está en aumento como consecuencia de la estabilidad de la infección. Esto es debido a la efectividad de los TAR introducidos en 1996 (actualmente las recomendaciones son tratar a todos los pacientes con infección por VIH, incluidas las gestantes, con independencia de la existencia de clínica y del número de linfocitos T CD4+) y a las medidas preventivas llevadas a cabo en las unidades de alto riesgo1,4.
En España, el número de gestantes con VIH parecía haber disminuido a finales del siglo xx, pero a inicios del siglo xxi ha habido un incremento debido al flujo migratorio5,6 y al cribado de la infección por VIH en todas las gestantes, con lo que se consigue diagnosticar en el embarazo pacientes que desconocían su infección.
La bibliografía relacionada con el control del embarazo y del parto de este tipo de gestaciones de alto riesgo es abundante, pero disponemos de pocos datos sobre cómo el TAR puede afectar al curso de la gestación y si puede aumentar el riesgo de complicaciones obstétricas debido a su potencial toxicidad.
El objetivo de este estudio es analizar si el TAR se asocia con más complicaciones maternofetales, basándonos en la prevalencia de dichas complicaciones en la población gestante general, y comparar las diferentes pautas de TAR utilizadas.
MétodosEstudio observacional retrospectivo realizado en la Sección de Tocología de Alto Riesgo y Obstetricia Médica del Hospital Universitario La Paz entre los años 2000-2017 de las gestantes infectadas por VIH.
Se recogieron todos los casos de gestaciones en mujeres infectadas por VIH de entre 16 y 45 años de edad.
Se ha considerado aborto espontáneo la pérdida gestacional por debajo de la semana 12 de gestación; aborto tardío, la pérdida gestacional en las semanas 12-22 de gestación; muerte fetal anteparto, la pérdida gestacional a partir de la semana 23 de gestación; crecimiento intrauterino restringido (CIR), el feto con un peso estimado inferior al percentil 3 para su edad gestacional; neonato de bajo peso a término, el recién nacido con un peso<2.500g más allá de la semana 37 de gestación; parto prematuro, el que sucede antes de la semana 37 de gestación; malformación congénita mayor, la así considerada por la Red Europea de Vigilancia de Anomalías Congénitas y Gemelos; diabetes gestacional, la diagnosticada según los criterios diagnósticos del National Diabetes Data Group, la Sociedad Española de Ginecología y Obstetricia y la Sociedad Española de Diabetes; preeclampsia, la presencia de tensión arterial≥140/90mmHg, y proteinuria>300mg/día en orina de 24h; carga viral plasmática (CVP) indetectable, si<50 copias/mL. La finalización del embarazo se programó en las semanas 38-39 de gestación, y la vía del parto venía condicionada por la CVP en el tercer trimestre, las condiciones cervicales y las indicaciones obstétricas adicionales (presentación podálica, placenta previa oclusiva total, etc.).
Se ha realizado un análisis descriptivo. En el caso de variables cualitativas el estudio se realizó mediante porcentajes y distribución de frecuencias, y en el caso de variables cuantitativas, mediante la determinación de medias y de la desviación estándar. En el análisis inferencial se emplearon el test t-Student y la prueba no paramétrica de Mann-Whitney.
En el análisis de la varianza se usaron los test de ANOVA o de Kruskal-Wallis.
La asociación entre variables cualitativas se estudió mediante el test de la χ2, con la corrección de Fisher en caso necesario, y con la razón de verosimilitud.
Los intervalos se expresaron con un intervalo de confianza del 95%, y se consideraron significativas las asociaciones estadísticas con un valor de p<0,05.
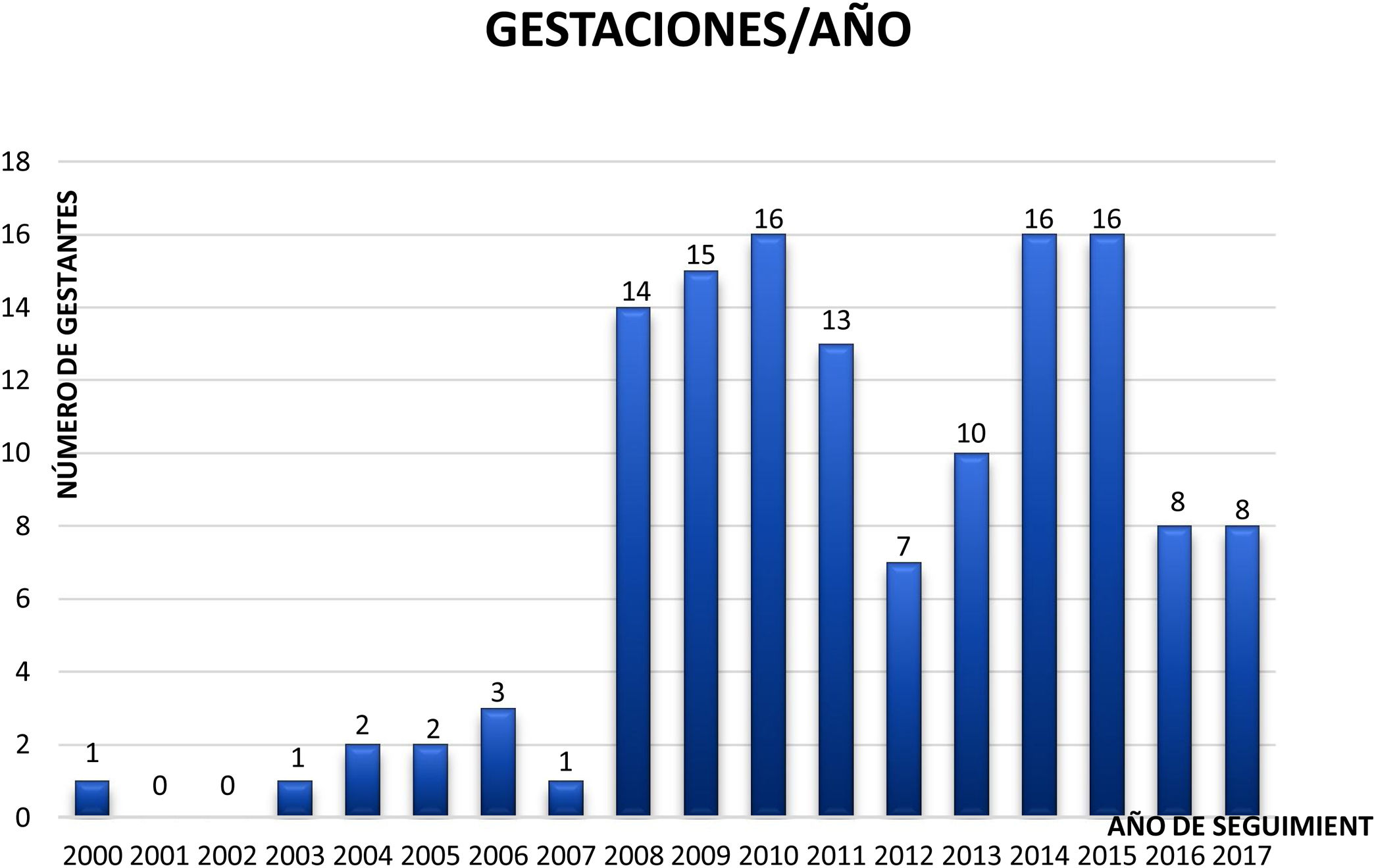
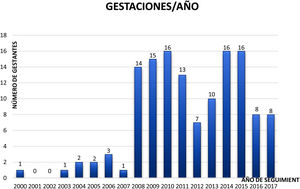
ResultadosEn total se estudiaron 112 pacientes y 141 gestaciones, ya que algunas de estas pacientes tuvieron varios embarazos (fig. 1). Un 17,4% de las infecciones por VIH se diagnosticaron en el embarazo.
En 138 de las 141 gestaciones se administró TAR. Un 10,2% tenían tratamiento antes del embarazo, y en el resto se inició durante la gestación. Un 2,2% no quiso recibir TAR.
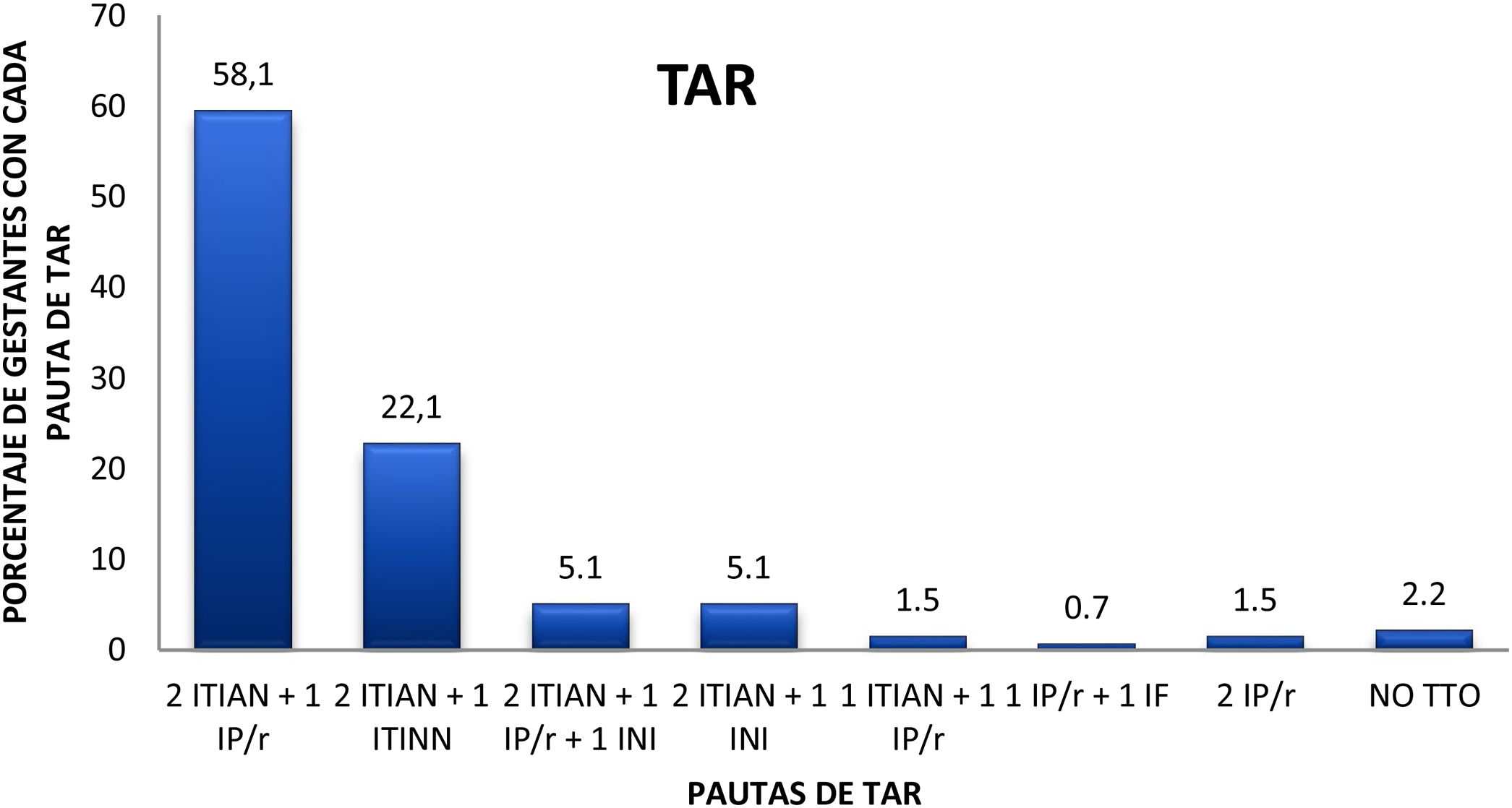
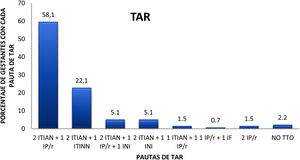
Las pacientes recibieron distintas combinaciones de antirretrovirales, siendo la más empleada la combinación de 2 inhibidores de la transcriptasa inversa análogos nucleosídicos (ITIAN) y un inhibidor de la proteasa potenciado con ritonavir (IP/r) (58,1%, 82 gestantes). La segunda pauta de TAR más frecuente fue la combinación de 2 ITIAN y un inhibidor de la transcriptasa inversa no nucleósido (ITINN) (22,1%, 31 gestantes). La combinación siguiente en frecuencia incluía un inhibidor de la integrasa (INI) (10,2%). De este 10,2% (14 pacientes), 11 pacientes recibieron raltegravir y 3 dolutegravir (fig. 2).
Distribución de pacientes en función del tratamiento antirretroviral (TAR) recibido durante la gestación. IF: inhibidores de la fusión; INI: inhibidores de la integrasa; IP/r: inhibidores de la proteasa potenciados por ritonavir; ITIAN: inhibidores de la tanscriptasa inversa análogos nucleosídicos; ITINN: inhibidores de la transcriptasa inversa no nucleosídicos.
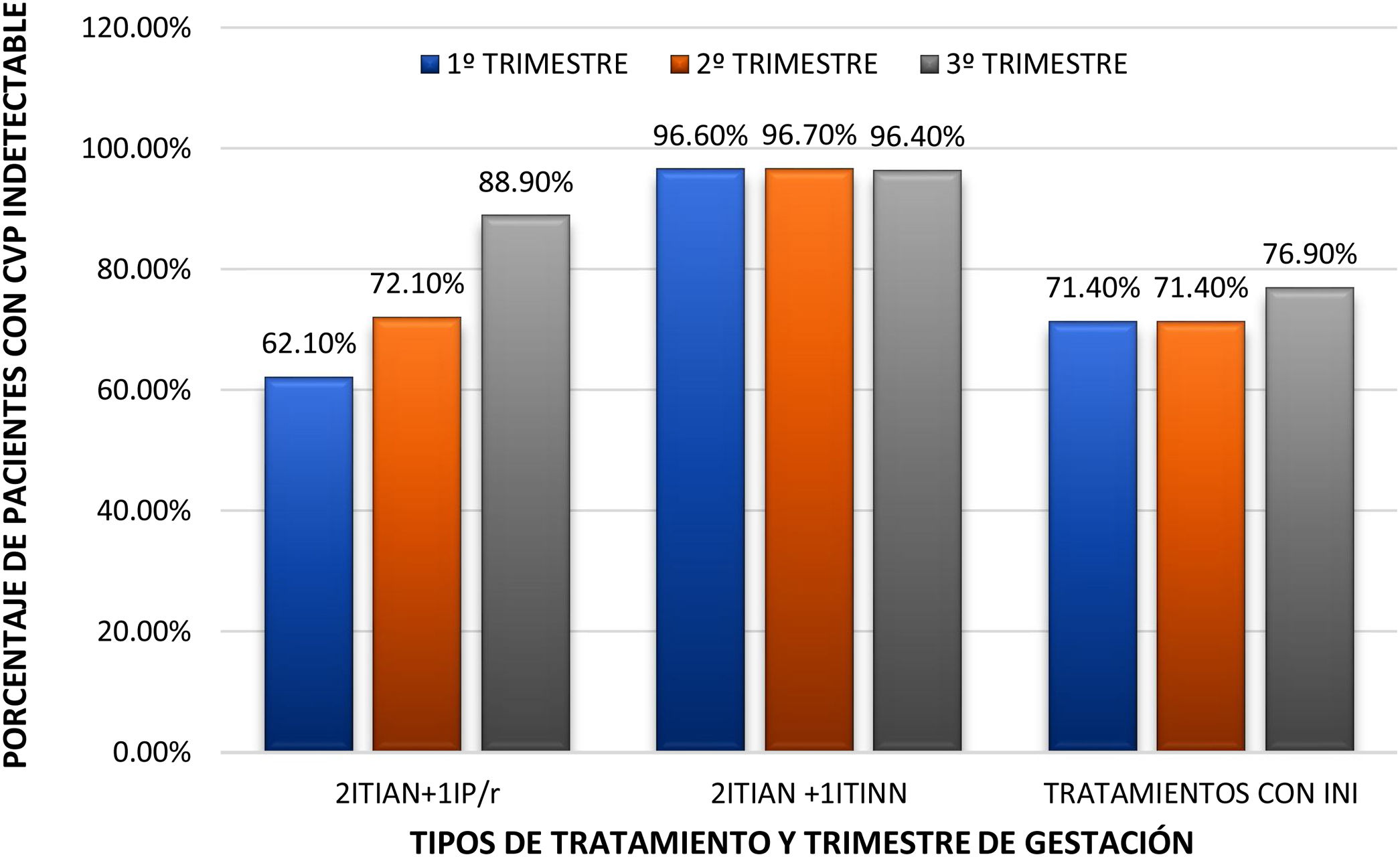
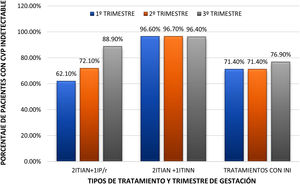
La tasa de gestantes con CVP indetectable fue aumentando tras la administración de TAR a medida que transcurría el embarazo, encontrándose diferencias significativas entre los distintos tipos de TAR (estratificado en 3 grupos: 2 ITIAN+1 IP/r, 2 ITIAN+1 ITINN y combinaciones con INI) (p=0,03 en el primer trimestre y p=0,02 en el segundo trimestre). En el tercer trimestre no se encontraron estas diferencias (p=0,22). La CVP fue indetectable en mayor medida con 2 ITIAN+1 ITINN que con 2 ITIAN+1 IP/r, las 2 pautas más utilizadas (p=0,0001 y p=0,005 en el primer y segundo trimestre, respectivamente), siendo homogéneos los distintos tipos de TAR en relación con esta variable en el tercer trimestre (p=0,27) (fig. 3).
Porcentaje de gestantes infectadas por VIH con carga viral plasmática (CVP) indetectable distribuidas según pauta de TAR y trimestre. INI: inhibidores de la integrasa; IP/r: inhibidores de la proteasa potenciados por ritonavir; ITIAN: inhibidores de la transcriptasa inversa análogos nucleosídicos; ITINN: inhibidores de la transcriptasa inversa no nucleosídicos.
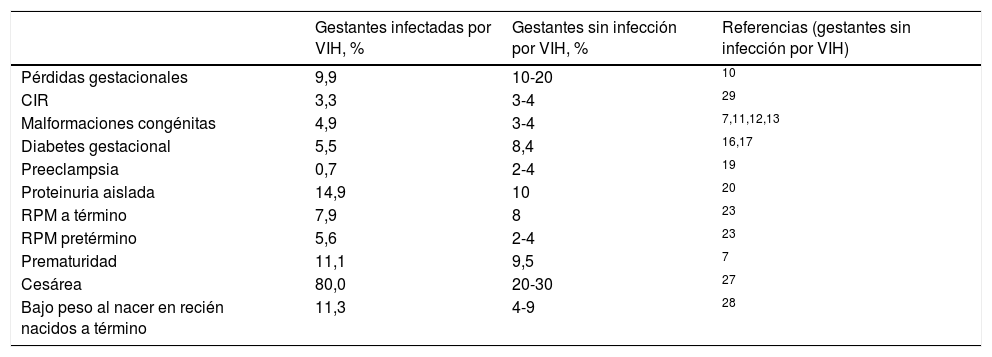
Las complicaciones obstétricas se muestran en la tabla 1. En 14 casos (9,9%) se produjo una pérdida gestacional: 6 abortos espontáneos, 5 abortos tardíos, una muerte fetal anteparto (en la semana 25 de gestación) y 2 interrupciones legales del embarazo (una en la semana 16 de gestación por trisomía 21 y otra en la semana 22 de gestación por fibrosis quística fetal). No se encontró asociación entre el TAR o la CVP y las pérdidas gestacionales.
Porcentajes comparativos de complicaciones obstétricas entre gestantes infectadas por VIH, controladas en el Hospital La Paz, y gestantes de la población general, sin infección por VIH
| Gestantes infectadas por VIH, % | Gestantes sin infección por VIH, % | Referencias (gestantes sin infección por VIH) | |
|---|---|---|---|
| Pérdidas gestacionales | 9,9 | 10-20 | 10 |
| CIR | 3,3 | 3-4 | 29 |
| Malformaciones congénitas | 4,9 | 3-4 | 7,11,12,13 |
| Diabetes gestacional | 5,5 | 8,4 | 16,17 |
| Preeclampsia | 0,7 | 2-4 | 19 |
| Proteinuria aislada | 14,9 | 10 | 20 |
| RPM a término | 7,9 | 8 | 23 |
| RPM pretérmino | 5,6 | 2-4 | 23 |
| Prematuridad | 11,1 | 9,5 | 7 |
| Cesárea | 80,0 | 20-30 | 27 |
| Bajo peso al nacer en recién nacidos a término | 11,3 | 4-9 | 28 |
CIR: crecimiento intrauterino restringido; RPM: rotura prematura de membranas; VIH: virus de la inmunodeficiencia humana.
El CIR apareció en 5 gestaciones (3,3%). En 7 gestantes (4,9%) se encontraron malformaciones congénitas mayores: una trisomía 21, un higroma quístico, un hidrops fetal con genitales ambiguos, una fibrosis quística y ascitis, un hidrops fetal, una microcefalia con quistes de plexos coroideos, un tabique auricular aneurismático y, por último, un arco aórtico derecho con ductus arterioso pequeño y dilatación del tronco de la arteria pulmonar. Ninguna estaba relacionada con ningún TAR en concreto.
Un 5,5% desarrollaron diabetes gestacional, todas en el segundo trimestre, de las cuales un 42,9% requirieron insulina. El 71,4% de las gestantes estaba en tratamiento con un IP/r, aunque sin asociación estadísticamente significativa (p=0,65).
Hubo un caso de preeclampsia, tardía y leve. Se detectaron un total de 24 casos de proteinuria (>300mg/día en orina de 24h), correspondientes a un 14,9% de la muestra total (7 en el segundo trimestre y 17 en el tercero) y a un 16,2% de todas las gestantes con un ITIAN en su pauta de tratamiento (siendo estas últimas el 91,9% de las gestantes de nuestra muestra). No se encontró asociación entre la pauta de TAR empleada y la proteinuria, aunque de entre todas las gestantes que tomaban 2 ITIAN y presentaron proteinuria, el 71% estuvieron en tratamiento con tenofovir disoproxil, frente al 46,3% de las gestantes con tenofovir disoproxil que no desarrollaron proteinuria.
Solo una de las pacientes con proteinuria desarrolló preeclampsia.
En un 5,6% (8 gestantes) de los casos se produjo una rotura prematura de membranas previa a las 37 semanas de embarazo. No se pudo demostrar asociación con la pauta de TAR, sin embargo, un 87,5% de las gestantes estaban en tratamiento con un IP/r.
No se encontró asociación entre la CVP en el tercer trimestre y la proteinuria o la rotura prematura de membranas pretérmino.
En lo relativo a la finalización del embarazo, la edad gestacional al parto fue de 37,9±1,6 semanas, encontrándose un 11,1% de prematuros. En un 73,3% de los partos prematuros, las gestantes tenían un IP/r en su TAR, pero no se encontró asociación con el tipo de TAR. Tampoco hubo asociación con la CVP en el tercer trimestre.
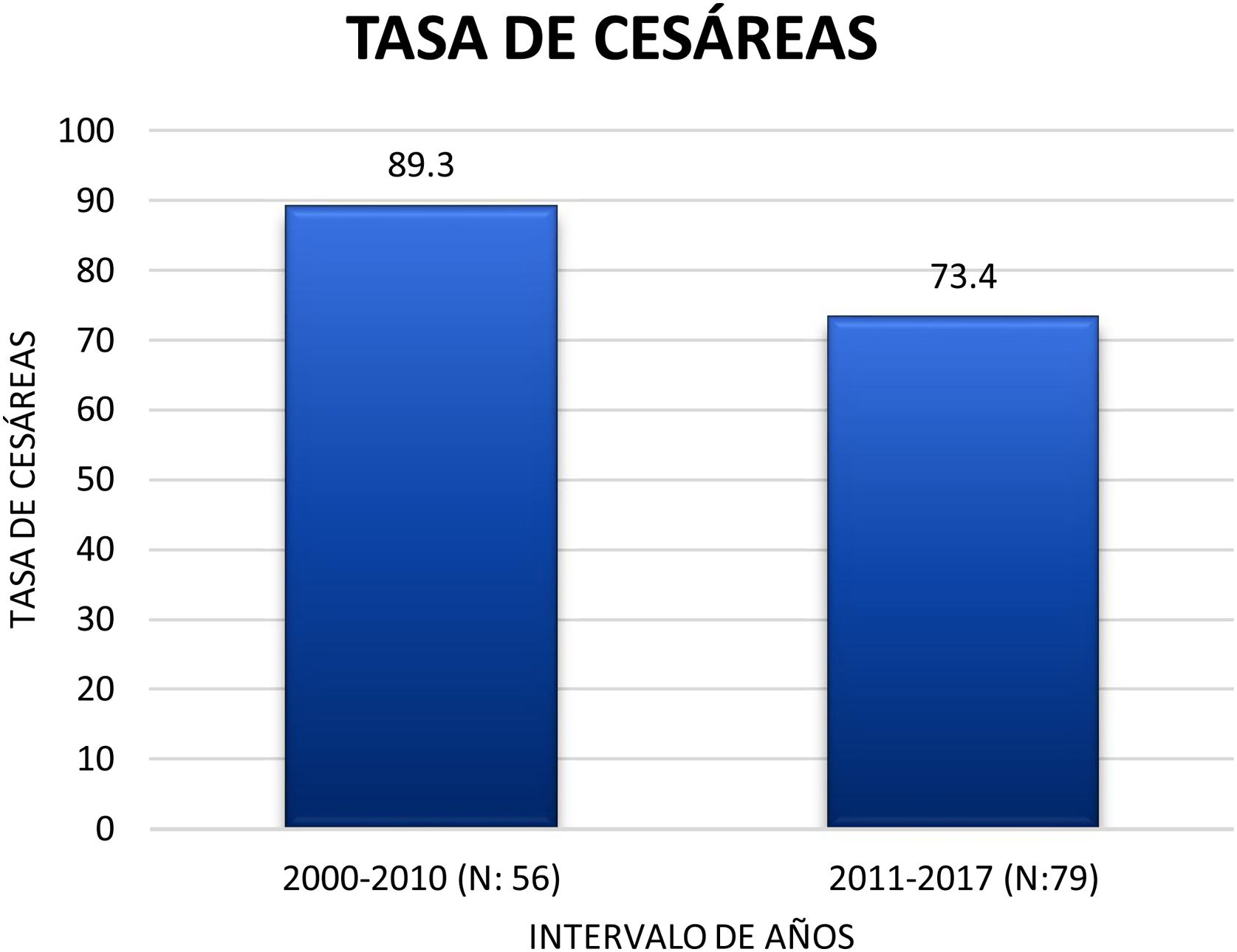
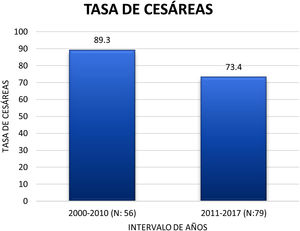
La vía del parto en el 80,0% de los casos fue la cesárea. La tasa de cesáreas ha ido disminuyendo ligeramente, de un 89,3% en la primera década del siglo xxi a un 73,4% entre los años 2011-2017 (fig. 4).
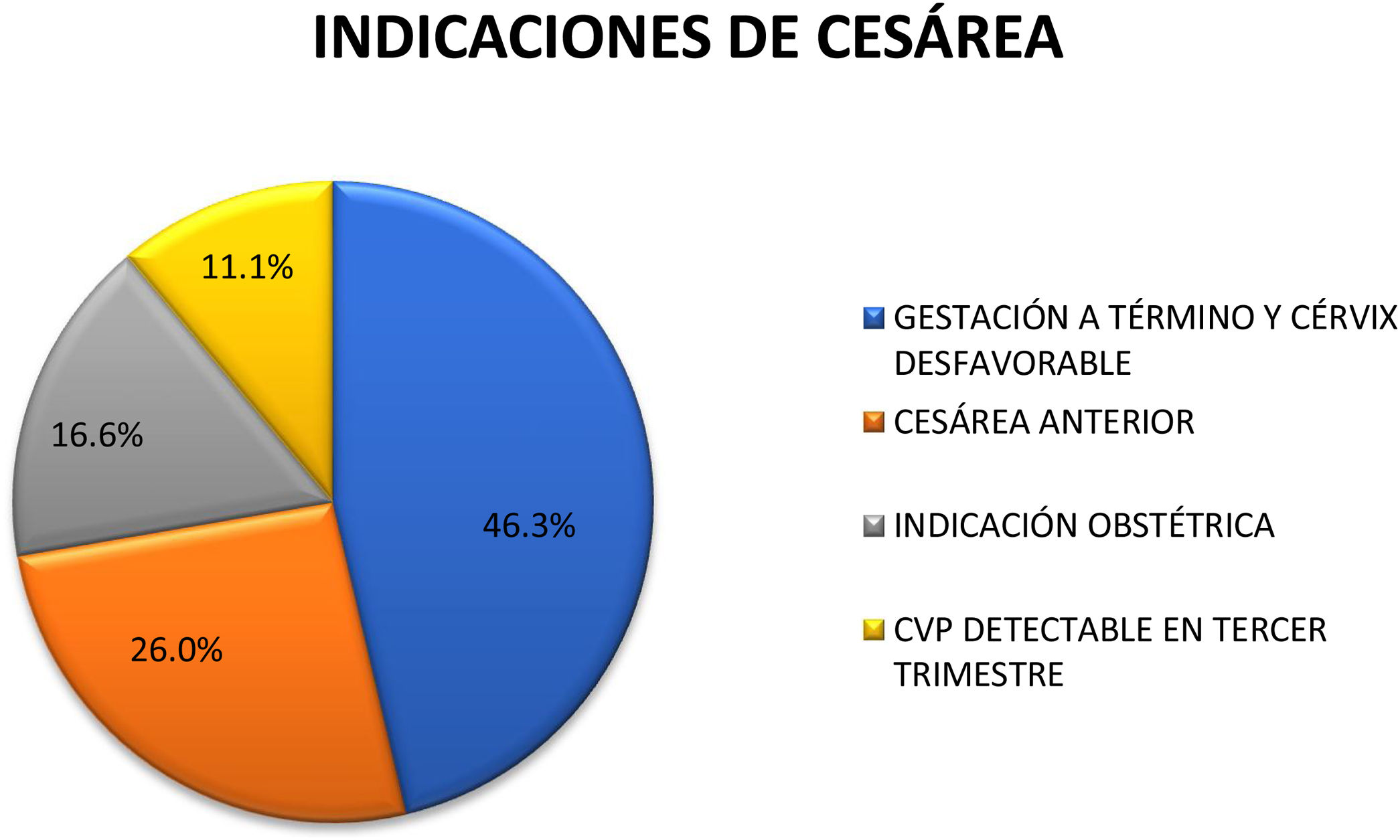
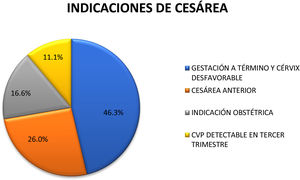
En cuanto a la indicación de la cesárea, en el 46,3% de las mismas fue por gestación a término y cérvix desfavorable para inducción (test de Bishop<4), en el 26,0% por cesárea anterior, en el 16,6% por indicación obstétrica (podálica, riesgo de pérdida de bienestar fetal) y en el 11,1% por CVP detectable en el tercer trimestre de gestación (fig. 5).
El peso de los recién nacidos fue de 3.015,25±496,9g, encontrándose un 11,3% de neonatos a término con bajo peso (<2.500g). No se demostró una asociación entre el peso y la CVP o el tipo de tratamiento. Un 64,3% de las pacientes con un neonato a término de bajo peso presentaron en su combinación de TAR un IP/r, frente a un 52,6% de las gestantes con neonatos a término normopeso.
En esta serie de casos, en ninguno de los neonatos se diagnosticó infección por el VIH; la TV fue del 0%.
DiscusiónLa TAR ha sido el factor más importante a la hora de reducir la TV del VIH7–9. La mayor parte de la TV se produce de forma tardía en la gestación o durante el parto, pero también se puede producir en etapas precoces. Esta es la razón por la cual se recomienda empezar el TAR lo más precozmente, especialmente si el diagnóstico se realiza durante el embarazo4,9,10. Un 10,2% de nuestras gestantes tenían tratamiento antes del embarazo, siguiendo las recomendaciones de la OMS del 2015 de iniciar TAR a todos los pacientes con infección por VIH4.
La tasa de abortos espontáneos clínicos en la población general es del 10-20% de los embarazos11, datos muy similares a los encontrados en nuestro estudio, con una tasa del 9,9%, por lo que no parece que el TAR esté relacionado con los abortos, tanto precoces como tardíos.
Los estudios observacionales han mostrado una incidencia de malformaciones congénitas similar en fetos expuestos al TAR y en fetos no expuestos4,12–14. En nuestro estudio se halló una tasa de malformaciones congénitas muy similar a la esperada en la población general (3-4%).
Clásicamente se había asociado el efavirenz a un mayor riesgo de anomalías del sistema nervioso central, si bien varios estudios, entre ellos un metaanálisis publicado en 2011, no confirmaron dicho riesgo15. Ninguna de nuestras gestantes recibió efavirenz.
En el caso de dolutegravir, se tiene una experiencia limitada en el embarazo por su reciente introducción en la gestante infectada. Los resultados del estudio Tsepamo en Botswana muestran una incidencia del 0,3% de defectos del tubo neural en recién nacidos de mujeres que tomaban dolutegravir, en comparación con una tasa esperada del 0,1%16. Tan solo 3 gestantes recibieron dolutegravir en nuestra muestra, sin malformaciones fetales.
La prevalencia de diabetes gestacional en la población general se encuentra en torno a 8-10%17,18; en nuestro estudio, 7 gestantes (5,5%) desarrollaron diabetes gestacional. De estas gestantes, casi la mitad precisaron insulina para el control de su diabetes gestacional, coincidiendo con los datos publicados para la población general17.
Ha habido mucha controversia por la posible asociación entre el tratamiento con IP/r y el aumento del riesgo de diabetes gestacional. Cada vez hay más estudios que muestran una tasa similar al comparar gestantes con TAR que contiene un IP/r y gestantes con una pauta distinta19; de hecho, con relación a los IP de nueva generación esta asociación no parece tan clara (darunavir y atazanavir, ampliamente utilizados durante la gestación).
En nuestra casuística, un 71,4% de las gestantes con diabetes gestacional estaba en tratamiento con un IP/r, aunque de nueva generación, lo que podría explicar que no se observase una tasa más elevada de diabetes gestacional.
La preeclampsia, antes de la era TAR, era una enfermedad muy poco frecuente debido a la inmunodeficiencia propia del VIH. Sin embargo, con el inicio del TAR se ha observado un aumento de su incidencia hasta valores similares a los de la población general20. En nuestro estudio solo hubo un caso de preeclampsia.
Se encontró un 14,9% de gestantes con proteinuria aislada, asociándose tan solo una de ellas a preeclampsia. La proteinuria es relativamente común en la población general (10%)21, aunque no se ha establecido el impacto de la proteinuria per se en los resultados maternofetales, ya que no predice de forma independiente un resultado adverso22. No hubo asociación con el TAR empleado, a pesar de que todas las pacientes con proteinuria que tenían en su pauta un ITIAN, un 71%, incluían tenofovir disoproxil, cuyo efecto adverso más característico es la toxicidad renal23, frente a un 46,3% de las gestantes que no desarrollaron proteinuria y que estaban en tratamiento con tenofovir disoproxil.
En cuanto a la rotura prematura de membranas a término, en nuestro estudio se encontró una prevalencia similar a la de la población general (7,9% en gestantes con infección por VIH frente al 8% en la población general), mientras que la rotura prematura de membranas pretérmino se presentó con una prevalencia casi 2 veces mayor (5,6 vs. 2-4)24. Esta prematuridad en la rotura de bolsa no se relacionó con la CVP, sin embargo, en cuanto al TAR empleado, casi todas las pacientes se encontraban en tratamiento con un IP/r.
En España la tasa de prematuridad es del 9,5%, y en gestantes con infección por VIH es aún mayor, hasta del 18%4. En nuestra casuística, aunque fue menor que la descrita en la literatura, también superó la de la población general. Esta asociación se produce fundamentalmente con pautas de TAR que contienen un IP/r, aunque no se limita a este grupo antirretroviral25. Nosotros no encontramos asociación con el TAR empleado, aunque la mayoría de las gestantes con parto prematuro (73,3%) estaban tomando un IP/r. No está muy clara la causa, pero recientes estudios muestran que las gestantes en tratamiento con IP/r tienen niveles más bajos de progesterona sérica, lo que podría favorecer el desencadenamiento del parto pretérmino26.
La cesárea es un método comprobado para prevenir la TV, si bien su efecto no es significativamente diferente al del parto por vía vaginal en el contexto de la supresión viral con TAR27.
La tasa de cesáreas en nuestro medio se encuentra en torno a un 20-30%, con importantes variaciones en función del grado de complejidad de las pacientes28. En nuestro estudio la tasa de cesáreas fue mayor (80,0%) a la descrita. El 88,8% de las mismas se realizó en pacientes con CVP indetectable. Esto fue debido a que la indicación de la cesárea no fue la infección por el VIH estrictamente, sino que, siguiendo el protocolo de manejo de la gestante infectada por VIH vigente en nuestro hospital en ese momento, ante una gestante de 38-39 semanas de gestación con un cérvix desfavorable para la inducción (test de Bishop<4), esta era candidata a cesárea.
En nuestro medio, la tasa de neonatos de bajo peso a término se encuentra en torno al 5,9-9%29. Aunque son controvertidos, y a menudo complicados por múltiples factores de confusión, los datos de numerosos estudios evidencian una asociación entre el uso de IP/r y el bajo peso al nacer en gestaciones a término, además de con la prematuridad y la rotura prematura de membranas pretérmino, ya mencionadas previamente24.
En nuestro estudio se obtuvo una tasa de bajo peso neonatal del 11,3% (14 neonatos), considerablemente más elevada que en la población general (4-9%). En 4 de estas gestaciones se tenía un diagnóstico ecográfico de CIR previo al nacimiento, lo que supuso un 3,3% de CIR, coincidiendo con las tasas halladas en la población general, así como con los datos encontrados en la literatura, tanto para población general como para las gestantes infectadas por VIH30.
Tras analizar los resultados extraídos de este estudio, se puede comprobar que ciertas complicaciones obstétricas son más frecuentes en las gestantes infectadas por VIH, como el recién nacido a término de bajo peso, la prematuridad, la rotura prematura de membranas pretérmino y la proteinuria.
Si bien no hay asociación, se ha encontrado una mayor tasa de recién nacidos a término con bajo peso, prematuridad y rotura prematura de membranas pretérmino en gestantes en tratamiento con un IP/r, mientras que la proteinuria es más frecuente en gestantes en tratamiento con tenofovir disoproxil.
A día de hoy, el TAR de elección es: 2 ITIAN (tenofovir o abacavir+lamivudina o emtricitabina)+1 INI (raltegravir) o un IP/r (atazanavir/ritonavir o darunavir/ritonavir)9,12, y a la vista de los resultados obtenidos en nuestro estudio, aun sin asociaciones significativas, podemos concluir que, tal y como recomiendan los documentos de consenso y guías internacionales para el seguimiento de la infección por el VIH en la gestante, la primera opción de tratamiento sería la combinación de 2 ITIAN+1 INI, intentando evitar en la medida de lo posible el empleo de IP/r para así disminuir el riesgo de recién nacido a término de bajo peso, el parto pretérmino y la rotura prematura de membranas pretérmino.
Limitaciones del estudioLas limitaciones principales de este estudio son el reducido tamaño muestral, la ausencia de grupo control y el carácter retrospectivo, que dificulta la recopilación de datos, por lo que sería necesario realizar en un futuro un estudio similar con un aumento del tamaño muestral, así como establecer una comparación con una población de gestantes sin infección por VIH similar a la formada por las gestantes infectadas seguidas en el Hospital La Paz.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónLa presente investigación no ha recibido ninguna financiación de agencias de los sectores público, comercial o sin ánimo de lucro
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses potenciales relacionados con los contenidos de este artículo.