Comparar las cantidades de células endoteliales maduras y progenitoras en preeclámpticas con embarazadas normotensas sanas.
Material y métodosSe seleccionó a pacientes que asistieron a la Emergencia de Obstetricia del Hospital Central Dr. Urquinaona, Maracaibo, Venezuela. Los grupos consistieron en preeclámpticas (grupo A; n=5) y embarazadas normotensas (grupo B; n=35), estas últimas consideradas como controles, estudiadas en forma consecutiva. Las muestras de sangre se recolectaron en todas las pacientes antes del parto y en el grupo en estudio inmediatamente después del diagnóstico para la determinación de la cantidades de células endoteliales maduras y progenitoras.
ResultadosLas pacientes del grupo A tenían promedios de edad y peso similares a los del grupo control (p=ns). Se observaron diferencias estadísticamente significativas con relación a la edad gestacional al momento de la toma de la muestra, presión arterial diastólica y sistólica, peso del recién nacido y presencia de proteinuria (p<0,05). También se encontraron diferencias estadísticamente significativas en las cantidades de células endoteliales progenitoras (p<0,05) y en las cantidades de células endoteliales maduras (p<0,05) entre las preeclámpticas y los controles.
ConclusionesLas preeclámpticas presentan reducción significativa en las células endoteliales maduras y progenitoras comparada con embarazadas normotensas sanas.
To compare the quantities of mature and progenitor endothelial cells in preeclamptic patients with those in normotensive pregnant women.
Materials and methodsPatients attending the Obstetrics Emergency Service at the Dr. Urquinaona Central Hospital in Maracaibo, Venezuela, were selected. There were two groups: group A (n=35) consisting of preeclamptic women and group B (n=35) consisting of normotensive pregnant women. This latter group was considered as a control group and the patients were studied consecutively. In all patients, blood samples were collected before labor and in the study group immediately after diagnosis to determine quantities of mature and progenitor endothelial cells.
ResultsAge and weight were similar in the two groups (p=ns). Statistically significant differences were observed in gestational age at sample collection, systolic and diastolic pressure, newborn weight and the presence of proteinuria (p<0.05). Significant differences were also found between preeclamptic patients and controls in the quantities of progenitor endothelial cells (p<0.05) and mature endothelial cells (p<0.05).
ConclusionsPreeclamptic patients showed a significant reduction in the quantities of mature and progenitor endothelial cells compared with normotensive pregnant women.
La preeclampsia es la principal causa de morbilidad y mortalidad perinatal. Aunque su etiología exacta aún es desconocida, la regulación del crecimiento vascular en la unidad fetoplacentaria parece estar alterada, llevando a alteraciones en la placentación1. Salafia et al2 demostraron una correlación positiva entre la presencia de lesiones vasculares uteroplacentarias y alteraciones de las vellosidades (vellosidades avasculares y endovasculitis hemorrágicas) en las preeclámpticas. Varios estudios han demostrado déficits selectivos de factores angiogénicos en el suero de las preeclámpticas y en la sangre venosa umbilical de los recién nacidos3,4. Las alteraciones en la expresión de los factores angiogénicos también han sido demostradas en la placenta5.
La angiogénesis es la generación de capilares desde vasos preexistentes, mientras que las vasculogénesis es el desarrollo de vasos sanguíneos a partir de células endoteliales. Éstas se diferencian in situ y son esenciales para la diferenciación de la red del sistema vascular en el embrión y el feto6,7. Las células endoteliales progenitoras han sido detectadas entre las células mononucleares en la circulación materna8, y se piensa que derivan de las células endoteliales de la medula ósea para contribuir a la neovascularización y a la vasculogénesis9,10.
Se ha descrito que la movilización e incorporación de células endoteliales contribuye a la restauración de la capa endotelial11. Las células endoteliales maduras son una subpoblación de células circulantes que no se multiplican, constituyendo una población celular estable y tienen la capacidad de diferenciarse en endotelio si se requieren capilares de neoformación12. Se ha descrito la alteración en la función y el número de las células endoteliales en condiciones patológicas, como las enfermedades cardiovasculares13 y la diabetes mellitus14. Las células endoteliales maduras y progenitoras pueden jugar un papel importante en la vascularización del miometrio al momento de la implantación y placentación, ya que la angiogénesis se incrementa en este sitio anatómico desde la implantación hasta el embarazo temprano15.
El objetivo de la investigación fue comparar la cantidad de células endoteliales maduras y progenitoras en preeclámpticas con embarazadas normotensas sanas.
Material y métodosSe seleccionó a pacientes que asistieron a la Emergencia de Obstetricia del Hospital Central Dr. Urquinaona, Maracaibo, Venezuela, mediante un muestreo no probabilístico intencionado en todas las pacientes con diagnóstico de preeclampsia y en las normotensas, en las que se pudo determinar la cantidad de células endoteliales maduras y progenitoras. Los grupos consistieron en preeclámpticas (grupo A) y embarazadas normotensas (grupo B), estas últimas consideradas como controles, estudiadas en forma consecutiva. La preeclampsia se definió como presión arterial mayor de 140/90mmHg en dos o más ocasiones con 4h de diferencia entre las mediciones después de la vigésima semana de gestación, con proteinuria de más de dos cruces, en dos ocasiones con 6h de diferencia. La presión sanguínea se midió en posición sentada después de 15min de descanso. Se excluyó a las pacientes con antecedentes de infección urinaria, hipertensión crónica, diabetes mellitus o enfermedad renal preexistente. El Comité de Ética del Hospital aprobó el estudio.
Las muestras de sangre (20ml) se recolectaron en todas las pacientes antes del parto y en el grupo en estudio inmediatamente después del diagnóstico. El plasma fue separado de las células posterior a centrifugación de la sangre durante 10min, posteriormente las células fueron diferenciadas utilizando un centrifugador con gradiente de densidad. Las células polimorfonucleares en sangre periférica fueron recolectadas y contadas para ser suspendidas en una solución salina de Dubelcco mezclado con suero bovino fetal para la realización del contaje de células fluorescentes. La presencia de las células progenitoras y maduras se confirmó con el uso de anticuerpos monoclonales marcados contra el receptor 2 del factor de crecimiento endotelial vascular (VEGF-R2), CD133 y CD34 humano. Las células fueron incubadas con todos los anticuerpos por 30min a 4°C en la oscuridad, utilizando los controles isotópicos como controles. Después de la incubación, las células fueron analizadas por citometría de flujo y contaje de las células fluorescentes. Las células progenitoras endoteliales circulantes fueron determinadas por la presencia de VEGF-R2 y CD133. Las células endoteliales maduras fueron identificadas por la presencia de VEGF-R2 y CD34.
Los datos se presentan como valores promedios ± desviación estándar. El análisis estadístico entre los dos grupos se realizó con el test de la t de Student para datos no relacionados para comparar las características demográficas y las cantidades de células endoteliales maduras y progenitoras entre el grupo de preeclámpticas y las normotensas sanas. Se aceptó un nivel de significancia de p<0,05.
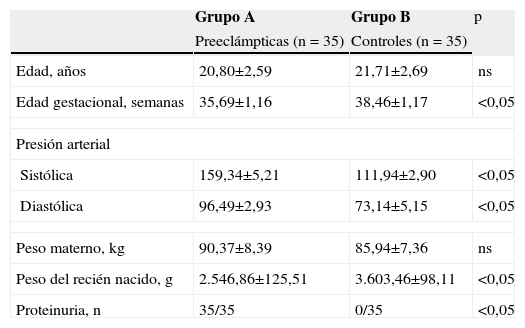
ResultadosUn total de 35 pacientes con diagnóstico de preeclampsia (grupo A) y 35 pacientes normotensas (grupo B) fueron incluidas en el estudio. Las características generales de las pacientes se muestran en la tabla 1. Las pacientes del grupo A tenían promedios de edad y peso similares a los del grupo control (p=ns). Se observaron diferencias estadísticamente significativas con relación a la edad gestacional al momento de la toma de la muestra, presión arterial diastólica y sistólica, peso del recién nacido y presencia de proteinuria (p<0,05).
Características demográficas
| Grupo A | Grupo B | p | |
| Preeclámpticas (n = 35) | Controles (n = 35) | ||
| Edad, años | 20,80±2,59 | 21,71±2,69 | ns |
| Edad gestacional, semanas | 35,69±1,16 | 38,46±1,17 | <0,05 |
| Presión arterial | |||
| Sistólica | 159,34±5,21 | 111,94±2,90 | <0,05 |
| Diastólica | 96,49±2,93 | 73,14±5,15 | <0,05 |
| Peso materno, kg | 90,37±8,39 | 85,94±7,36 | ns |
| Peso del recién nacido, g | 2.546,86±125,51 | 3.603,46±98,11 | <0,05 |
| Proteinuria, n | 35/35 | 0/35 | <0,05 |
ns: no significativo.
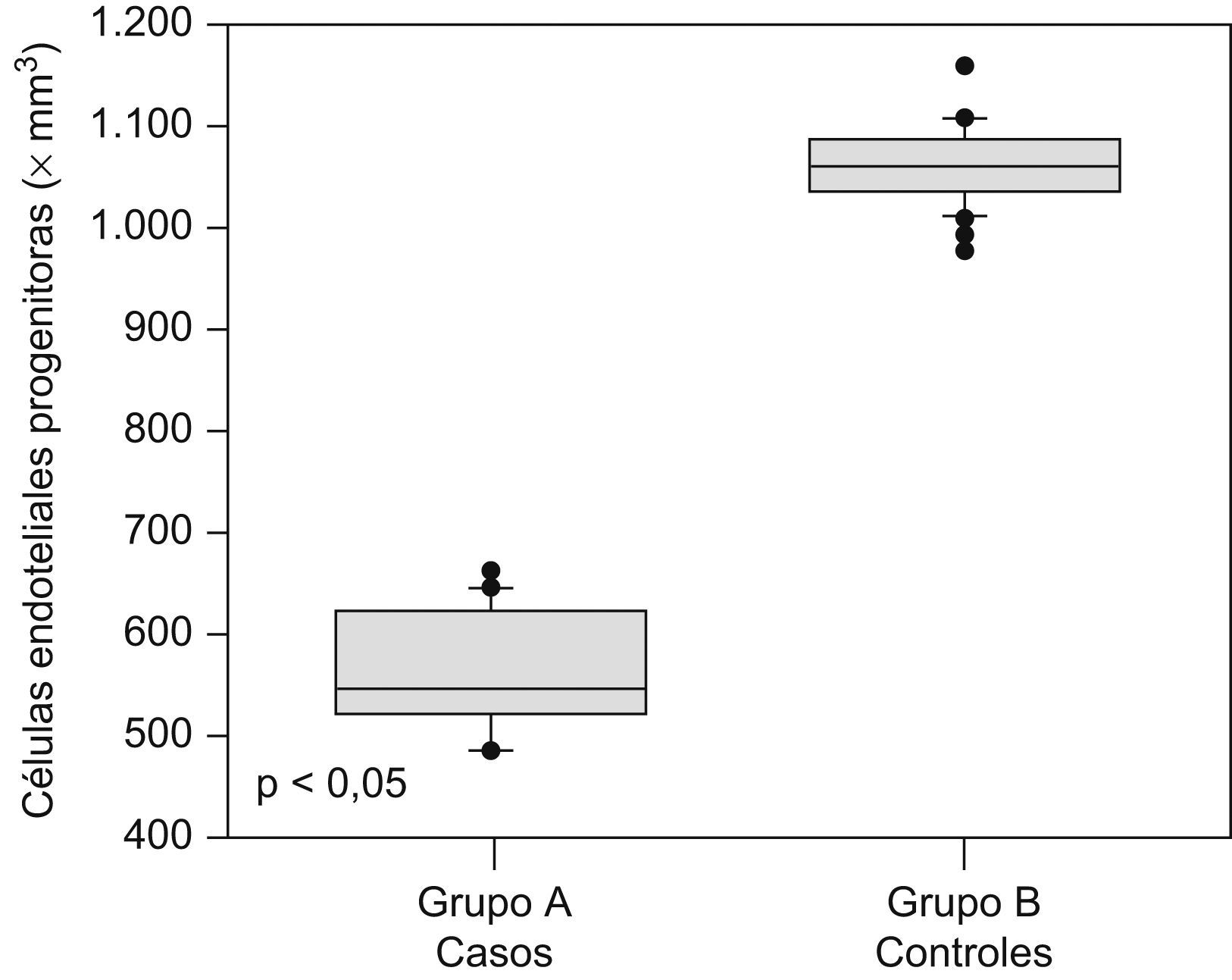
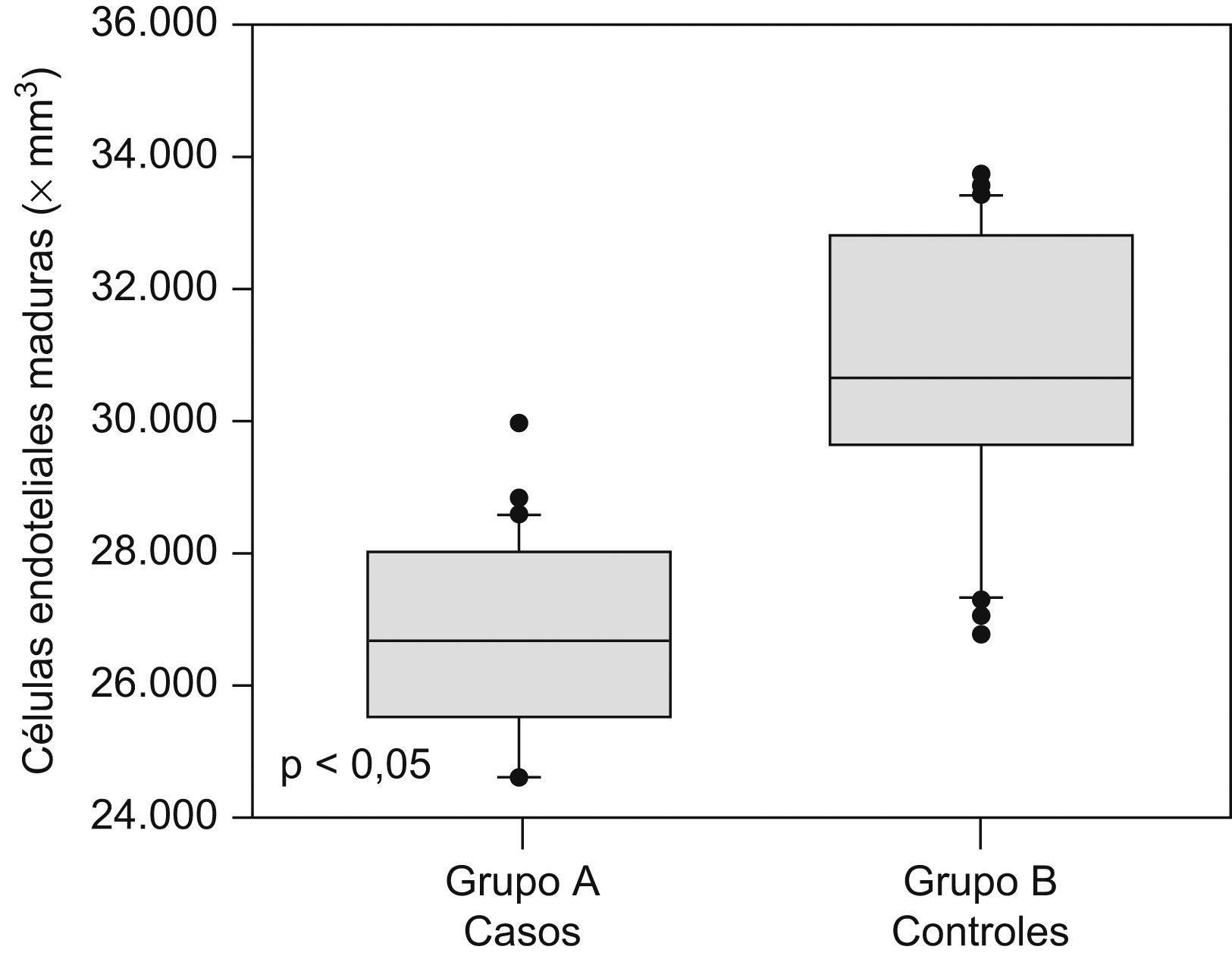
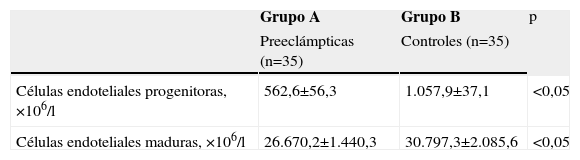
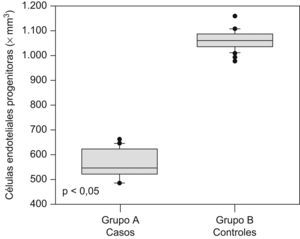
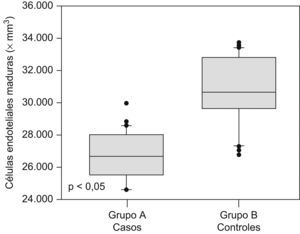
Las cantidades de células endoteliales maduras y progenitoras se muestran en la tabla 2. Se encontraron diferencias estadísticamente significativas en las cantidades de células endoteliales progenitoras (562,6+56,3 × 106/l en el grupo A comparado con 1.057,9±37,1×106/l en el grupo B; p<0,05; figura 1) y en las cantidades de células endoteliales maduras (26.670,2+1.440,3×106/l en el grupo de preeclámpticas comparado con 30.797,3+2.085,6×106/l en el grupo de controles; p<0,05; figura 2).
Cantidades de células endoteliales progenitoras y maduras en las participantes del estudio
| Grupo A | Grupo B | p | |
| Preeclámpticas (n=35) | Controles (n=35) | ||
| Células endoteliales progenitoras, ×106/l | 562,6±56,3 | 1.057,9±37,1 | <0,05 |
| Células endoteliales maduras, ×106/l | 26.670,2±1.440,3 | 30.797,3±2.085,6 | <0,05 |
Los hallazgos de esta investigación demuestran que las pacientes con preeclampsia presentan una disminución en las cantidades de células endoteliales maduras y progenitoras comparada con embarazadas normotensas.
El embarazo representa un reto fisiológico a los sistemas que dependen de la adaptación y plasticidad exitosa del endotelio. Es posible que las células endoteliales maduras y progenitoras contribuyan a los cambios en la adaptación del sistema cardiovascular. Tanto la neoangiogénesis, especialmente del lecho vascular uteroplacentario, como la vasodilatación de los vasos existentes contribuyen a estos cambios adaptativos16. El conocimiento actual con relación a la función de estas células en mujeres no embarazadas, al igual que el papel del endotelio en la adaptación cardiovascular al embarazo, sugiere que las células endoteliales pueden estar involucradas en esta adaptación16,17.
Debido a que las células endoteliales proliferan en forma marcada y se movilizan en la sangre periférica durante la fase lútea comparada con la fase folicular, se considera que juegan un papel crucial en el crecimiento vascular del endometrio en la preparación para la implantación. Aunque el mecanismo regulador de las células endoteliales no está claro en los órganos reproductivos, los estrógenos aceleran en parte la reparación endotelial de las arterias lesionadas mediante un mecanismo relacionado con el óxido nítrico8,18. Además, los estrógenos estimulan la neovascularización placentaria a través de la activación de factores angiogénicos en el útero durante el embarazo. La función de las células endoteliales ha sido descrita como un proceso de tres pasos: a) movilización desde la medula ósea; b) llegada al sitio de la lesión, y c) adhesión o incorporación a la zona. Cada una de estas fases es afectada por factores endógenos y puede ser modificada por la administración de agentes exógenos9.
La preeclampsia está caracterizada por isquemia y disfunción vascular de la circulación uteroplacentaria. Las células endoteliales en la sangre periférica son movilizadas para aumentar la neovascularización en las zonas de isquemia7,19. Múltiples líneas de investigación han propuesto al endotelio como el punto central de la fisiopatología de la preeclampsia20. Los cambios histológicos, los marcadores circulantes de la activación endotelial y los estudios funcionales in vitro apoyan este hecho16. Existe evidencia de que la disfunción endotelial proviene de la determinación de la respuesta presora característica del embarazo normal21, la activación de las células endoteliales umbilicales humanas posterior a la exposición al suero de preeclámpticas22 y las alteraciones en la vasodilatación en las pacientes con preeclampsia23. La disfunción endotelial descrita potencia la relación entre las células endoteliales y la preeclampsia. Las cantidades anormales durante o antes del embarazo pueden llevar a alteraciones de la reparación, lesión persistente o acelerada que conllevan a los cambios patológicos observados en la preeclampsia16.
Al igual que los hallazgos encontrados en esta investigación, Sugawara et al19 demostraron que las preeclámpticas tenían una menor cantidad de células endoteliales al compararlas con controles sanos y encontraron un aumento en el envejecimiento celular. Además, Kim et al24 también encontraron una disminución en las células endoteliales de pacientes con preeclampsia. Luppi et al25 demostraron que las células estaban significativamente más bajas en las pacientes preeclámpticas en comparación con las embarazadas normales y que el número de células endoteliales maduras circulantes no era estadísticamente diferente a aquellas que nunca habían estado embarazadas. Xia et al26 también encontraron una disminución significativa y alteraciones en la capacidad de proliferación, migración y vasculogénesis en las células endoteliales progenitoras en la sangre venosa placentaria/fetal en las preeclámpticas en comparación con los controles.
En contraste con los estudios descritos previamente, Matsubara et al7 reportaron que las cantidades de células endoteliales en la sangre periférica de las pacientes preeclámpticas no eran diferentes de las cantidades de las embarazadas normales durante el tercer trimestre. La posible diferencia puede estar en el subtipo de células endoteliales analizadas.
Hasta la fecha se desconoce si la disminución de las células endoteliales es una causa o una consecuencia de la enfermedad. Es posible que el agotamiento debido a su función de compensación del daño endotelial pueda afectar el número de células endoteliales. En la preeclampsia se incrementa la producción de citoquinas inflamatorias, posiblemente por la presencia de condiciones hipóxicas sobre la placenta o por una respuesta inflamatoria sistémica secundaria27,28. Además, la presencia del factor 1 derivado de la célula estromal, que es importante para la selección de las células endoteliales29, es estimulada por la hipoxia tisular a través de la acción del factor 1 inducible por la hipoxia30.
Se ha observado la presencia de estrés oxidativo y alteraciones de los lípidos en preeclámpticas, los cuales pueden estar relacionados con la disfunción endotelial sistémica31–33. Imanishi et al34 han sugerido que la lipoproteína de baja densidad (LDL) oxidada induce alteraciones en las células endoteliales. Además, diferentes investigaciones sugieren que las concentraciones de proteína C reactiva, un marcador de inflamación sistémica, pueden tener efectos sobre la disfunción vascular en la preeclampsia35,36. Se ha demostrado que la proteína C reactiva inhibe la diferenciación, proliferación y función de las células endoteliales37,38. Es posible que la LDL oxidada y la proteína C reactiva en las preeclámpticas produzcan alteraciones de las células endoteliales que puedan llevar a daño endotelial.
El papel de las células endoteliales maduras y progenitoras en la preeclampsia es desconocido. Aún no está claro si las diferencias en las cantidades de células endoteliales maduras y progenitoras son una causa o una consecuencia de la preeclampsia. Sin embargo, existe evidencia de que las pacientes con diabetes mellitus preconcepcional tienen una mayor tendencia a desarrollar preeclampsia. Se ha reportado que la disfunción endotelial observada en los diabéticos está asociada a modificaciones en las células endoteliales14, lo cual sugeriría que esta alteración puede ser uno de los factores contribuyentes principales a la patogénesis de la preeclampsia10. Estas alteraciones en número y función de las células endoteliales podrían ser la vía común que relaciona los factores de riesgo cardiovascular y la disfunción endotelial con la preeclampsia12.
En conclusión, las preeclámpticas presentan reducción significativa en las cantidades de células endoteliales maduras y progenitoras en comparación con las de embarazadas normotensas sanas.