Revisar nuestra experiencia en el manejo de pacientes posmenopáusicas diagnosticadas y tratadas de cáncer de mama.
Material y métodosSe ha realizado estudio descriptivo retrospectivo de 903 pacientes con cáncer de mama entre 1992 y 2008. Se seleccionó a las pacientes posmenopáusicas: 568 (62,90%). Se analizaron factores como edad, paridad, antecedentes familiares y personales, tipo de cáncer, tipo de cirugía, resultados a.p., estadio, tratamientos complementarios y seguimiento. Se ha realizado estudio estadístico mediante SPSS 15.0.
ResultadosLa edad media fue 65,26±0,46 (40–95) años. Solo en 117 (20,59%) pacientes existían antecedentes familiares de cáncer de mama. En 312 casos (54,92%) existían factores de riesgo epidemiológico. Eran nuligestas 55 pacientes (9,68%). El motivo de consulta más frecuente fue la palpación de un nódulo 328 (57,7%). Se emplearon diferentes métodos diagnósticos por imagen, siendo la mamografía 420 (73,9%) el más utilizado. En 238 (41,90%) fue necesario estudio mediante biopsia intraoperatoria para confirmación histológica del diagnóstico. El tratamiento neoadyuvante fue empleado en 63 casos (11,09%). El tratamiento quirúrgico como tratamiento inicial fue realizado en 505 casos (88,90%). Pudo realizarse cirugía conservadora en 225 (39,61%) casos. El tipo histológico más frecuente fue el carcinoma ductal infiltrante en 380 (66,9%) pacientes. El número de ganglios fue 12,41±0,26(1–36). La hormonoterapia se pautó en 333 (58,62%), siendo el tamoxifeno el más empleado, en 230 (69,1%).
ConclusionesEl incremento de la edad conlleva un aumento de la patología oncológica mamaria. El diagnóstico en estas pacientes es mayoritariamente clínico. Los tratamientos en estas pacientes son menos conservadores debido al diagnóstico en estadios más avanzados.
To review our experience in the management and treatment of postmenopausal women with breast cancer.
Material and methodsA descriptive and retrospective study was performed in 903 women with breast cancer between 1992 and 2008. A total of 568 (62.90%) menopausal women were selected. The factors studied included age, parity, familial and personal history, type of cancer, type of surgery, pathological findings, stage, complementary treatments and follow-up. Statistical analysis was performed using the SPSS statistical package version 15.0.
ResultsThe mean age was 65.26±0.46 (40–95) years. Familial breast cancer was found in only 117 patients (20.59%) patients. Epidemiological risk factors were found in 312 (54.92%). Nulliparity was found in only 55 patients (9.68%). The most frequent reason for consultation was palpation of a nodule in 328 (57.7%). Distinct imaging procedures were used, the most frequent being mammography in 420 (73.9%). Intraoperative biopsy was required for histological confirmation of the diagnosis in 238 (41.90%). Neoadjuvant treatment was indicated in 63 patients (11.09%). Surgical treatment was the first step in 505 women (88.90%). Conservative surgery was feasible in 225 (39.61%) patients. The most frequent histological type was infiltrating ductal carcinoma cancer in 380 (66.9%) patients. The mean number of nodes was 12.41±0.26 (1–36). Hormonotherapy was used in 333 (58.62%), the most widely used being tamoxifen in 230 (69.1%).
ConclusionsIncreased age is associated with a greater risk of breast cancer. Diagnosis in these patients is mainly clinical. Conservative treatment is infrequent in these patients as tumors are usually diagnosed in the more advanced stages.
El cáncer de mama es el tumor maligno más frecuente entre las mujeres de todo el mundo y la primera causa de muerte por cáncer entre las mujeres españolas (Ministerio de Sanidad y Consumo, 1998) seguido del colorrectal, estómago, páncreas y pulmón1.
Se sabe que una de cada 8 mujeres desarrollará un cáncer de mama invasivo a lo largo de su vida [datos: Asociación Española Contra Cáncer (AECC), 2006].
La mayoría de las mujeres diagnosticadas de cáncer de mama no presentan ningún factor de riesgo y tampoco historia familiar de cáncer de mama. Solo el 15–20% de todos los cánceres de mama están asociados con historia familiar de cáncer de mama y ovario familiar2,3.
En las últimas décadas los programas de detección precoz4 y los avances terapéuticos han logrado que la mortalidad por cáncer de mama disminuya a un ritmo de 1,4% anual y eso a pesar de que la incidencia continúa aumentado a un ritmo 1–2% anual1.
Se diagnostican 1,2 millones de casos nuevos de cáncer de mama al año y se estima que unas 400.000 mujeres mueren anualmente por esta causa. En España la incidencia refleja 15.979 casos anuales y 6.000 fallecimientos2.
Cuando se han comparado diferentes grupos en función de la edad, las tasas de incidencia son más altas en edades por encima de la menopausia5.
El cáncer de mama aumenta con la edad, existe una pendiente máxima alrededor de los años perimenopáusicos y luego un pico entre los 75–79 años. El cambio de la tendencia a esta edad puede estar sesgado por la disminución del screening mamográfico, sobre todo en pacientes ancianas por encima de 80 años6.
A pesar del aumento de incidencia en los últimos años, la mortalidad ha disminuido por la mejora en los métodos diagnósticos de detección precoz y por el empleo más generalizado de tratamientos adyuvantes7.
Por otro lado, se ha sugerido que el embarazo a edades tempranas, la lactancia prolongada, ovariectomías por debajo de 35 años, la práctica del ejercicio físico diario, la abstinencia del alcohol y la dieta pobre en grasas son factores epidemiológicos que pueden contribuir a disminuir el riesgo de desarrollar cáncer de mama8.
El objetivo de este trabajo ha sido revisar nuestra experiencia (en Hospital Universitario Príncipe de Asturias, Alcalá de Henares, Madrid) en el manejo de aquellas pacientes que han sido diagnosticadas y tratadas de cáncer de mama desde enero de 1992 a agosto de 2008 y cuyo estado menstrual era la menopausia en el momento del diagnóstico.
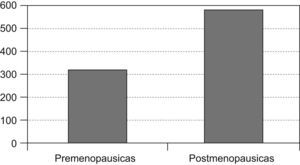
Material y métodosSe ha realizado un estudio descriptivo retrospectivo de 903 pacientes que han sido diagnosticadas de cáncer de mama en nuestro centro (Servicio de Ginecología y Obstetricia del Hospital Universitario Príncipe de Asturias, Alcalá de Henares, Madrid) desde enero de 1992 hasta agosto de 2008. Las pacientes fueron clasificadas según el estado menstrual: 335 (37,2%) premenopáusicas y 568 (62,9%) posmenopáusicas.
En este trabajo se han valorado únicamente las pacientes cuyo estado menstrual en el momento del diagnóstico era la menopausia. Las pacientes derivadas a otros centros para biopsia selectiva del ganglio centinela (BSGC) o cirugía oncoplástica de reconstrucción inmediata se han excluido de este trabajo.
Nuestro servicio se encuentra adscrito al Hospital Universitario Príncipe de Asturias, en Alcalá de Henares, pertenece al área sanitaria 3 de Madrid y cubre una población que ronda los 400.000 habitantes. El hospital público cuenta con 590 camas, de las cuales 60 corresponden a la especialidad de obstetricia y ginecología.
El diagnóstico del cáncer de mama se realiza en consultas externas de área [centros de Atención Especializada de Torrejón de Ardoz y de Alcalá de Henares o canalizado a través del screening precoz realizado por la Asociación Española contra el Cáncer (AECC)]. Las pacientes con diagnóstico de sospecha de cáncer de mama se remitieron a consulta de ginecología oncológica, situada en el hospital, donde se procedió a realizar un estudio de extensión preoperatorio, que consistió en analítica general, marcadores tumorales, biopsia de aguja gruesa (BAG), pruebas radiológicas complementarias [radiografía de tórax, ecografía hepatoabdominal, resonancia (RMN) de mamas], ECG, gammagrafía ósea y valoración preanestésica. Se explicó mediante consentimiento informado el tipo de cirugía o tipo de tratamiento propuesto.
Si la paciente era candidata a tratamiento neoadyuvante se presentaba en el Comité de Tumores de nuestro centro (compuesto por miembros del Servicio de Ginecología, de Oncología y por anatomopatólogos y radiólogos). La quimioterapia fue prescrita en nuestro centro, la radioterapia fue valorada y administrada en hospital de referencia (La Princesa) y la hormonoterapia fue prescrita indistintamente en nuestro servicio o en el de oncología.
Una vez completados los tratamientos adyuvantes fueron de nuevo remitidas a consulta de ginecología oncológica donde se realiza seguimiento con visitas semestrales hasta el 5.º año y anuales a partir del 5.º año. Nuestro protocolo incluye la realización de analítica general, marcadores tumorales y radiografía semestral (primeros 5 años) y mamografía, exploración ginecológica y citología anual. Todo ello puede complementarse con pruebas específicas en función de hallazgos o clínica de las pacientes.
Se diseño una base de datos en Access (la recogida fue realizada introduciendo los datos tras la intervención quirúrgica en la 1a visita tras postoperatorio) y se transfirieron los datos al programa SPSS 15.0 para poder realizar un análisis informático y un estudio estadístico de los datos. Se han analizado diferentes variables que han sido clasificadas en datos epidemiológicos (edad al diagnóstico, antecedentes personales epidemiológicos de riesgo, antecedentes familiares, paridad, número de hijos, estado menstrual), datos del diagnóstico [existencia de clínica y tipo en el momento del diagnóstico, realización de diferentes pruebas complementaria radiológicas (eco, mamografía, RMN y estudio anatomopatológico) marcadores, datos de la cirugía (tipo histológico, tamaño, afectación ganglionar, estudio inmunohistoquímico, tipo de receptores) y datos de seguimiento (tipo de tratamiento, duración, recidiva, lugar, meses de seguimiento)].
En primer lugar, se realizó un estudio descriptivo: se estudiaron las variables cualitativas mediante cálculo de frecuencias absolutas y relativas. En las variables cuantitativas se calcularon las medidas de tendencia central (media, mediana y moda), así como de dispersión (desviación típica varianza y recorrido intercuartílico).
La significación estadística fue definida para p<0,05. Se han estudiado y comparado las diferentes variables a través de contrastes. El análisis de supervivencia ha sido estudiado mediante la aplicación de Kaplan-Meier.
ResultadosDatos epidemiológicosLa edad media al diagnóstico fue de 65,26±0,46(40–95) años.
La edad media en que dichas pacientes presentaron la menopausia fue 49,05±0,22(20–59) años.
La edad media en que habían tenido su menarquia fue 12,60±0,13(9–18) años.
Habían tenido hijos 513 pacientes (90,3%), con más de un hijo 468 pacientes (82,39%) y eran nulíparas 55 (9,68%) pacientes.
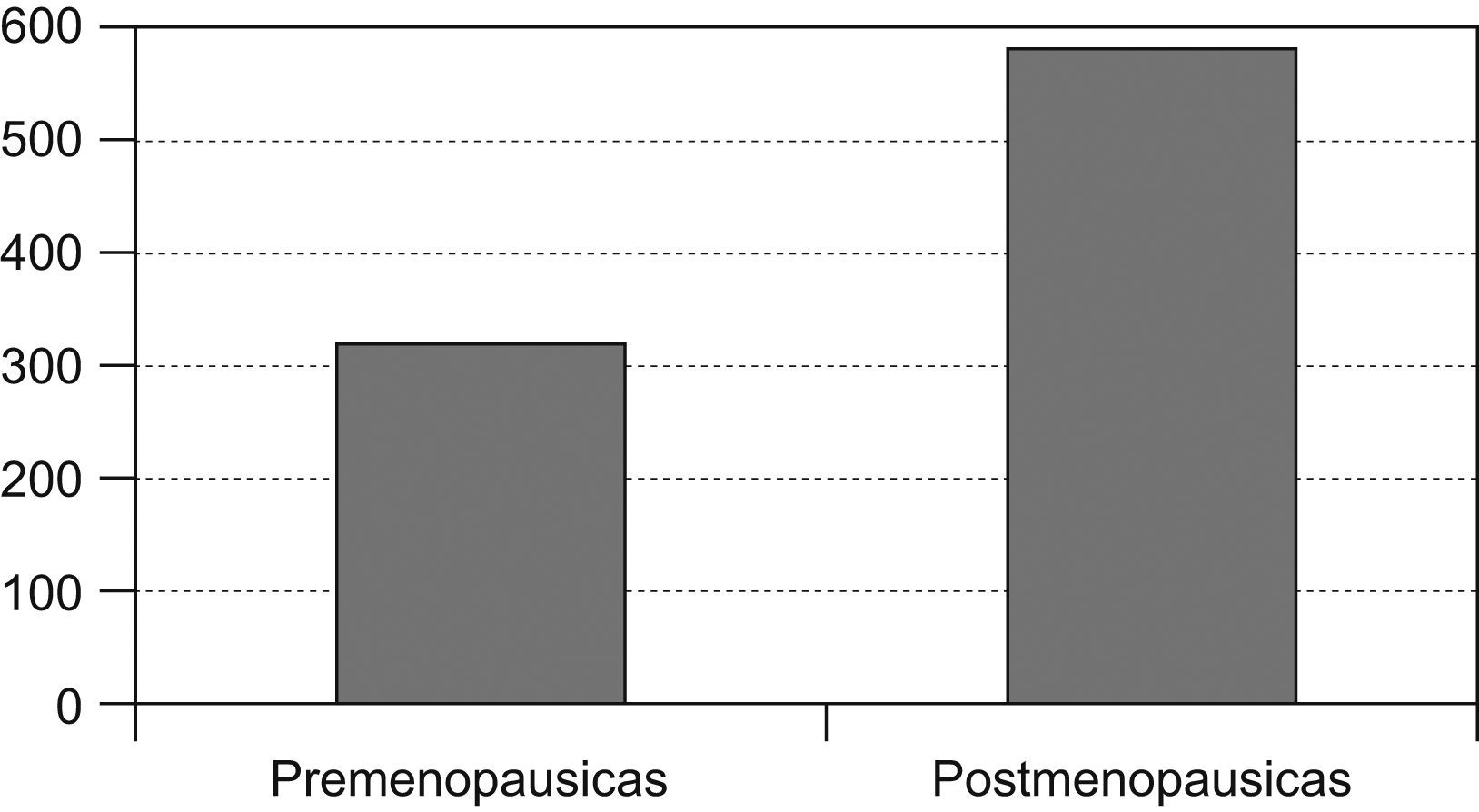
Las pacientes posmenopáusicas con cáncer de mama fueron 568 (representan el 62,9% de la población estudiada en nuestra área) y 335 las pacientes premenopausicas, lo que representa el 37,1% (fig. 1).
No existían antecedentes familiares de cáncer de mama en 451 mujeres (79,40%).
Las pacientes presentaban antecedentes personales de interés en 312 casos (54,92%) que fueron clasificados en HTA, diabetes, obesidad, tratamiento hormonal sustitutivo, ingesta diaria de alcohol y procesos oncológicos concomitantes; en algunos casos, se asociaban varios de estos factores.
Datos de clínica y pruebas diagnósticasClínicaEl motivo de consulta más frecuente en estas pacientes fue la palpación de un nódulo: 328 (57,7%), seguido de la existencia de signos inflamatorios: 11 (1,9%), presencia de úlceras: 8 (1,4%), eczema: 5 (0,9%), mastodinia: 4 (0,7%), coexistencia de varios síntomas o signos: 22 (3,9%) y ausencia de sintomatología: 188 (33,1%).
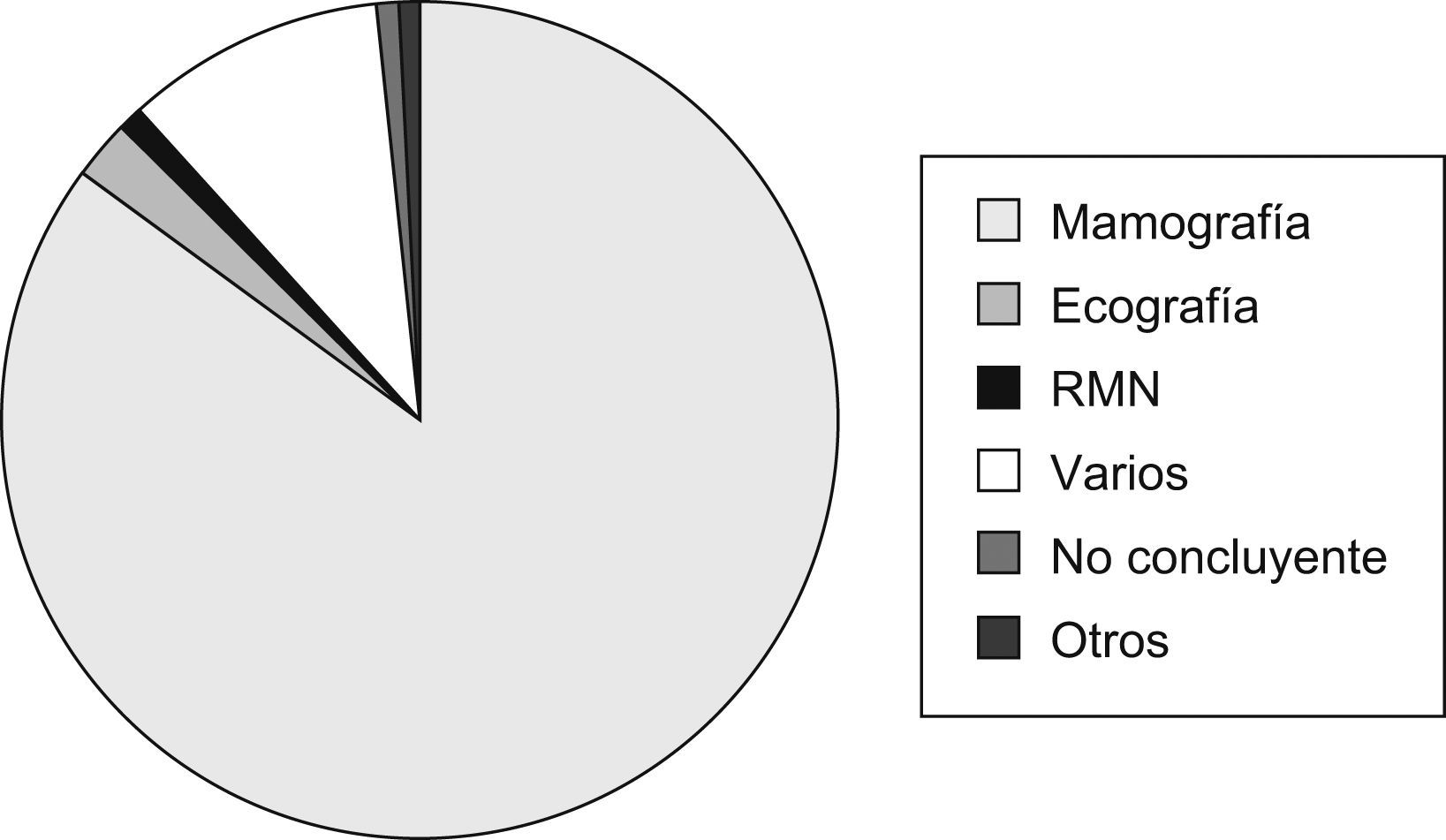
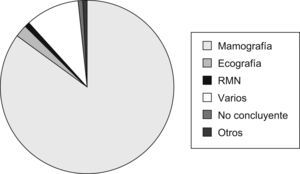
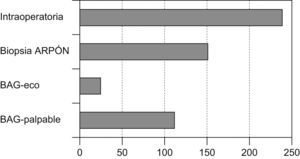
DiagnósticoMétodos de imagenSe emplearon diferentes técnicas o métodos diagnósticos por imagen que clasificaron a la paciente en «elevada sospecha de cáncer de mama», siendo la mamografía (420, 73,9%) el más utilizado (fig. 2).
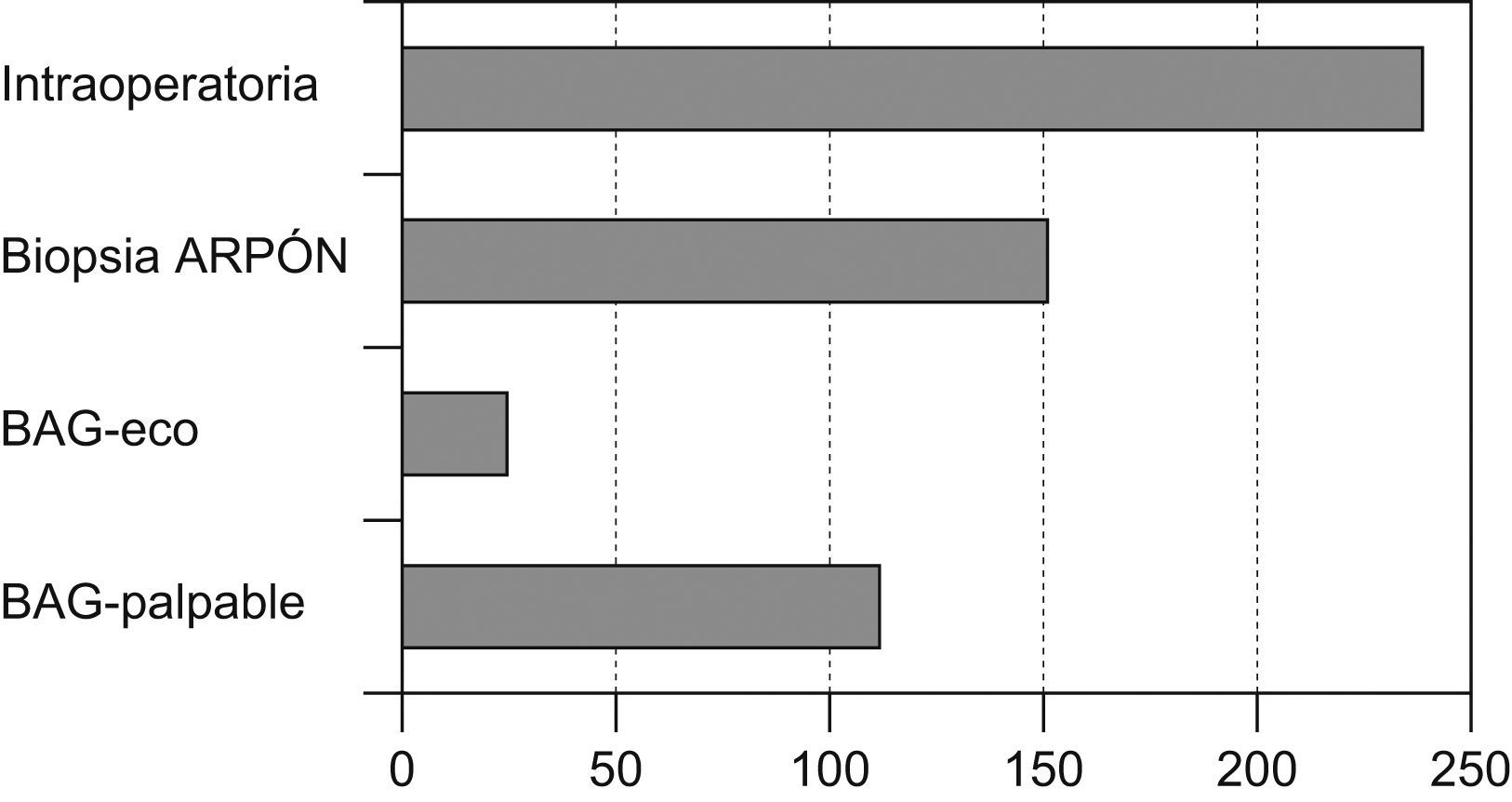
El método de diagnóstico definitivo (que conllevó a un diagnóstico preoperatorio anatomopatológico) pudo obtenerse en 330 casos (58,09%), en 238 fue necesario un estudio mediante biopsia intraoperatoria para tener la confirmación histológica del diagnóstico (fig. 3).
La RMN se emplea en nuestro medio desde el año 2002 como parte protocolizada del estudio preoperatorio. En las pacientes posmenopáusicas se realizó en 147 casos, y supuso un cambio en la actitud quirúrgica en 16 casos (2,8%).
El tamaño tumoral medio en el momento del diagnóstico obtenido por las diferentes pruebas de imagen fue: Mamografía: 22,78±1,13(0–260)mm. Ecografía: 20,47±0,98(0–80)mm. RMN: 20,18±0,91(0–60)mm.
No se obtuvieron diferencias significativas al comparar ambos grupos (p=0,38).
Marcadores tumoralesSe determinó preoperatoriamente, en el momento del estudio de extensión, previo a la cirugía o al tratamiento neoadyuvante, el marcador CEA y Ca 15, 3.
Los resultados de ambos fueron: CEA: 3,60±1,6(1,1–444). Ca 15,3: 30,90±10,12(18–2200).
Fue empleada en 63 casos, lo cual representa el 11,09% de la población posmenopáusica con cáncer de mama. La quimioterapia neoadyuvante fue utilizada en 45 casos (7,9%). La radioterapia neoadyuvante se empleó en 5 casos (0,9%).
La hormonoterapia como tratamiento neoadyuvante fue usada en 13 casos (2,3%), siendo el tamoxifeno administrado en 6 casos (46,15% del tratamiento hormonal neoadyuvante) y los inhibidores de la aromatasa (IA) en 7 (53,84%); de ellos, el más utilizado fue el letrozol.
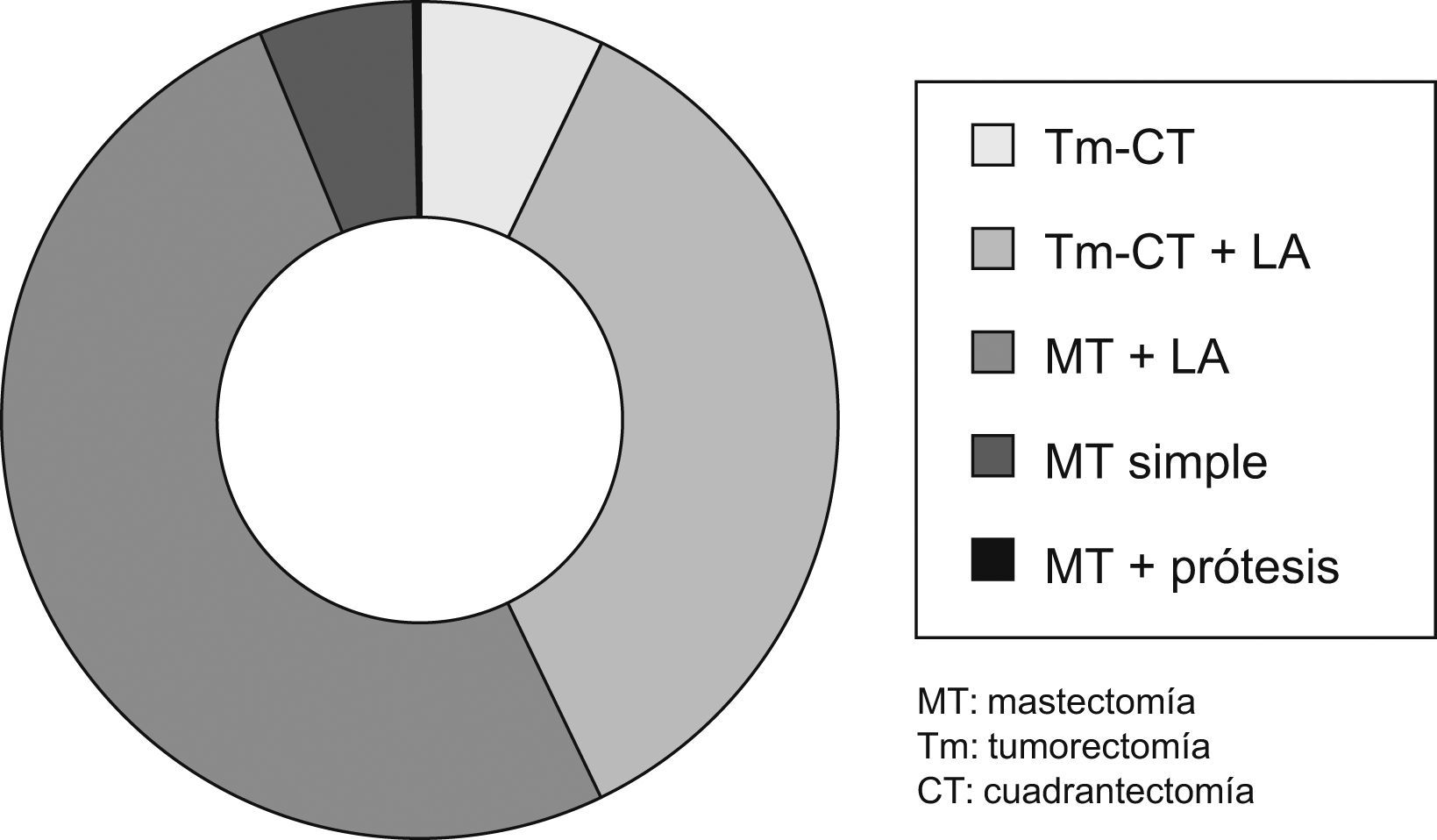
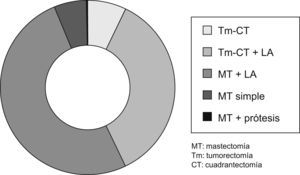
Tratamiento quirúrgicoComo tratamiento primario o inicial, fue realizado en 505 casos (88,90%).
Se pudo realizar una cirugía conservadora en 225 casos (39,61%).
La linfadenectomía se realizó en 452 pacientes (79,57%) (fig. 4).
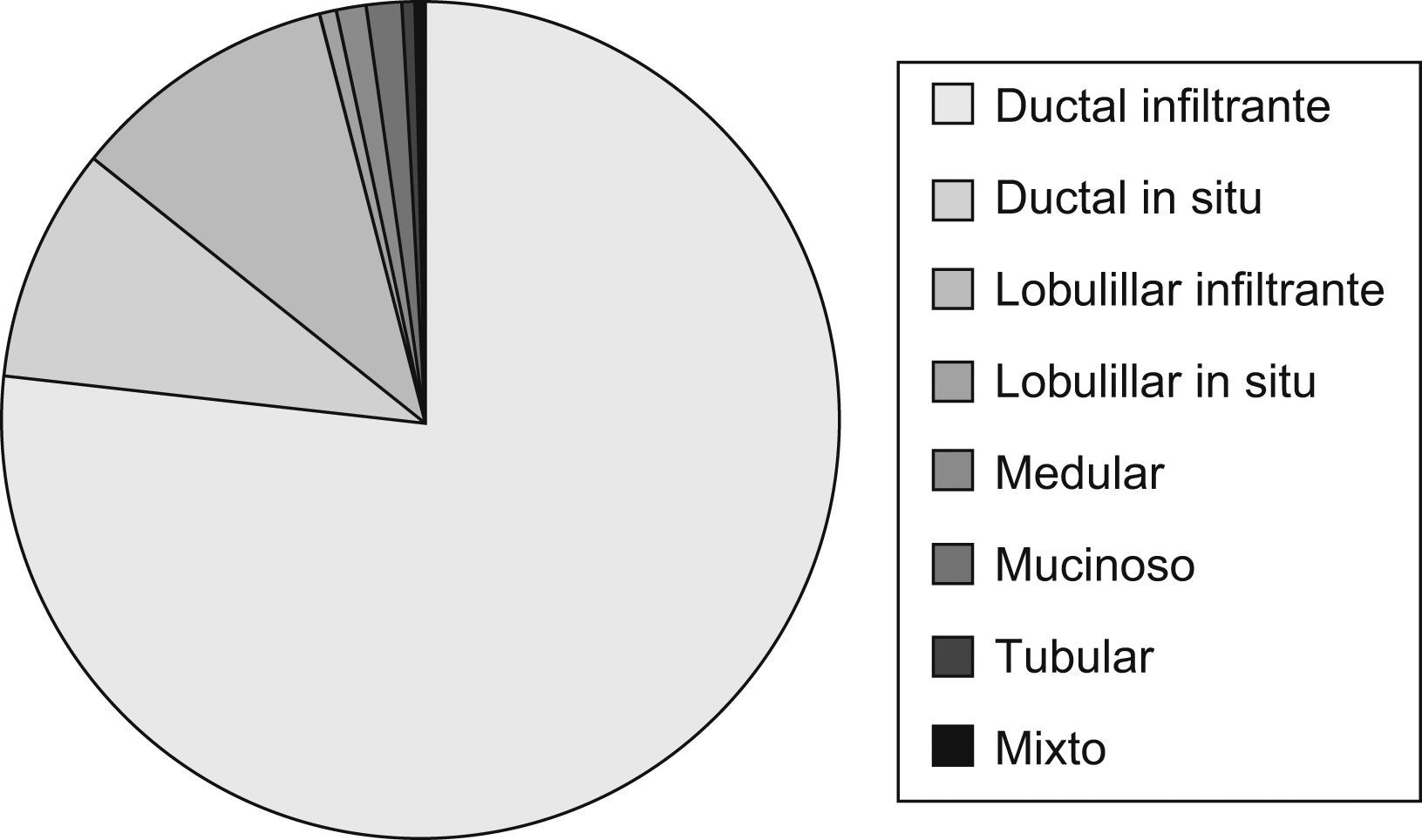
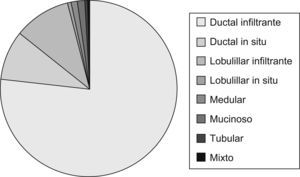
Datos de estudio anatomopatológicoEstudio histológicoEl tipo histológico está expresado en (fig. 5).
Grado de diferenciaciónLos diferentes tumores fueron clasificados siguiendo sistema de estadificación en:
G1: bien diferenciado (26%); G2: moderadamente diferenciado (52%); G3: pobremente diferenciado (22%).
N.º gangliosSe realizarón 452 linfadenectomías axilares; lo cual implica el 79,57% de la población estudiada. El número de ganglios medios obtenido fue de 12,41±0,26(1–36). El estudio patológico de los ganglios fue negativo en 208 pacientes, lo que implica que en el 46,01% de las pacientes intervenidas con linfadenectomía axilar no existía afectación a este nivel. Se objetivó afectación de dichos ganglios en 244 casos (lo que supone el 53,98% de las linfadenectomías realizadas). En estas pacientes la afectación ganglionar media fue de 2,11±1,99(1–27) ganglios afectos.
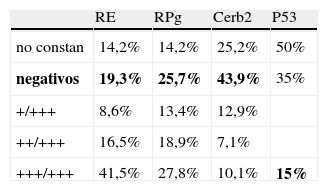
Estudio inmunohistoquímicoLa determinación de los diferentes receptores y marcadores pronósticos ha sido la siguiente tabla 1.
Tratamiento adyuvanteTipoSe han administrado diferentes tratamientos complementarios o adyuvantes a la cirugía.
La radioterapia fue precisa en 271 casos (47,71%).
La quimioterapia, en 253 (44,5%); en un 10% de los mismos se asoció terapia con anticuerpos monoclonales (trastuzumab).
La hormonoterapia se pautó en 333 (58,62%) de las pacientes.
De estas, el tipo de tratamiento hormonal más empleado fue el tamoxifeno en 230 (69,1%), IA en el 29% y faslodex en el 1,7%.
Tiempo y secuencia de tratamiento hormonalSe inició tratamiento con tamoxifeno sin realizar cambios posteriores en el 39% de dichas pacientes. Cuando se realizó el switch o cambio a un inhibidor de la aromatasa, a los 2–3 años del inicio del tratamiento hormonal con tamoxifeno, por orden de frecuencia en su utilización, fueron letrozol en el 36%, anastrozol en el 17% y exemestano en el 8%. El tiempo medio de utilización del tratamiento hormonal con tamoxifeno fue de 45, 46+1,61(2–72) meses y con IA: 20,75−2,17(1–62) meses.
Seguimiento y supervivenciaMeses de seguimientoLa pacientes han tenido un periodo medio de seguimiento de 59,65±1,92(1–276) meses.
No se ha podido completar o realizar el seguimiento en 77 pacientes, las cuales no acudieron a su cita por razones no aportadas o cambiaron de centro de referencia.
Periodo libre de enfermedadLas pacientes que han presentado alguna alteración en su proceso de seguimiento (incluyendo marcadores elevados, recidiva a nivel local o metástasis) han tenido un periodo libre de enfermedad medio de 34,72±3,5(0–136) meses.
Supervivencia a los 5 añosEl 75,9% de las pacientes diagnosticadas de cáncer de mama siguen vivas a los 5 años del diagnóstico versus tratamiento en nuestra área.
RecidivasHan existido 11 recidivas a nivel de la mama (5 en la misma mama y 6 de ellas en la mama contralateral). Han existido 8 recidivas a nivel de la cicatriz., 2 recidivas a nivel clavicular y 4 a nivel axilar.
Bilateralidad5 eran bilaterales desde el comienzo del proceso tumoral.
Metástasis-lugarEn 104 casos (18,30%) han aparecido metástasis.
Los lugares en orden de frecuencia de aparición han sido: óseas en 32 (30,76%), pulmón en 28 (26,92%), cerebrales en 13 (12,5%), hepáticas 10 (9,6%), intestinales 2 (1,92%), ovario 2 (1,92%), combinación de varias 17 (16,34%).
Marcadores en recidivas o metástasisCEA: 20,88±12,13(0,5–447)
Ca 15,3: 127,82±4,61(7–1837)
Tratamiento de las recidivas o metástasisEl tratamiento empleado en recidivas cuando las pacientes fueron susceptibles de alguna forma paliativa fue la radioterapia en 41%, quimioterapia en 35% y cirugía en 24%. Cuando se han valorado la evolución de las recidivas, hemos constatado que fallecieron el 62,3%.
FallecimientoHan fallecido 89 pacientes. Considerando que de las 568 iniciales no se pudo realizar seguimiento en 77, han fallecido el 18,12% de las pacientes con revisiones en nuestra área posmenopáusicas y con cáncer de mama.
Relación fallecimiento con enfermedadCuando hemos podido estudiar las razón de la muerte hemos objetivado que en 27,4% de las pacientes fallecidas la causa no ha sido el cáncer de mama y si lo ha sido en un 72,6%.
SupervivenciaNo existieron diferencias entre el grupo pre y posmenopáusico respecto a la causa de la muerte relacionada con cáncer de mama (p=0,32) Tampoco hemos encontrado diferencias en la supervivencia global a 5 años. Si han existido más muertes en grupo posmenopáusico sin considerar la causa de la muerte.
DiscusiónEn nuestro centro la consulta de ginecología oncológica realiza el diagnóstico y seguimiento de todos los cánceres ginecológicos. De ellos, el cáncer de mama es el más frecuente.
Dentro de dichas pacientes, la edad avanzada y el estado postmenstrual, como es lógico, son factores asociados y hallados con frecuencia.
Además, en una gran parte de la población hemos visto asociados problemas de patología médica severa (probablemente en relación a la edad avanzada y al sobrepeso).
No se ha podido estudiar en este trabajo la relación directa con sobrepeso y problemas médicos, pero opinamos, como las revisiones encontradas en la bibliografía, que ambos factores se encuentran asociados con bastante frecuencia al cáncer de mama en mujeres mayores8.
Otros factores epidemiológicos asociados han sido la edad de la menarquia y la edad de la menopausia, sin encontrar diferencias con lo descrito en la literatura.
La nuliparidad es uno de los factores epidemiológicos que más se han asociado al desarrollo del cáncer de mama. En nuestra población esta cifra fue similar o incluso algo más baja que lo publicado en la bibliografía al respecto5.
La existencia de antecedentes familiares no ha sido muy alta, como corresponde al desarrollo del cáncer de mama en pacientes de edades no precoces donde su asociación no se presenta de una manera elevada.
El diagnóstico de sospecha en estas mujeres en la mayoría de los caso ha sido la presencia de un bulto o masa palpable; el diagnóstico o screening precoz en nuestra área incluye a las pacientes hasta 69 años, lo que lleva implícito un diagnóstico más tardío en líneas generales en las pacientes más mayores.
La mamografía ha sido la prueba diagnóstica más utilizada con alta correlación con los resultados patológicos definitivos. Consideramos, como otros autores9 que por encima de 40 años, debe realizarse en primer lugar una mamografía ante todo nódulo o clínica sospechosa de patología mamaria. La ecografía ha sido en muchos casos una herramienta complementaria, muy útil para el diagnóstico, de la mamografía y, en algunos casos (escasos) en que las lesiones no han podido objetivarse por mamografía, ha sido el método diagnóstico principal.
La RMN está protocolizada en nuestro centro desde su incorporación y es práctica habitual como parte del estudio preoperatorio y de extensión. Hemos valorado la existencia de focos multifocales o multicéntricos y la posibilidad de bilateralidad. Esto ha supuesto cambios en la decisión quirúrgica en algunos casos10.
El tamaño tumoral medio en diagnóstico por técnicas de imagen ha tenido una elevada correlación con diagnóstico definitivo anatomopatológico; el mejor método para correlacionar tamaño en nuestra experiencia radiológica ha sido la RMN, seguida de la ecografía de mama.
Los marcadores tumorales se extraen en el momento del estudio preoperatorio y durante el seguimiento, aunque las recomendaciones de la ASCO11 aconsejan su uso solo en los casos de recidivas, dado que no parece aumentar la supervivencia global. En nuestro centro hasta el momento se procede de manera protocolizada en las visitas de seguimiento para solicitarlos y nuestra experiencia es que, en muchos casos antes de la existencia de clínica los marcadores, ya se han comenzado a elevar, lo cual actúa como marcador precoz para búsqueda de posible metástasis.
El estudio patológico preoperatorio siempre que es posible se realiza con BAG (biopsia de aguja gruesa), aunque en algunos casos esto no ha sido posible, lo cual ha obligado a un estudio intraoperatorio informando a la paciente de las posibilidades prequirúgicas en función de los hallazgos. En todos los casos se tenía una PAAF positiva, que en nuestro centro no ha supuesto nunca un falso positivo.
La neoadyuvancia, en sus diferentes formas ha sido administrada en los cánceres localmente avanzados, incluyendo los inflamatorios, de manera similar a lo publicado en la literatura12–15, la tolerancia ha variado según el estado físico-psíquico de la paciente. La demanda de cirugía inicial consideramos que es más alta en el grupo de pacientes mayores tanto por su parte como por el consejo familiar.
El tipo de cirugía realizada en estas pacientes ha sido más radical que en los grupos de menor edad en nuestro centro. Consideramos que influyen los siguientes factores además de por supuesto el tamaño y extensión de la enfermedad. En primer lugar, que nuestro centro se encuentra a 32km del Servicio de Radioterapia de referencia, lo cual supone, sobre todo para las pacientes de más edad, un problema añadido a su enfermedad y expresan, ellas y sus familiares, su deseo de cambio de tipo de cirugía (más radical para evitar la radioterapia complementaria) en un alto número de casos16,17.
Los diferentes tipos histológicos estudiados han sido similares a los descritos en la literatura médica8. El más frecuente ha sido el ductal infiltrante. En el carcinoma in situ tras la realización de la cirugía, se ha valorado la clasificación de Van Nuys como método de clasificación de riesgo y de realizar ampliación quirúrgica (mastectomía o radioterapia según la puntuación establecida).
Con los resultados quirúrgicos (tanto de las característica del tumor, tamaño, tipo histológico, marcadores pronósticos, receptores hormonales, número y afectación ganglionar, etc.) y reunido nuestro Comité de Tumores, formado por anatomopatólogos, radiólogos, oncólogos médicos (en permanente contacto con oncología radioterápica de referencia) y ginecólogos (la mama en nuestro centro es competencia de nuestro servicio) se decide conjuntamente el tratamiento de cada paciente. En caso de precisar tratamiento adyuvante quimioterápico o radioterápico (tras la revisión en consulta de ginecología oncológica después de la cirugía e información sobre resultados quirúrgicos vs anatomopatológicos y la decisión del Comité, se deriva al Servicio de Oncología; si por el contrario no precisa otro tratamiento o va a necesitar hormonoterapia, se sigue en nuestra consulta.
El tratamiento oncológico con quimioterapia de primera línea más empleado ha sido el CMF (ciclofosfamida, metotraxate, 5-fluoracilo). Desde la incorporación del trastuzumab (herceptin) como tratamiento adyuvante en aquellos casos que presentan marcadores cerb2+ (se realiza FISH además de inmunohistoquímica) se asocia este tratamiento.
La radioterapia tanto de la mama como de la axila se establece en función, tamaño, afectación extracapsular, número ganglios afectos, edad, estado de paciente, siguiendo protocolos similares a los publicados por otros autores y también ha sido particularmente útil en algunos casos de recidivas o metástasis18–20.
El protocolo de seguimiento es similar al descrito en las diferentes sociedades científica, cada 6 meses los primeros 5 años y luego si todo normal anual. Cuando existen recidivas o metástasis la paciente es presentada de nuevo en comité y revalorada conjuntamente por Servicio de Oncología.
En las pacientes que ha podido realizarse tratamiento hormonal (RE+ y/o RPG +) el más utilizado ha sido el tamoxifeno. Aunque la tendencia actual en los grupos de riesgo (definidos en Consenso St. Gallen 2007) es iniciar la terapia con IA. Opinamos como en la literatura que los 3 IA son fármacos eficaces, sin poder exponer en nuestra experiencia, por el número de casos pequeño respecto otras series, diferencias entre los grupos. Las pacientes refieren artralgias y osteopatías frecuentes pero en general son toleradas y no suelen abandonar el tratamiento. Con el tamoxifeno hemos encontrado algún caso de cáncer de endometrio asociado al de la mama tras >2 años de inicio del mismo, y en todos los casos han sido estadios muy precoces y al menos teóricamente de buen pronóstico21,22.
Cuando se ha requerido una segunda línea de quimioterapia, la paciente ha pasado a seguimiento simultáneo por Servicio de Oncología.
En los casos de metástasis se ha establecido de nuevo el estudio de receptores hormonales y marcadores pronósticos y los tratamientos en función de los resultados han incorporado diferentes líneas de tratamiento.
Las recidivas en los tratamientos conservadores han ocurrido con mayor frecuencia en los 3 primeros años de seguimiento.
Las metástasis más frecuentes han aparecido a nivel óseo seguido de las pulmonares.
Las pacientes con problemas médicos de base han tenido una supervivencia menor, pero debido a la patología primaria. Nuestros resultados respecto a la supervivencia no han sido estadísticamente significativos respecto de las premenopáusicas si excluimos las causas atribuibles a factores de patología médica, que en un elevado número de casos, se asocian a edades avanzadas.
Siempre que la paciente, a pesar de la edad, presente un estado clínico bueno puede optarse por cualquiera de las opciones de manejo terapéutico aceptadas en el cáncer de mama. Dicho de otro modo, la condición posmenopáusica y edad avanzada aunque condicione el tratamiento no debe limitar ni excluir los más conservadores, siempre que lo desee la paciente23–26. Los tratamientos adyuvantes deben individualizarse según las características de las pacientes.
El tratamiento con tamoxifeno o con IA cuando la paciente acepte y tolere es una opción válida de manejo terapéutico independiente de la edad27–30.
Todas las decisiones deben tomarse en un equipo multidisciplinar, si es posible integrado en unidades de mama y con participación de todas las especialidades que realizan el tratamiento integral de la patología mamaria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.