El objetivo del estudio fue analizar el tratamiento quirúrgico recibido en pacientes octogenarias con cáncer de mama en un centro hospitalario de tercer nivel, analizar la calidad de vida de estas pacientes, así como la influencia del tratamiento en la supervivencia global.
Material y métodosSe ha diseñado un estudio de cohorte retrospectivo. Se han analizado los resultados del tratamiento recibido, calidad de vida y supervivencia desde 2011 hasta 2015, con seguimiento prospectivo.
ResultadosLa primera opción de tratamiento fue la cirugía en el 97% de los casos, a pesar de presentar elevadas comorbilidades según el índice de Charlson ajustado por edad. Más de la mitad de las pacientes respondieron a la pregunta sobre autopercepción de su salud como excelente, muy buena o buena (53%), observándose una tendencia a mayor supervivencia en estas pacientes. La mortalidad a los siete años fue del 46%. Sin embargo, la causa de la muerte estaba relacionada con el cáncer de mama solo en el 31% de los casos.
ConclusionesLa mayoría de las pacientes octogenarias de nuestra cohorte se sometieron a cirugía como tratamiento de primera línea y se mostraron satisfechas con los resultados. La calidad de vida y la buena autopercepción del envejecimiento son un objetivo clave en las pacientes de edad avanzada y deben tenerse en cuenta.
Es preciso realizar estudios analizando los resultados de la cirugía en pacientes de edad avanzada con cáncer de mama para mejorar la medicina basada en la evidencia y optimizar su tratamiento.
The study objective was to analyse the results of surgical treatment of breast cancer in octogenarian women and to analyse these patients’ quality of life and factors related to treatment and its influence on overall survival over a 7-year follow-up.
MethodsA cohort cross-sectional observational study was designed. We analysed the results of treatment of octogenarian women with breast cancer in the Hospital Germans Trias i Pujol from 2011 to 2015 with follow-up until February 2018.
ResultsThe first treatment option was surgery in 97% of cases, despite their having a high comorbidity burden according to the age-adjusted Charlson Index. More than half the patients responded to the question on self-perceived health that their health was excellent, very good or good (53%) and survival was higher in patients reporting good self-perceived health. Mortality at 7 years was 46%. However, the cause of death was related to cancer in only 31% of cases.
ConclusionsMost of the octogenarian patients in our cohort underwent surgery as the first-line treatment and were satisfied with it. Quality of life and good self-perception of aging are a key aim in older adult patients and should be considered.
Additional studies analysing results of surgery for breast cancer in older adult patients are warranted to improve evidence-based medicine and optimize treatment, thus enhancing their quality of life and increasing their survival.
El cáncer de mama es la neoplasia más frecuente en mujeres con 1.671.149 de nuevos casos estimados por año en todo el mundo1. En España es muy prevalente, diagnosticándose casi 30.000 neoplasias al año2, aunque cabe destacar que es inferior a la media de los 27 países europeos (88,3 vs. 108,8 por 100.000 persona-año)2. En nuestro país, los cuatro tipos de cáncer más comunes en las mujeres son el cáncer de mama (que representa el 28% de las pacientes), seguido por el cáncer de colon-recto (16,9%), el de cuerpo uterino (6,2%) y el de pulmón (6%)2.
El cáncer de mama aumenta con la edad3-7 observándose las tasas de incidencia más elevadas en las personas más longevas8-12. Por consiguiente, la edad es el principal factor de riesgo no modificable del cáncer de mama2. Este dato es particularmente significativo en vista de la evolución demográfica de la población occidental, dado que el aumento de la esperanza de vida es proporcional al aumento del número de pacientes de edad avanzada con diversas enfermedades malignas, previéndose un mayor número de pacientes de elevada edad que desarrollará cáncer de mama en los próximos decenios6,7,13-16. En consecuencia, comprender y abordar las disparidades en el cáncer de mama entre los pacientes de edad superior a 70 y 80 años es una prioridad clínica y de investigación urgente14,17.Existe una gran dificultad en definir un punto de referencia numérico para la categoría de «edad avanzada» cuando se analizan los datos clínicos13, ya que el término «paciente anciano» no está claramente definido en la literatura. La mayoría de los estudios sobre el tratamiento del cáncer de mama en este grupo de pacientes, se centran en mujeres mayores de 65 a 70 años, pero excluyen a las mayores de 80 años o están insuficientemente representadas6,13,16,18-21, por lo tanto, los resultados podrían no ser válidos para las pacientes octogenarias16,19,20,22. En consecuencia, las prácticas de tratamiento se basan en gran medida en datos de observación o en pruebas indirectas, derivadas de la extrapolación de los resultados de los ensayos de pacientes más jóvenes18, lo que dificulta la creación de un plan terapéutico para las pacientes octogenarias con cáncer de mama13.
El objetivo principal de este estudio fue analizar el tratamiento recibido por las mujeres octogenarias diagnosticadas y tratadas de cáncer de mama en el Hospital Germans Trias i Pujol desde 2011 hasta 2015, con seguimiento hasta febrero de 2018. Los objetivos secundarios fueron analizar la calidad de vida de las pacientes y determinar la supervivencia global, según el tratamiento recibido con un seguimiento de siete años.
Material y métodosPoblación de estudioSe realizó un estudio de cohorte retrospectivo, utilizando datos de la Unidad de Patología Mamaria del Hospital Germans Trias i Pujol (Barcelona, España), que es un centro oncológico público universitario de tercer nivel.
En cuanto a los criterios de inclusión, están todas las pacientes de 80 años o más, diagnosticadas mediante una biopsia de aguja gruesa con posterior análisis anatomopatológico de cáncer de mama. Desde el 1 de enero de 2011 hasta el 31 de diciembre de 2015 se registraron los datos del tratamiento recibido, la calidad de vida de las pacientes después del tratamiento, sus comorbilidades individuales en el momento del diagnóstico de cáncer y las características del tumor. Las pacientes fueron seguidas desde el inicio del estudio hasta el 28 de febrero de 2018, con registro de la mortalidad y sus causas. No hubo criterios de exclusión en pacientes mayores de 80 años.
Los datos fueron recogidos a través de un protocolo aprobado por el Comité de Ética en investigación clínica. Todas las participantes dieron consentimiento para la participación en el estudio.
VariablesSe realizó la revisión del tratamiento recibido: cirugía, tratamiento hormonal y/o tratamiento sistémico. Si la paciente tuvo tratamiento quirúrgico, se registró si consistió en cirugía conservadora de tejido mamario o mastectomía, así como si en la cirugía axilar se realizó biopsia selectiva de ganglio centinela (BSGC), linfadenectomía, o no se realizó ninguna cirugía axilar.Para evaluar la calidad de vida de las participantes del estudio, se utilizó la encuesta Short Form (12) Health Survey (SF-12)23 a todas las pacientes a las cuatro semanas después del inicio del tratamiento de primera línea (quirúrgico u hormonal) en la visita hospitalaria de seguimiento, o bien telefónicamente. Se agregó una pregunta adicional para evaluar la satisfacción de la paciente con la Unidad de Patología Mamaria del Hospital Germans trias i Pujol y el tratamiento recibido.
La comorbilidad de cada paciente se evaluó con el índice de Charlson ajustado por edad mediante una herramienta informática24.
Además, se recogieron datos sobre las características específicas del tumor: tipo histológico (carcinoma intraductal, carcinoma ductal invasivo, carcinoma lobulado invasivo, otros carcinomas), tamaño tumoral (T), afectación ganglionar (N), presencia de metástasis (M), grado nuclear (1,2,3) y expresión de receptores (receptor estrogénico y Her-2neu).
La supervivencia total fue definida como el tiempo desde el tratamiento inicial hasta el exitus. Se registraron las causas de muerte. Las pacientes fueron rastreadas a través de las visitas hospitalarias de seguimiento, sus historias clínicas hospitalarias y del centro de atención primaria o localizándolas a ellos o a sus familiares telefónicamente.
Análisis estadísticoEn este estudio se utilizaron análisis estadísticos descriptivos. Se obtuvieron las frecuencias absolutas y relativas de las características del paciente y del tumor, de los tipos de tratamiento recibido, de las respuestas al SF-12 y de las causas de mortalidad.
Las medidas de centralización tales como media y desviación estándar fueron utilizadas para describir edad, el índice de la comorbilidad de Charlson, y supervivencia total.
También se analizó la supervivencia en relación al tipo de tratamiento, el tamaño tumoral, la edad, las comorbilidades y la respuesta a la primera pregunta del SF-12, sobre la autopercepción de salud, mediante el análisis de Kaplan-Meier. La significación estadística había sido definida como un p bilateral menor de 0,05.
ResultadosResultados del tratamiento recibidoEntre el 2011 y el 2015, se diagnosticaron con cáncer de mama a 1.060 mujeres en la Unidad de Patología Mamaria del Hospital Germans Trias i Pujol. De estas pacientes, se identificaron 63 con una edad superior a 80 años (incluyendo nueve con más de noventa años) que representan el 5,9% del total de pacientes. De modo que la edad media de la población diana de nuestro estudio fue de 85 años (rango 80-96).
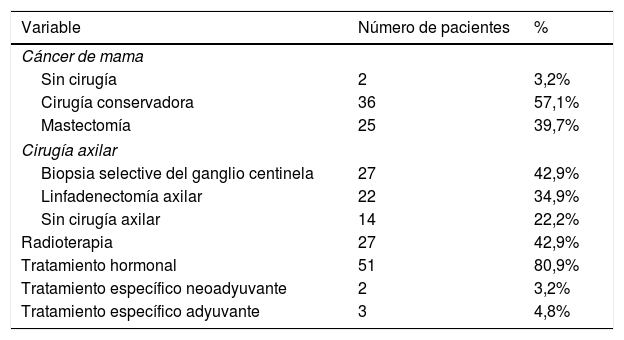
Las características del tratamiento recibido se muestran en la tabla 1. De las 63 pacientes, 61 fueron tratadas mediante cirugía como tratamiento primario y solo dos de ellas recibieron tratamiento hormonal primario de forma exclusiva. En cuanto a la técnica quirúrgica, se realizó una cirugía conservadora en casi el 60% de las pacientes y una mastectomía en alrededor del 40% de las pacientes.
Tratamiento recibido en pacientes octogenarias con cáncer de mama
| Variable | Número de pacientes | % |
|---|---|---|
| Cáncer de mama | ||
| Sin cirugía | 2 | 3,2% |
| Cirugía conservadora | 36 | 57,1% |
| Mastectomía | 25 | 39,7% |
| Cirugía axilar | ||
| Biopsia selective del ganglio centinela | 27 | 42,9% |
| Linfadenectomía axilar | 22 | 34,9% |
| Sin cirugía axilar | 14 | 22,2% |
| Radioterapia | 27 | 42,9% |
| Tratamiento hormonal | 51 | 80,9% |
| Tratamiento específico neoadyuvante | 2 | 3,2% |
| Tratamiento específico adyuvante | 3 | 4,8% |
Respecto a la cirugía axilar, se realizó BSGC en el 43% de las pacientes y linfadenectomía axilar en el 35% de ellas. No se realizó cirugía axilar en 14 pacientes (22,2%).
Como complemento del tratamiento local, 27 pacientes (42,9%) recibieron radioterapia. Referente al tratamiento sistémico, 51 pacientes (80,9%) recibieron tratamiento hormonal, aunque dos abandonaron su administración debido a los efectos adversos. Solo dos pacientes recibieron tratamiento neoadyuvante y solo tres recibieron tratamiento adyuvante después de la cirugía.
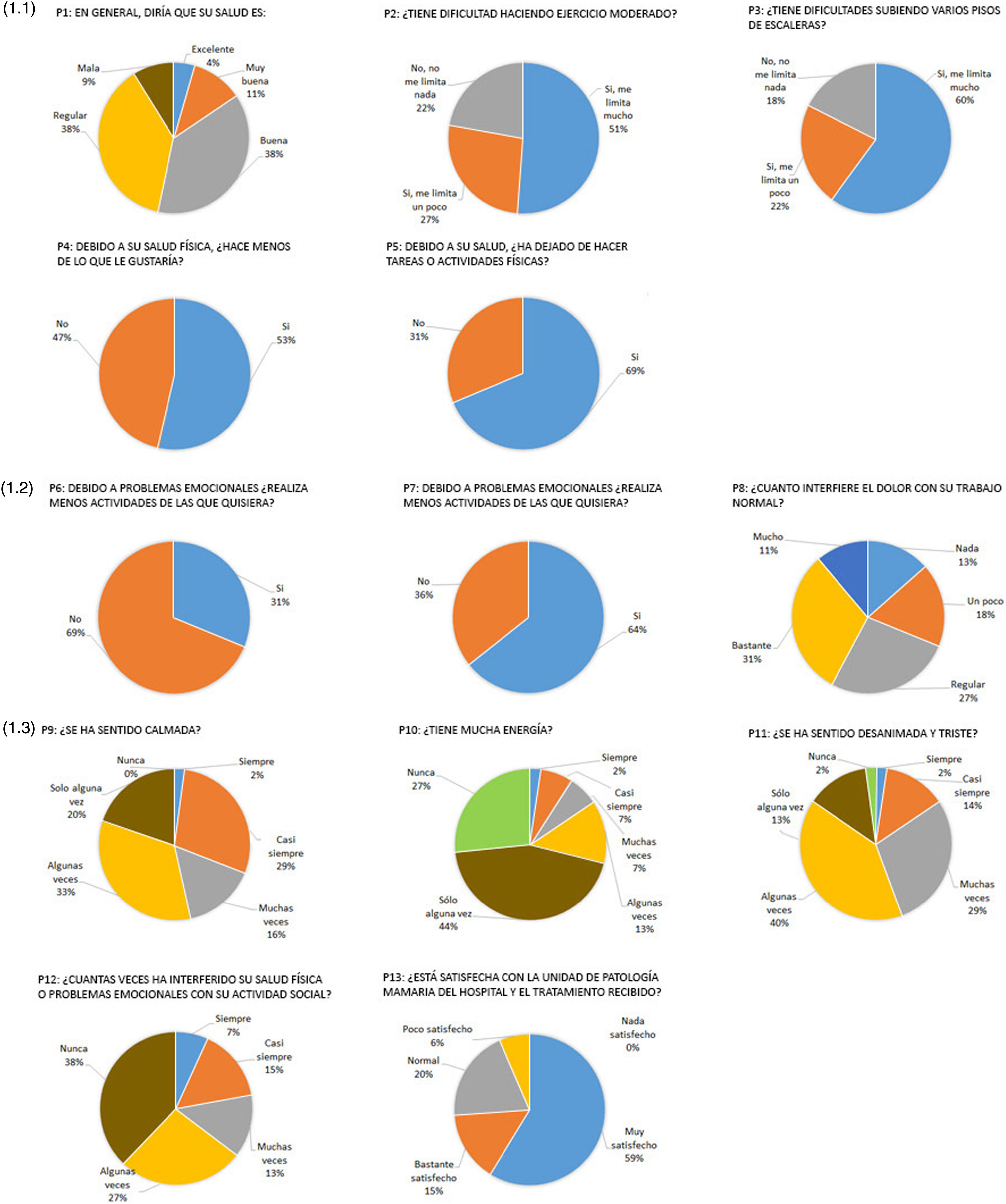
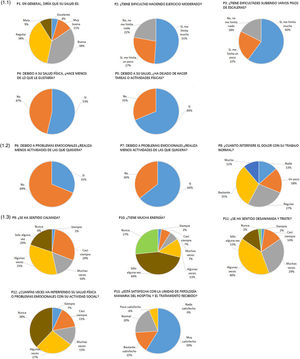
Resultados sobre la calidad de vidaEn nuestro estudio, el SF-12 mostró los siguientes resultados sobre la calidad de vida resumidos en la figura 1. Más de la mitad de las pacientes respondieron a la pregunta sobre su propia percepción de salud como excelente, muy buena o buena (53%) (fig. 1.1). Sin embargo, alrededor del 80% de las pacientes informaron que se sentían limitadas al realizar esfuerzos moderados o tenían dificultades para subir por las escaleras varios pisos. Casi el 70% de ellas tuvo que dejar de realizar ciertas tareas en su trabajo o algunas actividades diarias y el 53% hizo menos de lo que quería hacer debido a su salud física (fig. 1.1).En contraste con el estado físico, casi el 70% de las pacientes informaron que no presentaban ningún problema emocional que les impidiera realizar sus actividades, aunque el 64% no trabajaba o no podía realizar otras actividades como lo había hecho anteriormente y solo el 31% de las pacientes informó que el dolor obstaculizaba sus actividades diarias «un poco o nada», presentándose de forma «moderada, bastante o extrema» en un 69% (fig. 1.2).
Preguntas y respuestas de SF-12. (1.1) Primera pregunta del SF-12 sobre percepción de la propia salud y esfuerzo físico. (1.2) Preguntas sobre emociones, sensaciones y dolor. (1.3) Preguntas sobre el estado anímico, vida social y la unidad de patología mamaria del Hospital Germans Trias i Pujol.
Al responder a las preguntas relacionadas con su estado de ánimo en las últimas cuatro semanas, el 80% informó que se sentían tranquilas, pero el 70% tenían poca energía y el 85% se sentían desanimadas y/o tristes (fig. 1.3). No obstante, el 65% de las mujeres entrevistadas informaron que ni su salud física ni su estado de ánimo emocional obstaculizaban sus actividades sociales. Cabe destacar que el 94% de las pacientes entrevistadas se mostraron satisfechas con la Unidad de Patología Mamaria de nuestro centro y con el tratamiento recibido (fig. 1.3).
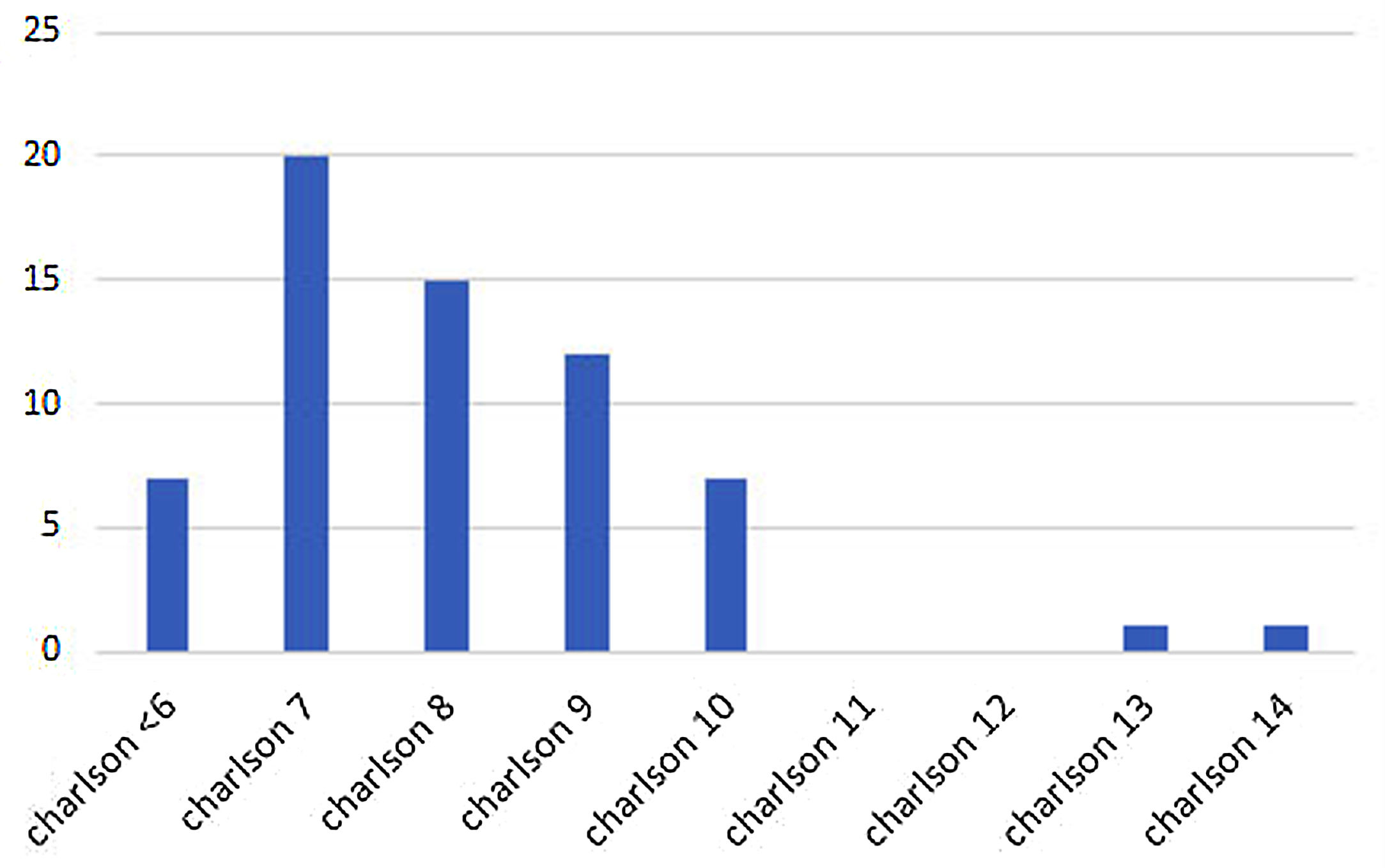
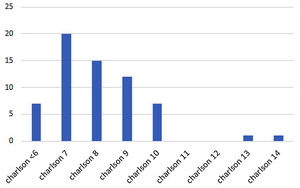
Resultados del análisis de comorbilidadLas pacientes de nuestro estudio tenían un alto número de comorbilidades, según el índice de Charlson ajustado por edad24, con una media de 8,15 puntos y una desviación estándar (DE) de 1,84 (fig. 2).
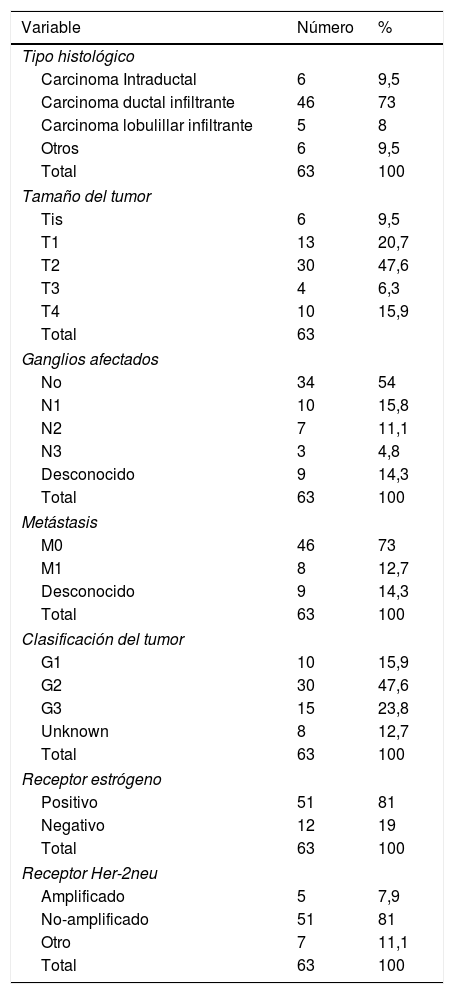
Resultados sobre las características biológicasLas características generales de los tumores estudiados en esta cohorte se muestran en la tabla 2. La mayoría de los tumores en este subgrupo de pacientes mayores de 80 años fueron carcinomas ductales infiltrantes (73%), de entre 2 y 5 cm de diámetro (47,6%), con un 54% de los casos sin afectación ganglionar (N0), sin metástasis a distancia (73% M0) grado tumoral 2 (47,6%), receptor de estrógeno positivo (81%) y receptor-2 del factor de crecimiento epidérmico humano no amplificado (HER2-) (81%).
Descripción de las características tumorales de las neoplasias de mama detectadas en pacientes octogenarias
| Variable | Número | % |
|---|---|---|
| Tipo histológico | ||
| Carcinoma Intraductal | 6 | 9,5 |
| Carcinoma ductal infiltrante | 46 | 73 |
| Carcinoma lobulillar infiltrante | 5 | 8 |
| Otros | 6 | 9,5 |
| Total | 63 | 100 |
| Tamaño del tumor | ||
| Tis | 6 | 9,5 |
| T1 | 13 | 20,7 |
| T2 | 30 | 47,6 |
| T3 | 4 | 6,3 |
| T4 | 10 | 15,9 |
| Total | 63 | |
| Ganglios afectados | ||
| No | 34 | 54 |
| N1 | 10 | 15,8 |
| N2 | 7 | 11,1 |
| N3 | 3 | 4,8 |
| Desconocido | 9 | 14,3 |
| Total | 63 | 100 |
| Metástasis | ||
| M0 | 46 | 73 |
| M1 | 8 | 12,7 |
| Desconocido | 9 | 14,3 |
| Total | 63 | 100 |
| Clasificación del tumor | ||
| G1 | 10 | 15,9 |
| G2 | 30 | 47,6 |
| G3 | 15 | 23,8 |
| Unknown | 8 | 12,7 |
| Total | 63 | 100 |
| Receptor estrógeno | ||
| Positivo | 51 | 81 |
| Negativo | 12 | 19 |
| Total | 63 | 100 |
| Receptor Her-2neu | ||
| Amplificado | 5 | 7,9 |
| No-amplificado | 51 | 81 |
| Otro | 7 | 11,1 |
| Total | 63 | 100 |
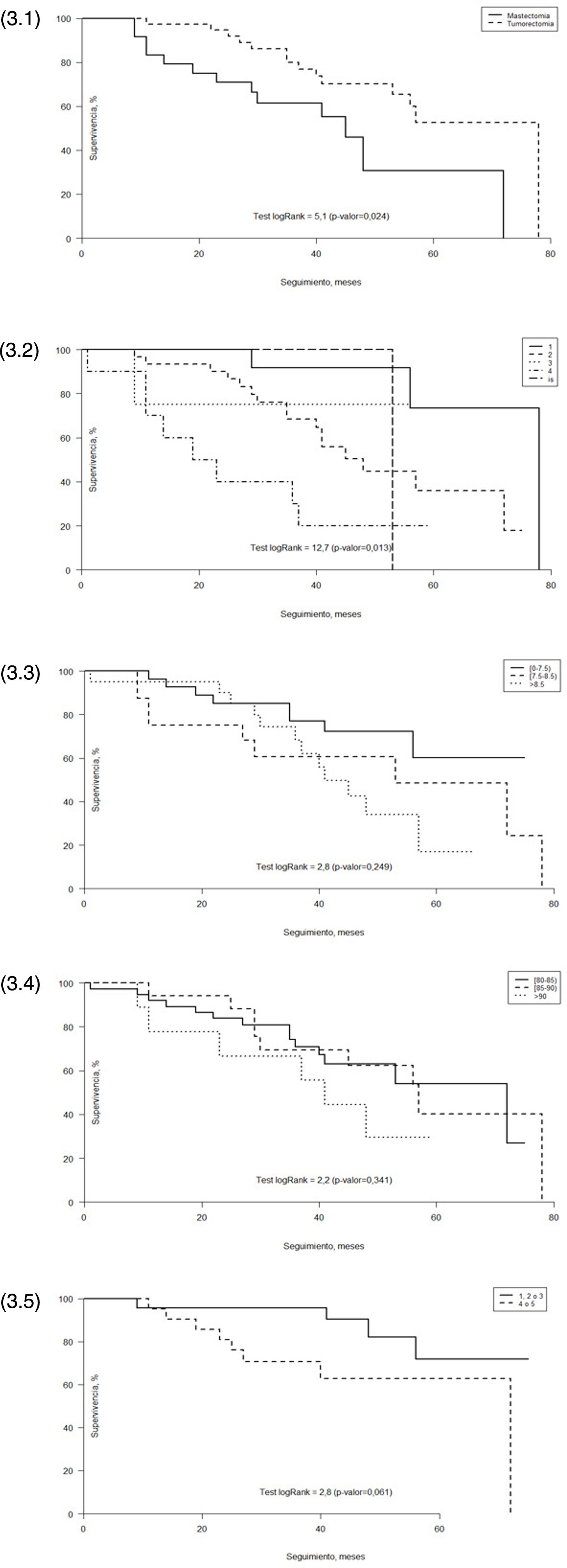
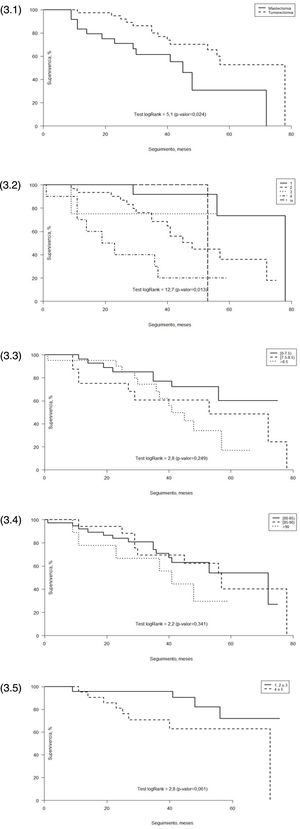
Con un seguimiento de 26 a 86 meses después del diagnóstico, se registraron 29 muertes (46%) hasta febrero de 2018. La media de supervivencia general de nuestro estudio fue de 39,4 meses y la causa de la muerte no estuvo relacionada con el cáncer de mama en 17 pacientes (59%), mientras que sí estuvo directamente relacionada con la neoplasia mamaria en nueve pacientes (31%) (fig. 3).
Análisis de supervivencia. (3.1) Análisis de supervivencia Kaplan-Meier respecto al tratamiento quirúrgico. (3.2) Análisis de supervivencia Kaplan-Meier respecto al tamaño tumoral (T). (3.3) Análisis de supervivencia Kaplan-Meier respecto al índice de Charlson. (3.4) Análisis de supervivencia Kaplan-Meier respecto a la edad. (3.5) Análisis de supervivencia Kaplan-Meier respecto a la primera pregunta sobre percepción de salud del SF-12.
Cuando comparamos los meses de supervivencia entre los diferentes tratamientos registrados, la supervivencia fue de 40,1 meses para el grupo quirúrgico y 18,5 meses para el grupo no quirúrgico. En cuanto a la técnica quirúrgica, el análisis de Kaplan-Meier muestra una supervivencia significativamente mayor en las pacientes sometidas a tumorectomía que en las sometidas a mastectomía (p = 0,024) (fig. 3.1).
Respecto al tamaño del tumor en el momento del diagnóstico, también se obtuvieron resultados estadísticamente significativos (fig. 3.2).
Cuando separamos la edad y la puntuación de Charlson en diferentes grupos para comparar la supervivencia, encontramos que la supervivencia fue peor en el grupo más longevo (> 90 años) (fig. 3.4) y en los que tenían puntuaciones de Charlson más altas (> 8,5) (fig. 3.3), pero esta diferencia no resultó estadísticamente significativa (p = 0,34 y p = 0,25, respectivamente).
También analizamos la relación entre la supervivencia y las respuestas a la primera pregunta del SF-12, en la que se evalúa la propia percepción de la salud de cada paciente. Creamos dos grupos: los pacientes que percibían su salud como excelente/muy buena/buena y los que la describían como media/mala. La figura 3.5 muestra claramente que la supervivencia fue más larga en aquellas pacientes que percibían una buena salud respecto de las que no, casi alcanzando la significación estadística (p = 0,061).
DiscusiónEn este estudio se observó que la mayoría de pacientes recibieron un tratamiento quirúrgico conservador de tejido mamario, en vez de un tratamiento hormonal de primera línea, aunque el porcentaje de mastectomías no fue despreciable. Asimismo, en el análisis realizado destaca la elevada satisfacción de las pacientes con el tratamiento recibido y con la Unidad de Patología Mamaria. Además, las pacientes presentaron una calidad de vida favorable en más de la mitad de los casos, observándose una fuerte tendencia de esta buena percepción de salud a una mejor supervivencia.
Situación del tratamiento en pacientes octogenariasEn publicaciones anteriores se ha evidenciado que las mujeres de edad avanzada tienen menos probabilidades de recibir el tratamiento estándar contra el cáncer de mama respecto de las mujeres más jóvenes. La mayoría de este subgrupo de pacientes reciben un tratamiento insuficiente a nivel quirúrgico y/o adyuvante6,13,25-32 o, en algunos casos, un tratamiento excesivo12. Se observa en varios estudios que las pacientes longevas se someten con menor frecuencia a cirugía de la glándula mamaria, así como a procedimientos axilares, recibiendo un tratamiento quirúrgico menos apropiado para su cáncer de mama29,33,34. Además, suelen recibir menos radioterapia adyuvante35 y menos tratamiento sistémico neoadyuvante/adyuvante3,12,27,36-38, con mayor probabilidad de recibir terapia endocrina primaria26,29,38.
Recomendaciones de las guías clínicasVarias publicaciones, como el metaanálisis de la Cochrane, han evidenciado que el tratamiento hormonal de primera línea es inferior a la cirugía en cuanto al control de recidiva local del cáncer de mama. Además, el control local de la enfermedad es independiente del tipo de cirugía (mastectomía o cirugía conservadora de la mama), siendo el tratamiento quirúrgico la opción que muestra la mejor supervivencia libre de progresión33,39-41. Asimismo, las mujeres que sufren una recaída presentan la posibilidad de recibir nuevamente un tratamiento quirúrgico, terapia hormonal de segunda línea o incluso radioterapia si presentan una edad más avanzada y de riesgo33. La Sociedad Internacional de Oncología Geriátrica (SIOG) y la Sociedad Europea de Especialistas en Cáncer de Mama (EUSOMA) afirman que a las pacientes de 70 años o más se les debe ofrecer la misma cirugía que a sus homólogas más jóvenes, recomendando la terapia hormonal como primera opción solo en pacientes con una esperanza de vida corta (menos de dos a tres años), las que no son aptas para la anestesia y/o las que rechazan la cirugía como decisión personal7,39.
Tratamiento de pacientes octogenarias en otros paísesSi observamos estudios de países diferentes encontramos que difieren en cuanto al tratamiento primario del cáncer de mama en pacientes ancianas, tanto en Europa como en el resto del mundo. En el Reino Unido, el tratamiento hormonal se utiliza ampliamente como tratamiento primario en el 45-55% de las mujeres mayores de 80 años15,33. Lo mismo ocurre en Suiza, donde un estudio de poblacional de pacientes con cáncer de mama informó de que solo el 54% de las mujeres de edad avanzada se sometían a cirugía42. Un punto intermedio sería el caso de los Países Bajos17 o Singapur27, donde el 67 y el 61% de las intervenciones quirúrgicas se realizan en pacientes mayores de 80 años, respectivamente. En nuestro estudio, el 97% de las pacientes se sometieron a una intervención quirúrgica como tratamiento primario, en consonancia con la situación de EE. UU.25,36,43, Italia y Francia33.
Tratamiento actual en pacientes octogenarias con cáncer de mamaAunque las guías clínicas dan unas recomendaciones claras para el tratamiento del cáncer de mama en pacientes de edad avanzada, la realidad es que actualmente el tratamiento en estas pacientes difiere de estas directrices en muchas ocasiones. Por ejemplo, en un estudio se mostraron varios escenarios hipotéticos de casos clínicos con neoplasias mamarias en mujeres de 70 años o más a 174 especialistas en cáncer de mama44. Resultó que estos especialistas se vieron altamente influenciados por la edad cronológica de las pacientes, cambiando las indicaciones de tratamiento locorregional y sistémico adyuvante. Probablemente esta discrepancia entre las guías de actuación y el tratamiento real recibido por las pacientes de edad avanzada se explica debido a las frecuentes comorbilidades médicas de la población de edad avanzada, la falta de apoyo social, la preferencia de la paciente y las posibles complicaciones relacionadas con el tratamiento25. Además, es posible que se hayan sobreestimado los riesgos de la anestesia y la cirugía, aunque cabe señalar que las pacientes de edad avanzada toleran bien la cirugía, si es cierto que afrontan peor las complicaciones, ya que tienen una reserva cardíaca y respiratoria reducida, por lo que es necesario prestar una atención meticulosa a los detalles41.
Nuestro grupo de trabajo cree que esta discordancia entre el tratamiento teórico y el real recibido, podría implicar que los especialistas necesitan más datos de resultados en pacientes mayores para sentirse cómodos haciendo recomendaciones en la práctica clínica.
En concordancia con otros autores16,18,19, creemos que deben abandonarse las decisiones de tratamiento basadas únicamente en la edad. Las estrategias terapéuticas deben adaptarse la esperanza de vida teniendo en cuenta varios factores: las comorbilidades significativas y la capacidad funcional actual, las características del tumor, la toxicidad potencial del tratamiento y la preferencia de la paciente6,16,18,19, porque muchas octogenarias sanas tolerarán la terapia convencional y tendrán una esperanza de vida de 10-15 años19, siendo la esperanza de vida media entre 9-10 años 6,7,12,19,20,39,45. Por lo tanto, para las pacientes de edad avanzada con cáncer de mama no metastásico, el tratamiento primario debe ser la cirugía, ya que la mastectomía o la cirugía conservadora de la mama siguen siendo el estándar de atención para las mujeres de cualquier edad. Estas pacientes deben someterse también a radioterapia y, si son aptas, terapia sistémica. Solo deben someterse a un tratamiento más limitado, terapia hormonal de primera línea o cuidados paliativos si son mujeres ancianas frágiles que no son candidatas a la cirugía, rechazan la cirugía, tienen una esperanza de vida limitada (< 2-3 años) o aquellas cuya supervivencia no se espera que mejore como resultado del tratamiento del cáncer de mama7,12,19,20,39,45. La radioterapia puede ser una solución local adecuada y no invasiva para las pacientes que rechazan, o no pueden, someterse a la cirugía mamaria. La radioterapia como tratamiento local para el cáncer de mama no metastásico en mujeres de edad avanzada parece ser segura y factible45 y la radioterapia axilar podría ser una opción razonable para algunas pacientes de edad avanzada con biopsia del ganglio centinela positivo46.
En nuestro estudio, la mayoría de las pacientes recibieron tratamiento quirúrgico como primera opción (97%), reservando el tratamiento hormonal para aquellas pacientes con menor esperanza de vida, las no aptas para la cirugía y las que rechazaron esta opción de tratamiento. En cuanto a la técnica quirúrgica, la cirugía conservadora se realizó en casi el 60% de las pacientes, un porcentaje similar al 66% publicado por Plichta et al. en 202036, y muy superior al reportado por otros estudios con un 4922, 3915 y 12%17. En cuanto a la cirugía axilar, cabe destacar que el estado de afectación de los ganglios linfáticos sigue siendo claramente un factor pronóstico importante, incluso en las pacientes de edad avanzada43. En nuestro estudio, se realizó BSGC en el 43% de las pacientes y en un 35% de los casos se practicó una linfadenectomía, observándose porcentajes similares a los descritos en la literatura22. De modo que aquellas pacientes octogenarias con ganglios axilares clínicamente implicados fueron consideradas para la disección axilar para controlar la enfermedad47, ya que, en el momento de nuestro estudio, la estadificación axilar mediante ganglio centinela y posterior limfadenectomía si el ganglio centinela resultaba positivo para células neoplásicas era el estándar de atención para las pacientes de cualquier edad con cáncer de mama16. Actualmente, en nuestro centro, las pacientes con BSGC positiva que cumplen con los criterios de Giuliano48 no se someten a linfadenectomía, pero sí a radioterapia axilar.
Papel de la calidad de vida en el tratamiento del cáncer de mama en pacientes octogenariasMantener la calidad de vida es un objetivo clave en todas las pacientes, pero sobre todo en las de edad avanzada49,50. Sin embargo, muy pocos ensayos clínicos han analizado la calidad de vida de las pacientes tras el tratamiento del cáncer de mama, a pesar de ser un factor determinante en la toma de decisiones sobre el mismo. En un estudio se observó que las pacientes sometidas a cirugía mostraban más morbilidad psicosocial que las mujeres que recibieron tratamientos no quirúrgicos, aunque estas diferencias entre ambos grupos desaparecieron dos años después de la cirugía51. Del mismo modo, un estudio que evaluaba la radioterapia y la cirugía axilar informó de que la calidad de vida de las pacientes de edad avanzada era en general tan buena como al principio del tratamiento, y que el deterioro de la calidad de vida era principalmente leve y estaba seguido de una pronta recuperación52. Las elevadas puntuaciones de calidad de vida comunicadas en ese estudio podrían deberse, en parte, a la capacidad de los pacientes de edad avanzada para gestionar las dificultades52.
La primera pregunta del SF-12 trata sobre la autopercepción de la salud, equiparable al término autopercepción del envejecimiento (self perception aging [SPA]). Varios estudios longitudinales han demostrado que la autopercepción de salud es un factor predictivo significativo del estado de salud y de la esperanza de vida53, y se ha observado que las pacientes con una autopercepción de salud negativa tienen 3,66 veces más probabilidades de morir que las que tienen una autopercepción de salud positiva53. En nuestro estudio, la supervivencia fue mayor en las pacientes con buena autopercepción de la salud respecto de las pacientes con una autopercepción de la salud deficiente, aunque esta diferencia no fue estadísticamente significativa, probablemente debido al reducido número de pacientes. Como se observa en otro estudio, la SPA tiene un impacto en la mortalidad, incluso en esta población específica, en donde las personas mayores con una SPA negativa tenían tres veces más probabilidades de morir que las que tenían una SPA positiva con una medida de hasta seis años antes54. A la vista de estos resultados, los estudios de calidad de vida sobre la cirugía en pacientes ancianos con cáncer podrían ser útiles, mientras que un mayor número de opciones quirúrgicas basadas en la evidencia podría aumentar su supervivencia global y su calidad de vida50.
Mortalidad en el tratamiento del cáncer de mama en pacientes octogenariasLas mujeres de edad avanzada tienen mayor riesgo de desarrollar y morir por cáncer de mama26. De hecho, se observa una peor supervivencia específica del cáncer de mama en las mujeres de mayor edad para todos los estadios y subtipos de la enfermedad14,15,21,28. Por otro lado, algunas publicaciones han informado de que las pacientes mayores de 80 años tienen más probabilidades de morir por causas distintas al cáncer de mama7,12,16,17,20,22,28. Este hallazgo coincide con nuestros resultados, que muestran que el 59% de las pacientes de nuestra cohorte murieron por causas no relacionadas con el cáncer de mama y que solo el 31% de las muertes estaban relacionadas directamente con esta enfermedad.
En nuestra cohorte, con un seguimiento de más de siete años y con una supervivencia media global de 39 meses, la mortalidad fue del 46%, que es inferior a la de otros estudios que informan de una mortalidad del 57%17 y del 52-64%20. En nuestro estudio, la supervivencia fue ligeramente superior en el grupo quirúrgico, pero no fue comparable con el grupo no quirúrgico debido a las diferencias en las características de las pacientes de cada grupo. Una mejor supervivencia fue estadísticamente significativa en las pacientes sometidas a tumorectomía respecto de las sometidas a mastectomía y también presentaron una mayor supervivencia en aquellas con tumores de menor tamaño, probablemente debido a la baja supervivencia de las pacientes en estadios avanzados.
Aunque algunos autores han argumentado que el tratamiento quirúrgico no da lugar a una supervivencia global significativamente mejor33, es bien sabido que independientemente de la edad, la mortalidad perioperatoria global tras la cirugía mamaria es baja29. De hecho, múltiples estudios han informado que la supervivencia de las pacientes de edad avanzada sometidas a cirugía sí que fue significativamente mejor que la de las pacientes no sometidas a cirugía17,40,42, siendo la cirugía el factor más importante asociado significativamente con una mejor supervivencia25 y un predictor independiente de la misma17. Añadiendo discrepancia, otros estudios han informado de una supervivencia similar en las pacientes que recibieron tratamiento hormonal o cirugía, aunque sí se observa claramente que las pacientes quirúrgicas obtuvieron mejores resultados en términos de supervivencia libre de recidiva local20,39,40.
Limitaciones del estudioEncontrar estudios de pacientes mayores de 80 años con cáncer de mama es complicado. Aunque en este estudio se han conseguido reclutar más de 50 casos, la limitación más importante radica en la dificultad de extraer conclusiones a partir de 63 pacientes de un único centro. Sin embargo, la muestra se considera representativa de esta subpoblación y los datos extraídos, junto con la exhaustiva y extensa revisión de la literatura publicada que los acompaña, pueden ser útiles para cambiar la práctica clínica en determinados casos. Es una buena premisa querer estudiar a un grupo poco representado en los estudios habituales sobre cáncer de mama y cuyas necesidades pueden diferir de las que participan en la mayoría de las investigaciones, por lo que animamos a otros autores a que publiquen sus series sobre esta subpoblación para continuar la investigación sobre el cáncer de mama en estas pacientes, que se presentarán con mucha más frecuencia en el futuro y que merecen el tratamiento más eficaz.
ConclusionesDelante de la variabilidad existente en el tipo de tratamiento recibido en pacientes octogenarias diagnosticadas de cáncer de mama, en este estudio se ha evidenciado que el tratamiento de primera línea recibido en este subgrupo de pacientes en un centro de tercer nivel ha sido mediante la realización de cirugía en amplia mayoría (97%). Solo las pacientes con menor esperanza de vida, las no aptas para la cirugía, o las que rechazaron esta opción de tratamiento recibieron tratamiento hormonal de primera línea.
La calidad de vida y la buena autopercepción del envejecimiento son un objetivo clave en los pacientes adultos mayores. La calidad de vida evaluada mediante el test SF-12 en pacientes octogenarias diagnosticadas de cáncer de mama en el Hospital Germans Trias i Pujol denotan una gran aceptación del tratamiento quirúrgico recibido y un elevado grado de satisfacción con la Unidad de Patología Mamaria. Las pacientes con mejor autopercepción de la salud tienden a presentar una mejor supervivencia.
La mortalidad fue del 47% a los siete años de seguimiento y fue ligeramente menor en el grupo quirúrgico. Cabe destacar que el 59% de las pacientes murieron por causas no relacionadas con el cáncer de mama y solo el 31% de las muertes se relacionaron directamente con él.
Debido al aumento de pacientes octogenarias con cáncer de mama, los estudios acerca del tratamiento recibido en edades avanzadas son de gran utilidad para mejorar la medicina basada en la evidencia y optimizar el tratamiento de estas pacientes, mejorando así su calidad de vida y aumentando su supervivencia.
Aspectos éticosEste estudio se ha llevado a cabo conforme el código de ética de la Asociación Médica Mundial (Declaración de Helsinki). Los datos fueron registrados a través de un protocolo aprobado por el Comité de Ética de Investigación Clínica del Hospital Germans Trias i Pujol con el número de registro PI-20-315 y todas las participantes consintieron la participación en el estudio.
Contribuciones de los autoresLidia Blay: Conceptualización, Recolección y Tratamiento de datos, Investigación, Metodología, Cirujana, Redacción de borrador y original.
Javier Louro: Análisis formal, metodología, validación
Paula Ribes: Conceptualización, Recolección y tratamiento de datos, investigación, análisis formal
Iciar Pascual: Visualización, cirujana
Iva Borisova: Visualización, cirujana
Miguel Angel Luna: Visualization, Surgeon
Cristian Rios: Visualización, cirujano
Mauricio Parrales: Visualización, redacción, revisión y edición
David Pares: redacción, revisión y edición
Maria Sala: Supervisión, Validación, administración del proyecto, redacción, revisión y edición
Joan Francesc Julian: Supervisión, administración del proyecto, redacción, revisión y edición
Responsabilidades éticasProtección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo contó con el apoyo de becas del Instituto de Salud Carlos III FEDER (número de beca: PI19/00056) y de la Red de Investigación en Servicios de Salud en Enfermedades Crónicas (RD16/0001/0013). Los patrocinadores no tuvieron ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Conflictos de interésLos autores declaran que no existe ningún conflicto de intereses con respecto a la publicación de este artículo.
Los autores desean agradecer al Dr. Moreno y a Arnau Sans su ayuda y aportaciones a este manuscrito.