Las estatinas son fármacos de alta eficacia para disminuir la concentración plasmática de lipoproteínas aterogénicas y prevenir las enfermedades cardiovasculares. Las guías de práctica clínica recomiendan el uso de estatinas de alta intensidad para disminuir el cLDL al menos un 50% en los pacientes con ECV y en los de alto RCV. Las recomendaciones para el tratamiento de la hipercolesterolemia del ACC/AHA han supuesto un cambio de paradigma en la prevención cardiovascular al abandonar los objetivos terapéuticos del cLDL y plantear el tratamiento con estatinas de alta o moderada intensidad en cuatro grupos poblacionales bien identificados de alto RCV. Dichas recomendaciones son distintas a las de las guías europeas de prevención cardiovascular en las que se mantienen dichos objetivos del cLDL. Este trabajo revisa dicha controversia desde distintos ángulos y desde la perspectiva del Comité Español Interdisciplinar para la Prevención Cardiovascular y también los estudios de intervención con estatinas de alta intensidad en prevención primaria, en pacientes con síndrome coronario agudo y con cardiopatía isquémica estable. Asimismo, se aborda el tratamiento con estatinas de alta intensidad en cuanto a su eficacia en prevención cardiovascular y a su seguridad, con particular atención a los efectos musculares, teniendo en cuenta las características farmacológicas de las distintas estatinas y la mayor seguridad de las que presentan un menor potencial de interacciones. Por último se describen nuevos agentes para el tratamiento de la hipercolesterolemia con especial énfasis en los anticuerpos monoclonales anti-PCSK9, un nuevo grupo terapéutico de alta eficacia hipocolesteremiante que supondrá un enorme progreso en la prevención de las enfermedades cardiovasculares.
Statins are highly effective drugs to decrease the plasma concentrations of atherogenic lipoproteins and prevent cardiovascular disease. The clinical practice guidelines recommend the use of high-intensity statins to lower LDL-cholesterol by at least 50% in patients with CVD and those at high cardiovascular risk. The recommendations for the treatment of hypercholesterolaemia by the ACC/AHA have led to a paradigm shift in cardiovascular prevention. These recommendations have abandoned the therapeutic goals of LDL-cholesterol, and recommend the treatment with statins of high or moderate intensity in four high cardiovascular risk groups. These recommendations are different from the European guidelines on cardiovascular disease prevention, in which their objectives are still towards LDL-cholesterol. This paper reviews this controversy from different angles and from the perspective of the Spanish Interdisciplinary Committee for Cardiovascular Disease Prevention. Intervention studies with high intensity statins in primary prevention, in patients with acute coronary syndrome, and with stable ischaemic heart disease are also described. Likewise, treatment with statins of high intensity is addressed in terms of their effectiveness in cardiovascular prevention and in terms of their safety, with particular attention to muscle effects, as well as taking into account the pharmacological characteristics of the different statins and the increased safety of those with less potential for interactions. Finally, new agents are described for the treatment of hypercholesterolaemia, with special emphasis on anti-PCSK9 monoclonal antibodies, a new therapeutic group for the treatment of hypercholesterolaemia that will offer a huge progress in the prevention of cardiovascular diseases.
Desde la década de los noventa del siglo XX, numerosas evidencias procedentes de los grandes ensayos clínicos aleatorizados y controlados han confirmado los beneficios del tratamiento con estatinas en la prevención de la enfermedad cardiovascular (ECV), tanto en prevención primaria1–4 y secundaria4–7, como sobre la evolución de la aterosclerosis8. Además, se ha demostrado un alto perfil de seguridad de las estatinas9, que las sitúa como el fármaco de elección en el control de la hipercolesterolemia y la prevención cardiovascular.
Existe una relación directa entre la reducción del colesterol de las lipoproteínas de baja densidad (cLDL) y la incidencia de episodios cardiovasculares10, de forma que por cada 39mg/dl de descenso de la concentración de cLDL, se consigue una reducción del riesgo cardiovascular (RCV) del 20%. En distintos metaanálisis se ha confirmado que cuanto mayor es la reducción de las concentraciones plasmáticas de colesterol, menor es el riesgo de presentar una ECV11.
A pesar de dichas evidencias, un gran porcentaje de pacientes, especialmente los de muy alto RCV, continúan sin alcanzar los objetivos terapéuticos. En este sentido, el EUROASPIRE IV12, registro de 7.998 pacientes con una edad inferior a los 80 años en prevención secundaria pertenecientes a 24 países constató que el 87% estaba tomando fármacos hipolipemiantes, estatinas casi exclusivamente; de estos, el 58% tenía un nivel de cLDL<100mg/dl, pero solo el 21% alcanzó el objetivo de cLDL<70mg/dl. En nuestro medio, el estudio EDICONDIS-ULISEA realizado en las unidades de lípidos y RCV acreditadas por la Sociedad Española de Arteriosclerosis mostró resultados similares; el 65% tenía un nivel cLDL<100mg/dl, pero solo el 18% una concentración<70mg/dl13. De la misma forma, diferentes registros y estudios nacionales han confirmado que la consecución del objetivo de cLDL<70mg/dl en pacientes con ECV es en general<20%14–16. Se han señalado como causas principales de la deficiente prevención secundaria de la ECV, la prescripción inadecuada y, por parte de los pacientes, una escasa mejora del estilo de vida y con el tiempo el abandono del tratamiento farmacológico17.
Implicaciones clínicas de las guías europea y estadounidense de prevención cardiovascularA finales del 2013, aparecieron las recomendaciones para el tratamiento de la hipercolesterolemia del American College of Cardiology/American Heart Association (ACC/AHA)18, que suponen un cambio de paradigma en la prevención cardiovascular. Esta guía se basa en el tratamiento con estatinas de alta o moderada intensidad en cuatro grupos poblacionales bien identificados de alto RCV, abandonando los objetivos terapéuticos del cLDL, una característica fundamental de los anteriores National Cholesterol Education Program-Adult Treatment Panel19 (NCEP-ATP) y de la guía europea de prevención cardiovascular 201220. En las guías de la ACC/AHA18 se definen como estatinas de alta intensidad a las que pueden disminuir el cLDL un 50% o más e incluyen la atorvastatina a dosis de 40-80mg/día y la rosuvastatina a dosis de 20-40mg/día. Se consideran tratamientos de intensidad moderada a los que pueden disminuir la concentración de cLDL entre un 30 y<50% que corresponden a las dosis diarias de 10-20mg de atorvastatina, 5-10mg de rosuvastatina, 2-4mg de pitavastatina, 20-40mg de simvastatina, 40mg de pravastatina, 40mg de lovastatina y 80mg de fluvastatina. Dosis inferiores se consideran de baja intensidad.
Por tanto, en la actualidad, los profesionales pueden encontrarse con dos formas diferentes de afrontar la decisión de instaurar un tratamiento farmacológico en prevención cardiovascular. Por una parte, la recomendación europea20 fundamentada en una estrategia que prioriza la consecución de los objetivos terapéuticos de cLDL en función del RCV y por otra, la alternativa americana, basada en indicar una dosis fija de una estatina de intensidad variable en función del riesgo del paciente18.
La guía europea de prevención cardiovascular identifica un grupo poblacional de muy alto RCV en el que se incluye a los pacientes con ECV clínica o subclínica, los pacientes con diabetes tipo 1 o 2 con uno o más factores de RCV y/o lesión de órgano diana o microalbuminuria, los pacientes en prevención primaria con un RCV a 10 años>10% calculado mediante la tabla SCORE y los pacientes que presentan enfermedad renal crónica con un filtrado glomerular estimado<30ml/min/1,73 m2. El objetivo recomendado en estos casos es una concentración de cLDL<70mg/dl, o bien una reducción≥50% si no se alcanza dicho objetivo20. Por su parte, según la guía del ACC/AHA los pacientes que se beneficiarían de la terapia con estatinas de alta intensidad (atorvastatina 40-80mg y rosuvastatina 20-40mg) serían los pacientes<75 años en prevención secundaria, los diabéticos de 40 a 75 años con una concentración de cLDL entre 70 y 189mg/dl, aquellos con cLDL>190mg/dl y aquellos en prevención primaria entre 40 y 75 años y RCV>7,5% según la «pooled cohort risk assessment equation»18. Dos análisis de la base de datos del VOYAGER destacan la importancia en la elección del tipo y posología de la estatina más eficaz, tanto para lograr la consecución de los objetivos terapéuticos del cLDL en los pacientes de muy alto RCV, recomendados en la guía europea21, como para alcanzar reducciones del cLDL ≥ 50% recomendadas en los cuatro grupos que se benefician de la terapia con estatinas de alta intensidad según las directrices del ACC/AHA del 201322. El análisis de dicha base de datos también ha mostrado que con la rosuvastatina se consiguen los objetivos de disminución del cLDL en un mayor porcentaje de pacientes que con otras estatinas y un incremento del colesterol de las lipoproteínas de alta densidad (cHDL) algo superior al obtenido con atorvastatina (4,4-6,8% vs.1,6-3,7%)23. A su vez, se ha observado que el incremento del cHDL es mayor con dosis altas de rosuvastatina que con dosis más bajas de este fármaco asociadas a ezetimiba24.
En cuanto a las diferentes herramientas diseñadas para facilitar la elección de la estrategia hipolipemiante más apropiada, remitimos al lector a la última actualización de las tablas de planificación terapéutica de Masana et al.25. En dichas tablas se tiene en cuenta el cLDL de partida y el objetivo terapéutico a alcanzar, y se plantea establecer el tratamiento hipocolesterolemiante más eficaz, ya sea una estatina en monoterapia o en combinación con otros fármacos hipolipemiantes, en un máximo de dos encuentros clínicos. Este aspecto es de gran relevancia en los pacientes de alto RCV, en los que se requiere una consecución rápida de los objetivos del cLDL.
El Comité Español Interdisciplinar para la Prevención Cardiovascular26 ha efectuado un análisis exhaustivo de las diferencias y similitudes entre ambas guías, concluyendo que la directriz europea además de utilizar tablas basadas en la población autóctona, ofrece mensajes más acordes al entorno español y previene del posible sobretratamiento farmacológico con estatinas en prevención primaria. Si bien las guías de práctica clínica se han convertido en un instrumento fundamental en nuestra actividad asistencial, no debemos olvidar que son simplemente el marco para orientar a los médicos en la toma de decisiones clínicas.
A continuación, vamos a revisar las evidencias clínicas que apoyan el tratamiento hipolipemiante intensivo en los pacientes de alto/muy alto RCV, así como el perfil de seguridad de dicha estrategia terapéutica.
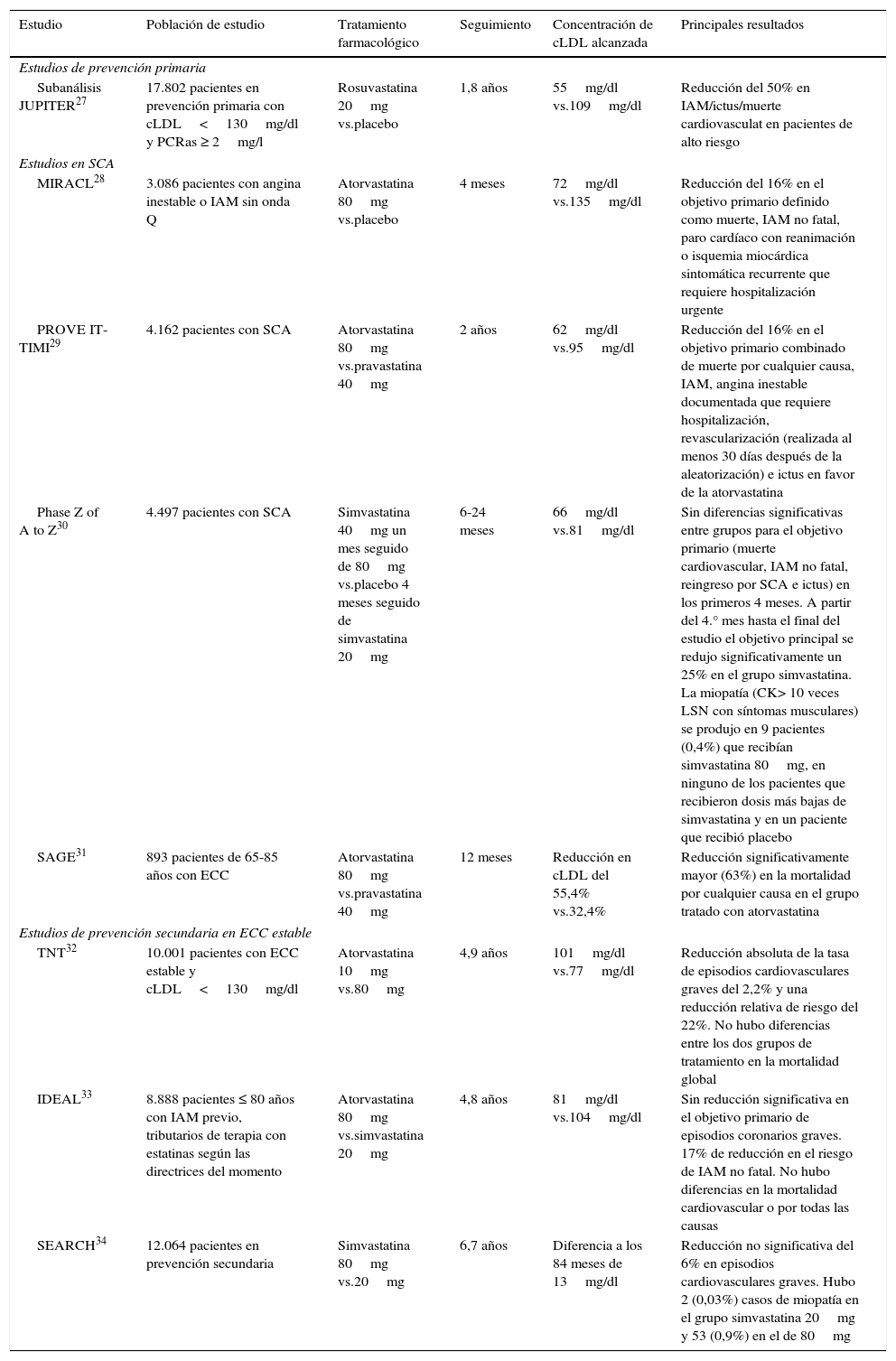
Beneficios clínicos del tratamiento con estatinas de alta intensidadEn la tabla 1 se exponen las principales características y resultados de los estudios de intervención con estatinas de alta intensidad en prevención primaria27, en pacientes con síndrome coronario agudo (SCA)28–31 y con cardiopatía isquémica estable4,32–34.
Principales estudios de intervención con estatinas de alta potencia en pacientes de alto/muy alto RCV
| Estudio | Población de estudio | Tratamiento farmacológico | Seguimiento | Concentración de cLDL alcanzada | Principales resultados |
|---|---|---|---|---|---|
| Estudios de prevención primaria | |||||
| Subanálisis JUPITER27 | 17.802 pacientes en prevención primaria con cLDL<130mg/dl y PCRas ≥ 2mg/l | Rosuvastatina 20mg vs.placebo | 1,8 años | 55mg/dl vs.109mg/dl | Reducción del 50% en IAM/ictus/muerte cardiovasculat en pacientes de alto riesgo |
| Estudios en SCA | |||||
| MIRACL28 | 3.086 pacientes con angina inestable o IAM sin onda Q | Atorvastatina 80mg vs.placebo | 4 meses | 72mg/dl vs.135mg/dl | Reducción del 16% en el objetivo primario definido como muerte, IAM no fatal, paro cardíaco con reanimación o isquemia miocárdica sintomática recurrente que requiere hospitalización urgente |
| PROVE IT-TIMI29 | 4.162 pacientes con SCA | Atorvastatina 80mg vs.pravastatina 40mg | 2 años | 62mg/dl vs.95mg/dl | Reducción del 16% en el objetivo primario combinado de muerte por cualquier causa, IAM, angina inestable documentada que requiere hospitalización, revascularización (realizada al menos 30 días después de la aleatorización) e ictus en favor de la atorvastatina |
| Phase Z of A to Z30 | 4.497 pacientes con SCA | Simvastatina 40mg un mes seguido de 80mg vs.placebo 4 meses seguido de simvastatina 20mg | 6-24 meses | 66mg/dl vs.81mg/dl | Sin diferencias significativas entre grupos para el objetivo primario (muerte cardiovascular, IAM no fatal, reingreso por SCA e ictus) en los primeros 4 meses. A partir del 4.° mes hasta el final del estudio el objetivo principal se redujo significativamente un 25% en el grupo simvastatina. La miopatía (CK> 10 veces LSN con síntomas musculares) se produjo en 9 pacientes (0,4%) que recibían simvastatina 80mg, en ninguno de los pacientes que recibieron dosis más bajas de simvastatina y en un paciente que recibió placebo |
| SAGE31 | 893 pacientes de 65-85 años con ECC | Atorvastatina 80mg vs.pravastatina 40mg | 12 meses | Reducción en cLDL del 55,4% vs.32,4% | Reducción significativamente mayor (63%) en la mortalidad por cualquier causa en el grupo tratado con atorvastatina |
| Estudios de prevención secundaria en ECC estable | |||||
| TNT32 | 10.001 pacientes con ECC estable y cLDL<130mg/dl | Atorvastatina 10mg vs.80mg | 4,9 años | 101mg/dl vs.77mg/dl | Reducción absoluta de la tasa de episodios cardiovasculares graves del 2,2% y una reducción relativa de riesgo del 22%. No hubo diferencias entre los dos grupos de tratamiento en la mortalidad global |
| IDEAL33 | 8.888 pacientes ≤ 80 años con IAM previo, tributarios de terapia con estatinas según las directrices del momento | Atorvastatina 80mg vs.simvastatina 20mg | 4,8 años | 81mg/dl vs.104mg/dl | Sin reducción significativa en el objetivo primario de episodios coronarios graves. 17% de reducción en el riesgo de IAM no fatal. No hubo diferencias en la mortalidad cardiovascular o por todas las causas |
| SEARCH34 | 12.064 pacientes en prevención secundaria | Simvastatina 80mg vs.20mg | 6,7 años | Diferencia a los 84 meses de 13mg/dl | Reducción no significativa del 6% en episodios cardiovasculares graves. Hubo 2 (0,03%) casos de miopatía en el grupo simvastatina 20mg y 53 (0,9%) en el de 80mg |
CK: creatincinasa; cLDL: colesterol de las lipoproteínas de baja densidad; ECC: enfermedad cardiaca coronaria; IAM: infarto agudo de miocardio; ICP: intervencionismo coronario percutáneo; LSN: límite superior de la normalidad; PCRas: proteína C reactiva de alta sensibilidad; SCA: síndrome coronario agudo.
En prevención primaria, un subanálisis del estudio JUPITER27 con pacientes de alto riesgo cardiovascular, cLDL<130mg/dl, proteína C reactiva de alta sensibilidad ≥ 2mg/l y un seguimiento medio cercano a los dos años demostró que el tratamiento con rosuvastatina 20mg se acompaña de una reducción significativa de episodios cardiovasculares graves.
Por lo que respecta al SCA, en el estudio MIRACL28 se aleatorizaron a 3.086 pacientes con SCA sin elevación del segmento ST a recibir en las primeras 24 a 96 h, atorvastatina 80mg o placebo con un seguimiento de 4 meses. Se constató una disminución significativa en la incidencia de episodios cardiovasculares graves en el grupo de tratamiento activo, especialmente a expensas de una reducción en el número de hospitalizaciones por angina recurrente. Desde entonces, la recomendación de que los pacientes deberían recibir atorvastatina 80mg/día antes del alta hospitalaria por un SCA se ha hecho extensiva a las estatinas de alta intensidad en la mayoría de los protocolos asistenciales hospitalarios. Con posterioridad, los estudios PROVE IT TIMI29, phase Z de A to Z30 y SAGE31, cada uno con las particularidades inherentes a su diseño, han indicado también reducciones en la mortalidad global y cardiovascular en pacientes con SCA tratados con estatinas de alta intensidad. Por lo tanto, en el contexto del SCA se puede concluir que el empleo de regímenes terapéuticos con estatinas de alta intensidad muestra importantes beneficios cardiovasculares.
En contraste con los estudios realizados en pacientes con SCA, los llevados a cabo en pacientes con enfermedad cardiaca coronaria estable, el tratamiento con estatinas de alta intensidad no se acompaña de beneficios en términos de mortalidad. En el estudio TNT32, 10.001 pacientes con cardiopatía isquémica estable fueron aleatorizados a un tratamiento con atorvastatina 10mg vs.80mg. Se obtuvieron concentraciones medias de cLDL de 101mg/dl frente a 77mg/dl, respectivamente. Hubo una reducción significativa del 22% en el objetivo combinado (primer episodio cardiovascular grave, definido como muerte coronaria, infarto no mortal no relacionado con procedimientos, resucitación tras parada cardiaca o ictus mortal o no mortal) y un 20% de reducción en las muertes de origen cardiaco. A pesar de estos resultados, no hubo reducción de la mortalidad total. En el estudio IDEAL33 se aleatorizaron 8.888 pacientes clínicamente estables con antecedentes de infarto de miocardio a recibir atorvastatina 80mg o simvastatina 20mg. Después de un seguimiento medio de 4,8 años, el cLDL se redujo a 81mg/dl frente a 104mg/dl, y se halló una disminución no significativa del 11% en el objetivo primario definido como el tiempo hasta el primer episodio coronario grave, hospitalización por infarto agudo de miocardio o parada cardiaca. Hubo una reducción del número de episodios, incluido el infarto de miocardio no mortal y la revascularización coronaria, pero no se documentó efecto en la mortalidad por cualquier causa, ni cardiovascular. En el estudio SEARCH34 se incluyeron 12.064 pacientes con antecedentes de infarto de miocardio que fueron randomizados a recibir simvastatina, 80mg frente a 20mg. Después de un seguimiento medio de 6,7 años, hubo una diferencia en las concentraciones de cLDL de 14mg/dl, y se observó una reducción no significativa del objetivo primario. El tratamiento con dosis altas no tuvo efecto en la mortalidad por todas las causas, ni en la mortalidad de causa vascular. Se registró un mayor número de efectos adversos musculares, que motivó que la Food and Drug Administration (FDA) limitara la dosis de 80mg de simvastatina35.
La ezetimiba inhibe la absorción intestinal de colesterol y potencia la acción hipocolesterolemiante de todas las estatinas con independencia de la dosis de estas, tanto en la hipercolesterolemia familiar monogénica36, como en pacientes de alto RCV con otras dislipemias37. Recientemente, en un estudio clínico con más de 18.000 pacientes con SCA, el IMPROVE-IT, se ha demostrado que la combinación de simvastatina (40mg/día) y ezetimiba (10mg/día) mantiene a largo plazo unas concentraciones más bajas de cLDL (53,7mg/dl) que la monoterapia con simvastatina (69,5mg/dl) y además dicho tratamiento combinado se asocia a una menor incidencia de ECV (32,7 vs.34,7%, respectivamente; razón de riesgo 0,936; IC 95% 0,89-0,99; p= 0,016)38. Estos datos apoyan tres conceptos de gran relevancia en la prevención39. En primer lugar, que cuanto más bajo es el cLDL mayor es el grado de prevención cardiovascular sin que exista un valor umbral a partir de que desaparezca dicha relación; en segundo lugar, que bajas concentraciones de cLDL (< 50mg/dl) se han mostrado seguras a largo plazo, y por último, que la disminución del cLDL es beneficiosa con independencia de si se obtiene con estatinas o con otros agentes hipolipemiantes. La combinación de estatinas con ezetimiba también se ha asociado a un mayor efecto reductor de determinados parámetros inflamatorios, como la fosfolipasa A2, la cual parece relacionarse con la magnitud del descenso del cLDL24.
Seguridad del tratamiento con estatinas de alta intensidadLas estatinas tienen un alto nivel de seguridad y son bien toleradas por la gran mayoría de los pacientes40. Su principal riesgo de efectos secundarios se sitúa a nivel hepático y muscular. A nivel hepático puede ocurrir un aumento moderado de las transaminasas que es más frecuente cuando se utilizan dosis altas de estatinas. A dosis bajas o medias afecta a <1% de los pacientes, mientras que a dosis altas la incidencia es de un 1-2%. Sin embargo, dicho aumento no se ha relacionado con un mecanismo de hepatotoxicidad, sino con una respuesta a la disminución hepática de colesterol o a otros mecanismos fisiológicos. Por otra parte, es frecuente que en los pacientes que presentan un incremento de las transaminasas durante el tratamiento con estatinas coexistan otras causas del mismo, y también que los niveles se normalicen a pesar de mantener el tratamiento. Pese a ello, se recomienda la interrupción de las estatinas cuando la concentración de transaminasas supera 3 veces el valor máximo del intervalo de referencia.
A nivel muscular, el efecto secundario más frecuente es la aparición de mialgias o debilidad muscular, con frecuencia sin aumentos de las enzimas musculares, que pueden persistir largo tiempo si se mantiene el tratamiento. También puede ocurrir un aumento de las enzimas musculares sin aparición de sintomatología. La incidencia de miopatía es mayor cuando se utilizan dosis altas de estatinas41 y parece ser superior con estatinas lipofílicas metabolizadas a través de la isoenzima 3A4 del citocromo P450, como la simvastatina, que con estatinas hidrofílicas no metabolizadas por esta vía como la pravastatina y la rosuvastatina que parecen estar sujetas a una menor captación por las células musculares estriadas42. La incidencia de afectación muscular es muy variable según las series y oscila entre un 0,1-1% de algunas43 a más del 10% en otras44. Dicha incidencia ha sido muy superior en los estudios de práctica clínica convencional que en los ensayos clínicos. La aparición de una rabdomiólisis, que cursa con destrucción del tejido muscular y afectación renal, es la complicación más grave del tratamiento con estatinas. Su incidencia es muy rara, y suele ocurrir en los pacientes en los que no se tienen en cuenta los factores predisponentes que aumentan la exposición del tejido muscular a estos fármacos, como la insuficiencia hepática o renal, o las interacciones farmacológicas. En un informe del sistema de registro de efectos adversos, la FDA comunicó una incidencia de rabdomiólisis mortal de un caso por cada millón de prescripciones de estatina45. Para prevenir dicha complicación se recomienda realizar una valoración clínica adecuada de la debilidad y de las molestias musculares, y en los pacientes en situación de mayor riesgo de miopatía, entre ellos los de edad avanzada, los de pequeño volumen corporal, con disfunción tiroidea, hepática o renal, miopatías de base genética y los tratados con múltiples fármacos, informar de los síntomas de miopatía, utilizar estatinas con menor potencial de interacciones a dosis bajas o medias y monitorizar las enzimas musculares. En los pacientes que se detecte un aumento enzimático superior a cinco veces el límite máximo de referencia hay que interrumpir el tratamiento con estatinas46,47.
Otros riesgos de las estatinasEl efecto del tratamiento con estatinas de alta intensidad sobre la función renal es controvertido. En dos amplios metaanálisis que incluyeron 15 y 11 estudios se observó que tanto la rosuvastatina como la atorvastatina mejoraban el filtrado glomerular en comparación con el tratamiento con placebo o con los cuidados habituales48,49. En un metaanálisis de 36 estudios con rosuvastatina en los que se habían incluido 40.600 pacientes se observaron 536 casos de afectación renal que afectaron con mayor frecuencia a los pacientes con factores de riesgo de nefropatía, entre ellos los hipertensos, diabéticos, con insuficiencia cardiaca o disfunción renal50. En dicho metaanálisis se concluyó que el uso de rosuvastatina no se asociaba a un mayor riesgo de deterioro de la función renal que el placebo. En cuanto a la utilización de estatinas en los pacientes con nefropatía, en dos metaanálisis se observó que estos fármacos no deterioraban la función renal, sino que existía una tendencia a la estabilidad o a la mejora de esta51,52. Así mismo, cuando se excluyeron los pacientes que se encontraban en programa de hemodiálisis se constató una disminución de la mortalidad y de la incidencia de ECV. Por contra, se ha descrito una asociación entre el tratamiento con estatinas y la aparición de proteinuria y hematuria, que en el caso de la rosuvastatina es más evidente cuando se utiliza la dosis máxima de 40mg/día53. En dos estudios observacionales de carácter transversal la incidencia de microalbuminuria fue mayor en los pacientes tratados con estatinas54,55, si bien dicho fenómeno fue atribuido a una inhibición de la reabsorción tubular de la albumina y no a una lesión estructural del parénquima renal.
Por otro lado, las estatinas han sido relacionadas con una alteración del metabolismo de la glucosa. El análisis de los datos de 13 ensayos clínicos con estatinas en los que se habían incluido 91.140 pacientes demostró que el uso de estos fármacos se asociaba a un incremento del riesgo de diabetes de un 9%, lo que en términos absolutos suponía la aparición de un caso de diabetes por cada 255 pacientes tratados con estatinas durante 4 años56, un número muy inferior al de casos de ECV evitados, incluyendo a la población afecta de diabetes o en situación de riesgo de presentarla57. La magnitud de dicho efecto negativo parece ser algo mayor con el uso de tratamientos de alta intensidad que con el uso de tratamientos de intensidad moderada (razón de odds, 1,12; IC 95%, 1,04-1,22)58. Con referencia a los tratamientos de alta intensidad, en un estudio sobre los efectos hipocolesteremiantes de la rosuvastatina a dosis de 40mg/día y de atorvastatina a dosis de 80mg/día en una población diabética, ambas incrementaron la HbA1c, de 7,6±1,0% a 7,9±1,2% (p=0,001) y de 7,4±1,0% a 7,7±1,3% (p=0,003), respectivamente59. También se ha observado una relación lineal entre la duración y la dosis acumulada de cualquier estatina y el riesgo de diabetes60. Por otra parte, a raíz de una amplia base de datos de los estudios observacionales y de los ensayos clínicos se ha postulado que la pitavastatina podría inducir un menor riesgo de diabetes61.
Por último, se ha prestado atención a los efectos de las estatinas sobre la función cognitiva, sin que pueda establecerse una relación de causalidad, tanto en sentido positivo como negativo62.
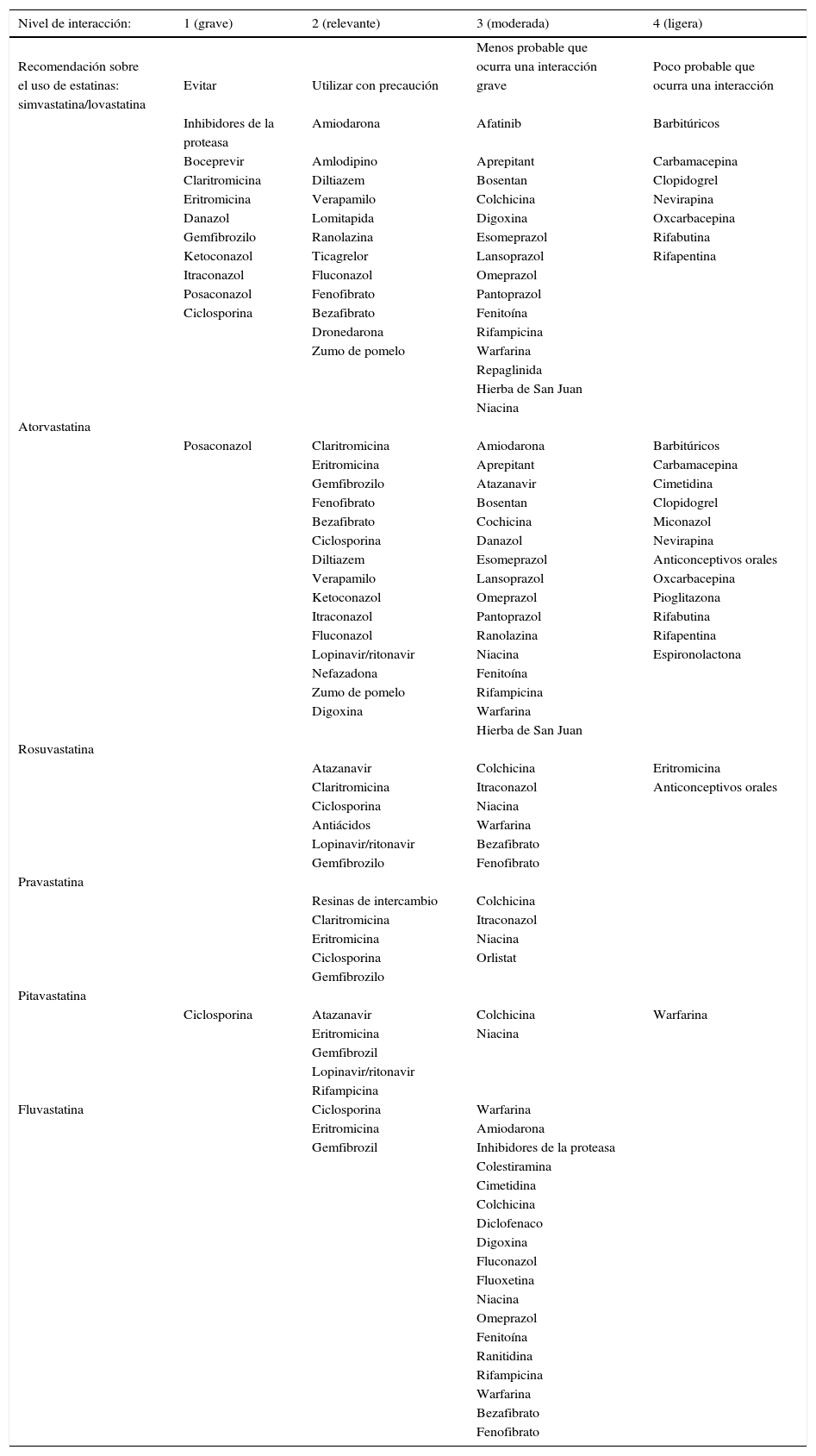
Las interacciones farmacológicas como causa de efectos secundarios por estatinasLas asociaciones inadecuadas de fármacos son una de las causas principales de aparición de efectos secundarios por estatinas y también por otros agentes63. Las estatinas que se metabolizan por la isoenzima 3A4 del citocromo P450, lovastatina, simvastatina y atorvastatina, interactúan con un gran número de fármacos que inhiben o utilizan esta vía de eliminación y por ello presentan un mayor potencial de efectos secundarios. En la tabla 2 se muestran los principales fármacos que interactúan con las distintas estatinas64. Los antifúngicos azólicos, los macrólidos, la ciclosporina, los bloqueadores de los canales del calcio y de los receptores 2 de histamina interactúan con dichas estatinas. Debido a su alto potencial de interacciones, la FDA emitió la recomendación de limitar las dosis de simvastatina en los pacientes tratados con fármacos eliminados a través de la isoenzima 3A4, entre ellos los calcioantagonistas, amlodipino, verapamilo y diltiacem65. La pravastatina, la rosuvastatina y la pitavastatina se metabolizan por vías independientes del citocromo P450 3A4. Otras características farmacológicas de las estatinas que se han barajado en la valoración de su tolerancia y seguridad son su grado de hidrofilia o lipofilia, la selectividad de su acción en el tejido hepático y su grado de unión a las proteínas plasmáticas y otras características66. Cabe destacar que en la población japonesa y china las concentraciones plasmáticas de rosuvastatina que se alcanzan después de una determinada dosis del fármaco son de aproximadamente el doble a las de la población caucásica, por lo que en la población de origen asiático en general se ha recomendado iniciar el tratamiento con dosis de 5mg/día67. Al parecer dichas diferencias étnicas se deben a la distinta prevalencia del polimorfismo 421C>A del gen de un transportador que interviene en el eflujo de fármacos, el ABCG268. Por otra parte, determinados polimorfismos del gen SCLO1B1 que regula la captación hepática de las estatinas y de otros fármacos, y que influyen en una mayor incidencia de miotoxicidad por simvastatina, no parecen influir en el riesgo de toxicidad por rosuvastatina, según datos del estudio JUPITER69.
Principales interacciones farmacológicas de las distintas estatinas
| Nivel de interacción: | 1 (grave) | 2 (relevante) | 3 (moderada) | 4 (ligera) |
|---|---|---|---|---|
| Menos probable que | ||||
| Recomendación sobre | ocurra una interacción | Poco probable que | ||
| el uso de estatinas: | Evitar | Utilizar con precaución | grave | ocurra una interacción |
| simvastatina/lovastatina | ||||
| Inhibidores de la | Amiodarona | Afatinib | Barbitúricos | |
| proteasa | ||||
| Boceprevir | Amlodipino | Aprepitant | Carbamacepina | |
| Claritromicina | Diltiazem | Bosentan | Clopidogrel | |
| Eritromicina | Verapamilo | Colchicina | Nevirapina | |
| Danazol | Lomitapida | Digoxina | Oxcarbacepina | |
| Gemfibrozilo | Ranolazina | Esomeprazol | Rifabutina | |
| Ketoconazol | Ticagrelor | Lansoprazol | Rifapentina | |
| Itraconazol | Fluconazol | Omeprazol | ||
| Posaconazol | Fenofibrato | Pantoprazol | ||
| Ciclosporina | Bezafibrato | Fenitoína | ||
| Dronedarona | Rifampicina | |||
| Zumo de pomelo | Warfarina | |||
| Repaglinida | ||||
| Hierba de San Juan | ||||
| Niacina | ||||
| Atorvastatina | ||||
| Posaconazol | Claritromicina | Amiodarona | Barbitúricos | |
| Eritromicina | Aprepitant | Carbamacepina | ||
| Gemfibrozilo | Atazanavir | Cimetidina | ||
| Fenofibrato | Bosentan | Clopidogrel | ||
| Bezafibrato | Cochicina | Miconazol | ||
| Ciclosporina | Danazol | Nevirapina | ||
| Diltiazem | Esomeprazol | Anticonceptivos orales | ||
| Verapamilo | Lansoprazol | Oxcarbacepina | ||
| Ketoconazol | Omeprazol | Pioglitazona | ||
| Itraconazol | Pantoprazol | Rifabutina | ||
| Fluconazol | Ranolazina | Rifapentina | ||
| Lopinavir/ritonavir | Niacina | Espironolactona | ||
| Nefazadona | Fenitoína | |||
| Zumo de pomelo | Rifampicina | |||
| Digoxina | Warfarina | |||
| Hierba de San Juan | ||||
| Rosuvastatina | ||||
| Atazanavir | Colchicina | Eritromicina | ||
| Claritromicina | Itraconazol | Anticonceptivos orales | ||
| Ciclosporina | Niacina | |||
| Antiácidos | Warfarina | |||
| Lopinavir/ritonavir | Bezafibrato | |||
| Gemfibrozilo | Fenofibrato | |||
| Pravastatina | ||||
| Resinas de intercambio | Colchicina | |||
| Claritromicina | Itraconazol | |||
| Eritromicina | Niacina | |||
| Ciclosporina | Orlistat | |||
| Gemfibrozilo | ||||
| Pitavastatina | ||||
| Ciclosporina | Atazanavir | Colchicina | Warfarina | |
| Eritromicina | Niacina | |||
| Gemfibrozil | ||||
| Lopinavir/ritonavir | ||||
| Rifampicina | ||||
| Fluvastatina | Ciclosporina | Warfarina | ||
| Eritromicina | Amiodarona | |||
| Gemfibrozil | Inhibidores de la proteasa | |||
| Colestiramina | ||||
| Cimetidina | ||||
| Colchicina | ||||
| Diclofenaco | ||||
| Digoxina | ||||
| Fluconazol | ||||
| Fluoxetina | ||||
| Niacina | ||||
| Omeprazol | ||||
| Fenitoína | ||||
| Ranitidina | ||||
| Rifampicina | ||||
| Warfarina | ||||
| Bezafibrato | ||||
| Fenofibrato |
Simvastatina/lovastatina.
Otras interacciones de nivel 1: cobicistat, elvitegravir, telaprevir, tenofovir, delavirdina, emtricitabina, voriconazol, nefazadona, telitromicina.
Otras interacciones de nivel 2: conivaptan, efavirenz, imatinib, simeprivir, troleandomicina.
Otras interacciones de nivel 3: fosaprepitant, dalfopristina/quinupristina, daptomicina, fluvoxamina, fosfenitoína, niacinamida, quinina, antiácidos, colestipol.
Atorvastatina.
Otras interacciones de nivel 2: fosamprenavir, nelfinavir, saquinavir, simeprevir, voriconazol, telitromicina.
Otras interacciones de nivel 3: fosaprepitant, dalfopristina/quinupristina, daptomicina, efavirenz, indinavir, mifepristona, nilotinib, niacinamida, quinina.
Rosuvastatina.
Otras interacciones de nivel 2: conivaptan, nelfinavir, saquinavir, simeprivir, telitromicina.
Otras interacciones de nivel 3: daptomicina, darunavir, indinavir, niacinamida.
Pravastatina.
Otras interacciones de nivel 2: darunavir, simeprevir, telitromicina.
Pitavastatina.
Otras interacciones de nivel 2: fosaprenavir, saquinavir, simeprevir, tripanavir, telitromicina, telitromicina.
Otras interacciones de nivel 3: raltegravir.
Fluvastatina.
Otras interacciones de nivel 2: daptomicina, delavirdina, efavirenz, fluvoxamina, gliburida, imatinib, nilotinib, sulfinpirazona, sulfonamidas.
Otras interacciones de nivel 3: voriconazol.
Todas las estatinas tienen una interacción de nivel 1 con la levadura de arroz rojo por el contenido de esta en monacolina K.
Modificado a partir de Sullivan et al.76.
Pese a la importancia de las interacciones farmacológicas en la aparición de efectos secundarios por estatinas, en la práctica médica habitual aún se tienen en cuenta de forma insuficiente. En un estudio observacional, transversal, de base poblacional con 7.880 pacientes que eran tratados con estatinas, un 21,5% lo eran con estatinas metabolizadas por el CYP 450 3A4 y al mismo tiempo con otro fármaco metabolizado por esta misma vía. No hubo diferencias en la frecuencia de utilización de estatinas metabolizadas o no por el CYP3A4, en función de si los pacientes recibían también fármacos metabolizados por esa misma vía (22 frente a 21%, respectivamente). A su vez, un 60% de los médicos refería tener muy en cuenta la posibilidad de interacción a la hora de seleccionar las estatinas y un 56% disponía de programas informáticos que alertaban del riesgo de interacciones, pero ello no determinaba una mejor práctica clínica en la prevención de dichas interacciones70.
Nuevos agentes en el tratamiento de la hipercolesterolemiaComo se ha comentado previamente, a pesar de la alta eficacia de las estatinas en el control de la hipercolesterolemia y del efecto potenciador de la ezetimiba, un alto porcentaje de pacientes no alcanzan un control óptimo de la hipercolesterolemia, a pesar del uso adecuado de dichos fármacos. Existe por ello la necesidad de disponer de nuevos agentes para mejorar la eficacia del tratamiento de la hipercolesterolemia, sobre todo en los pacientes de alto RCV. Entre ellos, se encuentra una nueva familia que neutraliza la actividad de la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9)71. La proteína PCSK9 favorece la destrucción del receptor LDL interfiriendo su reciclaje fisiológico. Como consecuencia de ello disminuye la actividad del receptor LDL y el aclaramiento plasmático de las LDL, con lo que la concentración plasmática de cLDL aumenta. La inhibición de la proteína PCSK9 se ha realizado con distintos agentes. Los que han sido mejor estudiados mediante amplios programas de ensayos clínicos son los anticuerpos (Ac) monoclonales. Entre ellos, evolocumab (Amgen Thousand Oaks, CA, EE.UU.; NCT01764633) y alirocumab (Sanofi/Regeneron Paris, Francia and Tarrytown, NYm EE. UU.; NCT01663402) son los que se encuentran en fase más avanzada de investigación, seguidos de bococizumab (Pfizer Nueva York, NY, EE. UU.; NCT01975376). Los dos primeros han sido aprobados para uso clínico por la FDA y la European Medicines Agency. Actualmente están en marcha distintos programas de investigación con Ac anti-PCSK9 en los que está previsto incluir más de 60.000 pacientes72.
Los Ac monoclonales anti-PCSK9 disminuyen el cLDL por encima del 60%, y también, aunque en un porcentaje algo menor, el colesterol no-HDL y la apolipoproteína B (apo B)73. En los ensayos clínicos de fase 2, estos agentes han demostrado su eficacia para disminuir el colesterol, tanto asociados a otros agentes hipolipemiantes, como en monoterapia74, y tanto en pacientes con distintas dislipemias, como en los pacientes con intolerancia a las estatinas75–77. Los Ac anti-PCSK9 inducen un descenso moderado y variable de los triglicéridos y un incremento promedio del cHDL y de la apolipoproteína A1 superior al 8 y al 5%, respectivamente78. Así mismo, disminuyen la lipoproteína(a), una lipoproteína de alto potencial aterogénico, alrededor de un 30%79. Actualmente se están estudiando los efectos de estos agentes en prevención cardiovascular en distintos ensayos de fase 3, entre los cuales están el estudio Further Cardiovascular Outcomes Research with PCSK9 Inhibition in Subjects With Elevated Risk y el estudio Odyssey Outcome. En un análisis preliminar del Odyssey Long Term Study sobre la eficacia y tolerancia de alirocumab en 2.341 pacientes de alto RCV con un cLDL igual o superior a 70mg/dl a pesar de seguir tratamiento con una estatina a la dosis máxima tolerada asociada, o no, a otros fármacos hipolipemiantes, alirocumab disminuyó el cLDL un promedio de un 62% y en un análisis post hoc de seguridad tras un seguimiento de al menos 52 semanas, se observó una disminución del RCV de un 54% (razón de riesgo=0,46 (IC 95%: 0,26 a 0,82)80. Así mismo, en dos ensayos clínicos abiertos y aleatorizados (OSLER-1 y OSLER-2) en los que se incluyeron un total de 4.465 pacientes tratados con evolocumab asociado a la terapia convencional o únicamente con esta última, evolocumab disminuyó el cLDL un 61% y la incidencia de ECV a los 11 meses un 53%81. Además de sus notables efectos hipolipemiantes y de sus muy probables efectos preventivos frente a la ECV, un aspecto destacable de estos agentes es su buena tolerancia y alto nivel de seguridad observado en los ensayos clínicos. Ya que los Ac anti-PCSK9 van a tener, de forma previsible, un alto coste económico, su uso quedará restringido, al menos en un primer periodo, a los pacientes que puedan beneficiarse en mayor medida de su utilización. Estos podrían ser los afectos de hipercolesterolemia familiar o con ECV en los que no se pueda lograr un control óptimo de la hipercolesterolemia a pesar del uso de estatinas de alta intensidad asociadas o no a ezetimiba, o a otros fármacos.
En conclusión, las estatinas son fármacos de alta eficacia para disminuir la concentración plasmática de lipoproteínas aterogénicas y prevenir las enfermedades cardiovasculares. Las guías de práctica clínica recomiendan el uso de estatinas de alta intensidad para disminuir el cLDL al menos un 50% en los pacientes con ECV y en los de alto RCV, si bien existen discrepancias entre ellas sobre la necesidad de definir objetivos terapéuticos del cLDL. Las estatinas son fármacos seguros, cuyos principales efectos secundarios se sitúan a nivel hepático y muscular. La incidencia de dichos efectos es mayor cuando se utilizan estatinas con mayor potencial de interacciones farmacológicas, sobre todo las metabolizadas a través del CYP 450 3A4 y la aparición de efectos graves obedece en la mayoría de los casos a un uso inadecuado de estos fármacos, en particular al no tener en cuenta los factores predisponentes a los mismos. Pese al seguimiento adecuado del tratamiento con estatinas de alta intensidad, un porcentaje significativo de pacientes de alto RCV no alcanzan una disminución suficiente del cLDL. La asociación con ezetimiba es una estrategia eficaz para potenciar el efecto hipocolesterolemiante de las estatinas que incrementa su efecto preventivo frente a la ECV. La disponibilidad de nuevos agentes hipolipemiantes de alta potencia, en particular los Ac monoclonales anti-PCSK9, abre un nuevo horizonte en la prevención y tratamiento de la aterosclerosis.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.