Nuevos horizontes en el tratamiento de la hipercolesterolemia
Más datosLa aterosclerosis es una enfermedad crónica que comienza en la primera infancia, y sin intervención, progresa a lo largo de la vida, e inevitablemente empeora con el tiempo, en ocasiones de forma acelerada. El colesterol LDL, más allá de ser un factor de riesgo cardiovascular, es agente causal de la aterosclerosis. Sin colesterol LDL no hay aterosclerosis, por lo que la evolución de la enfermedad es modificable, e incluso reversible.
Atherosclerosis is a chronic disease that begins in early childhood, and without intervention, progresses throughout life, and inevitably worsens over time, sometimes rapidly. LDL cholesterol, beyond being a cardiovascular risk factor, is a causal agent of atherosclerosis. Without LDL cholesterol there is no atherosclerosis, so the evolution of the disease is modifiable, and even reversible.
Hace unas 5 décadas, el rango superior considerado como «normal» del colesterol vehiculizado por las lipoproteínas de baja densidad (cLDL) en los países occidentales era muy superior al actual, dado que se basaba en datos epidemiológicos, y no en aspectos biológicos. Además, al igual que acontece con otros factores de riesgo cardiovascular, como el tabaquismo, la hipertensión arterial o la diabetes mellitus, el hecho de que no sea únicamente la concentración de cLDL, sino también el tiempo de exposición acumulada, incita a optimizar las estrategias terapéuticas actuales. Es más, hemos de sopesar que el retraso en iniciar un tratamiento hipocolesterolemiante continuará exponiendo a las personas a un riesgo a priori evitable1.
A continuación, vamos a explorar los datos más destacables del desarrollo evolutivo de los fármacos reductores de cLDL, así como aquellos aspectos más imbricados con el metabolismo del colesterol, para profundizar en el papel clave del cLDL en la aterosclerosis y finalizar con las evidencias que apoyan la seguridad y los beneficios cardiovasculares de las situaciones clínicas que se acompañan de bajas concentraciones de cLDL.
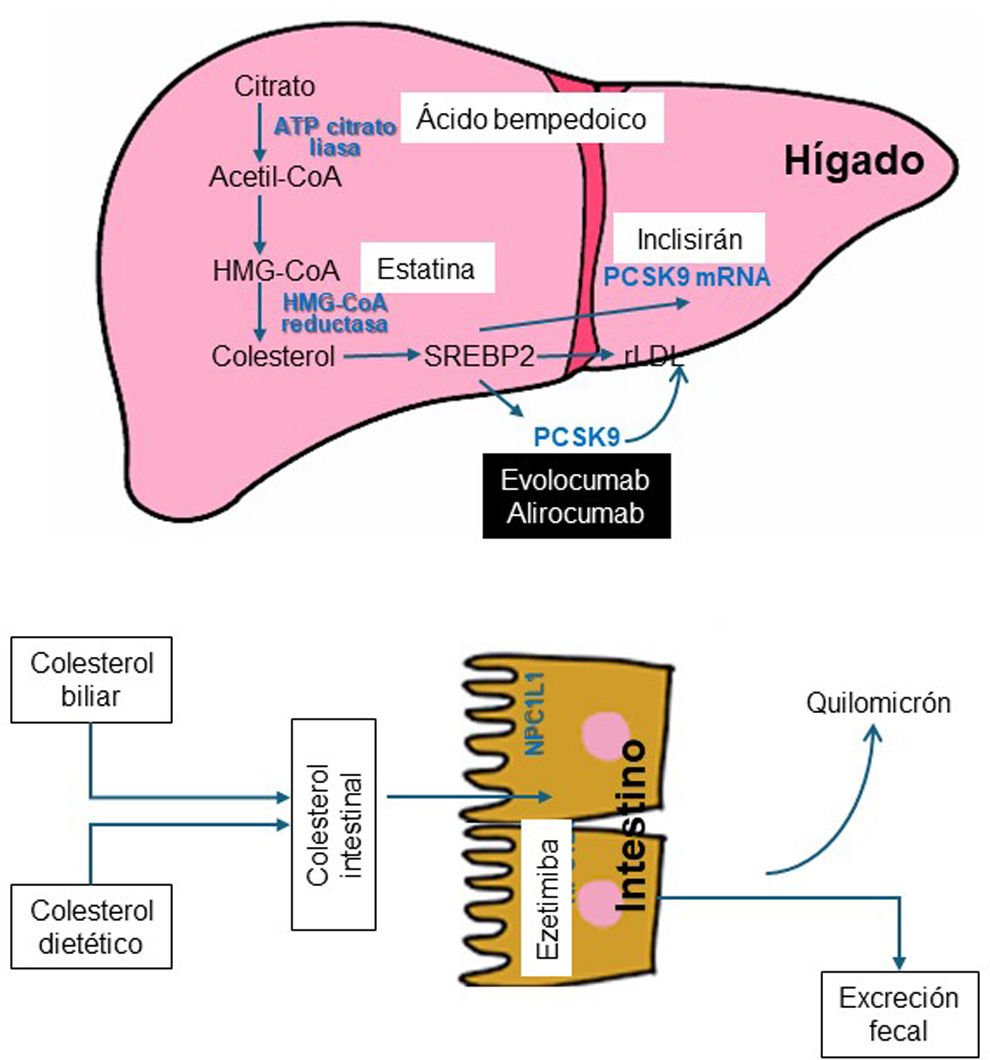
Evolución de los hipolipemiantes: de las estatinas a la actualidadLos mecanismos de acción y el efecto en la concentración de cLDL de los principales fármacos se detallan en la figura 1 y en la tabla 1, respectivamente. Dejando aparte fármacos ancestrales, como los fibratos, la niacina y las resinas, la introducción en 1987 de la primera estatina, la lovastatina, marcó un hito en la medicina cardiovascular al conseguir una reducción del cLDL cercana al 40% con su dosis máxima. Posteriormente, la atorvastatina y la rosuvastatina ampliaron esta reducción hasta el 50%. Los posibles interrogantes del impacto y seguridad de reducir el cLDL se disiparon en gran medida en 1994 con el Scandinavian Simvastatin Survival Study (4S)2 al revelar por primera vez una caída del 30% en la mortalidad total. Este resultado fue corroborado por los estudios Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID)3 y Heart Protection Study (HPS)4. Asimismo, el Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction (PROVE-IT)5 y Treating to New Targets (TNT)6 concluyeron que la estatina de mayor versus menor potencia se asociaba con mayores beneficios cardiovasculares. Desde entonces, las estatinas son los fármacos más utilizados al haber confirmado su eficacia en la prevención de la ECV para todos los grupos etarios y niveles de riesgo vascular7–10. En este punto, es obligado señalar que la reducción del riesgo cardiovascular con las estatinas es fruto de la reducción absoluta del cLDL, de forma que una disminución de 40mg/dl se acompaña de una reducción del 22% en el riesgo.
Reducción media del cLDL con los fármacos hipolipemiantes disponibles en la actualidad
| Fármaco | ↓≈ cLDL |
|---|---|
| Estatina de alta potencia | 50% |
| Estatina de alta potencia + ezetimiba | 65% |
| Ac Mo iPCSK9 (alirocumab/evolocumab) | 60% |
| Inclisirán | 50% |
| Estatina alta potencia + Ac Mo iPCSK9 | 75% |
| Estatina de alta potencia + ezetimiba + Ac Mo iPCSK9 | 85% |
| Ácido bempedoico | 25% |
| Ácido bempedoico + ezetimiba | 40% |
| Estatina de alta intensidad + ácido bempedoico + ezetimiba | 70% |
Ac Mo iPCSK9: anticuerpo monoclonal inhibidor de la proproteína convertasa subtilisina/kexina tipo 9; cLDL: colesterol de las lipoproteínas de baja densidad.
Otras opciones terapéuticas al margen de las estatinas, como la ezetimiba, el inhibidor selectivo del transportador intestinal del colesterol Niemann-Pick C1 like 1 (NPC1L1), introducido en 2001, reduce el cLDL un 21% adicional cuando se combina con una estatina. A partir del 2015, la inclusión en el arsenal terapéutico de los inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9) al tratamiento con estatinas de alta intensidad, con o sin ezetimiba, ha permitido alcanzar concentraciones plasmáticas de cLDL por debajo de los 40mg/dl. Los respectivos estudios clínicos con dichos fármacos, IMPROVE-IT11, FOURIER12 y ODYSSEY OUTCOMES13, objetivaron una reducción incremental de los episodios cardiovasculares no mortales, en consonancia con sus efectos hipolipemiantes, duración del tratamiento, y con la misma disminución de riesgo por unidad de cLDL reducido que las estatinas14. Es más, en conjunto, estos estudios han aportado 2 nuevas enseñanzas que conviene resaltar: el perfil de seguridad en este contexto clínico con concentraciones séricas muy bajas de cLDL, y que este es el único parámetro biológico que no tiene un dintel inferior a partir de cual no se obtienen beneficios cardiovasculares. De hecho, la guía clínica europea 2019 para el control de la dislipemia15 sugiere como objetivo terapéutico un nivel de cLDL<40mg/dl en aquellos pacientes que han presentado más de un episodio cardiovascular grave.
En el año 2020 la Food and Drug Administration y la European Medicines Agency licitaron un nuevo hipolipemiante oral, el ácido bempedoico, que inhibe la biosíntesis del colesterol bloqueando la adenosina trifosfato-citrato liasa (ACL), en un paso metabólico más precoz que las estatinas, y cuyo resultado es la reducción del cLDL un 25% en monoterapia y un 40% asociado a la ezetimiba. En el estudio CLEAR-Outcomes16, después de un seguimiento medio de 40,6 meses en pacientes intolerantes a estatinas, el tratamiento con ácido bempedoico 180mg/día se asoció con una disminución significativa del 13% en el riesgo de episodios cardiovasculares.
Finalmente, y de más reciente disponibilidad está el inclisirán, un ácido ribonucleico de interferencia pequeño (ARNip) bicatenario, en el que la cadena sentido está conjugada con un complejo de N-acetilgalactosamina triantenaria (GalNAc) para facilitar su captación por los hepatocitos, en los que despliega el mecanismo de interferencia del ARN y la rotura catalítica del ARNm de la PCSK9. Los estudios de eficacia han corroborado que con una administración semestral (después de una dosis inicial y otra a los 3 meses) por vía subcutánea se alcanza una reducción media del 50% en los niveles de cLDL. En la actualidad, hay 3 estudios clínicos en curso con inclisirán para demostrar sus posibles beneficios cardiovasculares17.
Metabolismo del colesterolEl colesterol es una molécula esencial para modular la fluidez de las membranas celulares, el funcionamiento de los transportadores celulares y de los sistemas de señalización intracelular; asimismo, es un precursor de la mielina, las sales biliares, la vitamina D, las hormonas esteroideas y juega un papel clave en el mantenimiento de la impermeabilidad cutánea. Todas las células somáticas, incluidos los astrocitos y los oligodendrocitos, sintetizan colesterol a través de la misma vía que utiliza el hígado, incluso, cuando la concentración plasmática del cLDL es baja; además, pueden obtener pequeñas cantidades de colesterol procedente de las lipoproteínas de alta densidad (HDL). De hecho, ningún tejido depende de la transferencia de colesterol a partir del cLDL18.
Por lo que respecta a su catabolismo, el organismo humano es incapaz de metabolizar el colesterol al no poder romper su esqueleto central constituido por el anillo ciclopentanoperhidrofenantreno, hecho que pone de relieve la importancia de la homeostasis del colesterol mediante el equilibrio entre la síntesis endógena, la absorción intestinal y la excreción de los ácidos biliares. Todo ello justifica el interés depositado en los mecanismos de síntesis intracelular y absorción intestinal del colesterol como dianas terapéuticas para disminuir la colesterolemia (fig. 1).
La hipercolesterolemia a expensas de la fracción LDL, y su consiguiente acúmulo en los tejidos como la esclerótica, dermis y tendones, pero principalmente en la pared arterial puede comportar complicaciones graves. En este sentido, la ECV, especialmente la enfermedad cardiaca coronaria y el ictus isquémico aterotrombótico, son la principal causa de mortalidad en el mundo y uno de los principales factores de discapacidad19.
LDL como agente etiológico de la arteriosclerosisLas lipoproteínas de muy baja densidad (VLDL) son sintetizadas en el hígado y liberadas al torrente circulatorio para transportar triglicéridos y vitaminas liposolubles a los tejidos; también, contienen colesterol esterificado que las estabiliza. La lipoproteínlipasa (LPL) libera ácidos grasos de los triglicéridos de los quilomicrones y de las VLDL, convirtiendo a estas últimas en lipoproteínas de densidad intermedia (IDL) y, posteriormente, en LDL. Por tanto, las partículas LDL son esencialmente un subproducto, y su eliminación de la circulación se logra fundamentalmente a través de los receptores LDL en la superficie de los hepatocitos, que se unen a la apolipoproteína (apo) B de la partícula LDL. Debido a que el LDL no tiene otra función esencial que reciclar el colesterol de regreso al hígado, un cLDL plasmático muy bajo es compatible con la salud, siempre y cuando los demás componentes del lipidoma se encuentran dentro de la normalidad.
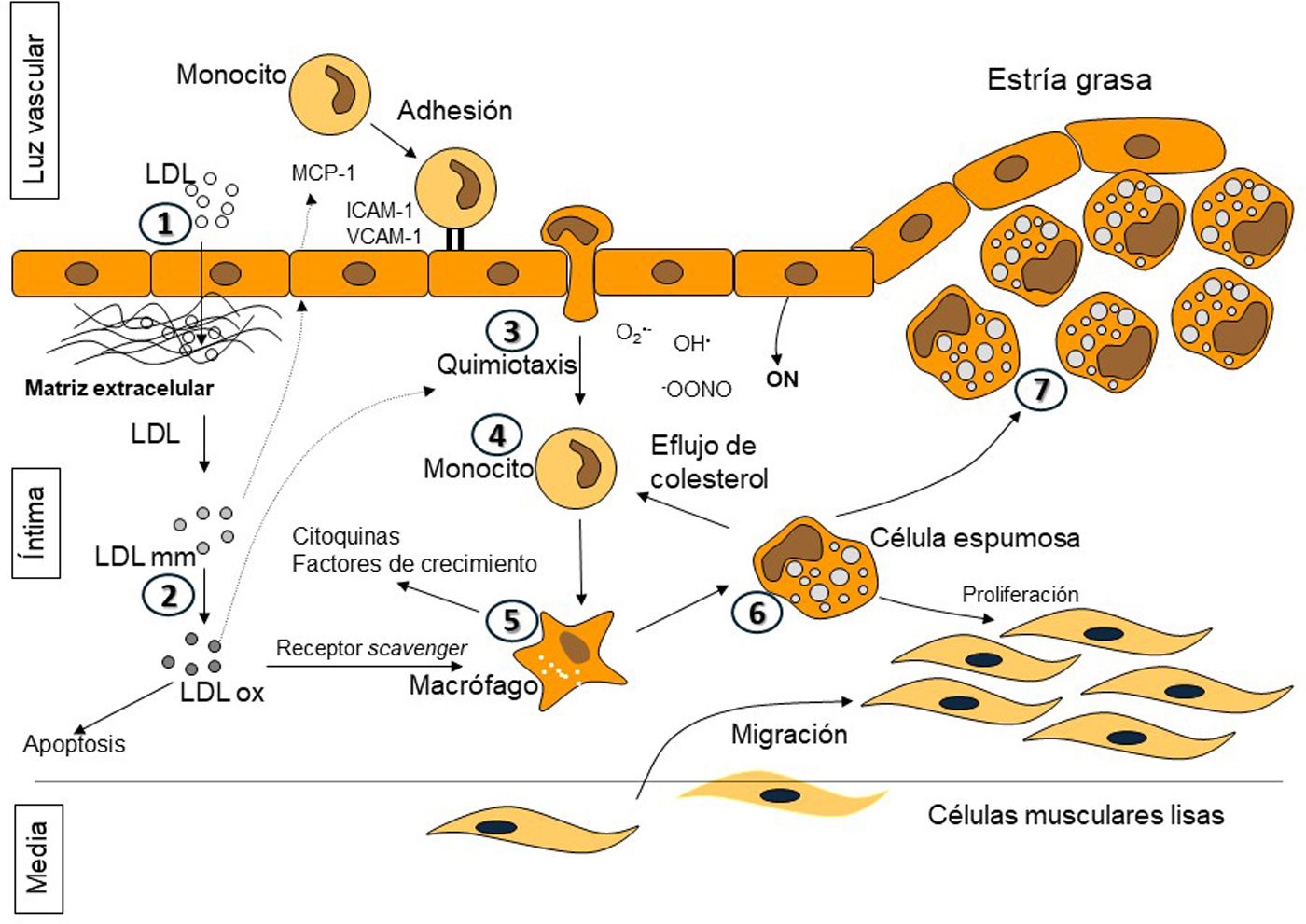
Aunque todavía quedan enigmas por resolver en la aterogénesis, su fisiopatología ha sido ampliamente estudiada, concluyendo que el cLDL es un tóxico vascular20,21 (fig. 2). El proceso central que subyace al inicio y progresión de la placa de ateroma es la entrada y retención de las LDL en el espacio subendotelial. Normalmente, la mayor parte de las partículas LDL que atraviesan el endotelio y entran en la íntima, suelen regresar a la circulación; sin embargo, en presencia de determinados factores de riesgo cardiovascular o alteración del flujo laminar, aumenta la probabilidad de que las partículas de LDL se adhieran a los proteoglicanos de la íntima y queden retenidas in situ, lo que conduce a un acúmulo progresivo con el tiempo en la pared arterial22. Estas partículas LDL retenidas son fagocitadas por los macrófagos, convirtiéndose en células espumosas. Finalmente, la liberación crónica de citocinas y otros mediadores inflamatorios y trombóticos conducen a una inflamación desadaptativa, apoptosis y activación de vías protrombóticas20,21.
Etapas en la formación de la placa de ateroma. 1-2: entrada de las lipoproteínas de baja densidad (LDL) en el espacio subendotelial y posterior modificación; 3-5: liberación de factores de crecimiento y citoquinas que promueven la diapédesis de los monocitos hacia la íntima y su diferenciación a macrófagos; 6: formación de células espumosas debido a la internalización de las LDL modificadas y oxidadas y 7: establecimiento de la estría grasa por acúmulo de células espumosas.
Más allá de las LDL, otras lipoproteínas que contienen apoB de hasta 70nm de diámetro incluidas las IDL, las VLDL más pequeñas, las partículas remanentes de quilomicrones y la lipoproteína(a), también atraviesan el endotelio y penetran en la íntima arterial. Las lipoproteínas ricas en triglicéridos pueden tener dificultades para salir de la íntima por su mayor tamaño o quedar atrapadas por componentes de la misma22. Mientras las LDL requieren su modificación para ser absorbidas por los macrófagos, las partículas remanentes son captadas por miembros de la familia del receptor LDL en su estado nativo. Además, la hidrólisis de los triglicéridos por la LPL a partir de las partículas remanentes incrementa la respuesta inflamatoria de los macrófagos21.
En general, todo este proceso ocurre durante décadas, por lo que pueden diferenciarse diferentes «etapas» en la aterosclerosis23,24 (fig. 1). Por tanto, es fácil comprender que se trata de una enfermedad crónica que empieza en la primera infancia, y sin intervención, progresa a lo largo de la vida, e inevitablemente empeora con el tiempo, en ocasiones de forma acelerada. Al final de la adolescencia, la prevalencia de lesiones ateroscleróticas reversibles (clase 1-3 de la American Heart Association) está directamente relacionada con los factores convencionales de riesgo cardiovascular; hacia los 30-35 años, se desarrollan lesiones avanzadas (clase 4-5 de la American Heart Association) en los mismos lugares y una relación similar con el riesgo25. El ritmo y el grado en que esto ocurre varía entre individuos, pero sin lugar a dudas la progresión está relacionada con la edad. Las placas complejas de mayor tamaño pueden romperse o erosionarse e iniciar la trombosis de los vasos intraluminales, su oclusión y el posterior infarto de órganos internos26. Por lo tanto, el proceso patológico fundamental que subyace en un episodio cardiovascular es el desarrollo de placa aterosclerótica de alto riesgo. En consecuencia, el diagnóstico precoz y el tratamiento intensivo de la aterosclerosis pueden ser la mejor estrategia para eliminar el riesgo cardiovascular.
El impacto mantenido del cLDL elevado en la progresión de la enfermedad aterosclerosa se ejemplifica en los individuos con hipercolesterolemia familiar, que al estar expuestos desde el nacimiento a concentraciones muy altas de cLDL, presentan complicaciones cardiovasculares antes de los 15 años en la forma homocigota, y a la edad adulta joven en la forma heterocigota, si no reciben tratamiento farmacológico hipolipemiante. Por otra parte, los modernos estudios de regresión con ecografía intravascular aplicando novedosas técnicas de análisis de imagen han mostrado que la consecución de bajos niveles de cLDL gracias a la terapia combinada de estatinas e inhibidores de PCSK9, se acompaña de efectos beneficiosos en la composición de la placa junto a una disminución de la carga aterosclerótica27; por tanto, en este escenario clínico estamos realizando un tratamiento etiológico de la enfermedad.
cLDL bajo: ciencia o ficciónLa seguridad de las concentraciones plasmáticas bajas o muy bajas de cLDL está avalada por las evidencias de diferentes situaciones clínicas que expondremos a continuación.
Es conocido que las concentraciones de cLDL son mucho más bajas en los recién nacidos que en los niños o en los adultos. Khoury et al.28 describieron que el cLDL medio en 122 muestras de sangre del cordón umbilical era de 23±10mg/dl. De forma similar, un estudio nacional con un mayor tamaño muestral arrojó una concentración de 35mg/dl29.
Además de este irrefutable testimonio fisiológico, cabe subrayar que nuestros antepasados, pertenecientes a sociedades primitivas cazadoras-recolectoras, mientras todavía seguían su estilo de vida indígena, no desarrollaron signos de aterosclerosis, incluso en aquellos que vivieron hasta la séptima y octava décadas de la vida. Estas poblaciones tenían una colesterolemia entre 100 y 150mg/dl con niveles estimados de cLDL de 50 a 75mg/dl30.
Por otra parte, hay mutaciones genéticas que cursan con bajas concentraciones de cLDL, y casi todas ellas están asociadas con un menor riesgo de ECV20. Por lo tanto, heredar un alelo reductor del cLDL en uno de estos genes es análogo a estar asignado aleatoriamente a una terapia reductora del cLDL. Existe una relación lineal dosis dependiente entre la magnitud absoluta de la exposición de por vida a un cLDL bajo y el correspondiente riesgo vascular. Esta relación es similar a la existente entre la reducción absoluta del cLDL y la proporcional de los episodios cardiovasculares observada en los ensayos de intervención farmacológica. Sin embargo, la pendiente de estas relaciones es mucho más pronunciada para la exposición de por vida determinada genéticamente a un cLDL más bajo en comparación con la exposición a un cLDL más bajo mediada por fármacos a corto plazo, lo que implica que el LDL tiene efectos causales y acumulativos en el riesgo de la ECV. Es más, cuando se ajusta a una disminución estándar en cLDL, cada una de las variantes genéticas asociadas con cLDL tiene un efecto similar en el riesgo de ECV por unidad de LDL más bajo, incluidas las mutaciones en los genes que codifican las dianas de los fármacos utilizados para reducir el cLDL como las estatinas, ezetimiba y los inhibidores de PCSK9. En definitiva, los estudios de aleatorización mendeliana aportan datos robustos del papel causal del LDL en el riesgo de ECV, y de que este efecto es en gran medida independiente del mecanismo de reducción del cLDL.
ConclusiónEn referencia al papel de la hipercolesterolemia, a expensas del aumento del cLDL, en el continuum del riesgo cardiovascular, cuando un paciente presenta un episodio cardiovascular, ya sea coronario o extracoronario, se sitúa en el ámbito de la prevención secundaria; ésta debe interpretarse desde el punto de vista fisiopatológico como el fracaso de la prevención primaria. La reducción del cLDL cuanto más bajo mejor en las personas con ECV, aterosclerosis subclínica avanzada, disfunción miocárdica, diabetes o. insuficiencia renal debe ser considerada como el tratamiento etiológico de la enfermedad aterosclerosa, y no una auténtica prevención. El efecto causal de las LDL y de las lipoproteínas que contienen apoB en el riesgo cardiovascular viene condicionado por la magnitud y tiempo de exposición a estas partículas. En ausencia del depósito lipídico en la pared arterial, la inflamación es mínima o nula y, no hay aterosclerosis. Es decir, sin cLDL no hay aterosclerosis, por lo que la evolución de la enfermedad es modificable, e incluso reversible.
Responsabilidades éticasNinguna.
FinanciaciónNovartis Farmacéutica SA ha financiado este monográfico, pero no han intervenido ni en su redacción, ni en su contenido.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Nuevos horizontes en el tratamiento de la hipercolesterolemia», que ha sido financiado por la Sociedad Española de Arteriosclerosis, con patrocinio de Novartis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Declaración sobre el uso de inteligencia artificialLos autores declaran que no han utilizado IA ni tecnologías asistidas por IA en el proceso de redacción del manuscrito.