El uso de fármacos que reducen el colesterol de lipoproteínas de baja densidad (cLDL) ha comportado un descenso significativo del riesgo cardiovascular tanto en la prevención primaria como secundaria. Las estatinas representan la piedra angular del tratamiento hipolipemiante y disminuyen sustancialmente la morbilidad y mortalidad cardiovascular. Sin embargo, todavía existen necesidades clínicas no satisfechas en el control de la dislipemia. De hecho, es difícil alcanzar los objetivos de cLDL en muchos pacientes, particularmente en aquellos con un riesgo cardiovascular alto/muy alto y en aquellos con concentraciones basales muy elevadas. Además, una proporción considerable de pacientes no tolera las dosis máximas de estatinas, principalmente debido a efectos adversos a nivel muscular. En la presente revisión narrativa, resumimos el conocimiento actual de los efectos de los diferentes fármacos hipocolesterolemiantes, incluidos los recientemente aprobados por las agencias reguladoras europea y americana, sobre el perfil lipídico y el riesgo cardiovascular. Dado que los pacientes de difícil control terapéutico pueden beneficiarse de las nuevas terapias combinadas, fruto de la aparición de nuevos fármacos con evidencias clínicas, sería recomendable actualizar las guías clínicas.
The use of low-density lipoprotein cholesterol (LDLc)-lowering medications has led to a significant reduction of cardiovascular risk in both primary and secondary prevention. Statins represent the cornerstone of lipid-lowering treatment and substantially decreases cardiovascular morbidity and mortality. However, there are still unmet clinical needs in the management of dyslipidaemia. Indeed, it is difficult to achieve LDLc targets in many patients, particularly in those at high/very high cardiovascular risk and in those with very high baseline LDLc concentrations. Moreover, a considerable proportion of patients are unable to tolerate maximum statin doses, mostly due to muscle-related adverse effects. In the present narrative review, a summary is presented on the current knowledge on the effects of the different cholesterol-lowering drugs, including those recently approved by European and American regulatory agencies, on lipid profile, and on cardiovascular risk. Since difficult-to-treat patients may benefit from new combination therapies as a result of the emergence of new drugs with clinical evidence, updates of the clinical guidelines would be recommended.
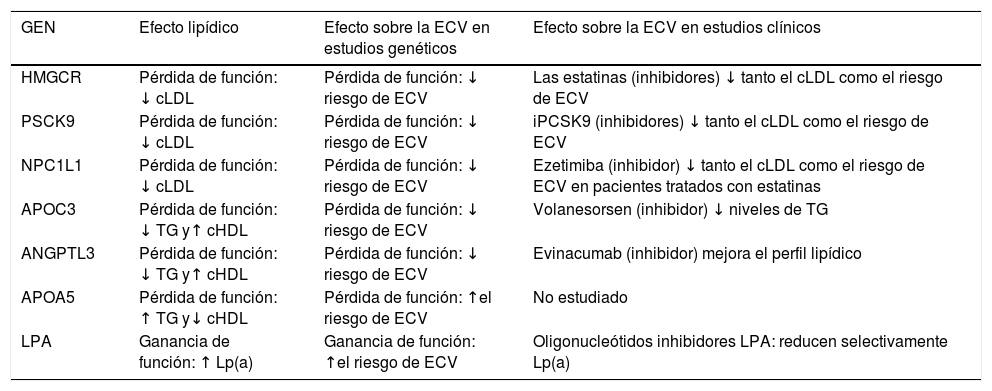
En la actualidad disponemos de fármacos y estrategias hipolipemiantes potentes y eficaces en la reducción del riesgo cardiovascular (RCV), que deben su existencia y descubrimiento, en parte, a las evidencias genéticas (tabla 1). Ejemplos destacados son las estatinas, la ezetimiba y los inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9), que han demostrado que la reducción de la morbimortalidad de la enfemedad cardiovascular (ECV) está mediada por el descenso en los niveles de colesterol de las lipoproteínas de baja densidad (cLDL).
Ejemplos de dianas terapéuticas lipídicas que se han validado en estudios de aleatorización mendeliana
| GEN | Efecto lipídico | Efecto sobre la ECV en estudios genéticos | Efecto sobre la ECV en estudios clínicos |
|---|---|---|---|
| HMGCR | Pérdida de función: ↓ cLDL | Pérdida de función: ↓ riesgo de ECV | Las estatinas (inhibidores) ↓ tanto el cLDL como el riesgo de ECV |
| PSCK9 | Pérdida de función: ↓ cLDL | Pérdida de función: ↓ riesgo de ECV | iPCSK9 (inhibidores) ↓ tanto el cLDL como el riesgo de ECV |
| NPC1L1 | Pérdida de función: ↓ cLDL | Pérdida de función: ↓ riesgo de ECV | Ezetimiba (inhibidor) ↓ tanto el cLDL como el riesgo de ECV en pacientes tratados con estatinas |
| APOC3 | Pérdida de función: ↓ TG y↑ cHDL | Pérdida de función: ↓ riesgo de ECV | Volanesorsen (inhibidor) ↓ niveles de TG |
| ANGPTL3 | Pérdida de función: ↓ TG y↑ cHDL | Pérdida de función: ↓ riesgo de ECV | Evinacumab (inhibidor) mejora el perfil lipídico |
| APOA5 | Pérdida de función: ↑ TG y↓ cHDL | Pérdida de función: ↑el riesgo de ECV | No estudiado |
| LPA | Ganancia de función: ↑ Lp(a) | Ganancia de función: ↑el riesgo de ECV | Oligonucleótidos inhibidores LPA: reducen selectivamente Lp(a) |
cHDL: colesterol de las lipoproteínas de alta densidad; cLDL: colesterol de las lipoproteínas de baja densidad; ECV: enfermedad cardiovascular; Lp(a): lipoproteína(a); TG: triglicéridos.
Las estatinas constituyen la base terapéutica de la prevención cardiovascular a través del control de las concentraciones del cLDL. Su impacto en la reducción de los episodios cardiovasculares está plenamente establecido y sus indicaciones terapéuticas se basan en contundentes evidencias científicas1. De hecho, el tratamiento con estatinas potentes a la máxima dosis tolerada reduce el RCV de forma muy significativa con relación en la no utilización de éstas2. Este efecto está claramente asociado al descenso del cLDL > 50% que son capaces de inducir estos fármacos a altas dosis. Millones de pacientes siguen en la actualidad tratamiento con estatinas, y en muchos casos este tratamiento se ha mantenido durante décadas, hecho que aporta evidencias de fármacovigilancia sobre su seguridad y efectividad a largo plazo, ya que su acción preventiva se mantiene en el tiempo3. A pesar de ello, existe un número no despreciable de pacientes que no tolera la terapia con estatinas.
La vía intestinal: las sales biliares (resinas) y el NPC1L1 (ezetimiba)En 1973, el Lipid Research Clinic Coronary Primary Prevention Trial (LRC-CPPT)4 mostró en 3.806 varones asintomáticos hipercolesterolémicos (> 265 mg/dL) de 35 a 59 años después de un seguimiento medio de 7,4 años, que el grupo de colestiramina, un secuestrador de los ácidos biliares y la clase terapéutica hipolipemiante más novedosa en aquel momento, una reducción del cLDL un 13% mayor que el placebo, así como un descenso del 19% en la tasa de infarto de miocardio no fatal y del 24% en la mortalidad cardiovascular. Sin embargo, la colestiramina se acompañó de efectos secundarios y no consiguió descensos valorables del cLDL en un número considerable de pacientes. Con posterioridad al LRC, no se dispone de información clínica adicional sobre los secuestradores de ácidos biliares.
Por su parte, el estudio IMPROVE-IT5 confirmó que el tratamiento intensivo con dosis altas de simvastatina asociadas a ezetimiba y la consecución de unos valores de cLDL de 53,7 mg/dL, reducía la incidencia de episodios cardiovasculares en mayor medida que el tratamiento con la misma dosis de simvastatina en monoterapia que mantenía unos valores promedio de 69,7 mg/dL.
PCSK9En los últimos años estamos asistiendo al inicio de una nueva era en el tratamiento de las dislipemias con la aparición de los anticuerpos monoclonales frente a PCSK96. Estos agentes han demostrado una capacidad de disminuir el cLDL superior a la de los fármacos hipolipemiantes precedentes (estatinas, ezetimiba, resinas y fibratos), y permiten a priori alcanzar los objetivos terapéuticos en la gran mayoría de los pacientes con hipercolesterolemia7. Por ello, tienen un especial protagonismo en el tratamiento de los pacientes de alto/muy alto RCV, entre los que destacan especialmente aquellos con hipercolesterolemia familiar (HF) y, sobre todo, aquellos con ECV establecida de origen aterotrombótico.
La PCSK9 interfiere en el reciclaje fisiológico del receptor LDL, que cuando no se encuentra bajo la acción de ésta se recicla unas 170 veces al día. De este modo, disminuye la actividad del receptor LDL y el catabolismo de las partículas LDL, dando lugar a un aumento del cLDL8. Los anticuerpos anti-PCSK9 disminuyen el cLDL por encima del 60% y también, aunque en un porcentaje algo menor, el colesterol no unido a las lipoproteínas de alta densidad (HDL) y la apolipoproteína (apo) B. Asimismo, inducen un descenso medio en los niveles de lipoprotína(a) [Lp(a)] de un 27%, un descenso moderado y variable de los triglicéridos y un incremento promedio del colesterol HDL y de la apo A1, en general inferior al 10%9–11. En los ensayos de fase III, la gran mayoría de los pacientes tratados con alirocumab11 y evolocumab10,12 alcanzaron el objetivo de cLDL para la prevención secundaria (cLDL < 70 mg/dL), y disminuyeron las concentraciones de cLDL por debajo de unos valores que no se habían alcanzado con los fármacos disponibles hasta la fecha.
Prevención secundaria y anticuerpos anti-PCSK9La prevención de las recurrencias isquémicas en los pacientes que han sufrido un episodio cardiovascular de origen aterotrombótico requiere una estrategia enérgica para conseguir el control global de los factores de RCV. Asimismo, cuanto mayor es la reducción en los niveles de cLDL y por consiguiente menores son sus concentraciones plasmáticas, mayor es la probabilidad de que las placas de ateroma regresen.
Los estudios SPIRE-1 y SPIRE-2 fueron suspendidos precozmente al detectar el desarrollo de anticuerpos bloqueadores frente a bococizumab con la consiguiente pérdida de su eficacia reductora de cLDL13. Sin embargo, los resultados del análisis conjunto de ambos estudios señalaron que la administración de bococizumab comparado con placebo no indujo beneficios cardiovasculares en el que incluía los pacientes de bajo riesgo, mientras que indujo un beneficio significativo en el que incluía pacientes de alto RCV14.
En el estudio ODYSSEY OUTCOMES15, se probó la hipótesis de que el tratamiento con alirocumab mejora los resultados cardiovasculares después de un síndrome coronario agudo (SCA). Los principales resultados revelaron una reducción del riesgo del 15% de presentar un episodio cardiovascular grave en relación con el del grupo placebo (p < 0,0003). Es importante destacar que los pacientes del grupo con mayor riesgo inicial (cLDL > 100 mg/dL) presentaron un mayor beneficio, con una reducción del riesgo relativo del 24% (HR 0,76; IC 95%: 0,65-0,87). Asimismo, el tratamiento con alirocumab se asoció a una menor incidencia de muerte por cualquier causa que el placebo (3,5 vs. 4,1%; HR: 0,85, IC 95%: 0,73-0,98, p = 0,026)16.
El estudio FOURIER17, incluyó a 27.564 pacientes con ECV estable y niveles de cLDL > 70 mg/dL tras tratamiento con la dosis máxima tolerada de estatinas. La tasa de episodios cardiovasculares fue del 9,8% en los pacientes tratados con evolocumab comparado con un 11,3% en el grupo placebo, lo que corresponde a una reducción de un 15% (HR 0,85; IC 95%: 0,79-0,92; p < 0,001) del riesgo de presentar uno de estos eventos. Dicho efecto preventivo se observó con independencia de la intensidad de la estatina basal y de la concentración basal de cLDL. Además, el tratamiento con evolocumab indujo reducciones del 21 al 27% en el riesgo de infarto de miocardio, accidente cerebrovascular y revascularización coronaria, pero no se observaron efectos en las tasas de hospitalización por angina inestable, muerte cardiovascular u hospitalización por insuficiencia cardíaca o muerte por cualquier causa.
Los hallazgos de los estudios IMPROVE-IT, FOURIER y ODISSEY, junto al resto de evidencias paralelas mencionadas, permiten cambiar el foco terapéutico dirigiéndolo hacia el concepto de usar las terapias hipocolesterolemiantes de alta intensidad18. Sin embargo, la triste realidad es que estas terapias no se utilizan, los pacientes con elevado RCV están infratratados y el porcentaje de consecución de objetivos terapéuticos sigue siendo inadmisiblemente bajo19,20. Por ello, la búsqueda de nuevas herramientas y estrategias terapéuticas para el tratamiento de estos pacientes es una necesidad pertinente.
Nuevas dianas y estrategias terapéuticas para reducir los niveles de cLDLÁcido bempedoico: posibles indicaciones terapéuticasDespués de lo expuesto en los apartados anteriores, y a la luz de la reciente aprobación del ácido bempedoico por la Food and Drug Administration (FDA) y la European Medicines Agency (EMA) consideramos oportuno discutir el posicionamiento del ácido bempedoico en el armamentario farmacológico hipolipidemiante. A pesar de que no disponemos de los resultados del estudio CLEAR-Outcomes (NCT02993406), que concluirá hacia el segundo semestre del 202221, el metaanálisis de Dai et al.22 subraya que el ácido bempedoico es una opción terapéutica eficaz para reducir las concentraciones plasmáticas de cLDL especialmente en combinación con ezetimiba y/o una estatina con un aceptable perfil de seguridad.
Vale la pena recordar, que los estudios genéticos de aleatorización mendeliana han mostrado que una menor actividad de la enzima ATP-citrato liasa, presente en la vía metabólica de la síntesis del colesterol, se asocia con efectos similares en el perfil lipídico y RCV a los observados con una menor actividad de la HMG-CoA reductasa, diana terapéutica de las estatinas23. Sin embargo, a diferencia de éstas, el ácido bempedoico es un profármaco que se activa por la enzima acil-coA sintetasa 1 de cadena muy larga, presente en el hígado y ausente en la mayoría de los tejidos como el músculo esquelético. Por lo tanto, la inhibición de la ATP-citrato liasa es un objetivo potencialmente viable para la reducción del cLDL y el riesgo de ECV.
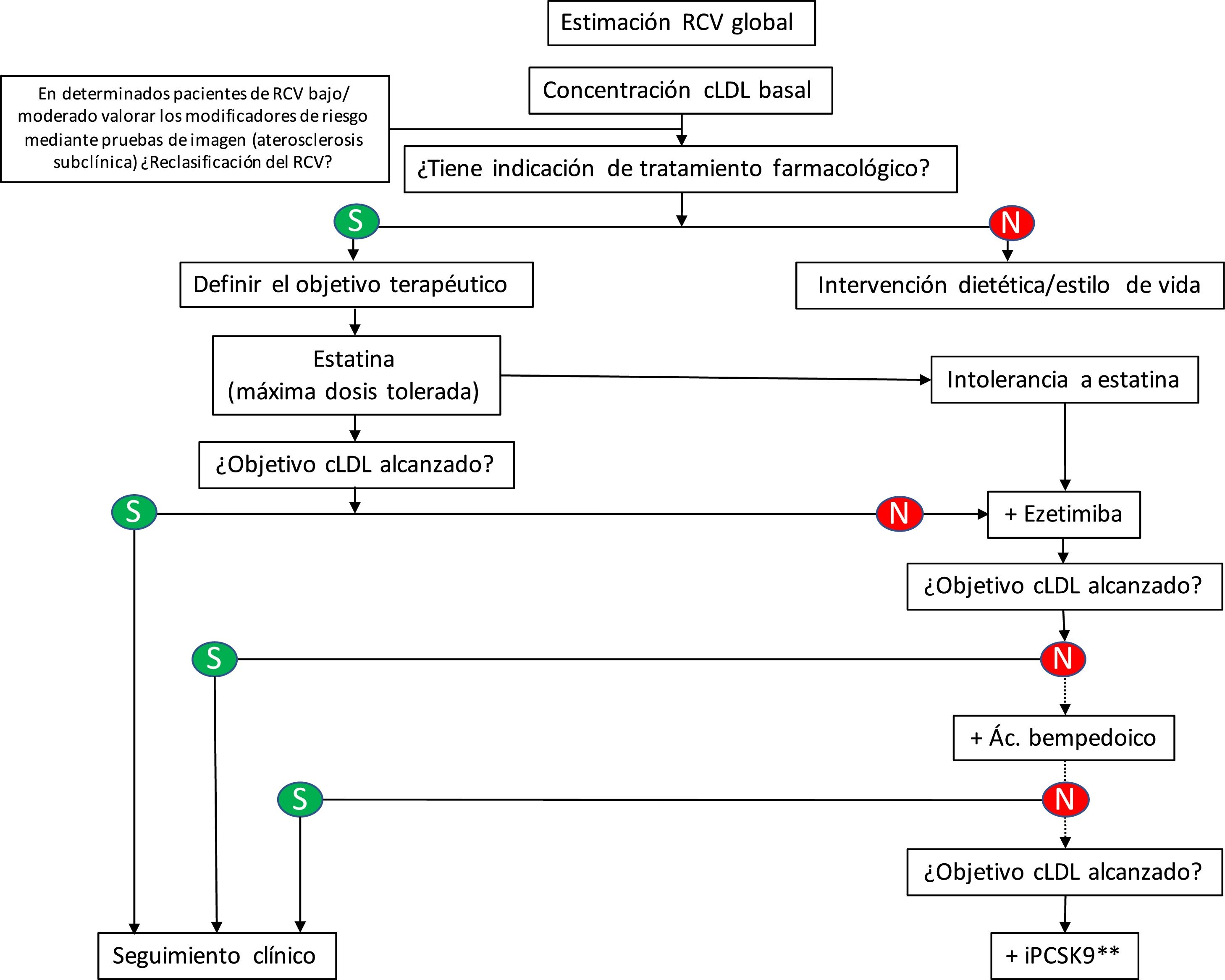
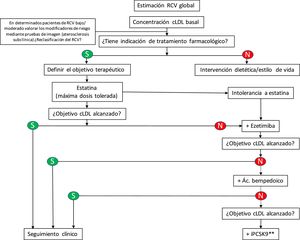
En la práctica clínica, y de acuerdo con las recomendaciones para el control de las dislipidemias de la European Society of Cardiology (ESC)/European Atherosclerosis Society (EAS) 201924, el ácido bempedoico debe incorporarse al algoritmo de abordaje terapéutico de la hipercolesterolemia (fig. 1). En este sentido, cabe considerar al ácido bempedoico como tercer fármaco cuando con la combinación estatina a la máxima dosis tolerada más ezetimiba no se alcancen los objetivos terapéuticos en cLDL. Debido al aumento en dos veces de la exposición a simvastatina inducida por el ácido bempedoico, se recomienda evitar su uso con dosis de simvastatina > 20 mg25. Por otra parte, la combinación de ácido bempedoico y ezetimiba también proporciona una nueva opción cuando tratamos a pacientes con intolerancia a las estatinas.
Algoritmo de tratamiento para la reducción farmacológica del colesterol LDL*.
*Adaptado de la guía ESC/EAS 201924.
**Según los informes de posicionamiento terapéutico de la Asociación Española de Medicamentos y Productos Sanitarios la prescripción de los iPCSK9 (evolocumab y alirocumab) está limitada a los pacientes con enfermedad cardiovascular establecida y/o hipercolesterolemia familiar con cLDL > 100 mg/dL a pesar de recibir la dosis máxima tolerada de estatinas y ezetimiba o por presentar intolerancia las estatinas.
Elementos anexados al algoritmo terapéutico para la reducción farmacológica del cLDL de la guía ESC/EAS 201924.
cLDL: colesterol unido a lipoproteínas de baja densidad; iPCSK9: inhibidores de la proproteína convertasa subtilisina/kexina tipo 9; RCV: riesgo cardiovascular.
No debemos olvidar que según la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), la financiación de los inhibidores de PCSK9, evolocumab y alirocumab, se limita a los pacientes con ECV establecida (cardiopatía isquémica, enfermedad cerebrovascular isquémica y enfermedad arterial periférica) y/o hipercolesterolemia familiar con cLDL > 100 mg/dL a pesar de recibir la dosis máxima tolerada de estatinas y ezetimiba o por intolerancia las estatinas26.
En espera de los resultados de los estudios que evalúan el impacto del ácido bempedoico en la morbimortalidad cardiovascular, los datos disponibles sugieren que este nuevo fármaco hipolipidemiante puede aportar beneficios adicionales en el tratamiento de la hipercolesterolemia y en la reducción del RCV, especialmente en los pacientes que a pesar de la terapia convencional o debido a la intolerancia a las estatinas no alcanzan el objetivo en cLDL.
Proteína de transferencia de triglicéridos microsomal y lomitapidaLa lomitapida (Aegerion, Cambridge, MA) es un fármaco aprobado para el tratamiento de la HF homocigota (HFHo) en los Estados Unidos y Europa en 2012. Este fármaco inhibe la proteína de transferencia de triglicéridos microsomal (MTP), que actúa para ensamblar lipoproteínas que contienen apo B, como quilomicrones, VLDL y LDL27. Aunque los ensayos clínicos de fase temprana de lomitapida mostraron una alta prevalencia de trastornos gastrointestinales, hígado graso y aumento de transaminasas, estas complicaciones se reducen con el tiempo y se balancean y compensan por la reducción del riesgo de ECV y una mejor calidad de vida, al reducir la frecuencia de sesiones de aféresis de LDL en estos pacientes28.
Apo B y mipomersenEl mipomersen es un oligonucleótido antisentido (ASO) de ARN mensajero (ARNm) inhibidor de la apo B-100, administrado por vía subcutánea una vez a la semana. Fue aprobado para su uso en HFHo en los Estados Unidos Estados en 2013. En un estudio controlado con placebo de 51 pacientes con HFHo, el mipomersen redujo el cLDL en un 25-33%29. En un metaanálisis de ocho estudios aleatorizados controlados, el mipomersen mostró una reducción del 36% en cLDL, pero con altas tasas de reacciones en el lugar de la inyección, elevaciones de transaminasas, esteatosis hepática y síntomas similares a los de la gripe. El mipomersen también redujo los niveles de Lp(a) en un 21% en voluntarios sanos30.
Otras estrategias para reducir los niveles de cLDLEl inclisirán (ALN-PCSsc; The Medicines Company, Parsippany-Troy Hills, NJ) es un ARN de interferencia contra PCSK9 con un efecto prolongado y larga duración de acción. En un estudio de fase 3 aleatorizado con 501 pacientes (www.cinicaltrials.gov: NCT02597127), aquellos que recibieron inclisirán 300 mg mostraron reducciones del cLDL en el día 180 de 27,9-41,9% y de 35,5-52,6% después de la primera y segunda dosis, respectivamente, con reacciones en el lugar de la inyección que ocurren en sólo un 5% de los pacientes31. Este modo de inhibir PCSK9 difiere de los anticuerpos monoclonales al interferir con la producción intracelular de PCSK9 bloqueando su RNAm.
Necesidades no cubiertasA pesar de que se dispone de fármacos con eficacia y seguridad probadas para reducir la concentración de cLDL, numerosos estudios epidemiológicos demuestran que la mayoría de los pacientes de alto/muy alto RCV presentan cifras de cLDL por encima de los objetivos recomendados en las diferentes guías de práctica clínica32. Este es un hecho relevante si se considera que los pacientes que alcanzan el objetivo terapéutico de cLDL tienen menos riesgo de complicaciones cardiovasculares y muerte33. Las causas que justifican un deficiente control son múltiples, destacando la falta de adherencia del paciente, la inercia terapéutica del médico, y en un porcentaje no despreciable de casos la falta de eficacia de los fármacos hipolipemiantes.
En este sentido, existen diversos subgrupos de pacientes con dificultades específicas para alcanzar los objetivos con las herramientas hipolipemiantes disponibles. Entre ellos se incluyen a los pacientes con HF, que habitualmente parten de concentraciones de cLDL muy elevadas, lo que dificulta alcanzar las concentraciones recomendadas a pesar de un tratamiento hipolipemiante óptimo34,35, los pacientes con intolerancia parcial o total a las estatinas36 que no pueden recibir el tratamiento hipolipemiante recomendado, y numerosos pacientes con un RCV muy elevado, que requieren reducciones del cLDL muy marcadas y no pueden alcanzar debido a la amplia variabilidad en la respuesta hipolipemiante a estatinas o al tratamiento combinado con estatinas y ezetimiba37,38.
Por otra parte, existe un número no despreciable de pacientes que no toleran la terapia con estatinas. Los efectos secundarios más importantes asociados a su uso son la afectación hepática, la muscular y la diabetogenicidad. En la práctica clínica, la causa más importante y frecuente de abandono del tratamiento con estatinas es el dolor muscular. Las alteraciones musculares asociadas al tratamiento con estatinas incluyen un amplio y mal definido grupo de signos y síntomas que impiden que un grupo significativo de pacientes pueda seguir dicha terapia. La intolerancia a las estatinas es motivo de debate, entre otras cosas por la dificultad de la definición del trastorno y la ausencia de marcadores biológicos de la misma. Además, existe una notable diferencia en la prevalencia de esta situación clínica en los estudios observacionales comparado con los ensayos clínicos aleatorizados39. Las manifestaciones clínicas son diversas e incluyen mialgias, aumento de enzimas musculares como la creatincinasa (CK) o incluso rabdomiólisis. Los casos de alteraciones musculares más frecuentes son pacientes que a las pocas semanas del inicio del tratamiento o incluso días de haberlo iniciado presentan dolores musculares, habitualmente sin elevación de la CK, que desaparecen al abandonar dicha terapia36. En muchos pacientes, estos síntomas aparecen con algún tipo de estatina y no con los demás. También se pueden relacionar con la dosis elevada de éstas, por lo que antes de considerar que un paciente es incapaz de seguir tratamiento con estatinas, se recomienda ensayar el uso de otras dos estatinas diferentes a la que ha producido el efecto secundario, iniciando el nuevo tratamiento con dosis bajas e incluso, para aquellas con una vida media amplia, utilizar la posología a intervalos superiores a los recomendados, por ejemplo, a días alternos o dos veces a la semana.
ConclusionesLas estatinas constituyen la base terapéutica de la prevención cardiovascular. Las guías actuales recomiendan la optimización de la dosis de estatinas cuando los pacientes no alcanzan los objetivos de cLDL. A pesar de ello, es posible que no se consigan los objetivos terapéuticos en muchos pacientes de alto/muy alto RCV, como los pacientes en prevención secundaria, o con HF o intolerancia a las estatinas. Estas poblaciones específicas requieren opciones más eficaces de tratamiento, limitadas en la actualidad a la terapia combinada con ezetimiba y/o un inhibidor de PCSK9 en situaciones especiales. El ácido bempedoico debería incorporarse al algoritmo de abordaje terapéutico de la hipercolesterolemia como tercer fármaco hipolipemiante.
Conflicto de interesesJ. López-Miranda ha recibido honorarios por labores de consultoría, preparación de manuscritos, ponencias y presentaciones educativas de Amgen, Sanofi, Laboratorios Dr. Esteve, Ferrer y MSD.
J. Pedro-Botet ha recibido honorarios por labores de consultoría, preparación de manuscritos, ponencias y presentaciones educativas de Amgen, Esteve, Ferrer, MSD, Mylan, Sanofi y Servier.
Nota al suplementoEste artículo forma parte del suplemento «Lípidos y nuevos tratamientos en dislipemias», que cuenta con el patrocinio de Daiichi-Sankyo.