Las alteraciones en el metabolismo de la glucosa son un factor de riesgo y de peor pronóstico para infarto agudo de miocardio (IAM), pero esta información en población latinoamericana es limitada. Por tanto, evaluamos la asociación del estado glucémico con desenlaces a corto y largo plazo en pacientes con un primer IAM.
MétodosEstudio observacional de cohorte, multicéntrico, prospectivo, conducido en 8 hospitales de Colombia y Ecuador.
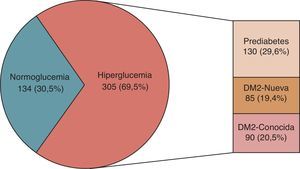
ResultadosSe incluyeron en total 439 pacientes con diagnóstico confirmado de IAM, de los cuales 305 (69,5%) presentaron prediabetes o diabetes mellitus tipo2 (DM2). En comparación con el grupo de normoglucemia, los pacientes con DM2 conocida presentaron mayor riesgo de estancia hospitalaria prolongada (HR: 2,60, IC95%: 1,38-4,92, p=0,003), de Killip claseiii/iv (HR: 9,46, IC 95%: 2,20-40,62, p=0,002) y de insuficiencia cardiaca intrahospitalaria (HR: 10,76, IC95%: 3,37-34,31, p<0,001). Los pacientes con prediabetes, DM2 conocida y DM2 nueva tuvieron tasas más altas de episodios adversos cardiovasculares mayores en el seguimiento a 3años.
ConclusiónAlteraciones en el metabolismo de la glucosa tienen una importante significación pronóstica a corto y a largo plazo en pacientes latinoamericanos sobrevivientes a un primer IAM.
Alterations in glucose metabolism have been reported as risk and poor prognostic factors for acute myocardial infarction (AMI); however in Latin-American population this information is limited. Thus, an evaluation was performed on the association between glycaemic status and short- and long-term outcomes in patients with a first AMI.
MethodsA multicentre, prospective, observational, cohort study was conducted in 8 hospitals from Colombia and Ecuador.
ResultsA total of 439 patients with confirmed AMI were included, of which 305 (69.5%) had prediabetes or type2 diabetes mellitus (DM2). Compared with normal glycaemia group, patients with known DM2 had greater risk of prolonged hospital stay (HR: 2.60, 95%CI: 1.38-4.92, P=.003), Killip class iii/iv (HR: 9.46, 95%CI: 2.20-40.62, P=.002), and in-hospital heart failure (HR: 10.76, 95%CI: 3.37-34.31, P<.001). Patients with prediabetes, new DM2, and known DM2 showed higher rates of major adverse cardiovascular events after 3years follow-up.
ConclusionGlucose metabolism abnormalities have an important significance in the short- and long-term prognosis in Latin-American patients that survive a first AMI.
La diabetes mellitus tipo2 (DM2) y la prediabetes son factores de riesgo bien establecidos de enfermedad cardiovascular (ECV), incluyendo infarto agudo de miocardio (IAM)1. Además, los pacientes con DM2 tienen peores desenlaces que los pacientes no diabéticos tras un IAM2. Resultados de grandes estudios de cohorte indican que sujetos con prediabetes también tienen un riesgo incrementado de episodios cardiovasculares y mortalidad3,4, implicando que la hiperglucemia es un factor de riesgo continuo para ECV.
Diferentes estudios a nivel mundial han reportado la asociación entre hiperglucemia y severidad y pronóstico del IAM2-5, pero la información en la población latinoamericana es limitada. Por lo tanto, el objetivo de este estudio fue evaluar la asociación entre hiperglucemia y desenlaces a corto y a largo plazo después de un primer IAM en pacientes admitidos a los servicios cardiovasculares de 8 hospitales de diferentes ciudades en Colombia y Ecuador.
Materiales y métodosDiseño del estudioEstudio observacional de cohorte, multicéntrico, prospectivo, conducido en 8 hospitales de Colombia y Ecuador. Las ciudades participantes fueron Floridablanca, Bogotá, Armenia, Cali, Barranquilla y Cartagena en Colombia, y Guayaquil en Ecuador.
PacientesDesde marzo de 2009 hasta diciembre de 2012, todos los adultos con un primer IAM admitidos a los servicios cardiovasculares de los diferentes centros participantes, y quienes sobrevivieron al menos 7 días al periodo de hospitalización, fueron candidatos elegibles para el estudio. El diagnóstico de IAM fue hecho de acuerdo a la definición de infarto de miocardio del Joint ESC/ACCF/AHA/WHF Task Force de 20076. Todos los pacientes fueron evaluados y tratados a discreción del médico responsable y según la práctica usual de cada institución. Individuos con diabetes tipo1, mujeres embarazadas y personas con enfermedades crónicas y esperanza de vida menor a 6meses fueron excluidos del estudio.
Procedimientos del estudioLa evaluación inicial fue llevada a cabo por un médico especialista en medicina interna o cardiología, quien verifico el cumplimiento de los criterios de inclusión/exclusión. La recolección de datos se hizo por medio de formatos de registro, en los cuales se incluyeron datos demográficos, historial médico, criterios diagnósticos de IAM, desenlaces clínicos y tratamientos. Posteriormente, y una vez alcanzada la estabilidad hemodinámica, los pacientes fueron sometidos a exámenes clínicos, incluyendo mediciones antropométricas (peso, talla, índice de masa corporal [IMC], circunferencia abdominal [CA] y circunferencia de cadera [CC]), presión arterial sistólica (PAS) y presión arterial diastólica (PAD), y determinaciones bioquímicas (glucosa plasmática en ayunas [GPA] y perfil lipídico). En los pacientes sin DM2 conocida se realizó también la prueba de tolerancia oral a la glucosa (PTOG), según las recomendaciones de la Organización Mundial de la Salud (OMS)7. Todas las determinaciones bioquímicas propias del estudio fueron realizadas el día previo al egreso hospitalario y bajo condiciones hemodinámicas estables con el propósito de evitar la hiperglucemia inducida por estrés8. Adicionalmente se hizo revisión de la historia clínica de cada paciente para hacer registro de determinaciones paraclínicas adicionales (creatinina, creatincinasa, entre otros).
La clasificación del estado glucémico fue basada en antecedentes personales y en resultados de GPA y PTOG en los casos en que esta prueba fue realizada, siguiendo los criterios de la Asociación Americana de Diabetes (ADA, por sus siglas en inglés)9. El diagnóstico de DM2-conocida fue establecido por autorreporte de enfermedad e historial de tratamiento con fármacos hipoglucemiantes, mientras que los pacientes sin antecedente medico de DM2 pero con GPA≥126mg/dl o PTOG≥200mg/dl fueron definidos como DM2-nueva. La prediabetes fue diagnosticada por la presencia de GPA alterada (≥100 a <126mg/dl) y/o PTOG alterada (≥140 a <200mg/dl). El estado de normoglucemia fue considerado con GPA<100mg/dl y PTOG<140mg/dl.
Definición de desenlacesLos desenlaces clínicos analizados a corto plazo incluyeron duración total de la estancia hospitalaria, duración de la estancia en la unidad de cuidados intensivos (UCI), morbilidad durante la hospitalización (clase de Killip, fibrilación/flutter auricular, insuficiencia cardiaca [IC]) y mortalidad intrahospitalaria. También se analizaron desenlaces a largo plazo, tales como re-infarto, IC requiriendo admisión hospitalaria, accidente cerebrovascular (ACV), angina inestable y mortalidad en el seguimiento. Las variables clínicas de seguimiento fueron obtenidas a través de visitas clínicas, conversaciones telefónicas y/o revisión de historia médica.
Disposiciones éticasEl protocolo del estudio está acorde con la declaración de Helsinki, y los comités de ética institucionales de cada uno de los hospitales participantes aprobaron el estudio. Todos los sujetos expresaron su deseo de participar y otorgaron su consentimiento informado escrito antes de ser incluidos en el estudio.
Análisis estadísticoLos datos continuos se presentan como promedio (desvío estándar [DE]) y los datos categóricos como números (porcentajes). La normalidad de la distribución para las variables continuas fue evaluada usando la prueba de Shapiro-Wilk y por métodos gráficos. Los datos continuos entre grupos fueron comparados usando la prueba t de Student o la prueba U de Mann-Whitney según la distribución de frecuencias. Los datos categóricos fueron analizados usando la prueba de Chi-cuadrado de Pearson (χ2) o la prueba exacta de Fisher. Todos los análisis comparativos fueron realizados tomando como referente al grupo de normoglucemia.
Para identificar la asociación independiente entre el estado glucémico basal y desenlaces a corto y largo plazo se emplearon análisis de regresión de riesgos proporcionales de Cox. Estos resultados se presentan como hazard ratio (HR) seguidos por el intervalo de confianza (IC95%). Las curvas de supervivencia libre de episodios (definidas como libres de episodios adversos cardiovasculares mayores [MACE]) fueron construidas usando el método de Kaplan-Meier. Se consideraron como MACE los episodios nuevos de re-infarto, IC requiriendo admisión hospitalaria, ACV, angina inestable o mortalidad. La significación de las diferencias entre curvas fue evaluada con la prueba Log-Rank. El modelamiento se hizo en forma parsimoniosa con un método forward incluyendo las variables que modificaban el efecto y su nivel de significación estadística según los criterios de Greenland10. Todos los análisis estadísticos fueron llevados a cabo usando el software estadístico Stata, versión 12.0 (Stata Corporation, College Station, TX, EE.UU.). La significación estadística fue definida con un valor de p<0,05.
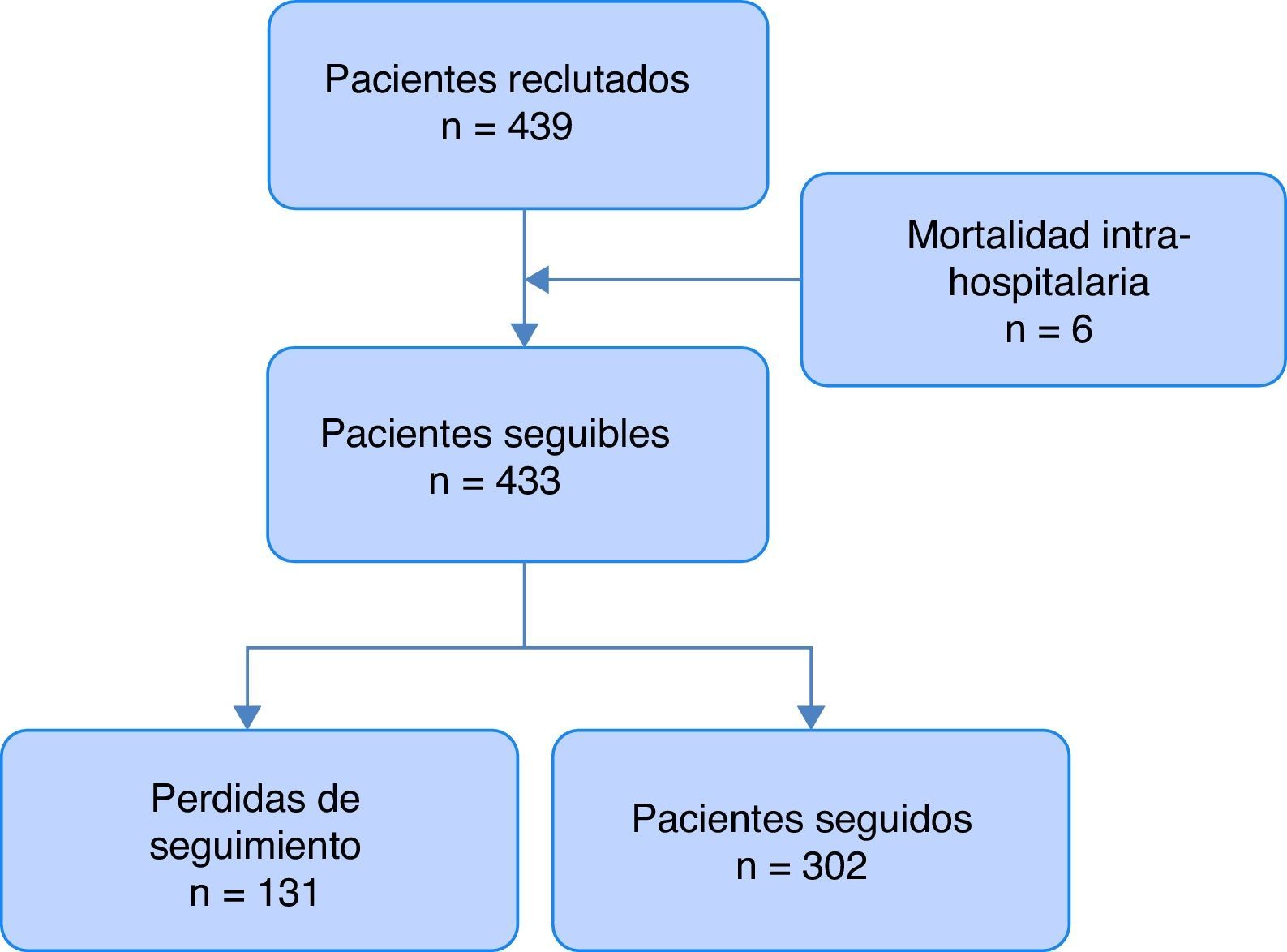
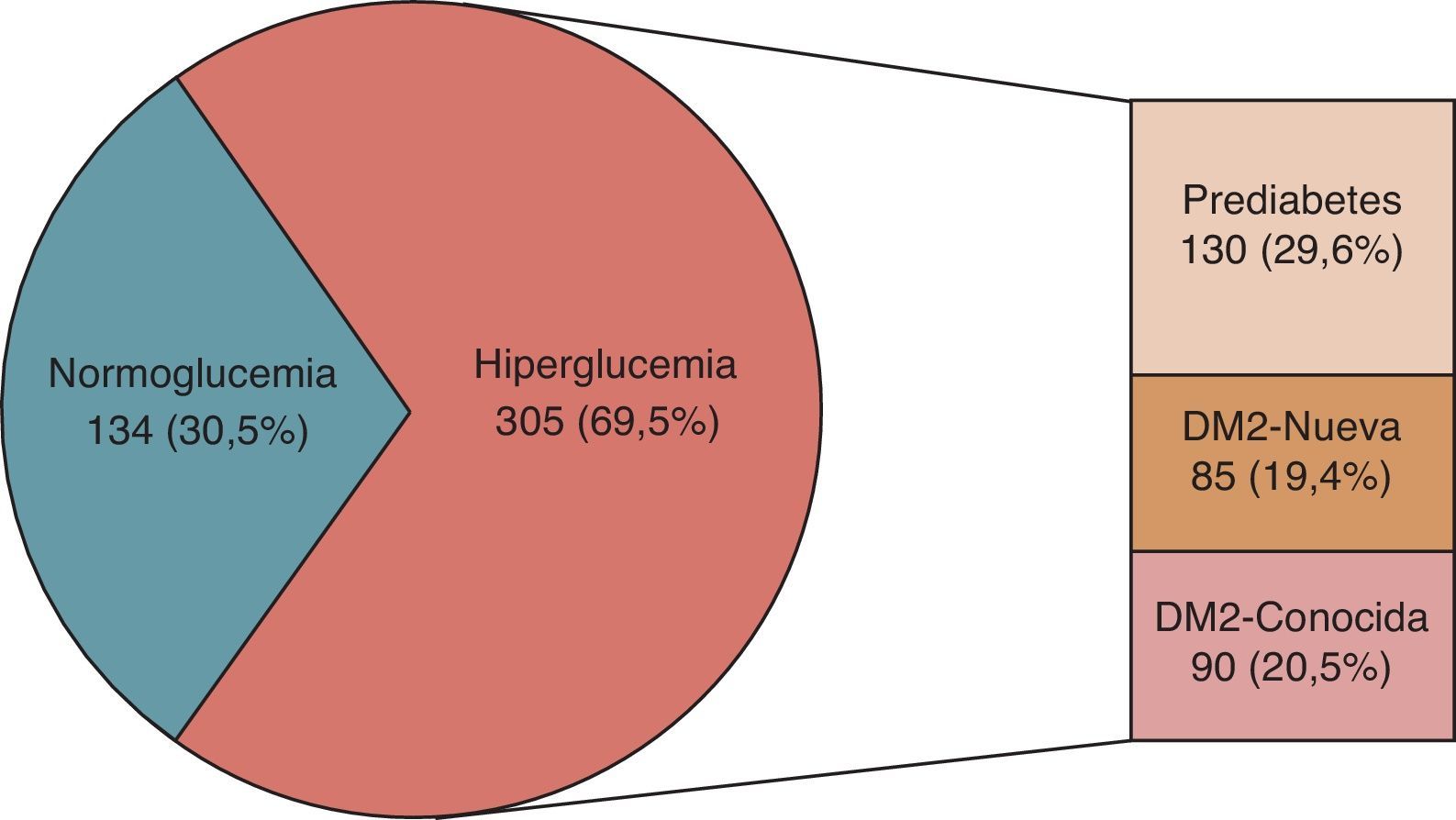
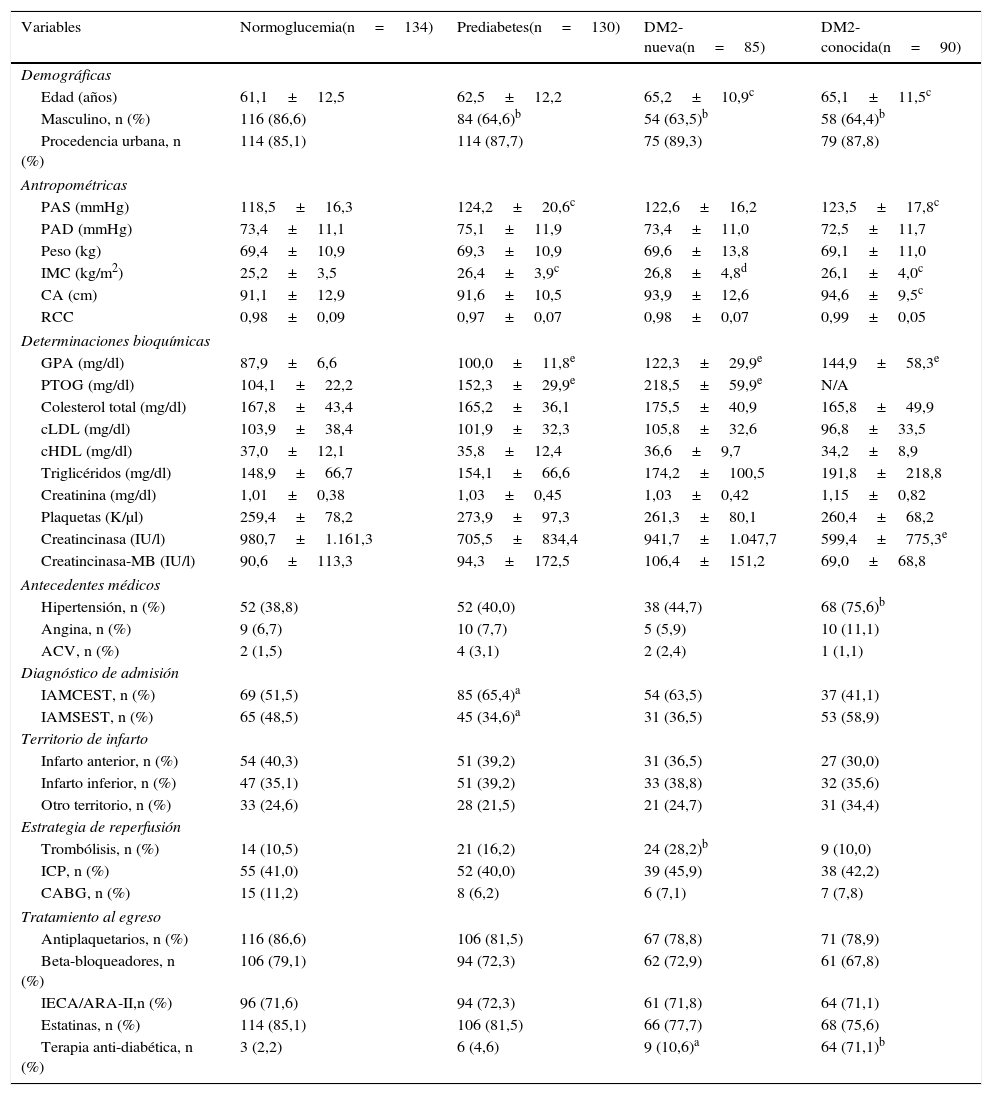
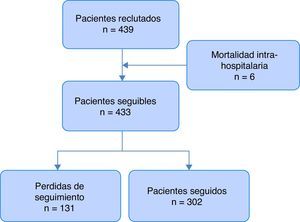
ResultadosSe incluyeron en total 439 pacientes durante la fase transversal del estudio, y se completó el seguimiento en 302 (68,8%) hasta 3años después del ingreso al estudio (fig. 1). Del total de pacientes incluidos, 305 (69,5%) presentaron hiperglucemia, y solo 134 (30,5%) fueron catalogados como normoglucémicos (fig. 2). Las características basales de los participantes de acuerdo a su estado glucémico se presentan en la tabla 1.
Características basales de los participantes estratificados por estado glucémico
| Variables | Normoglucemia(n=134) | Prediabetes(n=130) | DM2-nueva(n=85) | DM2-conocida(n=90) |
|---|---|---|---|---|
| Demográficas | ||||
| Edad (años) | 61,1±12,5 | 62,5±12,2 | 65,2±10,9c | 65,1±11,5c |
| Masculino, n (%) | 116 (86,6) | 84 (64,6)b | 54 (63,5)b | 58 (64,4)b |
| Procedencia urbana, n (%) | 114 (85,1) | 114 (87,7) | 75 (89,3) | 79 (87,8) |
| Antropométricas | ||||
| PAS (mmHg) | 118,5±16,3 | 124,2±20,6c | 122,6±16,2 | 123,5±17,8c |
| PAD (mmHg) | 73,4±11,1 | 75,1±11,9 | 73,4±11,0 | 72,5±11,7 |
| Peso (kg) | 69,4±10,9 | 69,3±10,9 | 69,6±13,8 | 69,1±11,0 |
| IMC (kg/m2) | 25,2±3,5 | 26,4±3,9c | 26,8±4,8d | 26,1±4,0c |
| CA (cm) | 91,1±12,9 | 91,6±10,5 | 93,9±12,6 | 94,6±9,5c |
| RCC | 0,98±0,09 | 0,97±0,07 | 0,98±0,07 | 0,99±0,05 |
| Determinaciones bioquímicas | ||||
| GPA (mg/dl) | 87,9±6,6 | 100,0±11,8e | 122,3±29,9e | 144,9±58,3e |
| PTOG (mg/dl) | 104,1±22,2 | 152,3±29,9e | 218,5±59,9e | N/A |
| Colesterol total (mg/dl) | 167,8±43,4 | 165,2±36,1 | 175,5±40,9 | 165,8±49,9 |
| cLDL (mg/dl) | 103,9±38,4 | 101,9±32,3 | 105,8±32,6 | 96,8±33,5 |
| cHDL (mg/dl) | 37,0±12,1 | 35,8±12,4 | 36,6±9,7 | 34,2±8,9 |
| Triglicéridos (mg/dl) | 148,9±66,7 | 154,1±66,6 | 174,2±100,5 | 191,8±218,8 |
| Creatinina (mg/dl) | 1,01±0,38 | 1,03±0,45 | 1,03±0,42 | 1,15±0,82 |
| Plaquetas (K/μl) | 259,4±78,2 | 273,9±97,3 | 261,3±80,1 | 260,4±68,2 |
| Creatincinasa (IU/l) | 980,7±1.161,3 | 705,5±834,4 | 941,7±1.047,7 | 599,4±775,3e |
| Creatincinasa-MB (IU/l) | 90,6±113,3 | 94,3±172,5 | 106,4±151,2 | 69,0±68,8 |
| Antecedentes médicos | ||||
| Hipertensión, n (%) | 52 (38,8) | 52 (40,0) | 38 (44,7) | 68 (75,6)b |
| Angina, n (%) | 9 (6,7) | 10 (7,7) | 5 (5,9) | 10 (11,1) |
| ACV, n (%) | 2 (1,5) | 4 (3,1) | 2 (2,4) | 1 (1,1) |
| Diagnóstico de admisión | ||||
| IAMCEST, n (%) | 69 (51,5) | 85 (65,4)a | 54 (63,5) | 37 (41,1) |
| IAMSEST, n (%) | 65 (48,5) | 45 (34,6)a | 31 (36,5) | 53 (58,9) |
| Territorio de infarto | ||||
| Infarto anterior, n (%) | 54 (40,3) | 51 (39,2) | 31 (36,5) | 27 (30,0) |
| Infarto inferior, n (%) | 47 (35,1) | 51 (39,2) | 33 (38,8) | 32 (35,6) |
| Otro territorio, n (%) | 33 (24,6) | 28 (21,5) | 21 (24,7) | 31 (34,4) |
| Estrategia de reperfusión | ||||
| Trombólisis, n (%) | 14 (10,5) | 21 (16,2) | 24 (28,2)b | 9 (10,0) |
| ICP, n (%) | 55 (41,0) | 52 (40,0) | 39 (45,9) | 38 (42,2) |
| CABG, n (%) | 15 (11,2) | 8 (6,2) | 6 (7,1) | 7 (7,8) |
| Tratamiento al egreso | ||||
| Antiplaquetarios, n (%) | 116 (86,6) | 106 (81,5) | 67 (78,8) | 71 (78,9) |
| Beta-bloqueadores, n (%) | 106 (79,1) | 94 (72,3) | 62 (72,9) | 61 (67,8) |
| IECA/ARA-II,n (%) | 96 (71,6) | 94 (72,3) | 61 (71,8) | 64 (71,1) |
| Estatinas, n (%) | 114 (85,1) | 106 (81,5) | 66 (77,7) | 68 (75,6) |
| Terapia anti-diabética, n (%) | 3 (2,2) | 6 (4,6) | 9 (10,6)a | 64 (71,1)b |
ACV: accidente cerebrovascular; ARA-II: antagonistas de los receptores de angiotensina-ii; CA: circunferencia abdominal; CABG: cirugía de revascularización coronaria; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; DM2: diabetes mellitus tipo 2; GPA: glucosa plasmática en ayunas; IAMCEST: infarto agudo de miocardio con elevación del ST; IAMSEST: infarto agudo de miocardio sin elevación del ST; ICP: intervención coronaria percutánea; IECA: inhibidores de la enzima convertidora de angiotensina; IMC: índice de masa corporal; N/A: no aplicable; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PTOG: prueba de tolerancia oral a la glucosa; RCC: relación cintura/cadera.
Los valores de p están dados para la comparación contra el grupo de normoglucemia. Las variables están reportadas como promedio±DE o n (%).
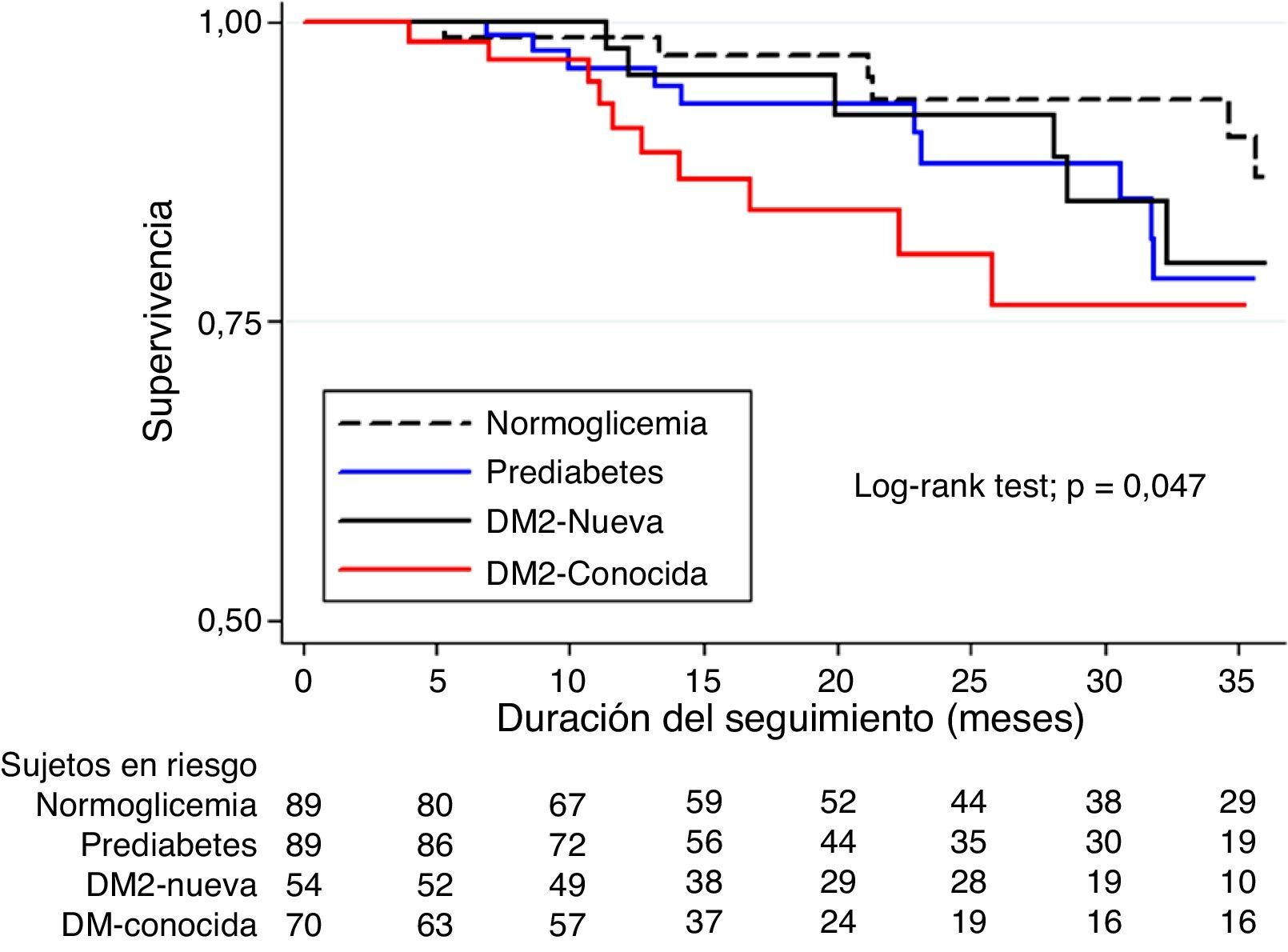
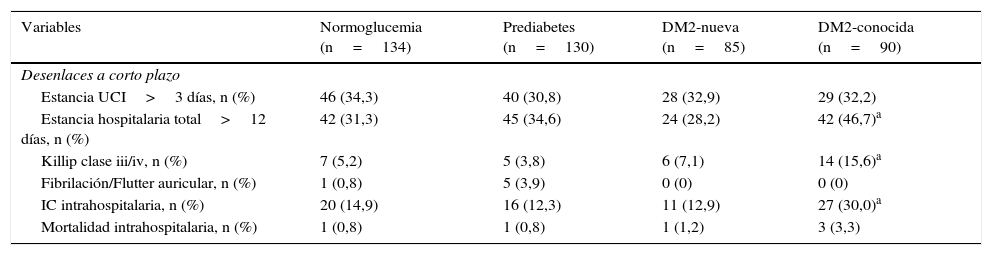
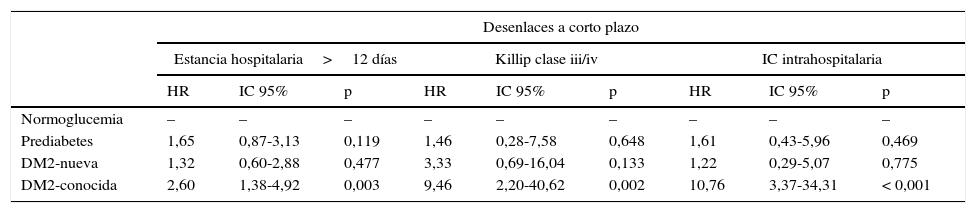
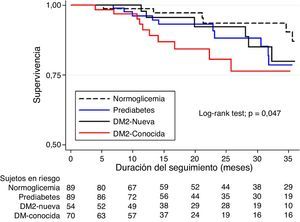
En comparación con el grupo de pacientes normoglucémicos, los pacientes con DM2-conocida presentaron en mayor proporción desenlaces adversos a corto plazo, tales como estancia hospitalaria mayor a 12días (46,7% vs. 31,3%, p<0,05), Killip claseiii/iv (15,6% vs. 5,2%, p<0,05) e IC intrahospitalaria (30,0% vs. 14,9%, p<0,05) (tabla 2). En el análisis de regresión de riesgos proporcionales de Cox, y ajustando por edad, sexo, PAS, IMC, CA, creatincinasa, antecedente de hipertensión, diagnóstico de infarto agudo de miocardio con elevación del ST (IAMCEST) y terapia de reperfusión con trombólisis, la DM2-conocida mantuvo su asociación de mayor riesgo para estancia hospitalaria mayor a 12días (HR: 2,60, IC95%: 1,38-4,92, p=0,003), Killip claseiii/iv (HR: 9,46, IC95%: 2,20-40,62, p=0,002), e IC intrahospitalaria (HR: 10,76, IC95%: 3,37-34,31, p<0,001) (tabla 3). En cuanto a los desenlaces a largo plazo, no hubo diferencias en la proporción de episodios presentados por cada uno de los grupos (tabla 2), pero las curvas de supervivencia libre de episodios de Kaplan-Meier mostraron tasas más altas de MACE en los pacientes con DM2-conocida, DM2-nueva y prediabetes a los 3años de seguimiento (prueba Log-Rank, p=0,047) (fig. 3).
Desenlaces a corto y a largo plazo (3 años de seguimiento) por grupos de estado glucémico
| Variables | Normoglucemia (n=134) | Prediabetes (n=130) | DM2-nueva (n=85) | DM2-conocida (n=90) |
|---|---|---|---|---|
| Desenlaces a corto plazo | ||||
| Estancia UCI>3 días, n (%) | 46 (34,3) | 40 (30,8) | 28 (32,9) | 29 (32,2) |
| Estancia hospitalaria total>12 días, n (%) | 42 (31,3) | 45 (34,6) | 24 (28,2) | 42 (46,7)a |
| Killip clase iii/iv, n (%) | 7 (5,2) | 5 (3,8) | 6 (7,1) | 14 (15,6)a |
| Fibrilación/Flutter auricular, n (%) | 1 (0,8) | 5 (3,9) | 0 (0) | 0 (0) |
| IC intrahospitalaria, n (%) | 20 (14,9) | 16 (12,3) | 11 (12,9) | 27 (30,0)a |
| Mortalidad intrahospitalaria, n (%) | 1 (0,8) | 1 (0,8) | 1 (1,2) | 3 (3,3) |
| Variables | Normoglucemia (n=89) | Prediabetes (n=89) | DM2-nueva (n=54) | DM2-conocida (n=70) |
|---|---|---|---|---|
| Desenlaces a largo plazo | ||||
| Re-infarto, n (%) | 2 (2,3) | 2 (2,3) | 1 (1,9) | 3 (4,3) |
| IC con admisión hospitalaria, n (%) | 1 (1,1) | 1 (1,1) | 0 (0) | 1 (1,4) |
| ACV, n (%) | 0 (0) | 0 (0) | 0 (0) | 2 (2,9) |
| Angina inestable, n (%) | 3 (3,4) | 4 (4,5) | 4 (7,4) | 3 (4,3) |
| Mortalidad al seguimiento, n (%) | 0 (0) | 3 (3,4) | 1 (1,9) | 1 (1,4) |
| MACE, n (%) | 6 (6,7) | 10 (11,2) | 6 (11,1) | 10 (14,3) |
| Pérdidas de seguimiento, n (%) | 44 (33,1) | 40 (31,0) | 30 (35,7) | 17 (19,5)a |
ACV: accidente cerebrovascular; DM2: diabetes mellitus tipo 2; IC: insuficiencia cardiaca; MACE: episodios adversos cardiovasculares mayores; incluye re-infarto, IC requiriendo admisión hospitalaria, accidente cerebrovascular, angina inestable o mortalidad al seguimiento; UCI: unidad de cuidados intensivos.
Los valores de p están dados para la comparación contra el grupo de normoglucemia. Las variables están reportadas como promedio±DE o n (%).
Hazard ratios e intervalo de confianza 95% por grupos de estado glucémico
| Desenlaces a corto plazo | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Estancia hospitalaria>12 días | Killip clase iii/iv | IC intrahospitalaria | |||||||
| HR | IC 95% | p | HR | IC 95% | p | HR | IC 95% | p | |
| Normoglucemia | – | – | – | – | – | – | – | – | – |
| Prediabetes | 1,65 | 0,87-3,13 | 0,119 | 1,46 | 0,28-7,58 | 0,648 | 1,61 | 0,43-5,96 | 0,469 |
| DM2-nueva | 1,32 | 0,60-2,88 | 0,477 | 3,33 | 0,69-16,04 | 0,133 | 1,22 | 0,29-5,07 | 0,775 |
| DM2-conocida | 2,60 | 1,38-4,92 | 0,003 | 9,46 | 2,20-40,62 | 0,002 | 10,76 | 3,37-34,31 | < 0,001 |
DM2: diabetes mellitus tipo 2; HR: hazard ratio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza 95%.
Ajustado por edad, sexo, presión arterial sistólica, índice de masa corporal, circunferencia abdominal, creatincinasa, antecedente de hipertensión, infarto agudo de miocardio con elevación del ST y trombólisis.
Curva de supervivencia libre de episodios (Kaplan-Meier) para MACE en los diferentes grupos de estado glucémico durante 3 años de seguimiento.
DM2: diabetes mellitus tipo 2; MACE: episodios adversos cardiovasculares mayores; incluye re-infarto, IC requiriendo admisión hospitalaria, accidente cerebrovascular, angina inestable o mortalidad al seguimiento.
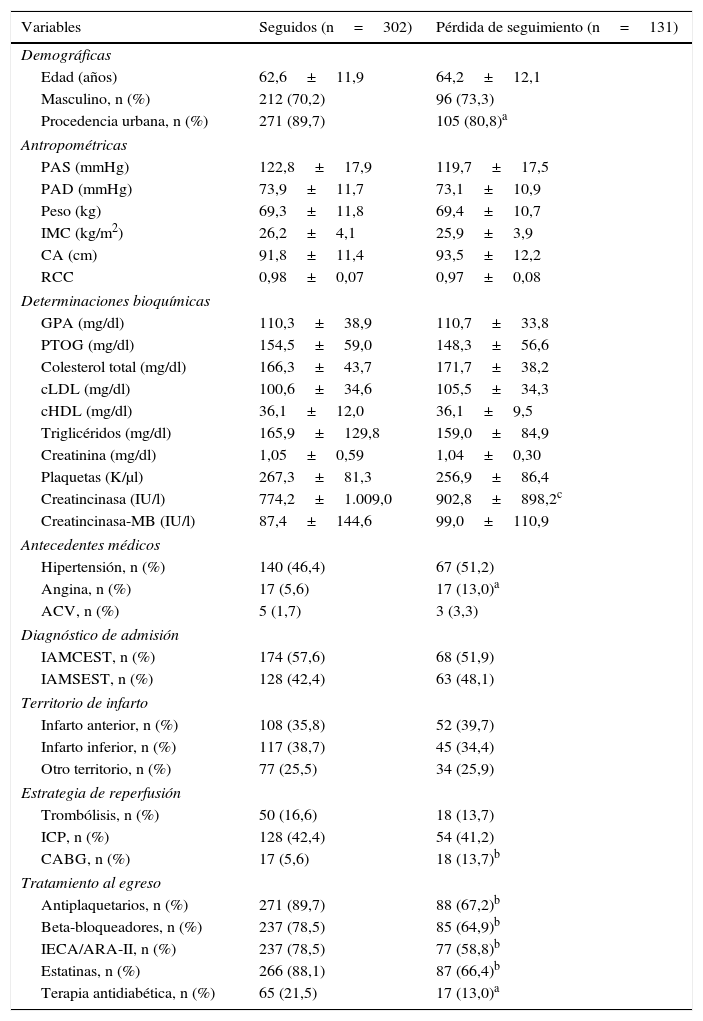
Al comparar los pacientes contactados durante la fase de seguimiento con aquellos no contactados se observó que los pacientes perdidos procedían en mayor proporción de áreas rurales (19,2% vs. 10,3%, p<0,05), tuvieron niveles basales de creatincinasa más elevados (902,8±898,2 vs. 774,2±1.009,0, p<0,05), eran hipertensos en mayor proporción (13,0% vs. 5,6%, p<0,05), un mayor número de ellos fue sometido a cirugía de revascularización coronaria (CABG) (13,7% vs. 5,6%, p<0,005) y recibieron al egreso una menor prescripción de medicamentos antiplaquetarios (67,2% vs. 89,7%, p<0,005), beta-bloqueadores (64,9% vs. 78,5%, p<0,005), inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas de los receptores de angiotensina-ii (ARA-II) (58,8% vs. 78,5%, p<0,005), estatinas (66,4% vs. 88,1%, p<0,005) y terapia antidiabética (13,0% vs. 21,5%, p<0,05) (tabla 4).
Comparación entre pacientes seguidos y pacientes con pérdida de seguimiento
| Variables | Seguidos (n=302) | Pérdida de seguimiento (n=131) |
|---|---|---|
| Demográficas | ||
| Edad (años) | 62,6±11,9 | 64,2±12,1 |
| Masculino, n (%) | 212 (70,2) | 96 (73,3) |
| Procedencia urbana, n (%) | 271 (89,7) | 105 (80,8)a |
| Antropométricas | ||
| PAS (mmHg) | 122,8±17,9 | 119,7±17,5 |
| PAD (mmHg) | 73,9±11,7 | 73,1±10,9 |
| Peso (kg) | 69,3±11,8 | 69,4±10,7 |
| IMC (kg/m2) | 26,2±4,1 | 25,9±3,9 |
| CA (cm) | 91,8±11,4 | 93,5±12,2 |
| RCC | 0,98±0,07 | 0,97±0,08 |
| Determinaciones bioquímicas | ||
| GPA (mg/dl) | 110,3±38,9 | 110,7±33,8 |
| PTOG (mg/dl) | 154,5±59,0 | 148,3±56,6 |
| Colesterol total (mg/dl) | 166,3±43,7 | 171,7±38,2 |
| cLDL (mg/dl) | 100,6±34,6 | 105,5±34,3 |
| cHDL (mg/dl) | 36,1±12,0 | 36,1±9,5 |
| Triglicéridos (mg/dl) | 165,9±129,8 | 159,0±84,9 |
| Creatinina (mg/dl) | 1,05±0,59 | 1,04±0,30 |
| Plaquetas (K/μl) | 267,3±81,3 | 256,9±86,4 |
| Creatincinasa (IU/l) | 774,2±1.009,0 | 902,8±898,2c |
| Creatincinasa-MB (IU/l) | 87,4±144,6 | 99,0±110,9 |
| Antecedentes médicos | ||
| Hipertensión, n (%) | 140 (46,4) | 67 (51,2) |
| Angina, n (%) | 17 (5,6) | 17 (13,0)a |
| ACV, n (%) | 5 (1,7) | 3 (3,3) |
| Diagnóstico de admisión | ||
| IAMCEST, n (%) | 174 (57,6) | 68 (51,9) |
| IAMSEST, n (%) | 128 (42,4) | 63 (48,1) |
| Territorio de infarto | ||
| Infarto anterior, n (%) | 108 (35,8) | 52 (39,7) |
| Infarto inferior, n (%) | 117 (38,7) | 45 (34,4) |
| Otro territorio, n (%) | 77 (25,5) | 34 (25,9) |
| Estrategia de reperfusión | ||
| Trombólisis, n (%) | 50 (16,6) | 18 (13,7) |
| ICP, n (%) | 128 (42,4) | 54 (41,2) |
| CABG, n (%) | 17 (5,6) | 18 (13,7)b |
| Tratamiento al egreso | ||
| Antiplaquetarios, n (%) | 271 (89,7) | 88 (67,2)b |
| Beta-bloqueadores, n (%) | 237 (78,5) | 85 (64,9)b |
| IECA/ARA-II, n (%) | 237 (78,5) | 77 (58,8)b |
| Estatinas, n (%) | 266 (88,1) | 87 (66,4)b |
| Terapia antidiabética, n (%) | 65 (21,5) | 17 (13,0)a |
ACV: accidente cerebrovascular; ARA-II: antagonistas de los receptores de angiotensina-ii; CA: circunferencia abdominal; CABG: cirugía de revascularización coronaria; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; DM2: diabetes mellitus tipo 2; GPA: glucosa plasmática en ayunas; IAMCEST: infarto agudo de miocardio con elevación del ST; IAMSEST: infarto agudo de miocardio sin elevación del ST; ICP: intervención coronaria percutánea; IECA: inhibidores de la enzima convertidora de angiotensina; IMC: índice de masa corporal; N/A: no aplicable; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PTOG: prueba de tolerancia oral a la glucosa; RCC: relación cintura/cadera.
Las variables están reportadas como promedio±DE o n (%).
De nuestro conocimiento, este es el primer estudio en evaluar la asociación entre el estado glucémico y desenlaces cardiovasculares a corto y a largo plazo en pacientes latinoamericanos sobrevivientes a un primer IAM. Encontramos que una considerable proporción de los pacientes admitidos con un primer IAM tienen algún grado de hiperglucemia (69,5%), siendo la prediabetes el diagnóstico más común (29,6% del total de la población de estudio). Comparados con los pacientes normoglucémicos, los pacientes con DM2-conocida presentaron riesgo incrementado de desenlaces adversos tempranos caracterizados por estancia hospitalaria prolongada, mayor severidad determinada por clase de Killip y mayores tasas de IC intrahospitalaria. Adicionalmente, durante el seguimiento a 3años los pacientes con DM2-conocida, DM2-nueva y prediabetes presentaron tasas más altas de MACE que los pacientes normoglucémicos.
Aunque la prevalencia de prediabetes y DM2 continúa aumentando a nivel mundial11, estas condiciones permanecen sin ser diagnosticadas y tratadas oportunamente en muchos pacientes. El diagnóstico está siendo realizado en algunos casos de forma tardía cuando ya se han presentado daños vasculares irreversibles12. Al igual que en nuestro estudio, en el cual encontramos un 29,6% de la población con prediabetes y un 19,4% de la población con DM2-nueva que no había sido diagnosticada previamente, muchos otros estudios también han reportado prevalencias altas de alteraciones de la glucemia no diagnosticadas anteriormente en pacientes con IAM13,14.
Las anormalidades de la glucemia de reciente diagnóstico han mostrado estar asociadas con mayor morbimortalidad cardiovascular a corto y a largo plazo15. En nuestro estudio los pacientes con DM2 tuvieron mayor morbilidad intrahospitalaria y aquellos con cualquier nivel de hiperglucemia tuvieron tasas más altas de MACE en el seguimiento a 3años en comparación con los pacientes normoglucémicos. Previamente reportamos, en población colombiana, que una GPA alterada (>100mg/dl) es el factor de riesgo con mayor grado de asociación con la presencia de enfermedad arterial coronaria en pacientes con angina estable, independientemente de la presencia de otros factores de riesgo cardiovascular clásicos16. Además, demostramos que la resistencia a la insulina es un predictor de nuevos episodios y muerte cardiovascular en pacientes que sobreviven a un primer IAM17. Por tanto, en los pacientes latinoamericanos que presentan un primer IAM se debe obligatoriamente hacer búsqueda activa de prediabetes y DM2 e instaurar estrategias efectivas de manejo con el propósito de contribuir a la prevención de desenlaces cardiovasculares futuros.
La estrategia óptima para la identificación de individuos con alteraciones glucémicas en el escenario de un IAM no está completamente definida. Aunque las guías clínicas de la Joint British Societies para la prevención de ECV recomendó la realización de una GPA como alternativa de la PTOG en pacientes que han tenido un episodio cardiovascular agudo18, evidencia reciente sugiere que la utilización de la GPA como criterio único puede llevar al subdiagnóstico de una proporción importante de pacientes con DM2 después de un IAM15. Adicionalmente, los pacientes no diabéticos pueden presentar hiperglucemia inducida por estrés durante la fase aguda del episodio coronario debido a los niveles incrementados de mediadores contrarreguladores de insulina como citoquinas proinflamatorias, epinefrina, cortisol y factor de necrosis tumoral alfa19. Sin embargo, el estudio GAMI mostró que la PTOG realizada en el hospital 4-5días después de un IAM tiene una buena correlación con el estado glucémico incluso a los 3 y 12meses después del episodio8. De esta manera, recomendamos la realización sistemática de una PTOG en todos los pacientes no diabéticos ingresados por IAM y bajo condiciones de estabilidad hemodinámica, tal como se hizo en el presente estudio.
Se han descrito diferentes mecanismos para explicar la asociación entre hiperglucemia y disfunción coronaria y miocárdica. En la fase aguda del IAM la resistencia a la insulina causa producción excesiva de ácidos grasos libres, lo cual agrava la inflamación y consecuentemente empeora la disfunción endotelial junto con la hiperglucemia20,21. La disfunción endotelial causada por la hiperglucemia se caracteriza por la supresión de la vasodilatación mediada por flujo21, y esto se manifiesta con alteraciones en la microcirculación a pesar de una reperfusión exitosa22. Adicionalmente, la hiperglucemia se asocia con episodios adversos en la función plaquetaria, fibrinólisis, coagulación y pre-acondicionamiento isquémico del corazón, fenómenos que generan directamente daño en el miocardio23,24. En el presente estudio observacional, la DM2 se asoció con función miocárdica alterada, manifiesta por IC intrahospitalaria, aunque los mecanismos implicados no fueron determinados.
La hiperglucemia crónica produce glucosilación no enzimática de proteínas, aumento del metabolismo de la glucosa a través de las vías de poliol y glucosamina y generación de radicales libres, entre otros efectos25-31. La glucosilación de lipoproteínas de baja densidad hace que estas sean más oxidables y aterogénicas25; además, los productos finales de glucosilación avanzada (AGE, por sus siglas en inglés) pueden generar enlaces cruzados entre proteínas, particularmente en la matriz extracelular de la pared vascular29,30. El metabolismo del exceso de glucosa por vías secundarias también puede alterar la función celular mediante la modificación de la transducción de señales y cambiar el potencial oxidativo en las células28. Estas vías pueden activar también la proteincinasaC específica de tejidos27, y el aumento en la actividad de la proteincinasaC disminuye la fibrinólisis y los niveles de óxido nítrico (NO), y aumenta la proliferación celular y la coagulación26-28. Todos estos mecanismos pueden contribuir al desarrollo de ECV a largo plazo, y por ende podrían explicar las mayores tasas de MACE observadas en los pacientes prediabéticos y diabéticos de nuestro estudio en el seguimiento a 3años.
El presente estudio no contempló intervención de ningún tipo, por lo que los pacientes fueron manejados de acuerdo al criterio del médico responsable y a los protocolos de cada institución. Es de resaltar la baja prescripción de terapia hipoglucemiante al egreso en los pacientes prediabéticos e inclusive en los pacientes con DM2, pero también de otros medicamentos de eficacia probada en prevención secundaria tales como aspirina, clopidogrel, estatinas, beta bloqueadores e IECA32. Estudios epidemiológicos de gran escala han confirmado la sub-utilización de estos fármacos para la prevención secundaria en la población latinoamericana33, y también de los cambios terapéuticos en los hábitos de vida, incluyendo actividad física de fuerza34,35. Estos hallazgos destacan la necesidad de insistir con los médicos en la importancia del manejo farmacológico y de hábitos de vida para la prevención secundaria, como también la de estudiar las barreras que determinan este comportamiento.
La principal limitante de este estudio es que durante la fase de seguimiento no se logró contactar a un 30,3% de la población susceptible de seguimiento, siendo que la población no contactada tuvo mayores factores de riesgo basales y no recibió en mayor proporción una terapia óptima al egreso, lo cual podría suponer un sub-registro de episodios en el presente estudio. Estimamos necesaria la ejecución de otros estudios prospectivos que incluyan un mayor número de pacientes para confirmar el efecto negativo de la hiperglucemia en el pronóstico de pacientes con IAM en nuestra población.
ConclusiónEste estudio confirma en pacientes colombo-ecuatorianos con un primer IAM hallazgos previos, realizados en otras poblaciones, del efecto negativo a corto y a largo plazo de la hiperglucemia en desenlaces cardiovasculares. Estos pacientes deben ser candidatos de un cribado activo y de un tratamiento hipoglucemiante óptimo en la fase aguda y a largo plazo, acompañado de modificaciones en el estilo de vida y del uso de medicamentos de eficacia probada en la prevención secundaria.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste estudio no tuvo ningún soporte económico externo y fue soportado por cada una de las entidades participantes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen por su colaboración en el estudio a: Martin Aldana-Campos, Julie Alvarez-Camacho, Katherine Rincón-Romero, Laura Alvarado-Jurado, Carlos F. Puerta, Sergio D. Montalvo, Vanessa Lopez, Azucena Martínez y María A. Bravo.