Introducción
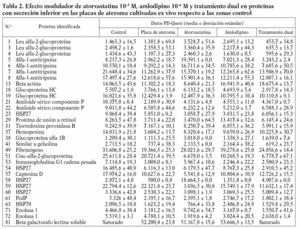
La aterosclerosis es una de las principales causas de defunción en los países desarrollados. La placa de ateroma es el resultado de la interacción entre varias especies celulares y moleculares, incluida la matriz de tejido conectivo (colágeno) producida por las células musculares lisas (CML), lípidos (incluidos en el núcleo de células espumosas derivadas de macrófagos o libres en el tejido), así como células del sistema inmunitario (macrófagos y linfocitos T). Algunas de estas interacciones están mediadas por proteínas secretadas por ambos tipos celulares, CML y células inflamatorias, durante el desarrollo y la proliferación de la placa. Algunas de estas proteínas podrían participar más activamente no sólo en la formación de la placa, sino también promoviendo su posible rotura y posterior trombosis, precipitando eventos coronarios agudos1. La caracterización de estas proteínas, por tanto, resulta esencial para poder entender mejor el proceso aterosclerótico.
Recientemente, el uso de técnicas proteómicas, como la electroforesis bidimensional (2D-EF) o la espectrometría de masas (EM), se ha convertido en una potente estrategia para la caracterización de proteínas, puesto que miles de proteínas pueden ser separadas, detectadas e identificadas en un único experimento. Uno de los principales obstáculos en la aplicación del análisis proteómico para estudiar las placas de ateroma es su composición heterogénea. Con objeto de solventar este problema, en nuestro laboratorio presentamos una estrategia alternativa, analizando por 2D-EF los sobrenadantes derivados de las placas ateromatosas incubadas ex vivo y comparándolos con los obtenidos de arterias sanas2. En el presente trabajo, tras mejorar notablemente los protocolos de preparación de muestras, se ha podido analizar un mayor número de muestras. Además, hemos considerado la zona fibrosa adyacente como control para evitar las diferencias asociadas al comparar con otras zonas arteriales (arterias radiales o mamarias, por ejemplo), centrándonos en la identificación de proteínas que pudieran estar más directamente involucradas en la formación y la rotura de la placa.
A pesar de su complejidad, la estructura y la composición de las placas de ateroma pueden modificarse mediante tratamiento farmacológico. Es el caso de las estatinas3,4 o los agentes bloqueadores de los canales de calcio (BCC)5, empleados en el tratamiento de afecciones vasculares, que además pueden modificar los valores de diversas proteínas circulantes. La combinación de fármacos es hoy un objetivo importante en la investigación cardiovascular dada la naturaleza multifactorial de estas enfermedades. En este sentido, este trabajo proteómico pretende ser una estrategia alternativa que permita acercarse un poco más a los mecanismos de estos tratamientos y sus efectos beneficiosos, tratando de entender las vías por las cuales estos fármacos podrían modular los valores de proteínas liberadas por las placas de ateroma.
Métodos
Colección e incubación de tejidos
Se incluyó a un total de 25 pacientes sometidos a endarterectomía carotídea en nuestra institución, previamente se obtuvo el consentimiento informado. Este estudio fue aprobado por el Comité Ético local de acuerdo con los requisitos institucionales. De cada endarterectomía carotídea se diseccionaron 2 regiones diferentes, la zona complicada estenosante (origen de la arteria carotídea interna) y la zona fibrosa adyacente (arteria carotídea común y externa), tal como describimos previamente2, comparando y analizando esas muestras pareadas. Las histologías mostraron que las placas complicadas contenían un porcentaje importante, aunque variable, de células inflamatorias. La zona adyacente consistía en una región fibrosa, que contenía principalmente CML vasculares.
Para evaluar el efecto de determinados fármacos en los perfiles de secreción proteico, las placas complicadas se dividieron en secciones similares (100 mg, aproximadamente) y se incubaron con dosis fisiológicas de atorvastatina (105M), amlodipino (106 M) o ambos fármacos combinados (dual). Tras 24 h, se recogieron los medios, centrifugándose a 14.000 g, y se determinó la concentración de proteínas mediante el método Bradford. Además, otros 2 pacientes fueron tratados con atorvastatina (80 mg/día) durante 1 mes, antes de la cirugía. La endarterectomía carotídea se cultivó en las mismas condiciones descritas arriba, permitiendo comparar la modulación de los perfiles de secreción en función del modo de administrar el fármaco. Los sobrenadantes se alicuotaron y conservaron a 80 °C.
Electroforesis bidimensional
Los sobrenadantes obtenidos de las placas de ateroma y los segmentos fibrosos incubados ex vivo se analizaron por 2D-EF, tal como describimos previamente2, comparando los patrones de proteínas de ambos sobrenadantes. Para mejorar los resultados de la 2D-EF incluimos un protocolo de precipitación con TCA/acetona, eliminando así especies interferentes en la separación por 2D-EF (lípidos o sales) y consiguiendo una mayor concentración de la muestra proteica. Se precipitaron 600 µg de proteína con 10% TCA y 0,07% de 2-mercaptoetanol en acetona, incubando durante una hora a 20 °C. Estas muestras se centrifugaron, lavando el precipitado con 1 ml de acetona fría que contenía 0,07% 2-mercaptoetanol (20 °C, 20 min, aproximadamente). La acetona residual se elimina finalmente secando al aire. El precipitado se resuspendió en 300 µl de tampón de rehidratación (8 M urea, 0,5% CHAPS, 1% TCEP, 0,2% anfolitos, pH 3-10) para llevar a cabo los geles 2D. En la primera dimensión o IEF se emplearon tiras de pH 4-7, y se usaron geles al 12% de acrilamida en la segunda dimensión. Los geles se tiñeron con plata, según Blum et al6, y se escanearon con un escáner DuoScan Hid (AGFA). El procesamiento, la evaluación y el análisis estadístico de los datos se realizaron con el programa informático PD-Quest 7.1.1. (Bio-Rad, Hercules, CA,USA). Las imágenes se normalizaron para compensar las diferencias asociadas con el ruido por variación en la carga de proteínas, la tinción o la preparación de la muestra, y considerando solamente las variaciones asociadas con los valores de secreción de proteínas.
Digestión en gel
Siguiendo los datos del PD-Quest, aquellos puntos con diferentes valores de secreción en los sobrenadantes analizados se sometieron a digestión tríptica según Shevchenko et al7, incluidas algunas modificaciones. Las piezas del gel se extra-jeron previamente con un escalpelo estéril, tratándolas e in cubándolas finalmente con 50 mM NH4HCO3 que contenía 12,5 ng/µl de tripsina modificada (Promega, Madison, WI, USA) en un baño de hielo. Tras 45 min, el sobrenadante se descarta y se añaden 20 ml de 50 mM NH4HCO3, dejando la digestión toda la noche a 37 °C. Finalmente, se recogieron los sobrenadantes que contienen los péptidos trípticos para usarlos directamente en el análisis con MALDI.
Purificación de las muestras digeridas mediante microcolumnas
Los digeridos se purificaron según Gobom et al8. Para ello se prepara una columna casera con una punta GELoader (Eppendorf, Hamburgo, Alemania) y 100-300 ml de material POROS R2 (PerSeptive Biosystems, Framingham, MA). Con ayuda de una jeringa de 1 ml se ejerce presión para que el líquido pase a través de la columna. La columna se equilibró con 20 µl de 5% de ácido fórmico (AF), añadiendo a continuación el analito en un medio acidificado. Tras lavar con 20 µl de 5% de AF, los péptidos retenidos se eluyen directamente en la placa del MADI empleando 0,5 µl de DHB (20 µg/µl en ACN: 0,1% TFA 70:30 v/v). Los reactivos y las matrices para el MALDI se obtuvieron de Aldrich Chemicals (Milwaukee, WI, USA).
Identificación y caracterización de proteínas mediante EM
Las mezclas peptídicas se analizaron mediante MALDI-MS, con un instrumento Voyager-DE STR BioSpectrometry Workstation (Applied Biosystems, Foster City, CA), en modo reflector positivo y usando los siguientes parámetros: voltaje de aceleración 20 kV, rejilla 72%, tiempo de retraso 300 ns, 100 disparos/espectro y rango de masa 800-3500 Da. La calibración interna se hizo con picos derivados de productos típicos de autólisis tríptica, resultando en una precisión de masa < 50 ppm. Los espectros se analizaron con el programa Data Explorer (Applied Biosystems, Foster City, CA).
Algunas muestras se analizaron por EM en tándem, acoplando cromatografía líquida a un instrumento Q-TOF Micro (Waters, Manchester, UK) y una adquisición automática de datos dependiente (DDA). La velocidad de flujo, 200 nl/min se controló mediante un sistema de nanoflujo-HPLC (Ultimate; Switchos2; Famos; LC packings, Ámsterdam, Holanda). La separación cromatográfica se llevó a cabo cargando las muestras peptídicas en una precolumna casera de sílice, 2 cm (75 µm ID; 375 µm O.D.; Zorbax® SB-C18 3 µm [Agilent, Wilmington, DE]), tal como describieron Meiring et al9. Los péptidos se eluyeron secuencialmente usando un gradiente linear combinando los solventes A (0% AcN en 1% FA/0,6% ácido acético/0,005% ácido heptafluorobutírico [HFBA]) y B (90% AcN en 1% FA/0,6% ácido acético/0,005% HFBA) durante 30 min en la precolumna en línea con una columna casera de resolución 8 cm (75 µm ID; 375 mm O.D.; Zorbax® SB-C18 3,5 µm). Esta última columna se conectó a un emisor de sílice (New Objective, Cambridge, MA, USA) (360 µm OD/ 20 µm ID / 10 µm aguja ID) a ~2,6 kV. La calibración externa se llevó a cabo usando NaI, resultando en errores de masa menores de 50 ppm. Los datos obtenidos se procesaron con MassLynx 3.5 ProteinLynx, exportándolos al formato Micromass pkl.
Para la identificación proteica se empleó el programa Mascot (http:// www.matrixscience.com), comparando los datos experimentales con una base de datos de secuencia de proteínas no redundante (NCBI) y usando los siguientes parámetros: precisión de masa monoisotópica < 50 ppm, 1 rotura ausente, permitiendo como modificaciones la carbamidometilación de cisternas (completa), oxidación de metioninas y formación de ácido piroglutámico (parcial).
Clasificación jerárquica del efecto modulador del tratamiento farmacológico en los valores de secreción proteica de la placa ateromatosa
Los datos obtenidos por PD-Quest tras la adición de fármacos (atorvastatina, amlodipino y tratamiento dual) a las placas ateromatosas cultivadas ex vivo fueron analizados y agrupados mediante clasificación jerárquica, obteniendo el cluster resultante. Estos datos se normalizaron previamente frente a los valores de secreción de la región fibrosa, considerados controles; se trataron posteriormente con el programa informático Gene Expresión Pattern Análisis Suite v.1.1. (GEPAS)10 y se obtuvieron los respectivos valores logarítmicos. El cluster en sí se obtuvo con el programa Self-Organizing hierarchical Neural Network (SOTA)11, empleando los siguientes parámetros: distancias euclídeas para las condiciones del cluster (árbol superior) y distancia euclidiana (normal) entre los genes. Los demás parámetros permanecieron sin modificar, tal como indica el programa.
Análisis estadístico
Los datos del PD-Quest se expresan en media error estándar. Para analizar las diferencias entre las placas de ateroma complicadas (con o sin tratamiento) y las zonas fibrosas se utilizó la prueba de Wilcoxon. Las diferencias se consideraron significativas cuando el valor de p < 0,05.
Resultados
Identificación de proteínas en el medio condicionado de las placas de ateroma en cultivo
Resultados previos obtenidos en nuestro laboratorio2 demostraron que las placas de ateroma cultivadas ex vivo pueden secretar proteínas al medio, detectándose un perfil diferencial de secreción proteica entre las placas ateromatosas y las arterias sanas. En total, 200 puntos fueron detectados en las zonas más complicadas. En este trabajo, se han mejorado los protocolos de preparación de muestras, sobre todo al aplicar un paso de precipitación con TCA/acetona, lo que permitió obtener geles con mayor resolución y calidad, y derivó en un mayor número de proteínas detectadas e identificadas mediante EM. En este caso nos hemos centrado en el análisis de 260 puntos en una media de 620 puntos detectados por gel.
De acuerdo con los resultados obtenidos por PD-Quest, un total de 217 puntos (88,21%) presentaron valores de secreción mayores en el secretoma de la placa de ateroma que en el medio de la región fibrosa. El resto de las proteínas aparecía disminuido o no mostró diferencias significativas entre la placa y la zona control. Así, mediante EM pudimos identificar 83 proteínas, 34 de las cuales estaban incrementadas en el secretoma de la placa mientras que otras 31 presentaron valores de secreción inferiores en la placa de ateroma que en los controles. Los nombres y las características de estas proteínas se han incluido en las tablas 1 y 2. Algunas proteínas fueron detectadas en varios puntos del gel, sugiriendo la presencia de modificaciones postraduccionales. Entre ellas están, por ejemplo, la transferrina (2 isoformas), la apolipoproteína A-I (3 isoformas), el fibrinógeno (3 isoformas), la alfa-1-antitripsina (4 isoformas) o la enolasa 1 (2 isoformas).
Agentes terapéuticos moduladores del perfil de secreción proteico en la placa de ateroma
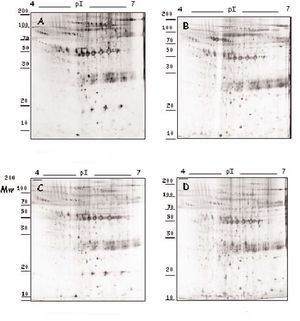
La adición in vitro de fármacos a los segmentos carotídeos complicados con placa ateromatosa produjo diversos efectos en los valores de secreción proteica (tablas 1 y 2), dependiendo del tipo de fármaco (atorvastatina, amlodipino o tratamiento dual) y de la proteína considerada (fig. 1). Estas variaciones en el perfil de secreción proteico de la placa se han agrupado según una clasificación jerarquizada o cluster (fig. 2).
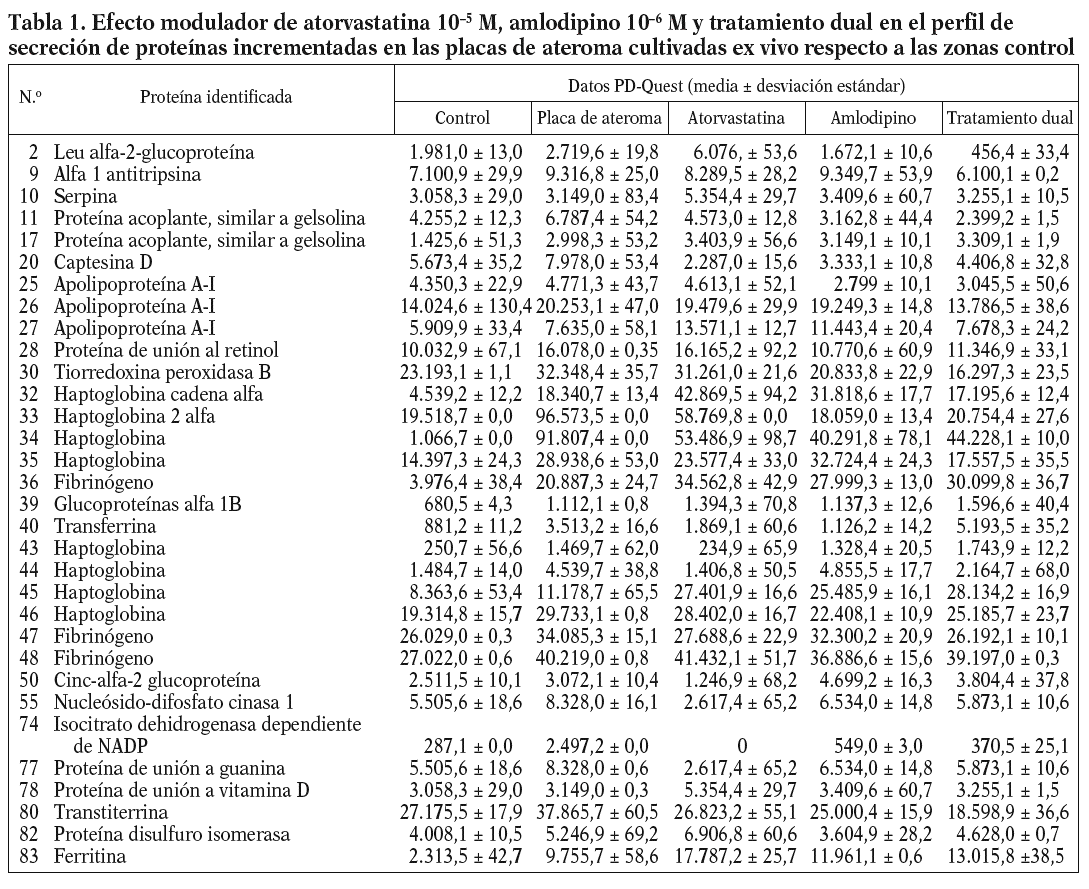
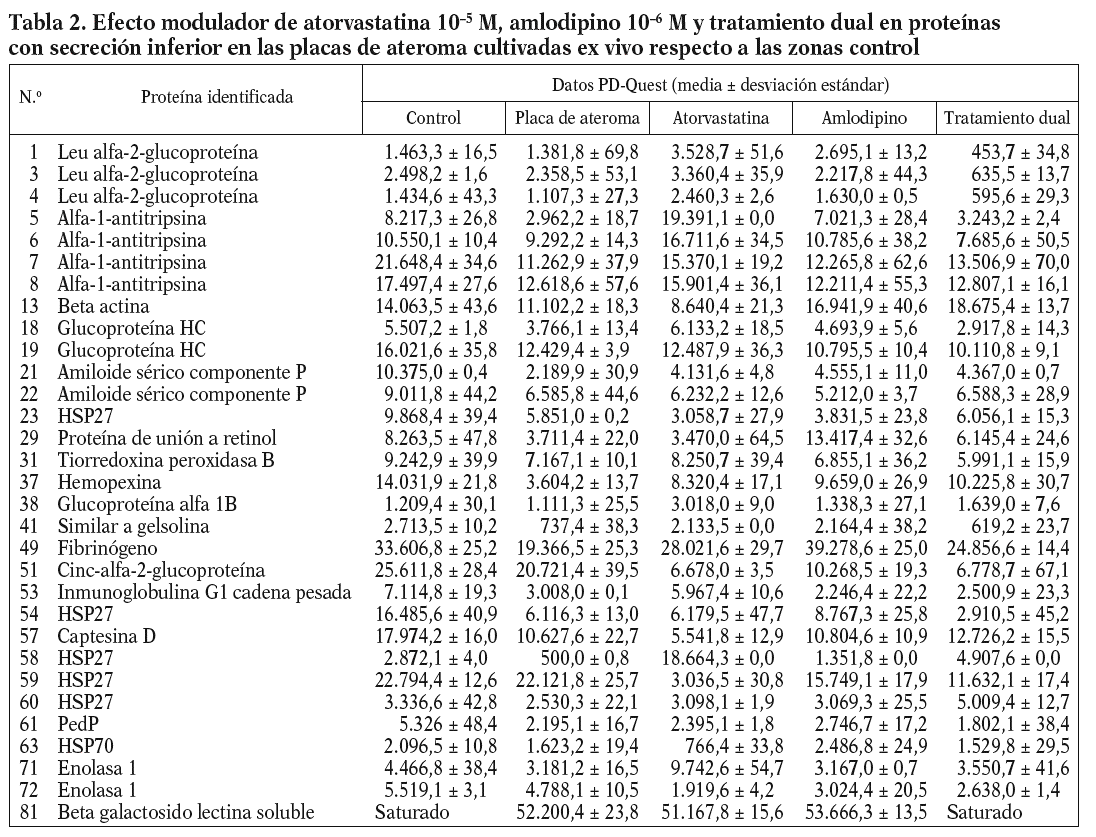
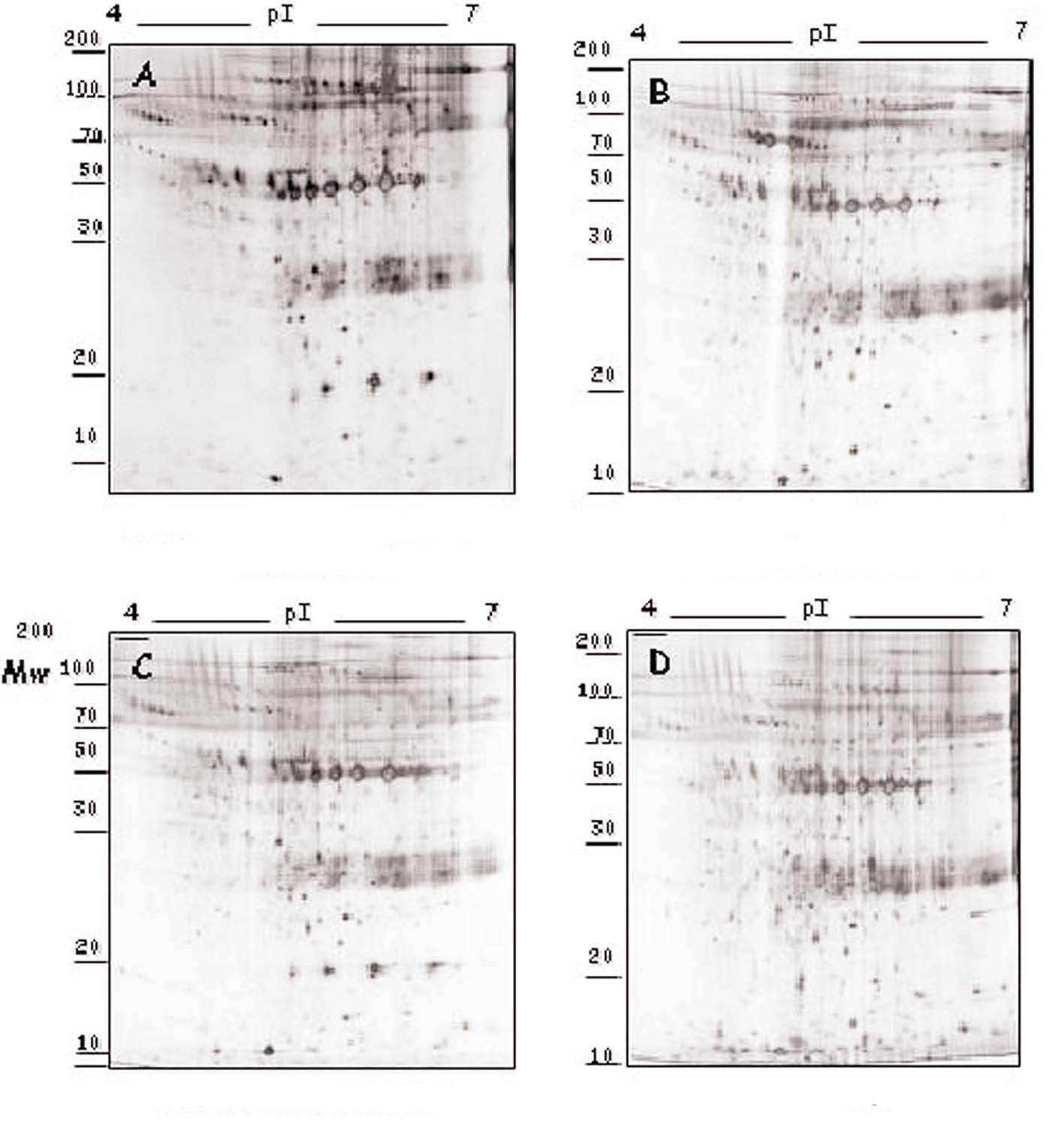
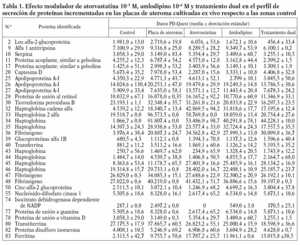
Figura 1. Modulación del perfil de secreción proteico detectado en las placas de ateroma mediante tratamiento farmacológico. Geles 2D correspondientes al perfil de secreción proteico observado en los segmentos complicados de placas de ateroma (A) y la variación tras la adición de atorvastatina 105 M (B), amlodipino 106 M (C) y tratamiento combinado de ambos fármacos (D) a las placas de ateroma cultivadas ex vivo.
La mayoría de las proteínas identificadas con valores de secreción incrementados en las placas de ateroma respecto a las zonas control revertía a valores control independientemente del tratamiento aplicado (12 proteínas revertían con atorvastatina, amlodipino y tratamiento dual), seguido de aquellas que aumentaban aun más los valores de secreción, independientemente del tratamiento (6 proteínas). Otras 5 presentaban valores superiores de secreción tras tratamiento con atorvastatina comparado con la placa sin tratar, pero estos valores disminuían con amlodipino o doble tratamiento.
En el caso de las 31 proteínas con valores de secreción inferiores en la placa de ateroma respecto a las zonas control, la respuesta frente a los fármacos derivó en nuevos perfiles de secreción. La mayoría revertía a valores control independientemente del fármaco empleado, mientras que un número reducido de ellas disminuía aun más su secreción tras el tratamiento.
Modulación del perfil proteico mediante administración directa de atorvastatina a pacientes con aterosclerosis carotídea
Con la idea de aproximarnos aun más a los mecanismos por los cuales la atorvastatina parece regular los valores de secreción proteica detectados en la placa de ateroma, decidimos plantear un ensayo paralelo, en el que pacientes con aterosclerosis carotídea son tratados con 80 mg de atorvastatina un mes antes a la endarterectomía. Las placas correspondientes fueron incubadas como indicamos previamente y los sobrenadantes fueron analizados mediante 2D-EF y EM. Se trata de un estudio piloto, puesto que el número de muestras disponibles en el momento de llevar a cabo el análisis proteómico era insuficiente. La figura 3 muestra una comparación entre los patrones de secreción obtenidos a partir de placas de ateroma incubadas ex vivo con atorvastatina o aquellas derivadas de pacientes tratados con el fármaco, previa endarterectomía y extracción de la placa.
Figura 2. Representación mediante clasificación jerárquica de los diferentes efectos promovidos por los fármacos en las proteínas secretadas por la placa ateromatosa. Los diferentes tratamientos aplicados a las placas de ateroma ex vivo se han agrupado y comparado en este cluster, donde la escala de colores es representativa de los diferentes niveles observados en las proteínas secretadas tras la adición de los fármacos, tomando la zona fibrosa adyacente como valores control. De este modo, proteínas con valores de secreción inferiores a los controles tras el tratamiento se incluyen en la escala de verdes, y aquellos con secreción incrementada aparecen en rojo, asociando el "verde oscuro" a los controles.
Figura 3. Comparación mediante 2D-EF de la modulación por atorvastatina in vivo e in vitro. La figura recoge algunas de las diferencias más significativas cuando los mapas proteicos detectados para las placas de ateroma tratadas ex vivo con atorvastatina 105 M (A) y el obtenido en placas de pacientes tratados con este fármaco (80 mg/día) un mes antes de la endarterectomía (B). A pesar de la semejanza, pueden detectarse significativas diferencias entre ambos perfiles proteicos, posiblemente debido al tiempo de administración del fármaco.
Discusión
La estructura de la placa de ateroma es compleja, constituida por células de la pared vascular (endoteliales y CML), lipoproteínas y células inflamatorias. Son varias las estrategias seguidas hasta hoy para analizar los mecanismos implicados en la formación y la rotura de la placa12. En este sentido, nuestro laboratorio se ha centrado en el estudio de las proteínas secretadas por la pared vascular. Así, en un análisis proteómico preliminar demostramos que placas de ateroma, obtenidas mediante endarterectomía y cultivadas ex vivo, son capaces de secretar proteínas al medio2, detectando un perfil diferencial de secreción entre las placas de ateroma y arterias sanas mediante 2D-EF y EM. En el presente trabajo, tras algunas mejoras en los protocolos para el tratamiento de las muestras, hemos comparado los perfiles de secreción de la placa de ateroma y la zona adyacente fibrosa, con objeto de detectar así proteínas que pudieran estar más directamente implicadas en la formación y la rotura de la placa. Un total de 83 proteínas diferencialmente secretadas por ambas fueron identificadas por EM, de las cuales 34 estaban incrementadas en el sobrenadante de las placas de ateroma frente a los controles y otras 31 parecían disminuir en la secreción detectada en las placas. Varias proteínas fueron identificadas en varios puntos del gel, indicando la presencia de modificaciones postraduccionales en ellas.
Algunas de las proteínas identificadas podrían estar más directamente involucradas en el proceso aterosclerótico. Así, en el grupo de proteínas con valores de secreción aumentados en la placa de ateroma encontramos proteínas clásicas, como fibrinógeno y antitripsina; proteínas antioxidantes, como la tiorredoxina peroxidasa, cuyo papel protector en la placa se ha discutido recientemente13; proteínas estructurales, como la proteína acoplante de macrófagos, involucrada en la reorganización de la actina durante aterosclerosis14; proteínas transportadoras de hierro, como la ferritina o la transferrina, cuyo incremento supondría un aumento de los valores de hierro y, por tanto, un aumento en los valores de radicales libres15; la proteína disulfuro isomerasa, cuya sobreexpresión podría suprimir la activación de NF-*B16, un factor de transcripción clave en la aterosclerosis17; o finalmente proteínas relacionadas con el metabolismo del colesterol, como apolipoproteína A-IV o cinc-alfa-2-glucoproteína. El aumento de apolipoproteínas A-IV en la placa podría ser beneficioso, al promover una disminución de los valores de colesterol en el tejido dañado. Del mismo modo, la cinc-alfa-2-glucoproteína podría favorecer la regresión de la estructura de la placa al estimular la degradación lipídica en los adipocitos y reducir los depósitos lipídicos. Por el contrario, la proteína Apo A-I, un componente de la lipoproteínas de alta densidad (HDL), aparecía disminuida en la placa, lo cual estaría en concordancia con aquellos estudios que asocian la reducción de la Apo A-I con un aumento en fenómenos cardíacos18.
A pesar de su complejidad, las placas de ateroma no son inmutables, puesto que su estructura y composición pueden modificarse mediante tratamiento farmacológico. El uso de medicamentos tales como las estatinas, agentes reductores de valores lipídicos, o los BCC, fármacos capaces de reducir la presión sanguínea al controlar los valores de calcio corporales, ha permitido reducir notablemente el índice de mortalidad en varias enfermedades cardiovasculares. En el caso de las estatinas, se ha demostrado previamente que estos fármacos son capaces de modular los valores de diferentes proteínas inflamatorias, tanto en placas de ateroma carotídeas3,4 como en la sangre de los pacientes con aterosclerosis carotídea4. Según esto, nos planteamos si estos fármacos, estatinas y BCC, podrían ser capaces de modular los valores de secreción proteica observados en las placas de ateroma cultivadas ex vivo y, en ese caso, comparar los efectos derivados de estos tratamientos. Para ello empleamos la misma estrategia proteómica, comparando mediante 2D-EF los perfiles de secreción proteica de las placas en presencia o ausencia de atorvastatina, amlodipino o de la combinación de ambos. El análisis por PD-Quest produjo una combinación compleja de datos, obteniendo diversas respuestas según el tipo de fármaco y de la proteína considerada. Al agrupar estos datos en un cluster pudo verse una clara separación entre las proteínas con valores de secreción aumentados o disminuidos en la placa respecto a las zonas fibrosas. Del mismo modo, los fármacos administrados pudieron compararse y agruparse según el efecto en los valores de secreción. El tratamiento dual y la adición simple de amlodipino aparecen juntos en este cluster, resultando en efectos similares sobre los valores de secreción. La figura parece indicar que la atorvastatina podría inducir la reversión a valores normales en un mayor número de proteínas que el amlodipino. Finalmente, el tratamiento dual resultó en algunos casos incluso mejor que la aplicación individual de estos fármacos, al promover la reversión a valores de secreción normales o al menos disminuyendo el efecto asociado con la presencia de la placa. Los tratamientos con atorvastatina o amlodipino no siempre favorecieron la reversión a valores de secreción normales, sino que promovieron en algunos casos el efecto contrario, detectando valores de secreción incluso mayores y menores que aquellos relacionados con la placa sin tratamiento. El aumento de proteínas que estén implicadas en mecanismos de defensa o la disminución de las proteínas que estén favoreciendo procesos implicados en aterogénesis mediante estos tratamientos farmacológicos podrían favorecer la estabilización de pacientes con aterosclerosis. En este sentido, es necesario llevar a cabo estudios funcionales posteriores para entender los diferentes efectos provocados por estos fármacos. Finalmente, planteamos igualmente un estudio proteómico para evaluar los efectos derivados de la administración directa de atorvastatina a pacientes con aterosclerosis carotídea un mes antes de la endarterectomía sobre los perfiles de secreción proteica. Si bien se trata de un estudio piloto, puesto que necesitamos aun incorporar un mayor número de muestras para este análisis, es posible encontrar una notable semejanza al comparar a simple vista los geles 2D derivados de los perfiles de secreción proteica de las placas de ateroma procedentes de pacientes tratados previa endarterectomía o de placas cultivadas ex vivo con atorvastatina. Estos datos sugieren la necesidad de continuar con este análisis, puesto que podría acercarnos aun más a conocer los mecanismos por los cuales estos fármacos pueden modular in-vivo los valores de potenciales nuevos biomarcadores de aterosclerosis.
En definitiva, el uso de técnicas proteómicas nos ha permitido identificar y caracterizar un importante número de proteínas secretadas por las placas de ateroma al medio circulante, algunas potencialmente involucradas en la formación e inestabilidad de la placa de ateroma. El patrónnciones pro o antiaterogénicas, podría sugerir que el balance entre estas proteínas sería decisivo en la progresión o no de la lesión. Por otro lado, siguiendo esta misma estrategia proteómica, hemos podido evaluar por primera vez el efecto modulador que determinados fármacos ejercen sobre los valores de secreción proteicos, bien por administración directa al paciente o por tratamiento in vitro de las placas ateromatosas. Tal estrategia podría emplearse, por tanto, como una herramienta importante para entender los mecanismos por los cuales estos fármacos ejercen beneficios en el tratamiento de las enfermedades cardiovasculares.