Introducción
La hipercolesterolemia familiar (HF) presenta un elevado riesgo de mortalidad por enfermedad coronaria1. Datos del Registro Español1 y del Registro inglés2 de esta enfermedad muestran que los factores nutricionales pueden ser clave como predictores de riesgo. En la pasada década se ha acumulado un gran cuerpo de evidencia sobre la interacción genes-dieta como determinante de la respuesta lipídica plasmática a intervenciones en la alimentación3. Muchos genes candidatos se han mostrado como marcadores potenciales de la respuesta individual a la dieta, entre los que destacan los genes de la apo E, apo A-IV, apo B, apo C-III y el de la lipoproteína lipasa (LPL)4. Sin embargo, la posible influencia de la interacción genético-ambiental en los valores del colesterol plasmático es poco conocida en los pacientes con HF5,6.
Los transportadores ABCG5 y 8 son proteínas localizadas en la membrana plasmática y en las membranas intracelulares de los enterocitos y de los hepatocitos que están implicadas en la absorción de los esteroles vegetales de la dieta y en la regulación del transporte lipídico intracelular7. La presencia de mutaciones en los genes que codifican estas proteínas se ha identificado como causa de la sitosterolemia, un raro trastorno del metabolismo caracterizado por valores plasmáticos elevados de esteroles vegetales, debido a una hiperabsorción y descenso en la secreción biliar de esteroles8. Una alteración en estas vías metabólicas aumenta la posibilidad de que variaciones genéticas en estos genes contribuyan a la variabilidad interindividual en la colesterolemia y en la respuesta tanto a la dieta como al tratamiento con estatinas. Recientes hallazgos en pacientes con sitosterolemia y en modelos experimentales con animales sugieren que la disfunción en las actividades de los transportadores ABCG5/8 reduce de manera significativa la síntesis de colesterol en los hepatocitos9-11.
Gracias a las modernas tecnologías en la producción de alimentos, en los últimos años han aparecido nuevos productos capaces de reducir los valores plasmáticos de colesterol por la adición de esteroles vegetales. Éstos podrían ejercer un efecto aditivo en los pacientes con HF tratados con dieta y con hipolipemiantes12. En este sentido se han publicado varios trabajos que demuestran que el tratamiento combinado con estatinas y esteroles vegetales, al inhibir tanto la síntesis como la absorción del colesterol, sería útil para reducir las cifras de colesterol13,14. Sin embargo, son muy escasos los trabajos que han analizado estos efectos en pacientes con HF, sobre todo en relación con la existencia de variantes genéticas en los transportadores ABCG5 y ABCG8.
Por todo ello, nos planteamos como objetivo conocer si mutaciones en los genes de estos transportadores pueden condicionar una diferente respuesta lipídica en pacientes con HF cuando son sometidos a dietas con diferente contenido en colesterol y en esteroles vegetales; esto nos permitiría identificar subgrupos de pacientes con una respuesta diferente a la dieta.
Métodos
Población
La población estudiada inicialmente fueron 38 pacientes seleccionados de la cohorte de HF y del Registro Nacional de esta enfermedad que la Fundación de Hipercolesterolemia Familiar está llevando a cabo (http//www.colesterolfamiliar. com). Los criterios de inclusión fueron: HF según diagnóstico genético y/o clínico superior o igual a 8 puntos (criterios MedPed de la Organización Mundial de la Salud [MS])15 sin antecedentes personales de enfermedad coronaria, con una edad comprendida entre los 18 y los 75 años y sin padecer otras enfermedades que afectaran al metabolismo lipídico, con genotipo de apo E, E3/E3 (para eliminar la influencia de esa variación genética en la respuesta lipídica a la dieta), y que presentaran valores de colesterol unido a lipoproteínas de baja densidad (cLDL) mayores de 130 mg/dl y cifras de triglicéridos menores de 200 mg/dl. Durante el estudio todos los pacientes mantuvieron constante su tratamiento con estatinas (19 con 40 mg/día de atorvastatina y 19 con 40 mg/día de simvastatina) y ninguno se encontraba en tratamiento con otros hipolipemiantes (ezetimiba, resinas, fibratos). Se excluyó del estudio a los que precisaron cambios en las dosis de estatinas (2 sujetos), así como a los que decidieron abandonar el estudio por motivos personales (3 sujetos). También se excluyó a aquellos que realizaban una actividad física significativamente superior a la normal y a aquellos que ingirieron más de 20 g de alcohol al día (en total 3 sujetos). Completaron el estudio un total de 30 pacientes (15 varones y 15 mujeres, con una proporción homogénea en cuanto al genotipo de ABCG8 analizado). Todos los pacientes aceptaron su inclusión en el estudio previa firma de un consentimiento informado. El estudio fue aprobado por el Comité de Ética e Investigación Clínica del Hospital Universitario Reina Sofía.
Diseño del estudio
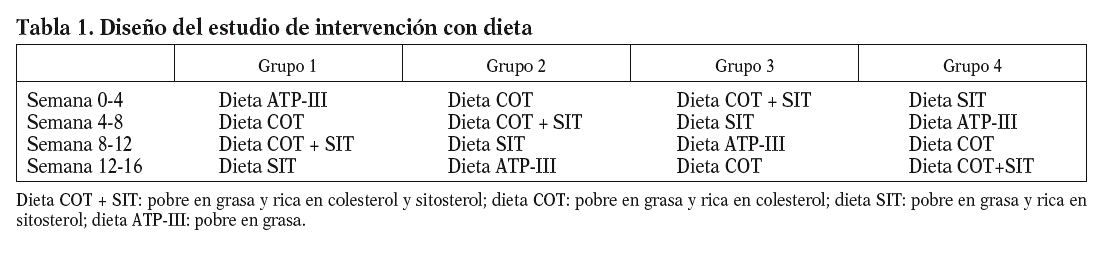
Se empleó un diseño aleatorizado y cruzado en cuadrados latinos estratificado. Estos pacientes fueron sometidos a 4 períodos de intervención dietética de 4 semanas de duración cada uno de ellos, isocalóricos en relación con su consumo previo habitual con objeto de mantener el peso de los pacientes estable. Durante el primer período de dieta (dieta pobre en grasa-dieta ATP-III) de forma aleatorizada se administró a una cuarta parte de los enfermos una dieta pobre en grasa, baja en colesterol (150 mg/día) con < 30% de grasa (< 10% saturada, 6% PUFA, 12% MUFA), 55% carbohidratos y 15% proteínas. Posteriormente, y de forma aleatorizada y cruzada, consumieron una dieta pobre en grasa (dieta rica en colesterol-dieta COT) pero con mayor contenido en colesterol (280-300 mg/día) y baja en sitosterol (< 1 g). A continuación, consumieron una dieta pobre en grasa pero con un mayor contenido en colesterol (280-300 mg/día) y de sitosterol (2,5 g/día) (dieta rica en colesterol y sitosterol-dieta COT + SIT) y, por último, consumieron una dieta pobre en grasa con bajo contenido en colesterol (150 mg/día) y rica en sitosterol (2,5 g/día) (dieta rica en sitosterol-dieta SIT). El diseño de las dietas del estudio se muestra en la tabla 1.
El contenido de colesterol de las dietas se mantuvo siempre dentro de los límites recomendados por los organismos internacionales para el tratamiento dietético de las hipercolesterolemias16. Asimismo, se tomaron el peso, la talla y se calculó el índice de masa corporal (IMC) en cada período.
La dieta se realizó en base a 20 menús rotativos previamente establecidos, utilizando alimentos naturales y calibrados para administrar las proporciones establecidas en cada período de dieta. Estos menús se administraron a los participantes del estudio en una institución cerrada y bajo la supervisión de un dietista.
Determinaciones analíticas
Se realizaron extracciones de 30 ml de sangre venosa en situación de ayunas (12-14 h) en tubos que contenían 1 mg/ml de EDTA y otros 30 ml de sangre en tubos que contenían citrato sódico al 3,8% al final de cada uno de los períodos de intervención dietética previamente señalados. Se determinaron los valores plasmáticos de colesterol total, triglicéridos, colesterol unido a lipoproteínas de alta densidad (cHDL), apo A-I, apo B, y se calcularon los valores de cLDL mediante la fórmula de Friedewald al final de cada uno de los períodos de intervención con dieta. Las cifras de colesterol y triglicéridos se determinaron mediante procedimientos colorimétricos-enzimáticos, y los valores de apo A-I y de apo B, mediante nefelometría. Los valores de cHDL se midieron mediante precipitación en ácido fosfotúngstico. Los esteroles vegetales se midieron mediante cromatografía de gases en el laboratorio de la Unidad de Lípidos del Hospital Clínico de Barcelona, según método descrito previamente17.
Análisis de los genotipos
La determinación de la variación genética C54Y en el gen del transportador ABCG8 y Q604E en el gen del transportador ABCG5 se realizó mediante análisis de los fragmentos de restricción del ADN amplificado por PCR. Se realizó la amplificación mediante un sistema de PCR con 500 ng de ADN genómico, 15 pmol de cada uno de los oligonucleótidos, 100 µmol dNTP, 10 mmol Tris HCl pH 8.3, 50 mmol KCl, 1,5 MgCl2 y 2,5 U Taq polimerasa en 50 µl. El ADN se desnaturalizó a 95 oC durante 5 min seguido de 30 ciclos de desnaturalización a 95 oC durante 1 min, annealing a 60 oC durante 1 min, y extensión a 72 oC durante 1 min y 30 s; 20 ml de los productos de amplificación por PCR se sometieron a la digestión con 5 unidades de las enzimas de restricción correspondientes (SmlI para la variación Q604E del ABCG5 y SexAI para la variación C54Y del ABCG8) en un volumen total de 35 µl. Los productos de digestión del ADN se sometieron a electroforesis no desnaturalizante en geles de poliacrilamida al 8% a 150 V durante 2 h para identificar el tamaño de los productos de digestión del ADN y de esta forma determinar las diferentes variaciones alélicas mediante tinción con sales de plata.
Análisis estadístico
En el estudio estadístico de los datos se utilizó el análisis de la varianza (ANOVA) para medidas repetidas, para determinar el efecto de las dietas en los diferentes parámetros estudiados y su interacción con la variación genética del transportador ABCG8. No se tuvo en cuenta el genotipo del ABCG5 por la escasa frecuencia alélica de la mutación encontrada (GG sólo 5%). Cuando se observaron diferencias significativas se utilizó la prueba de Tukey en comparación post hoc para identificar las diferencias existentes entre cada grupo. Los valores de lípidos plasmáticos se expresaron en mg/dl como medias ± desviación estándar. Se consideraron significativos valores de p < 0,05. Se empleó el paquete estadístico SPSS versión 11.0.
Resultados
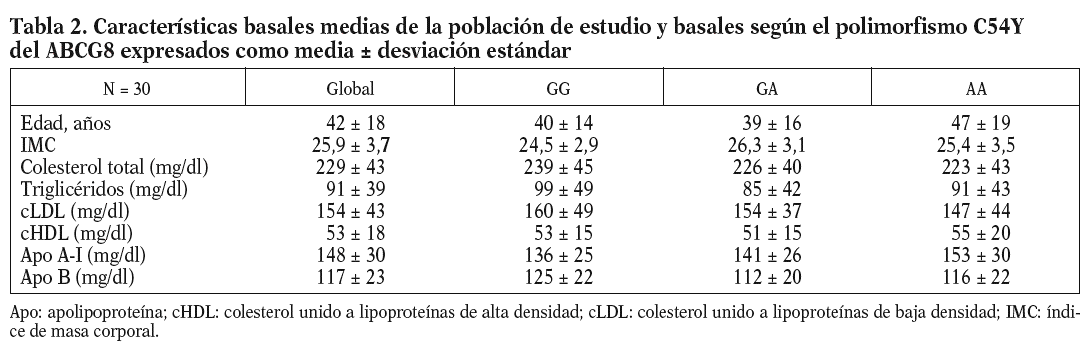
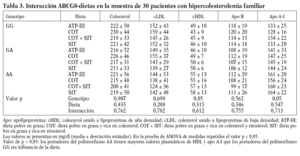
Las características basales de los participantes en el estudio se muestran en la tabla 2. La frecuencia de los genotipos estudiados fue la siguiente: ABCG8 (GG, 9 pacientes [5 varones y 4 mujeres]; GA, 10 pacientes [6 varones y 4 mujeres]; AA, 11 pacientes [4 varones y 7 mujeres]). Dada la escasa representación encontrada del alelo G en la variante genética del ABCG5 (sólo 4 pacientes), no se tuvo en cuenta para hacer el análisis estadístico.
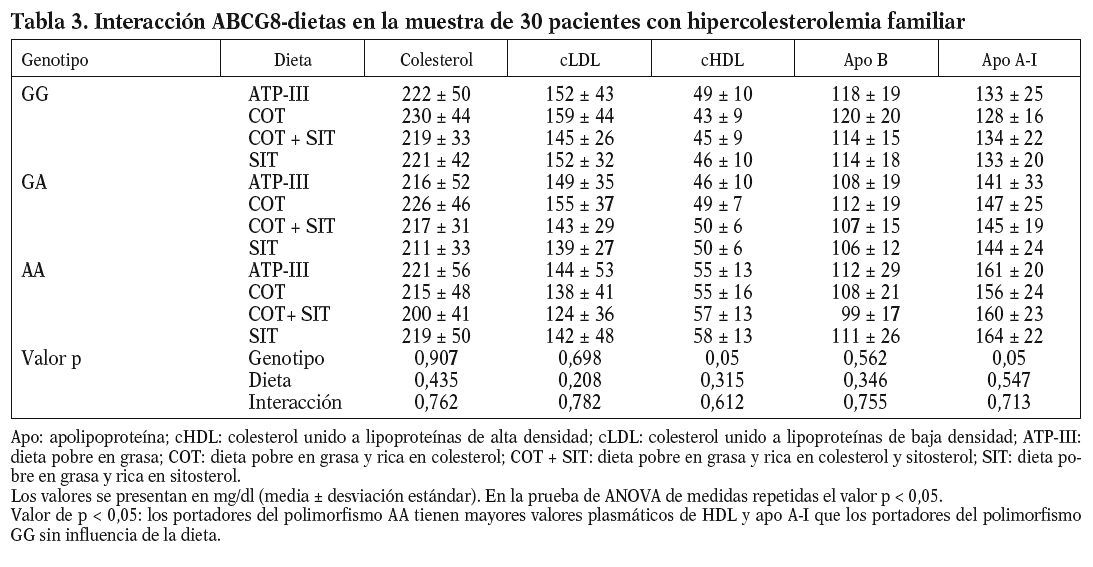
Al analizar los parámetros lipídicos tras la intervención dietética, no obtuvimos diferencias significativas ni tampoco encontramos un efecto de interacción genotipo-dieta en toda la muestra. Sí observamos una tendencia al descenso de las cifras de cLDL plasmáticas cuando se consumieron las dietas enriquecidas en esteroles vegetales (cLDL tras dieta COT + SIT, 143 mg/dl frente a 155 mg/dl de la dieta rica en COT; p = 0,141). Encontramos un efecto del genotipo del ABCG8, de forma que los homocigotos para la mutación C54Y (AA) del gen presentaron unos mayores valores de cHDL y de apo A-I que los portadores del alelo normal (56 ± 14 frente a 43 ± 8; p < 0,05) (tabla 3). No hubo diferencias entre las dietas en los valores de colesterol total, cLDL, triglicéridos y apo B según el genotipo de ABCG8.
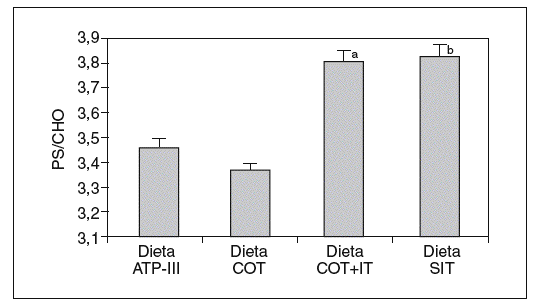
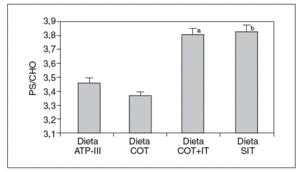
Cuando analizamos los valores plasmáticos de esteroles vegetales, encontramos mayores valores en los períodos ricos en esteroles vegetales (fig. 1), al igual que cuando determinamos el cociente sitosterol/colesterol (PS/CHO), lo que nos indica una buena adhesión de los pacientes a las dietas. No obtuvimos diferencias en estos valores en situación basal ni tras las dietas según el genotipo de ABCG8.
Figura 1. Valores del cociente esteroles vegetales/colesterol (PS/CHO) expresados en µmol/mmol tras las diferentes dietas. ANOVA de medidas repetidas. aDieta COT + SIT frente a dieta COT y dieta ATP-III (p < 0,05). bDieta SIT frente a dieta COT y dieta ATP-III (p < 0,026).
Dieta ATP-III: dieta pobre en grasa; dieta COT: dieta pobre en grasa y rica en colesterol; dieta COT + SIT: dieta pobre en grasa y rica en colesterol y sitosterol; dieta SIT: dieta pobre en grasa y rica en sitosterol.
Discusión
Nuestros datos muestran una asociación entre el polimorfismo C54Y del gen del ABCG8 y los valores plasmáticos de cHDL y apo A-I en pacientes con HF, de forma que los portadores del genotipo AA presentan unas mayores concentraciones plasmáticas de cHDL y apo A-I, mientras que esta mutación no condiciona una diferente respuesta en los valores de cLDL.
El uso terapéutico de margarinas enriquecidas con esteroles y estanoles vegetales puede reducir el riesgo cardiovascular debido al descenso de los valores plasmáticos de colesterol. Los ensayos clínicos con estas margarinas han demostrado una reducción en los valores de cLDL, independientemente de la cantidad de grasa saturada y total de la dieta previa18-20. En un metaanálisis de 14 estudios aleatorizados y doble ciego ha quedado demostrada su eficacia de modo dependiente de la dosis21, de forma que hasta 2 g/día de esteroles o estanoles vegetales conseguían una media de reducción en los valores de cLDL del 13 al 17%. En nuestro caso, hemos observado una escasa respuesta del cLDL (sólo un 5% de descenso) y cuando analizamos la influencia del genotipo del ABCG8 sobre esa respuesta, no obtuvimos influencia alguna. Tan sólo apreciamos un claro beneficio en la respuesta del cHDL en aquellos pacientes portadores del genotipo AA, ya que aumentaron sus valores plasmáticos de manera significativa en comparación con los portadores del genotipo GG.
Los transportadores ABCG5 y ABCG8 se han implicado en la absorción de los esteroles de la dieta y en la regulación del transporte lipídico intracelular22,23. Las concentraciones plasmáticas de esteroles vegetales varían ampliamente entre los individuos, pero suelen ser estables a lo largo del tiempo en un individuo dado. Este hecho sugiere que la carga genética puede ejercer un notable efecto en el metabolismo de los esteroles. Esto fue recientemente analizado por Miwa et al24, en un trabajo donde han demostrado que mutaciones del gen del ABCG8 (C54Y, Q604E, T400K y M429V) pueden explicar parcialmente esta variabilidad en pacientes con hipercolesterolemia primaria. Sin embargo, en este mismo trabajo no encontraron asociación entre los distintos polimorfismos analizados y los valores de los lípidos plasmáticos, incluido el HDL. Esto sugiere que las variantes genéticas en estos locus no son determinantes importantes en el perfil lipídico en estos pacientes. Esto concuerda con lo descrito previamente en la literatura médica, donde no existen trabajos que relacionen estas mutaciones con los valores de HDL.
En otro trabajo se ha demostrado que la variación genética D19H en el gen del ABCG8 se asocia a una mayor respuesta en los valores de cLDL al tratamiento con atorvastatina en pacientes con hipercolesterolemia moderada9. En nuestro estudio todos los pacientes estaban tomando estatinas al igual que en el mencionado pero no obtuvimos diferente respuesta en el cLDL, a pesar de añadir una dieta pobre en grasa y rica en esteroles vegetales. Sólo encontramos beneficio en la respuesta del cHDL en los pacientes con el genotipo AA del gen de ABCG8. No se conoce si este efecto puede deberse sólo al genotipo y no se ve influido por el tratamiento con estatinas.
La importancia de nuestros hallazgos radica en que pueden contribuir a explicar parte de la variabilidad en la respuesta a la dieta que caracteriza a los pacientes con HF. En este sentido cabe destacar que aquellos pacientes con HF que sean portadores del genotipo AA del gen del ABCG8 pueden ver incrementados sus valores de cHDL y apo A-I como circunstancia beneficiosa para su salud cardiovascular tras el consumo de estas dietas, con lo que podríamos seleccionar grupos de pacientes según este genotipo que podrían beneficiarse de esta intervención terapéutica.
Agradecimientos
A la Red de Hiperlipemias Genéticas G03/181; a Unilever Foods España por la margarina Flora pro-activ®.