Los niveles plasmáticos de la proteína FABP4 son superiores en pacientes con diabetes tipo 2 (DT2), obesidad y síndrome metabólico. La disfunción endotelial es una característica común en el desarrollo de las enfermedades vasculares asociadas a las alteraciones metabólicas. El objetivo del trabajo es estudiar la relación entre FABP4 circulante y la función endotelial en pacientes con elevado riesgo cardiovascular (RCV).
MétodosDoscientos cincuenta y siete pacientes (57,29±10,66 años) con RCV incrementado. Se determinó FABP4 plasmática. En el estudio vascular se valoró la función endotelial mediante el índice de la hiperemia reactiva (IHR) por tonometría arterial periférica, el grosor de la íntima-media carotídeo (GIM) y el índice tobillo-brazo (ITB). Las características antropométricas y los biomarcadores endoteliales, de inflamación y de oxidación fueron determinados.
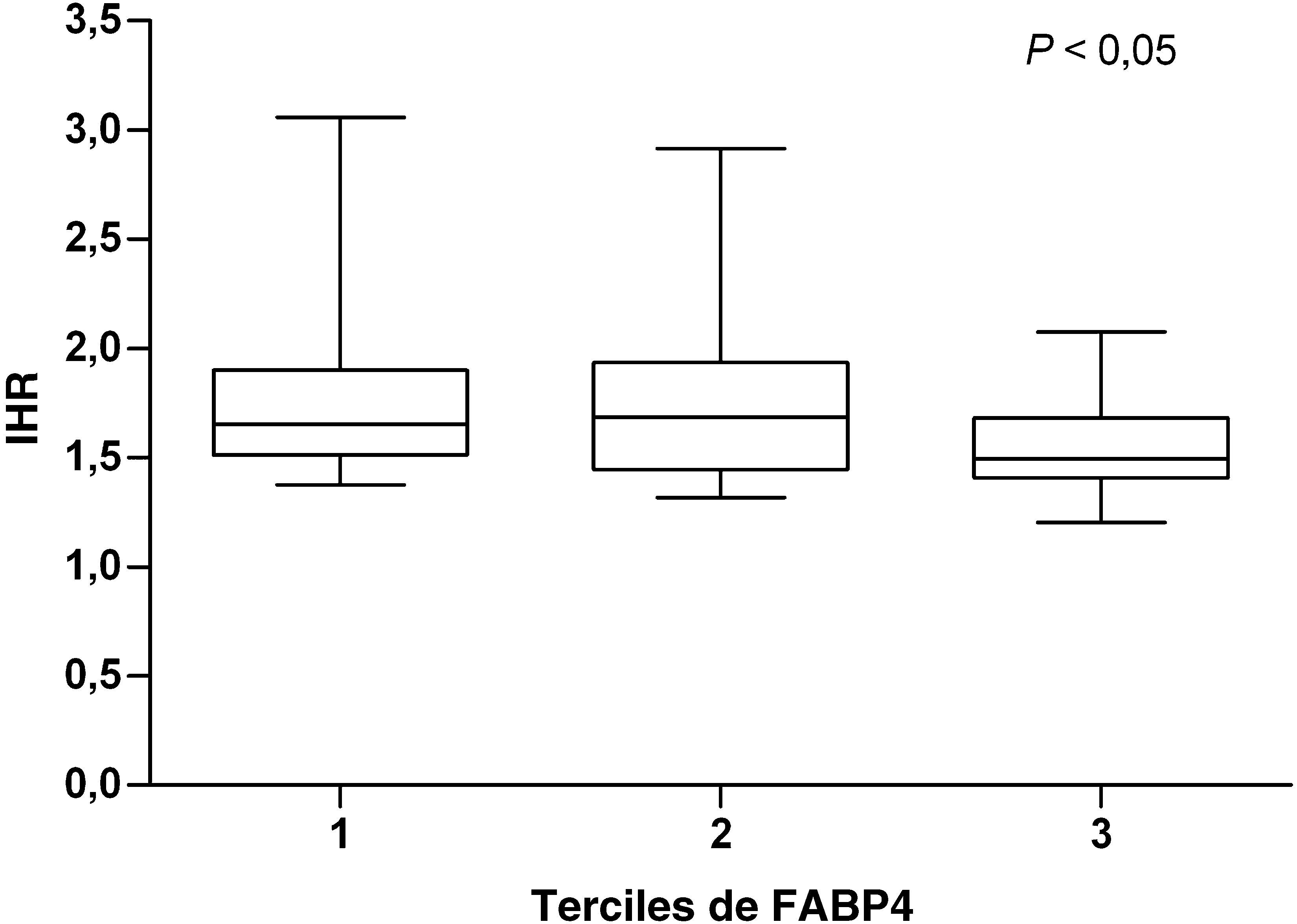
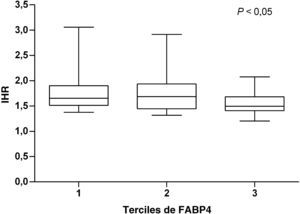
ResultadosFABP4 se asoció negativamente con la función endotelial medida por IHR (r=-0,226; p=0,027) en los pacientes DT2. No se observó ninguna asociación significativa con GIM e ITB en este grupo. Se observó una asociación inversa y significativa de IHR a través de los terciles de FABP4 (p=0,023). En el modelo de regresión lineal, FABP4 fue el único predictor de IHR en DT2 (p<0,05). Se observó una correlación positiva entre FABP4 y el índice de masa corporal (r=0,211; p=0,03) y los anticuerpos de las LDL oxidadas (r=0,251; p=0,01). No se obtuvieron diferencias significativas de GIM y ITB entre los pacientes.
ConclusionesLos niveles aumentados de FABP4 circulante se asocian a una peor función endotelial, medida por IHR en pacientes DT2. Nuestro trabajo sugiere un efecto directo de FABP4 plasmática en el endotelio vascular en pacientes DT2.
Adipocyte fatty acid binding protein (FABP4) plasma levels are higher in type 2 diabetes (T2D), obesity and metabolic syndrome. Endothelial dysfunction is a common feature in the development of vascular diseases associated with metabolic disturbances. We have investigated the relationship between circulating FABP4 levels and endothelial function in patients at cardiovascular risk.
MethodsTwo hundred and fifty-seven patients (mean age, 57.29±10.66 years) at increased cardiovascular risk (CVR). Fasting plasma FABP4 levels were measured. Endothelial function was assessed as reactive hyperemia (IHR) by peripheral artery tonometry (PAT), carotid intima-media thickness and ankel-brachial index. Antropometry and endothelial, inflammation and oxidation biomarkers were measured.
ResultsFABP4 was negatively associated with endothelial function, as measured by the IHR (r=-.226, P=.027) in T2D subjects. There was a significant inverse association of the IHR across FABP4 tertiles (P=.023). In a stepwise multivariable linear regression model, FABP4 was a predictor of IHR in T2D patients (P<.05). FABP4 levels were higher in T2D patients. We also observed a significant positive correlation between FABP4 and BMI (r=.211; P=.03) and Ab ox-LDL (r=.251; P=.01). The correlation between FABP4 and IHR was maintained after adjusting for these confounding variables. There were not significance differences in GIM and ABI among patients.
ConclusionHigh circulating levels of FABP4 are associated with worse endothelial function, as measured by IHR in T2D patients. We suggest a direct effect of plasma FABP4 on the vascular endothelium in T2D patients.
Adipocyte fatty-acid binding protein (FABP), también conocida como FABP4 y aP2, es una de las proteínas intracelulares mejor caracterizadas responsables del transporte lipídico1. Se expresa en el tejido adiposo y los macrófagos2,3. Representa el 5% del total de proteínas intracelulares del adipocito maduro4. Su principal función parece ser como chaperona citoplasmática de ácidos grasos de cadena larga, los cuales son transportados a los compartimentos subcelulares para el metabolismo o la secreción después de la lipólisis1,4,5. FABP4 también puede ser translocada al núcleo para liberar ácidos grasos que regulan la función de factores de transcripción como PPARγ6. Los modelos murinos knock-out por FABP4 son protectores frente la hiperinsulinemia y la resistencia a la insulina inducida por obesidad7. El knock-out de FABP4 -/- reduce la lipólisis, sugiriendo que FABP4 puede tener un papel fisiológico destacado en la regulación de ésta. Otros estudios demuestran que FABP4 activa a la hormona lipasa sensible (HSL) mediante interacciones proteína-proteína8. FABP4 también es sobreexpresada en macrófagos durante el proceso de diferenciación a células espumosas y el doble knock-out de FABP4 -/- y apo E -/- presenta un retroceso en el desarrollo de placas de ateroma7,9.
FABP4 también se encuentra circulante en el plasma, y en los últimos años diversos trabajos se han centrado en estudiar su función en circulación. Sin embargo, ni la vía de secreción ni la función de FABP4 plasmática ha sido conocida. En nuestro grupo y en varios grupos más se ha demostrado que la concentración de FABP4 plasmática se asocia con la distribución de grasa corporal y está incrementada en pacientes con obesidad, síndrome metabólico (SM), diabetes tipo 2 (DT2), hiperlipemia familiar combinada (HFC) o síndromes de lipodistrofia10–14. Otros estudios muestran correlación de FABP4 y resistencia a la insulina, han postulado FABP4 como marcador predictor de la aparición de alteraciones metabólicas4,15,16. Los niveles de FABP4 también han sido asociados a la presencia de enfermedad cardiovascular (CV). No obstante, el papel causal de FABP4 en estos procesos no ha sido establecido. Existen evidencias de que FABP4 circulante es capaz de mediar indirectamente la resistencia a la insulina, la dislipemia aterógena y promover la inflamación, y ha sido asociada al grosor de la íntima-media (GIM) de las carótidas y al volumen de placa de ateroma medido por sonografía intravascular17. Además, un estudio reciente presenta un impacto directo de FABP4 circulante en las células del músculo miocárdico produciendo una disminución de la contractibilidad de los cardiomiocitos18, sugiriendo que FABP4 circulante puede tener un efecto directo sobre las células y los tejidos periféricos. La hipótesis del estudio es que las concentraciones elevadas de FABP4 en plasma observadas en los pacientes con obesidad, SM y DT2 pueden estar implicadas en favorecer el daño vascular que aparece en estas condiciones.
La disfunción endotelial aparece en la primera etapa de la aterosclerosis contribuyendo a la iniciación y la progresión del proceso aterosclerótico19. La disfunción endotelial es un mecanismo común en las enfermedades metabólicas mencionadas previamente. Múltiples factores independientes como la resistencia a la insulina, la dislipemia, la hipertensión, la hiperglicemia, la obesidad visceral, la inflamación, han sido asociados con esta condición en pacientes con DT220, pero la causa exacta de esta alteración no está clara. Aunque existen evidencias significativas de la relación de la disfunción endotelial y el riesgo cardiovascular (RCV), la valoración de la función endotelial no se usa habitualmente en la práctica clínica21, principalmente por las dificultades de estas técnicas. El índice de la hiperemia reactiva (IHR) medido por la tonometría arterial periférica (PAT) es un método no invasivo, reproducible y práctico para la valoración de la función endotelial a nivel clínico. Además, presenta concordancia con la dilatación coronaria medida por el test de la acetilcolina y la arteria braquial (FMD)21,22. Se correlaciona con el Score de Framingham (FRS) de la población general23. La capacidad predictiva del IHR ha sido recientemente demostrada y se han asociado valores disminuídos de IHR con el riesgo de aparición de enfermedad cardiovascular24. Además, en un estudio de nuestro grupo se ha mostrado que el IHR se correlaciona con los parámetros antropométricos, bioquímicos y el perfil lipídico y la mejora del IHR se asocia a una disminución de la progresión del GIM de las carótidas25.
En este trabajo se ha estudiado la relación entre FABP4 plasmática y la función endotelial en pacientes DT2 y no-DT2 con elevado riesgo CV.
Materiales y métodosPacientesSe incluyeron en el estudio 257 pacientes, hombres y mujeres, de edad comprendida entre los 22 y los 80 años, sin evidencia de enfermedad CV, pero con DT2 o RCV global intermedio (5-20% durante los siguientes 10 años según el FRS) y reclutados en la Unidad de Medicina Vascular y Metabolismo del Hospital Universitario Sant Joan de Reus. La diabetes fue definida según los criterios internacionales. Se excluyeron aquellos pacientes con enfermedad CV (coronaria, cerebral o periférica), neoplasias (hepático, renal, de pulmón), enfermedad inflamatoria crónica o dislipemia genética. A todos los participantes se les realizó una exploración física y antropométrica completa y se les valoró el RCV. La valoración de la función vascular se realizó antes de la extracción de sangre. El estudio se llevó a cabo mientras los pacientes se encontraban bajo tratamiento para el control de los fatores de RCV según indicaciones del protocolo del hospital. El estudio fue aprobado por el Comité de Ética y Clínico del hospital y todos los participantes firmaron el consentimiento informado.
Determinaciones bioquímicasLas muestras de sangre se obtuvieron después de un período de ayunas de 12 horas, se centrifugaron immediatamente y fueron congeladas a -80°C hasta ser analizadas. Los parámetros bioquímicos estándars se determinaron mediante los métodos usuales del laboratorio clínico. Los niveles de colesterol, triglicéridos, glucosa, LDL directa, HDL y la proteína C reactiva ultrasensible (PCR) fueron determinados mediante ensayos enzimáticos y immunoturbidimétricos (Spinreact, SA, Spain) adaptados para el autoanalizador Cobas Mira Plus (Roche Diagnostics, Spain).
Determinación de FABP4 plasmáticaLos niveles plasmáticos de FABP4 fueron determinados mediante kits comerciales de ELISA (Bio Vendor Laboratory Medicine Inc., Brno, Czech Republic). Los resultados fueron calculados mediante la reducción de los datos computados por la absorbancia de los estándar es versus la concentración utilizada en una regresión polinómica de cuarto grado. Los resultados fueron expresados en ng/ml. Las características representativas del ensayo fueron<5% para el coeficiente de variación intraensayo y<8% para el coeficiente de variación interensayo.
Determinación de sVCAM-1, sICAM-1, sE-selectina, TNFα y IL-6 mediante Human Cytokine Antibody ArrayLa expresión diferencial de las citocinas inflamatorias y los biomarcadores endoteliales se determinó mediante Human Cytokine Antibody Array (RayBiotech, Norcross, GA; EE.UU.). Consiste en determinar simultaniamente 5 citocinas mediante la técnica ELISA. El complejo de citocinas-anticuerpo-biotina fue visualizado a través de la adición de estreptavidina marcada con colorante fluorescente utilizando un lector de fluorescencia. Los resultados se muestran en ng/ml para la molécula de adhesión intercelular soluble-1 (sICAM-1), la molécula de adhesión vascular soluble-1 (sVCAM-1) y E-selectina soluble (sE-selectin) y en pg/ml para la interleucina-6 (IL-6) y el factor tumoral de necrosis α (TNFα). Los coeficientes de variación interensayo y los coeficientes de variación intraensayo de los biomarcadores fueron de<12% y<10% respectivamente.
Determinación de las LDL oxidadasPara cuantificar las LDL oxidadas en plasma se utilizó la técnica de immunoensayo en fase sólida del kit comercial ELISA Mercodia Oxidized LDL ELISA (Mercodia AB, Uppsala, Sweden). Los resultados se obtubieron como U/L y fueron expresados como la ratio entre ox-LDL/LDL colesterol (U/mmol). Los coeficientes de variación interensayo y los coeficientes de variación intraensayo fueron 4,7% y 6,3% respectivamente.
Determinación de los anticuerpos de las ox-LDLSe utilizó la técnica de immunoensayo del kit comercial IMTEC-ox-LDL-antibodies (IMTEC Immunodiagnostika GmbH, Berlin, Germany) para cuantificar los niveles de anticuerpos de las LDL oxidadas (Ab ox-LDL) en el plasma. Los resultados fueron expresados como U/mL. Los coeficientes de variación interensayo y los coeficientes de variación intraensayo fueron 8,6 y 7,8% respectivamente.
Estudio de la función vascularValoración de la función endotelialLa función endotelial fue determinada mediante el aparato EndoPAT-2000 (Itamar Medical Ltd., Israel). La valoración se realizó a todos los participantes en un ambiente tranquilo, con la temperatura controlada (22°C) depués de un período de 12 horas en ayunas, 24 horas sin fumar y sin practicar ejercicio físico. El método consiste en comparar el cambio del volumen de flujo sanguíneo en los dos dedos, uno de cada mano, antes y después de una isquemia controlada de 5 minutos en el brazo probando. Los resultados se obtuvieron comparando la dilatación (antes y después de la isquemia) del brazo probando y el brazo control. El valor obtenido se refiere como el IHR.
Determinación del grosor de la íntima-media (GIM) carotídeoEl GIM de las arterias carótidas fue evaluado mediante un ecógrafo Acuson Sequoia 512 (Siemens Medical Solutions, Erlangen, Germany), con un transductor lineal de alta resolución multifrecuencia 5-8MHz. Se realizaron un total de 6 mediciones en la carótida derecha y otras 6 en la carótida izquierda: carótida común (CC), bifurcación de la carótida (BC), y carótida interna (CI). En todas las mediciones se utilizó el software Thicksoft. El aumento de GIM fue definido como el GIM>percentil 75 ajustado para la edad y el género según la población ARIC26.
Determinación del índice tobillo-brazo (ITB)Para la valoración del ITB se utilizó un manguito convencional de determinación adecuado de la presión sanguínea y un equipo Doppler continuo bidireccional (Hadeco Mini Doppler Es 100X, 8MHz). Se valoraron las arterias tibiales posteriores y pedias de ambas extremidades inferiores utilizando el valor más alto y se valoraron las arterias braquiales de ambos brazos. Se consideró patológico un valor de ITB<0,9, que indica la existencia de enfermedad arterial periférica.
Análisis estadísticoTodas las variables fueron analizadas con el test de Kolmogorov-Smirnov para estudiar si seguían una distribución normal. Las variables continuas con distribución normal se presentan como la media±SD y las variables con distribución no-normal como la mediana (percentil 25 - percentil 75). Las variables categóricas se presentan como frecuencias (n) o porcentajes (%). Las comparaciones entre grupos fueron analizados mediante ANOVA o el test de U de Mann-Whitney. Las correlaciones se han determinado mediante coeficientes de correlación de Spearman o Pearson. Las diferencias entre los terciles de FABP4 según padecer diabetes se analizaron con el test de la Chi-cuadrado. Los predictores para el modelo de regresión stepwise fueron seleccionados según el análisis de correlación y la asociación conocida de las variables con la variable dependiente (IHR). Todos los análisis se han realizado con el programa SPSS (versión 17.0, SPSS Inc., Chicago, IL). Un p<0,05ha sido considerado estadísticamente significativo.
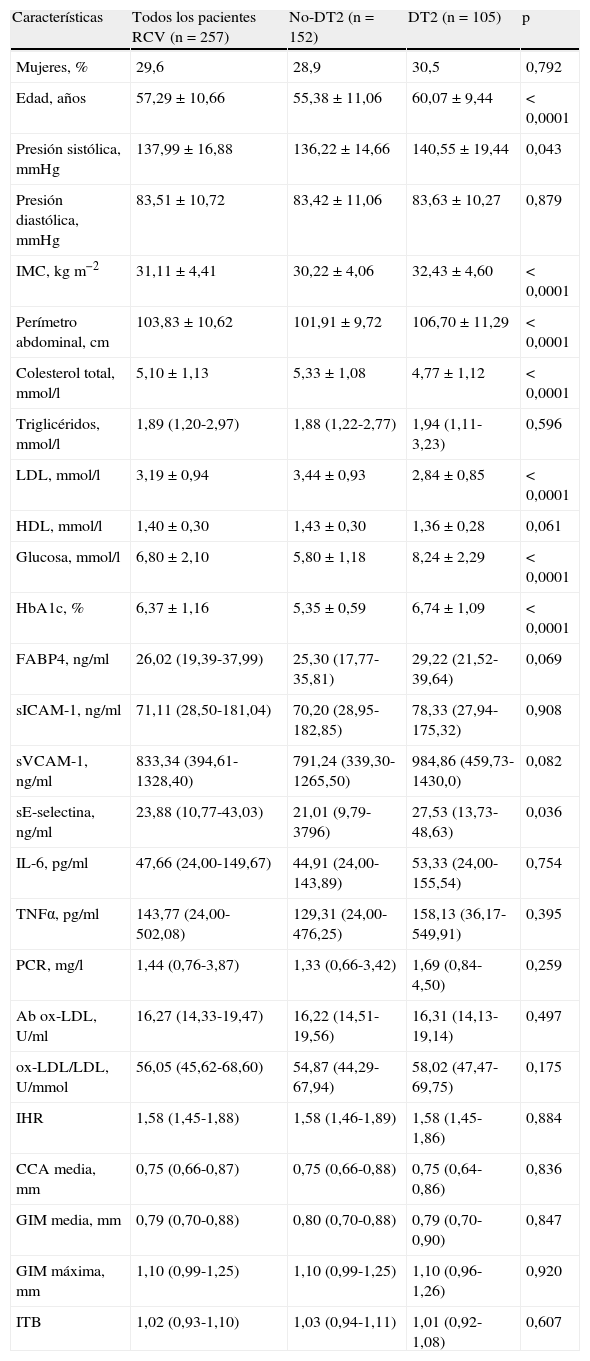
ResultadosLas características clínicas y bioquímicas de los 257 pacientes distribuidos según DT2 han sido resumidos en la tabla 1. La media de edad de los participantes fue de 57,29±10,66, de los cuales el 30% fueron mujeres. Los pacientes DT2 (41%) fueron mayores que los no-DT2 (p<0,05) y presentaron valores significativamente mayores de presión sistólica, índice de masa corporal (IMC), perímetro abdominal, y niveles menores de LDL y colesterol total (p<0,05). Los pacientes DT2 presentaron niveles aumentados de glucosa y hemoglobina glucosilada (HbA1c) (p<0,05).
Parámetros clínicos, metabólicos, bioquímicos y vasculares de los pacientes con RCV según padezcan diabetes
| Características | Todos los pacientes RCV (n=257) | No-DT2 (n=152) | DT2 (n=105) | p |
| Mujeres, % | 29,6 | 28,9 | 30,5 | 0,792 |
| Edad, años | 57,29±10,66 | 55,38±11,06 | 60,07±9,44 | < 0,0001 |
| Presión sistólica, mmHg | 137,99±16,88 | 136,22±14,66 | 140,55±19,44 | 0,043 |
| Presión diastólica, mmHg | 83,51±10,72 | 83,42±11,06 | 83,63±10,27 | 0,879 |
| IMC, kg m−2 | 31,11±4,41 | 30,22±4,06 | 32,43±4,60 | < 0,0001 |
| Perímetro abdominal, cm | 103,83±10,62 | 101,91±9,72 | 106,70±11,29 | < 0,0001 |
| Colesterol total, mmol/l | 5,10±1,13 | 5,33±1,08 | 4,77±1,12 | < 0,0001 |
| Triglicéridos, mmol/l | 1,89 (1,20-2,97) | 1,88 (1,22-2,77) | 1,94 (1,11-3,23) | 0,596 |
| LDL, mmol/l | 3,19±0,94 | 3,44±0,93 | 2,84±0,85 | < 0,0001 |
| HDL, mmol/l | 1,40±0,30 | 1,43±0,30 | 1,36±0,28 | 0,061 |
| Glucosa, mmol/l | 6,80±2,10 | 5,80±1,18 | 8,24±2,29 | < 0,0001 |
| HbA1c, % | 6,37±1,16 | 5,35±0,59 | 6,74±1,09 | < 0,0001 |
| FABP4, ng/ml | 26,02 (19,39-37,99) | 25,30 (17,77-35,81) | 29,22 (21,52-39,64) | 0,069 |
| sICAM-1, ng/ml | 71,11 (28,50-181,04) | 70,20 (28,95-182,85) | 78,33 (27,94-175,32) | 0,908 |
| sVCAM-1, ng/ml | 833,34 (394,61-1328,40) | 791,24 (339,30-1265,50) | 984,86 (459,73-1430,0) | 0,082 |
| sE-selectina, ng/ml | 23,88 (10,77-43,03) | 21,01 (9,79-3796) | 27,53 (13,73-48,63) | 0,036 |
| IL-6, pg/ml | 47,66 (24,00-149,67) | 44,91 (24,00-143,89) | 53,33 (24,00-155,54) | 0,754 |
| TNFα, pg/ml | 143,77 (24,00-502,08) | 129,31 (24,00-476,25) | 158,13 (36,17-549,91) | 0,395 |
| PCR, mg/l | 1,44 (0,76-3,87) | 1,33 (0,66-3,42) | 1,69 (0,84-4,50) | 0,259 |
| Ab ox-LDL, U/ml | 16,27 (14,33-19,47) | 16,22 (14,51-19,56) | 16,31 (14,13-19,14) | 0,497 |
| ox-LDL/LDL, U/mmol | 56,05 (45,62-68,60) | 54,87 (44,29-67,94) | 58,02 (47,47-69,75) | 0,175 |
| IHR | 1,58 (1,45-1,88) | 1,58 (1,46-1,89) | 1,58 (1,45-1,86) | 0,884 |
| CCA media, mm | 0,75 (0,66-0,87) | 0,75 (0,66-0,88) | 0,75 (0,64-0,86) | 0,836 |
| GIM media, mm | 0,79 (0,70-0,88) | 0,80 (0,70-0,88) | 0,79 (0,70-0,90) | 0,847 |
| GIM máxima, mm | 1,10 (0,99-1,25) | 1,10 (0,99-1,25) | 1,10 (0,96-1,26) | 0,920 |
| ITB | 1,02 (0,93-1,10) | 1,03 (0,94-1,11) | 1,01 (0,92-1,08) | 0,607 |
Las variables con distribución normal se presentan como la media±SD o porcentaje de pacientes. Las variables con distribución no-normal se presentan como la mediana (percentil 25 - percentil 75).
Ab oxLDL: anticuerpos de lipoproteínas de baja densidad oxidadas; CC: carótida común; DT2: diabetes tipo 2; FABP4: fatty acid binding protein 4; GIM: grosor de la íntima-media; HDL: lipoproteínas de alta densidad; IHR: índice de hiperemia reactiva; IL-6: interleucina 6; IMC: índice de masa corporal; ITB: índice tobillo-brazo; LDL: lipoproteínas de baja densidad; ox-LDL/LDL: lipoproteínas de baja densidad oxidadas/LDL; p: diferencias entre DT2 y no-DT2 analizadas mediante ANOVA o el test de U de Mann-Whitney; PCR: proteína C reactiva; RCV: riesgo cardiovascular; sE-selectina: E-selectina soluble; sICAM-1: molécula de adhesión intercelular soluble-1; sVCAM-1: molécula de adhesión vascular soluble-1; TNFα: factor tumoral de necrosis α.
Las concentraciones plasmáticas de FABP4 presentaron tendencia a ser mayores en los sujetos DT2 (p=0,069). Al dividir la población de estudio en terciles de FABP4 se observó que el porcentaje más elevado de sujetos DT2 se encontraba en el tercil mayor, en comparación a los pacientes no-DT2 (24,8, 36,2, y 39,0% vs 38,8, 31,6 y 29,6% respectivamente; p=0,05). Además, las concentraciones de FABP4 fueron significativamente mayores en mujeres que en hombres (p<0,001). Los niveles de sE-selectina también resultaron ser significativamente mayores en los pacientes DT2 (p<0,05), y las concentraciones de sVCAM-1 también tendieron a incrementar en este grupo (p=0,082). No se obtuvieron diferencias significativas de IHR, GIM y ITB entre los pacientes DT2 y no-DT2 (Tabla 1).
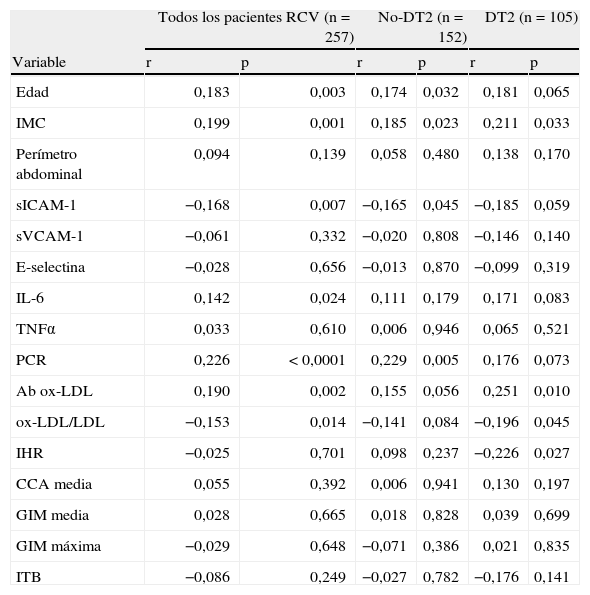
En la tabla 2 se muestra las correlaciones de FABP4 plasmática y los parámetros clínicos, bioquímicos, los biomarcadores endoteliales, inflamación, oxidación y la valoración de la función vascular. Se observó una correlación positiva entre FABP4 y edad, IMC, IL-6, PCR y Ab ox-LDL y una correlación inversa con sICAM-1 y ox-LDL/LDL (p<0,05) en la población total. No se observó ninguna asociación significativa con IHR, GIM e ITB en este grupo.
Correlaciones de FABP4 con los parámetros antropométricos, biomarcadores endoteliales, inflamación, oxidación y vasculares
| Todos los pacientes RCV (n=257) | No-DT2 (n=152) | DT2 (n=105) | ||||
| Variable | r | p | r | p | r | p |
| Edad | 0,183 | 0,003 | 0,174 | 0,032 | 0,181 | 0,065 |
| IMC | 0,199 | 0,001 | 0,185 | 0,023 | 0,211 | 0,033 |
| Perímetro abdominal | 0,094 | 0,139 | 0,058 | 0,480 | 0,138 | 0,170 |
| sICAM-1 | −0,168 | 0,007 | −0,165 | 0,045 | −0,185 | 0,059 |
| sVCAM-1 | −0,061 | 0,332 | −0,020 | 0,808 | −0,146 | 0,140 |
| E-selectina | −0,028 | 0,656 | −0,013 | 0,870 | −0,099 | 0,319 |
| IL-6 | 0,142 | 0,024 | 0,111 | 0,179 | 0,171 | 0,083 |
| TNFα | 0,033 | 0,610 | 0,006 | 0,946 | 0,065 | 0,521 |
| PCR | 0,226 | < 0,0001 | 0,229 | 0,005 | 0,176 | 0,073 |
| Ab ox-LDL | 0,190 | 0,002 | 0,155 | 0,056 | 0,251 | 0,010 |
| ox-LDL/LDL | −0,153 | 0,014 | −0,141 | 0,084 | −0,196 | 0,045 |
| IHR | −0,025 | 0,701 | 0,098 | 0,237 | −0,226 | 0,027 |
| CCA media | 0,055 | 0,392 | 0,006 | 0,941 | 0,130 | 0,197 |
| GIM media | 0,028 | 0,665 | 0,018 | 0,828 | 0,039 | 0,699 |
| GIM máxima | −0,029 | 0,648 | −0,071 | 0,386 | 0,021 | 0,835 |
| ITB | −0,086 | 0,249 | −0,027 | 0,782 | −0,176 | 0,141 |
Las correlaciones se han determinado mediante coeficientes de correlación de Spearman o Pearson.
Ab oxLDL: anticuerpos de lipoproteínas de baja densidad oxidadas; CC: carótida común; DT2: diabetes tipo 2; GIM: grosor de la íntima-media; IHR: índice de hiperemia reactiva; IL-6: interleucina 6; IMC: índice de masa corporal; ITB: índice tobillo-brazo; ox-LDL/LDL: lipoproteínas de baja densidad oxidadas/LDL; PCR: proteína C reactiva; RCV: riesgo cardiovascular; sE-selectina: E-selectina soluble; sICAM-1: molécula de adhesión intercelular soluble-1; sVCAM-1: molécula de adhesión vascular soluble-1; TNFα: factor tumoral de necrosis α.
En los pacientes DT2, los niveles de FABP4 se asociaron significativamente con IMC y los Ab ox-LDL (p<0,05), y al límite de la significación con IL-6 and PCR. En este grupo, FABP4 se asoció inversa y significativamente con el IHR (r=-0,226; p=0,027). Esta correlación se mantuvo significativa después de ajustar por edad, género e IMC (p=0,05). Este efecto no fue observado en los pacientes no-DT2. Al dividir la población en terciles de FABP4, se determinó una asociación negativa entre IHR y los terciles de FABP4 (p=0,023) (fig. 1). Después de ajustar por edad, género e IMC, la asociación se mantuvo significativa.
El modelo de regresión lineal por stepwise, incluyendo la edad, el género, el IMC, el colesterol total, los triglicéridos, la glucosa, la sE-selectina, los Ab ox-LDL y PCR como variable independientes, reveló que FABP4 era la única variable asociada inversamente a los niveles de IHR en los pacientes DT2 (R2=0,034; p=0,043).
DiscusiónEl principal resultado de nuestro trabajo es que niveles altos de FABP4 circulante están asociados con disfunción endotelial en pacientes DT2, indicando un posible impacto directo de FABP4 sobre la lesión arterial y la aterosclerosis subclínica en este grupo de pacientes. El análisis multivariado reveló que FABP4 plasmática fue un factor independiente asociado a la disfunción endotelial. Además, se demostró la asociación directa de FABP4 y diversos biomarcadores de oxidación lipídica e inflamación como IL-6, PCR y los Ab ox-LDL, en los pacientes con RCV moderado. Todos estos resultados presentados sugieren que FABP4 podría estar implicada en el mecanismo fisiopatológico de las alteraciones metabólicas que favorecen la enfermedad CV y podría considerarse como marcador de la disfunción endotelial en DT2.
En los últimos años, aunque el estudio del papel de FABP4 intracelular ha mejorado, la función de FABP4 circulante se mantiene desconocida. Estudios previos han demostrado que los niveles de FABP4 circulante son superiores en mujeres que en hombres11. Además, en concordancia con otros trabajos, las concentraciones plasmáticas de FABP4 correlacionan directamente con la masa de grasa corporal, probablemente porque FABP4 es secretada a la circulación en exceso por la sobreproducción durante la hipertrofia del tejido adiposo27. Un incremento de la síntesis de FABP4ha sido documentada durante la maduración del adipocito y la activación del macrófago y transformación a células espumosas28. Durante el desarrollo de la obesidad, la hipertorfia del adipocito y la infiltración del macrófago son observadas; sin embargo, la contribución del tejido adiposo y de las células inflamatorias originales al aumento de FABP4 circulante es desconocida. La asociación del incremento de FABP4 intracelular y los niveles de FABP4 plasmática también es desconocida. Algunas alteraciones metabólicas con efectos periféricos pueden ser asociadas al aumento de los niveles de FABP4. El incremento de FABP4 intracelular en los adipocitos aumenta la lipólisis mediante la activación de HLS, induciendo la secreción de los ácidos gasos no esterificados (NEFA) a la circulación sanguínea8. Nuestro grupo, previamente, ha demostrado que los niveles altos de FABP4 en DT2 están relacionados con la dislipemia aterógena producida por el hiperflujo de NEFA al hígado favoreciendo la secreción de VLDL13. FABP4 también puede interferir en el metabolismo de la insulina interaccionando directamente con el receptor de insulina de diferentes tipos celulares29. En estudios previos, se ha postulado FABP4 como biomarcador plasmático del SM y la DT230. Por esto, el aumento de las concentraciones de FABP4 plasmática puede ser considerado un riesgo para los tejidos periféricos. Recientemente se ha demostrado que los niveles altos de FABP4 pueden producir un daño directo a los cardiomiocitos, contribuyendo a la disfunción contráctil de estas células18. Nuestros resultados respaldan la hipótesis de que FABP4 circulante no es solo un marcador bioquímico, sino también un efecto de las complicaciones observadas en la lesión vascular en DT2. Otros grupos han presentado que FABP4 circulante se asocia con la presencia de enfermedad CV y la aterosclerosis subclínica valorada mediante el GIM, no observada en nuestro estudio, y también con el volumen de placa de ateroma medido mediante IVUS17,31,32. La asociación de FABP4 y la disfunción endotelial es otra etapa en la relación de FABP4 y la lesión arterial. Aunque nuestros resultados no pueden establecer una relación causal, podemos especular que FABP4 puede inducir directamente disfunción endotelial. FABP4 se correlaciona claramente con el IMC en los pacientes DT2 y no-DT2. Se puede interpretar que FABP4 es un biomarcador de los factores de daño endotelial asociados a la obesidad. Aún así, los niveles altos de FABP4 están asociados a IHR después de ajustar por las variables de confusión.
Además, estudios recientes han demostrado que FABP4 se asocia con múltiples marcadores de inflamación como la IL-6 y PCR31. Nuestros resultados son comparables a resultados previos, cuando se considera el grupo total, sin embargo la asociación no se mantiene en el grupo de DT2.
FABP4 se asoció a los niveles de Ab ox-LDL en los pacientes DT2. La oxidación lipídica es considerada como un inductor de la disfunción endotelial; por esto, no podemos excluir una interacción entre las dos variables y la alteración del IHR. Por otra parte, gracias a la estructura terciaria, FABP4 puede unir un amplio espectro de moléculas hidrofóbicas, desde aldehídos derivados de la oxidación de ácidos grasos como el hidroxinonenal. Esta característica ha sido argumentada para respaldar el posible efecto antioxidante de FABP4 a nivel celular. Si esta capacidad está presente en los niveles plasmáticos, es desconocida. Aún así, los Ab ox-LDL no se han relacionado con el IHR ni en la correlación univariada ni en el análisis de regresión. Además, la asociación entre FABP4 y IHR se mantiene después de ajustar por Ab ox-LDL.
Finalmente, FABP4 aparece como el único biomarcador asociado con el IHR en los pacientes DT2 en el análisis de regresión por stepwise. La razón por la cual la correlación de FABP4 e IHR no se ha observado en los paciente no-DT2, no está muy clara. Una hipótesis es que los factores adicionales de daño endotelial presentes en DT2, son necesarios para expresar la lesión endotelial; o bien, que los niveles altos de estos factores en los pacientes no-DT2 son necesarios.
Este trabajo presenta diversas limitaciones. Se trata de un estudio transversal, en el cual se pueden detectar correlaciones, pero no se pueden formular predicciones. Para evaluar la relevancia clínica de los niveles plasmáticos de FABP4 son necesarios estudios prospectivos. Por otra parte, el impacto del tratamiento hipolipemiante e hipoglicémico sobre la asociación de FABP4 y IHR no está claro. No obstante, el efecto probablemente sería en contra de su asociación y por la tanto, refuerza nuestros resultados.
En resumen, en este trabajo se demuestra por primera vez que los niveles de FABP4 circulante se asocian con la disfunción endotelial, valorada por IHR en DT2. Si se pudiera establecer una relación causal, las concentraciones de FABP4 circulante podrían ser buena diana terapéutica para prevenir la lesión vascular en pacientes DT2.
FinanciaciónEste trabajo ha sido subvencionado por las becas de ISCIII, Madrid, España (PI 051954, PI 081409, FEDER), CIBER de Diabetes y Enfermedades Metabólicas Asociadas (ISCIII, Ministerio de Ciencia e Innovación).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Una comunicación referente a esta línea de trabajo, titulada «Fatty Acid Binding Protein 4 se asocia con disfunción endotelial en pacientes diabéticos tipo 2» fue presentada en el XXIII Congreso Nacional de la SEA-Córdoba 2010 y galardonada con una mención especial.