La célula mononuclear-fagocítica es un elemento celular clave en el proceso aterogénico. El monocito forma parte trascendental del proceso inflamatorio característico del inicio y desarrollo de la placa de ateroma. Por otra parte, la infiltración celular es también un elemento que debe tenerse en cuenta en el proceso inflamatorio cuando se ha considerado la asociación entre arteriosclerosis e infección. En la teoría infecciosa los gérmenes más frecuentemente asociados a la patología vascular han sido Citomegalovirus, Helicobacter y Chlamydia. En el presente trabajo nos ha interesado evaluar las características del comportamiento celular en cultivos de células implicadas en el proceso aterogénico infectadas con Chlamydia.
Material y métodosSe han empleado células endoteliales humanas establecidas (células Hep-2), células mononucleares establecidas (células THP-1) y cultivos primarios de monocitos procedentes de sangre periférica de voluntarios.
ResultadosTodos los cultivos celulares son fácilmente infectados por Chlamydia. No obstante, sus efectos son distintos dependiendo del tipo celular. Cuando se ha comparado el efecto de sueros normo e hiperlipidémicos en los cultivos de células mononucleares infectadas con Chlamydia, se ha podido comprobar que el efecto que provoca la infección es amortiguado por la existencia de valores elevados de lípidos plasmáticos.
The mononuclear-fagocitic cellular type is a key element during the atherogenic process. The monocyte takes a transcendental role in the inflammatory process that is relevant at the onset and subsequent development of atheroma plaque. Otherwise, the cellular infiltration is a key feature to consider during the inflammatory process that we can found related with the atherosclerosis/infection association. According with the infectious explanation of atherosclerosis, microorganism more frequent associated with vascular pathology has been: Citomegalovirus, Helicobacter and Chlamydia. In the present paper we are interested to evaluate the characteristics and cellular behaviour of cultures of cells related with atherogenic process that has been previously infected with Chlamydia.
Material and methodsWe have analized established human endothelial cells (Hep-2 cells), established mononuclear cells (THP-1 cells) and primary cultures of monocytes from blood health volunteers.
ResultsAll of cells types has been easily infected by Chlamydia. Nevertheless, the effects are different according with the different cells types. When we have compared the effect of normo or hyperlipidemic serum specimens over the cultures of infected mononuclear cells it is possible to show that the effect of infection is amortiguated by the presence of high serum levels of lipids.
La aterosclerosis es un proceso multifactorial caracterizado por la formación de las placas de ateroma. En la patogenia de la aterosclerosis se distinguen dos elementos básicos: la lesión endotelial y el proceso inflamatorio crónico de la pared arterial. En consecuencia, el sistema monocito-macrófago juega un papel fundamental en la fisiopatología de la aterosclerosis, debido a su papel central en el proceso inflamatorio en la aterogénesis, y asimismo es un elemento clave en el reclutamiento celular que tiene lugar en las lesiones ateroscleróticas y en el depósito lipídico en ellas1,2. De hecho, uno de los fenómenos más precoces del proceso aterogénico es la adherencia de los monocitos al endotelio, proceso que está regulado por la expresión de moléculas de adhesión específicas en la superficie de las células endoteliales.
El monocito es, por tanto, un elemento fundamental en los procesos inflamatorios: actúa como célula procesadora de antígenos, promueve respuestas inmunológicas de tipo humoral o celular y expresa antígenos del complejo mayor de histocompatibilidad de la clase II, I, receptores para Fc y C3. Asimismo, los monocitos presentan una importante actividad fagocítica o citocida, por lo que van a participar en la respuesta ante la infección provocada por múltiples patógenos2. Por tanto, los macrófagos son un trascendental mediador inflamatorio celular en la aterogénesis, elemento clave junto con las células musculares lisas en el reclutamiento celular de las lesiones ateroscleróticas y en el depósito lipídico en dichas lesiones3.
También es conocida la relación entre la aterosclerosis y la infección. En lo que se refiere a la asociación entre agentes infecciosos e inflamación vascular es preciso considerar varios hechos: a) los agentes infecciosos pueden ejercer efectos directos e indirectos sobre la pared arterial y favorecer el tropismo hacia el subendotelio de las células del sistema inmunológico; b) tras la infección se puede comprobar la activación y diferenciación de monocitos, la adherencia al endotelio y la migración al espacio subendotelial; c) se ha observado la transformación subsiguiente de los monocitos activados por las lipoproteínas oxidadas en macrófagos y en células espumosas, creando una situación permanente de inflamación, y, finalmente, d) se produce un aumento de los monocitos en la placa de ateroma relacionada con alteraciones inmunológicas locales y progresión de la placa.
En el proceso aterogénico cada vez se concede más atención a los fenómenos inflamatorios crónicos4, y se ha argumentado sobre la importancia que puedan tener los agentes infecciosos en la patogenia de la aterosclerosis5,6. Los agentes infecciosos podrían producir efectos directos sobre la pared arterial, incluyendo lesión, disfunción endotelial7,8, proliferación de las células musculares lisas e inflamación local9, así como efectos indirectos a través de modificaciones en la expresión celular de citocinas y de mediadores de la inflamación crónica, inducción de anticuerpos o cambios en factores de riesgo cardiovascular (fibrinógeno, homocisteína)9-11. La presencia de lipopolisacáridos bacterianos promueve la producción de oncostatina M, y la infección con Chlamydia pneumoniae, de TNF-α, IL-1-B, IL-6 e IFN por parte de los monocitos12.
Las infecciones bacterianas podrían permitir cambios moleculares que tendrían efectos en el inicio y el mantenimiento del proceso aterosclerótico13. Son de interés los cambios observados en el metabolismo lipídico durante la sepsis por gramnegativos. Tanto los valores de triglicéridos séricos como las lipoproteínas de muy baja densidad (VLDL) aumentan durante la fase aguda de la sepsis por gramnegativos en el hombre, descendiendo los valores de colesterol unido a lipoproteínas de baja y alta densidad (LDL y HDL, respectivamente)14.
Así, con independencia de los factores de riesgo identificados, ciertos factores adicionales como agentes infecciosos pueden contribuir a la iniciación, la promoción y la rotura de la placa aterosclerótica, al desarrollo de fenómenos aterotrombóticos y a estimular un estado inflamatorio crónico15,16. Son varios los agentes infecciosos que se han relacionado con la aterosclerosis, aunque los más frecuentemente asociados han sido Ch. pneumoniae17, Citomegalovirus18 y Helicobacter pylori19.
Sobre las bases anteriores y en atención a que los monocitos humanos cultivados in vitro, infectados y sin infectar con Ch. pneumoniae, en presencia de diferentes ambientes lipídicos pueden presentar distintos patrones de comportamiento, nos hemos planteado los siguientes objetivos en el presente estudio: a) estudiar las características in vitro del crecimiento celular de monocitos procedentes de sangre periférica de sujetos sanos y de una línea monocitomacrofágica humana establecida de referencia (THP-1); b) valorar, en las situaciones anteriores, las modificaciones del comportamiento de las mismas células cuando están infectadas por Ch. pneumoniae, y c) analizar las modificaciones que promueven en dichas células los suplementos con suero de sujetos normo e hiperlipidémicos, estudiadas in vitro.
Material y métodosSe han empleado muestras sanguíneas procedentes de sujetos voluntarios sanos normolipidémicos y de pacientes hiperlipidémicos procedentes de la consulta de riesgo vascular y lípidos del Hospital General Universitario Gregorio Marañón de Madrid (España). Se han empleado 10 muestras en cada grupo: 5 hombres y 5 mujeres con una edad media de 44 (controles) y 48 años (hiperlipidémicos).
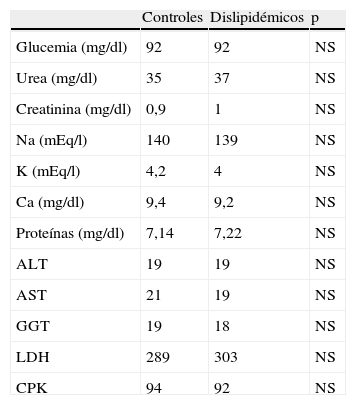
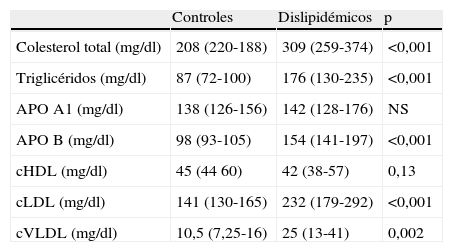
En todos los casos se recogieron los datos de acuerdo con un protocolo de recogida que incluye: datos clínicos, enfermedades asociadas, factores de riesgo cardiovascular y datos analíticos de las muestras seleccionadas (hemograma, bioquímica, perfil lipídico). Los datos bioquímicos poblacionales se pueden comprobar en las tablas 1 y 2.
Parámetros bioquímicos en los sueros de pacientes normo y dislipidémicos
| Controles | Dislipidémicos | p | |
| Glucemia (mg/dl) | 92 | 92 | NS |
| Urea (mg/dl) | 35 | 37 | NS |
| Creatinina (mg/dl) | 0,9 | 1 | NS |
| Na (mEq/l) | 140 | 139 | NS |
| K (mEq/l) | 4,2 | 4 | NS |
| Ca (mg/dl) | 9,4 | 9,2 | NS |
| Proteínas (mg/dl) | 7,14 | 7,22 | NS |
| ALT | 19 | 19 | NS |
| AST | 21 | 19 | NS |
| GGT | 19 | 18 | NS |
| LDH | 289 | 303 | NS |
| CPK | 94 | 92 | NS |
NS: no significativo; ALT: alanina-aminotransferasa; AST: aspartato-transaminasa; GGT: gammaglutamil transpeptidasa; LDH: lactatodeshidrogenasa; CPK: creatinfosfocinasa.
Parámetros lipídicos en los sueros utilizados in vitro de pacientes normo y dislipidémicos
| Controles | Dislipidémicos | p | |
| Colesterol total (mg/dl) | 208 (220-188) | 309 (259-374) | <0,001 |
| Triglicéridos (mg/dl) | 87 (72-100) | 176 (130-235) | <0,001 |
| APO A1 (mg/dl) | 138 (126-156) | 142 (128-176) | NS |
| APO B (mg/dl) | 98 (93-105) | 154 (141-197) | <0,001 |
| cHDL (mg/dl) | 45 (44 60) | 42 (38-57) | 0,13 |
| cLDL (mg/dl) | 141 (130-165) | 232 (179-292) | <0,001 |
| cVLDL (mg/dl) | 10,5 (7,25-16) | 25 (13-41) | 0,002 |
NS: no significativo; APO A1: apolipoproteína A1; APO B: apolipoproteína B; cHDL: colesterol ligado a lipoproteínas de alta densidad; cLDL: colesterol ligado a lipoproteínas de baja densidad; cVLDL: colesterol ligado a lipoproteínas de muy baja densidad.
Soluciones y medios de cultivo: se han seguido los empleados en nuestro laboratorio según los procedimientos habituales, que son los siguientes.
Procedimientos básicos en técnicas de cultivos: a) técnica de subcultivos; b) técnicas de recuento celular: recuento de células viables utilizando colorantes de exclusión, recuento de células totales con cristal violeta; c) curvas de crecimiento: recuentos directos en contraste de fases sobre el mismo frasco de cultivo en campos previamente localizados, y recuentos por cinefotovideomicrografía; d) técnicas de congelación-descongelación, y e) determinación de la eficiencia de plancheo.
CélulasSe han utilizado líneas celulares establecidas procedentes de la American Type Culture Collection (ATCC) obtenidas mediante la European Collection of Cell Cultures (ECACC) y líneas establecidas en nuestro laboratorio. Inicialmente hemos utilizado:
• Células epiteliales humanas HEp-2 establecidas por Moore, Sabachewsky y Toolan en 1952 a partir de células de un tumor de laringe humano. Se mantienen en medio R5aI suplementado con suero de ternera y suero bovino fetal al 1%. Se subcultivan cada 7 días. Estas células se utilizan para el mantenimiento y la activación de Chlamydia.
• Células monocitomacrofágicas humanas THP-1 establecidas por Tsuchiya et al. en 198020. Derivan de monocitos transformados de una leucemia monocítica aguda. Se mantienen en medio R5aI completo, suplementado con glutamina 200mM y 2-mercaptoetanol 0,05mM. Las células se subcultivan cada 7 días.
• Cultivos primarios de monocitos humanos de sangre periférica. Las muestras se recogen en tubos estériles con EDTA-Na (1,5mg/ml de sangre) y siliconados para evitar la coagulación e impedir la adhesión de los monocitos a las paredes del recipiente. Se centrifugan a 125 × G a temperatura ambiente durante 15 min para separar y recoger los plasmas. El sedimento que contiene las células hemáticas se ajusta al volumen inicial con solución salina equilibrada sin iones Ca++ ni Mg++. Las células se purifican por centrifugación sobre lecho de polisucrosa y diatrizoato sódico ajustado a una densidad de 1,077, utilizando el sistema Accuspin. La centrifugación se realiza a temperatura ambiente a 800 × G durante 15 min en centrífuga IEC modelo HN. Se seleccionan por aspiración la banda de células linfomononucleares21,22.
Cepa bacteriana de Chlamydia pneumoniaeElegimos la cepa aislada por Black23 y homologada por Wong en la ATCC con la designación de VR 1360, que fue aislada a partir del esputo de un hombre de 58 años con neumonía. Mantenemos el germen en células humanas HEp-2 en las condiciones recomendadas por Wong.
• Inoculación deChlamydia pneumoniae1360 en células HEp-2 cultivadas en tubos de Shell. Ch. pneumoniae recién activada se puede utilizar para inocular nuevos tubos de Shell o frascos de mayor superficie, en cuyo caso se añaden en esta suspensión células HEp-2 no inoculadas y recién desprendidas a razón de 104 células Hep-2 por mililitro de inóculo. Se centrifugan 1h a temperatura ambiente a 125 × G. Se añade medio fresco de inoculación para ajustar al volumen final necesario, se resuspenden suavemente y se siembran los nuevos recipientes.
• Preparación y titulación de la provisión de inóculo deChlamydia pneumoniaedestinado a los experimentos. Para las inoculaciones destinadas a todos los experimentos preparamos previamente una provisión grande de Ch. pneumoniae mantenida en células HEp-2. Para ello se hicieron tres pases de activación sembrando células HEp-2 recién inoculadas con Ch. pneumoniae en recipientes de 75cm2, utilizamos 2 × 105 células/cm2 inoculadas con el homogenato del pase anterior (el primer pase se realizó con la muestra original recibida de la cepa VR-1360 de la ATCC, dejando un tiempo de adsorción de 1h, centrifugando a continuación la suspensión que contiene las células con la Ch. pneumoniae a 800 × G, suspendiendo, sembrando y manteniendo los cultivos de células inoculadas durante 3 a 5 días con medio R5a de McCoy suplementado con cicloheximida 1μg/ml, glucosa al 2%, anfotericina-B 0,25μg/ml y suero bovino fetal al 5%. En el tercer pase de activación se recogen las células, se homogenizan en su propio medio de cultivo, se distribuyen en viales de congelación y se conservan a –90° C.
Técnicas de videointervalometría y microscopia digital de intervalosUtilizamos estos procedimientos para el estudio de las características morfodinámicas de las células control e inoculadas con Ch. pneumoniae24,25. Utilizamos un microscopio invertido Nikon modelo M y un microscopio Nikon modelo Diaphot. La posibilidad de utilizar iluminación diascópica o episcópica nos permite localizar con precisión la zona de estudio. Ambos equipos llevan incorporada una cámara de incubación que permite mantener la temperatura con una precisión ±0,1°C. La temperatura se mantiene con un dispositivo de inyección de aire caliente en la cámara, regulada por un dispositivo de control que responde a las modificaciones de temperatura detectadas por un termopar que colocamos en la zona próxima al recipiente de observación.
Utilizamos óptica de contraste de fases con condensador de larga distancia focal. Esta óptica permite la visualización en las células vivas de un mayor número de estructuras.
La larga distancia focal permite, ajustando las condiciones óptimas de iluminación y contraste, realizar las observaciones en frascos de hasta 17mm de altura. Con esta distancia focal se pueden utilizar recipientes como los Earle T-15 o los Falcon, sin necesidad de emplear microcámaras especiales.
Ambos microscopios están diseñados para poder utilizar dos salidas de recogida de imagen; a una de ellas van adaptados el portaoculares y el tubo para la cámara de fotografía, y la otra es una salida horizontal especialmente diseñada para la adaptación de una cámara de cine o vídeo.
• Condiciones de filmación. Procuramos establecer las mismas condiciones de los experimentos que paralelamente se realizaron en los microcultivos de cámaras múltiples, con objeto de poder extrapolar los datos obtenidos. La cadencia de registro de imagen se programa en función de la duración del fenómeno que se ha de estudiar, utilizando aceleraciones comprendidas entre 4 imágenes por segundo y una imagen cada 8min, lo que nos permite, con la máxima aceleración, visionar en 1min los fenómenos que se producen en 3 días. El análisis de las distintas secuencias requiere la utilización de diversos protocolos que permiten correlacionar los datos del registro con el momento real en que se producen los fenómenos estudiados.
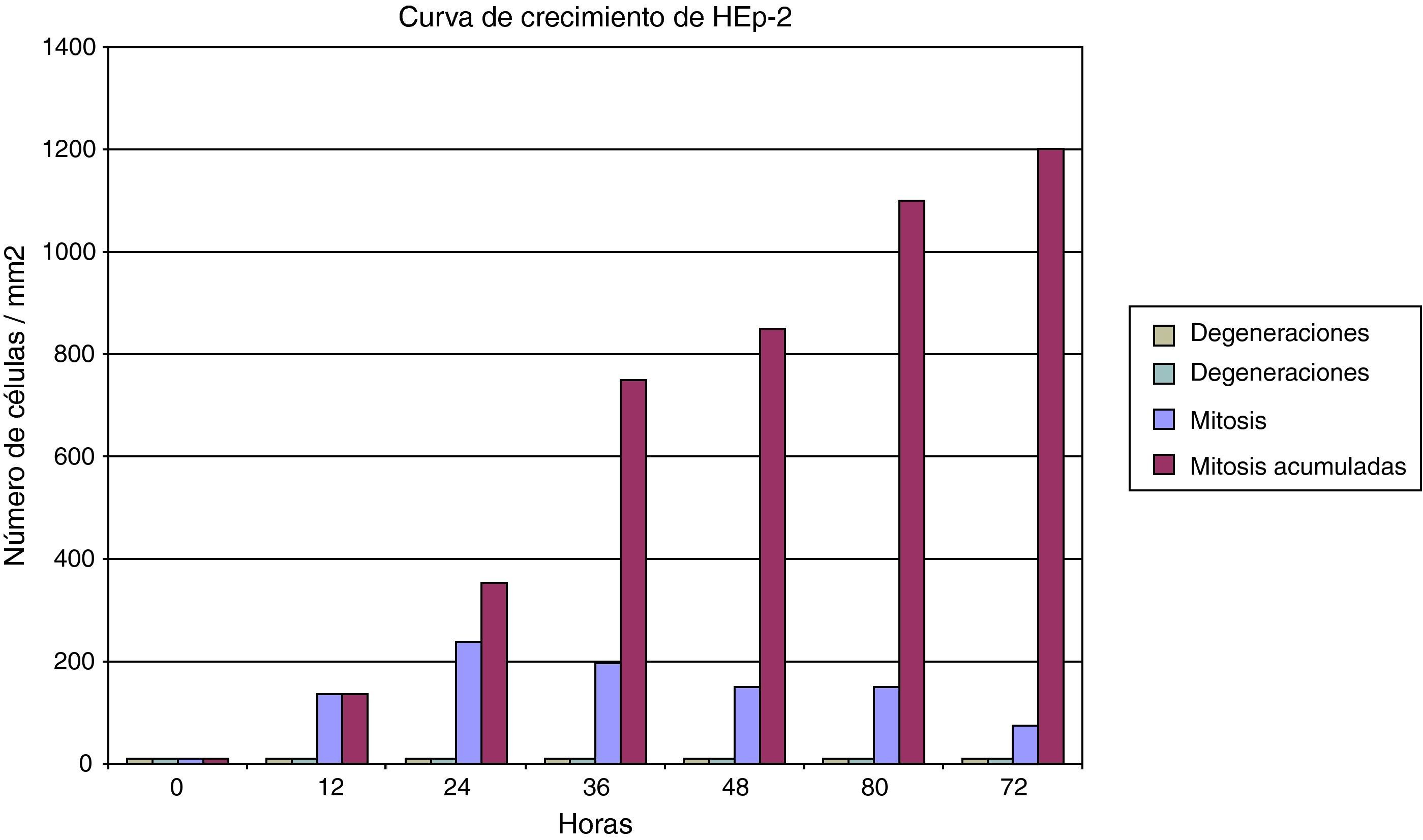
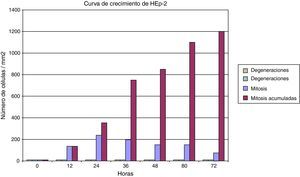
ResultadosLos cultivos de células HEp2 (células epiteliales humanas) se pudieron caracterizar correctamente. Han crecido en monocapa, con aspecto epitelioide, y con una elevada capacidad proliferativa gracias a su marcada actividad mitótica. En consecuencia, su tasa de viabilidad es alta y su tasa de muerte es baja. Algunos datos del comportamiento del cultivo celular se puede observar en la figura 1, en la que se muestran distintos parámetros de la cinética de las células HEp2. Dada la escasísima tasa de mortalidad y la (casi constante) tasa mitótica, el cultivo culmina con un crecimiento lineal.
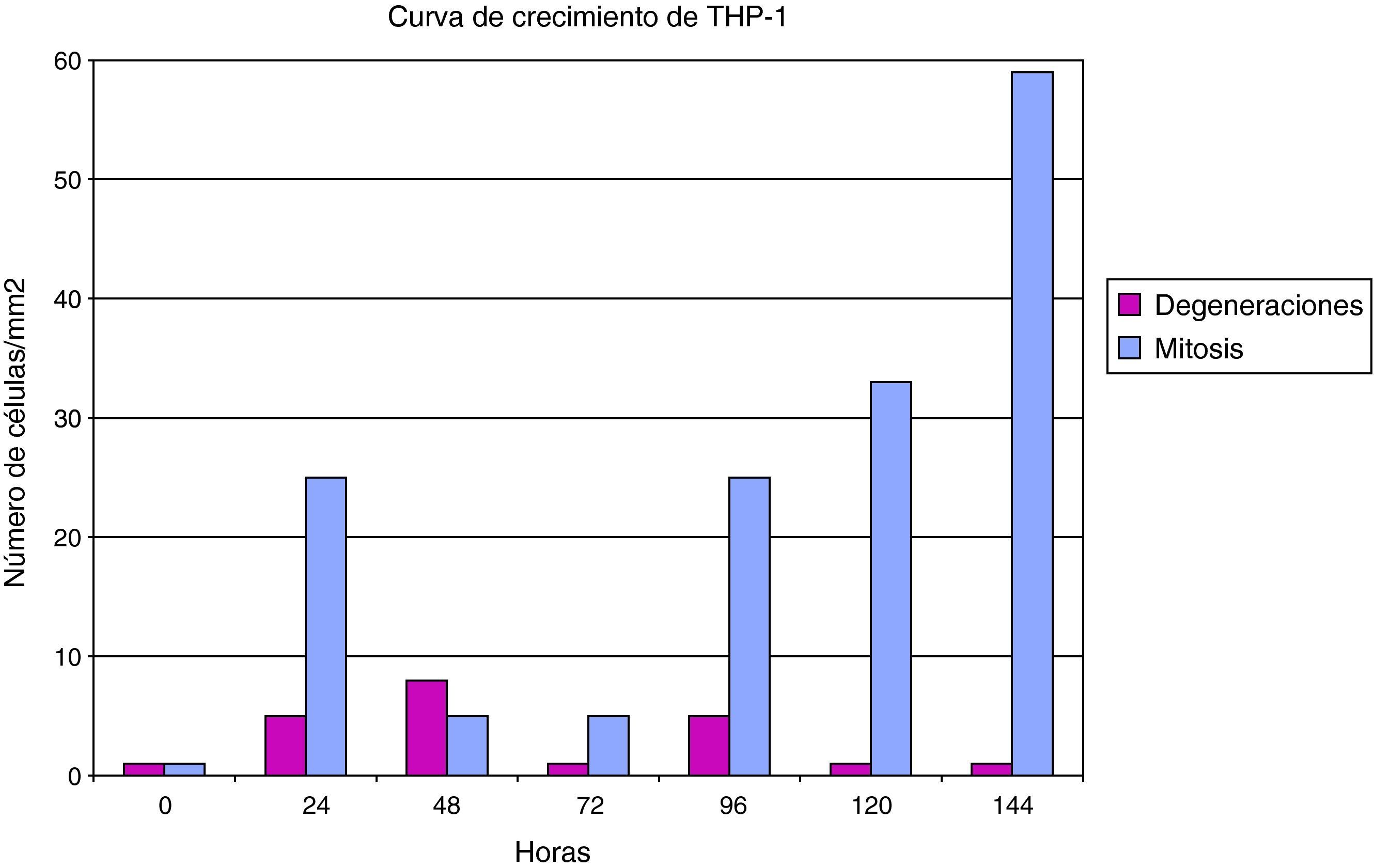
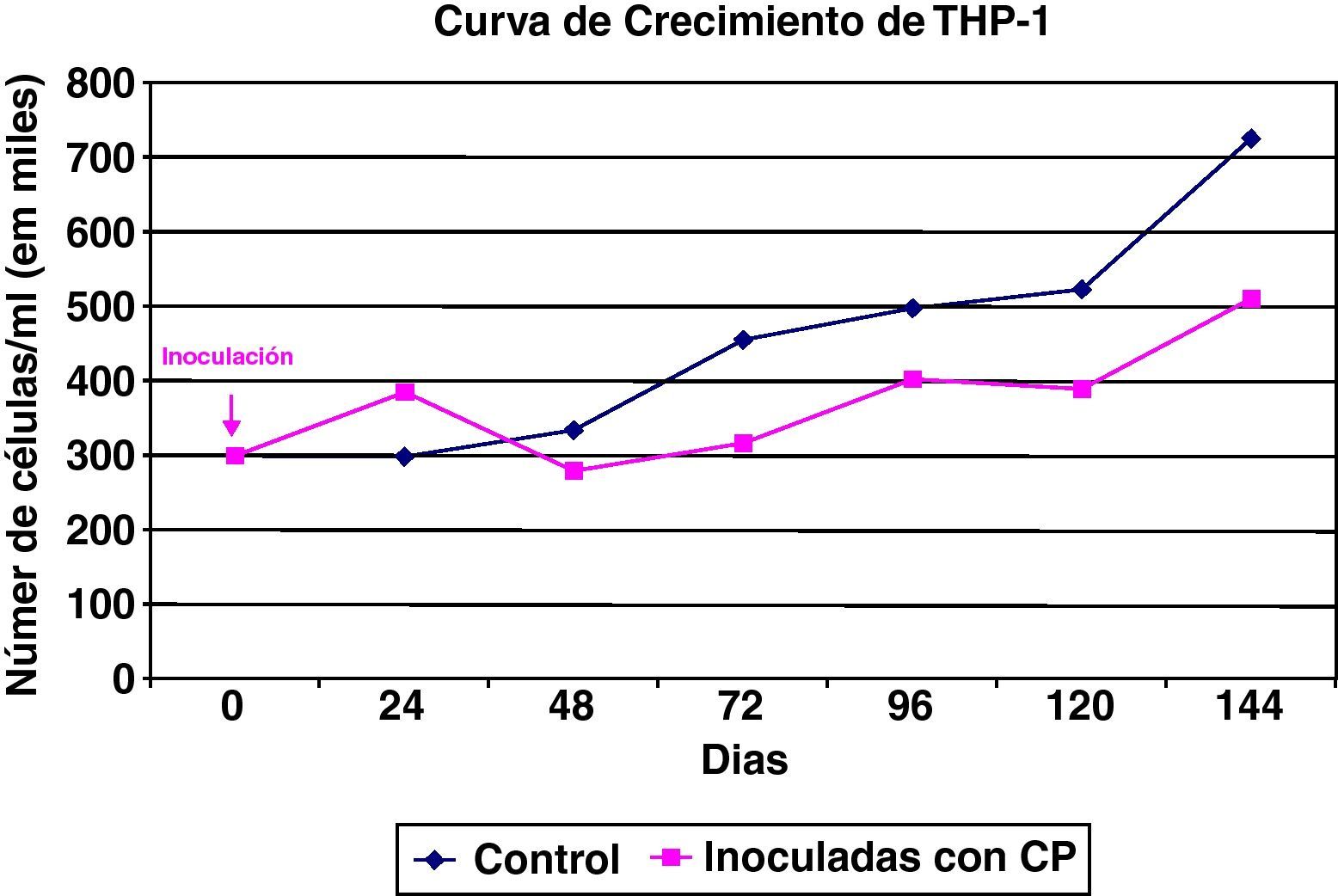
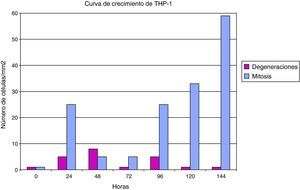
Las células THP1 (mononucleares de línea preestablecida) también mostraron una buena capacidad proliferativa y una elevada actividad mitótica, si bien su tasa de muerte es superior a las células HEp2. El cultivo de células THP-1 tiene una cinética celular que se encuentra más influenciada por esa mayor mortalidad celular (fig. 2).
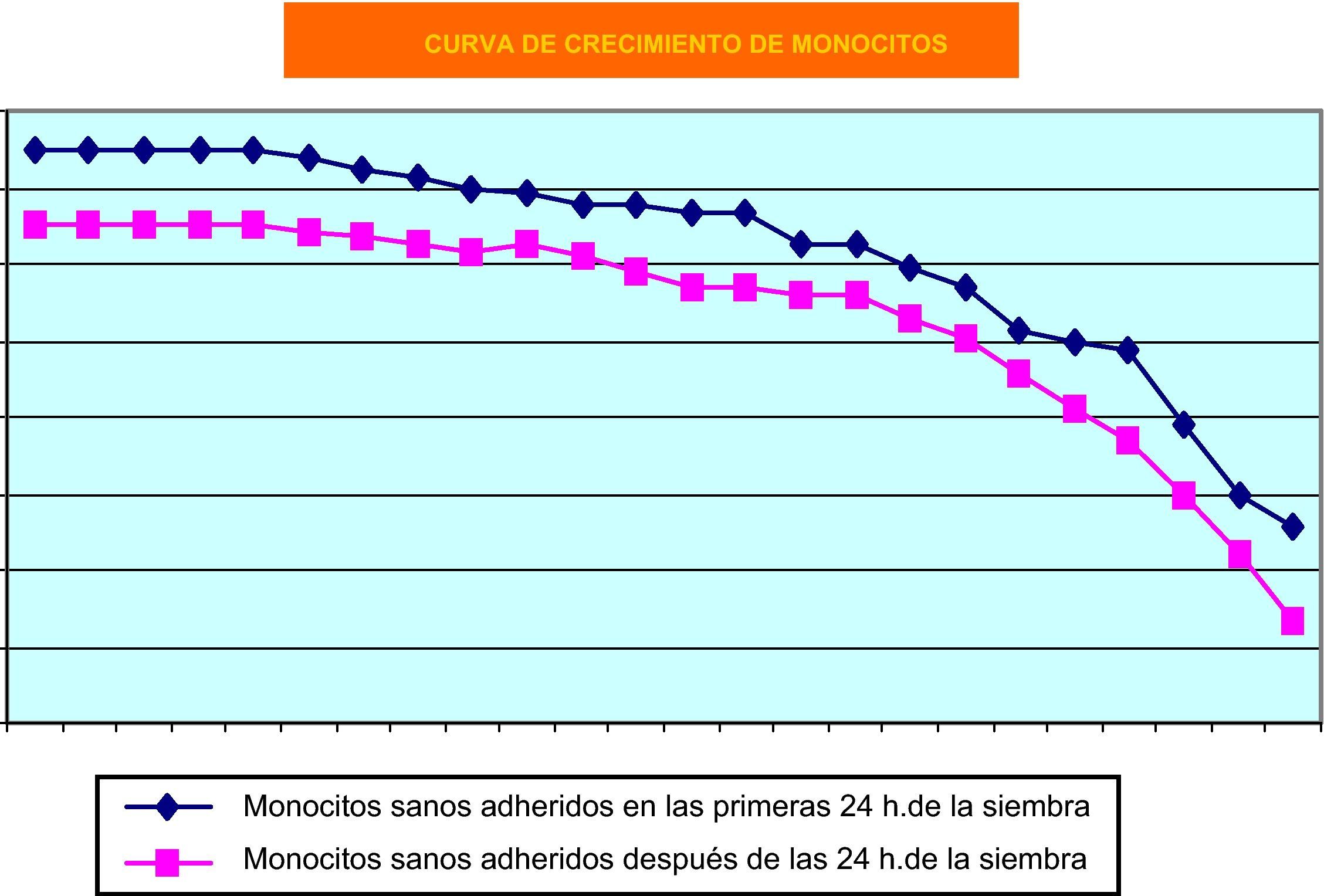
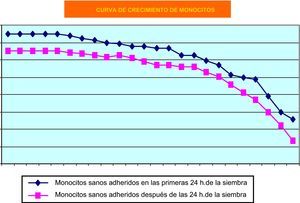
Como cabía esperar, los monocitos humanos de sangre periférica en cultivos primarios fueron los que más dificultades plantearon, debido a que, con el paso del tiempo, su tasa de muerte es muy elevada. Su cinética de crecimiento se puede observar en la figura 3. Nos resultó difícil mantener el cultivo primario de células mononucleares obtenidas de sangre periférica humana, aun a expensas de utilizar factores de crecimiento.
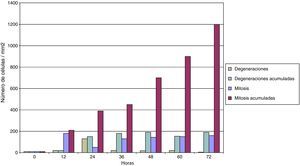
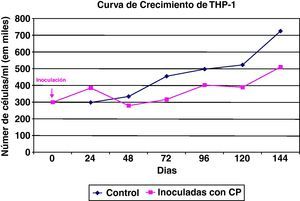
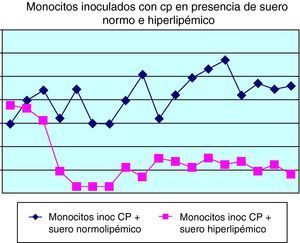
Con respecto al comportamiento celular, una vez que los distintos cultivos celulares fueron inoculados in vitro con la cepa estandarizada de Chlamydia, se observaron sus resultados; algunos de los principales se muestran en las figuras 4-6.
Las células epiteliales humanas (HEp2) resultaron muy sensibles a la infección por Chlamydia. El cultivo de células infectadas se puede mantener correctamente de tal manera que puede ser una opción para el mantenimiento de una línea celular infectada porque, aun a pesar de las degeneraciones que se van acumulando como consecuencia de la infección celular, el porcentaje de viabilidad celular es muy elevado (fig. 4). Con respecto a la degeneración celular inducida por la inoculación, en las primeras 24h se produce una onda de muerte celular, para posteriormente mantener una tasa menor pero constante de degeneración celular.
También las células mononucleares THP-1 fueron susceptibles a la infección por Chlamydia (fig. 5), y su curva de crecimiento es paralela a una control, aunque con un perfil inferior debido a la tasa de degeneración celular inducida por la infección del cultivo. El efecto de la degeneración celular se observa principalmente a partir de las 48h de la inoculación del germen al cultivo celular.
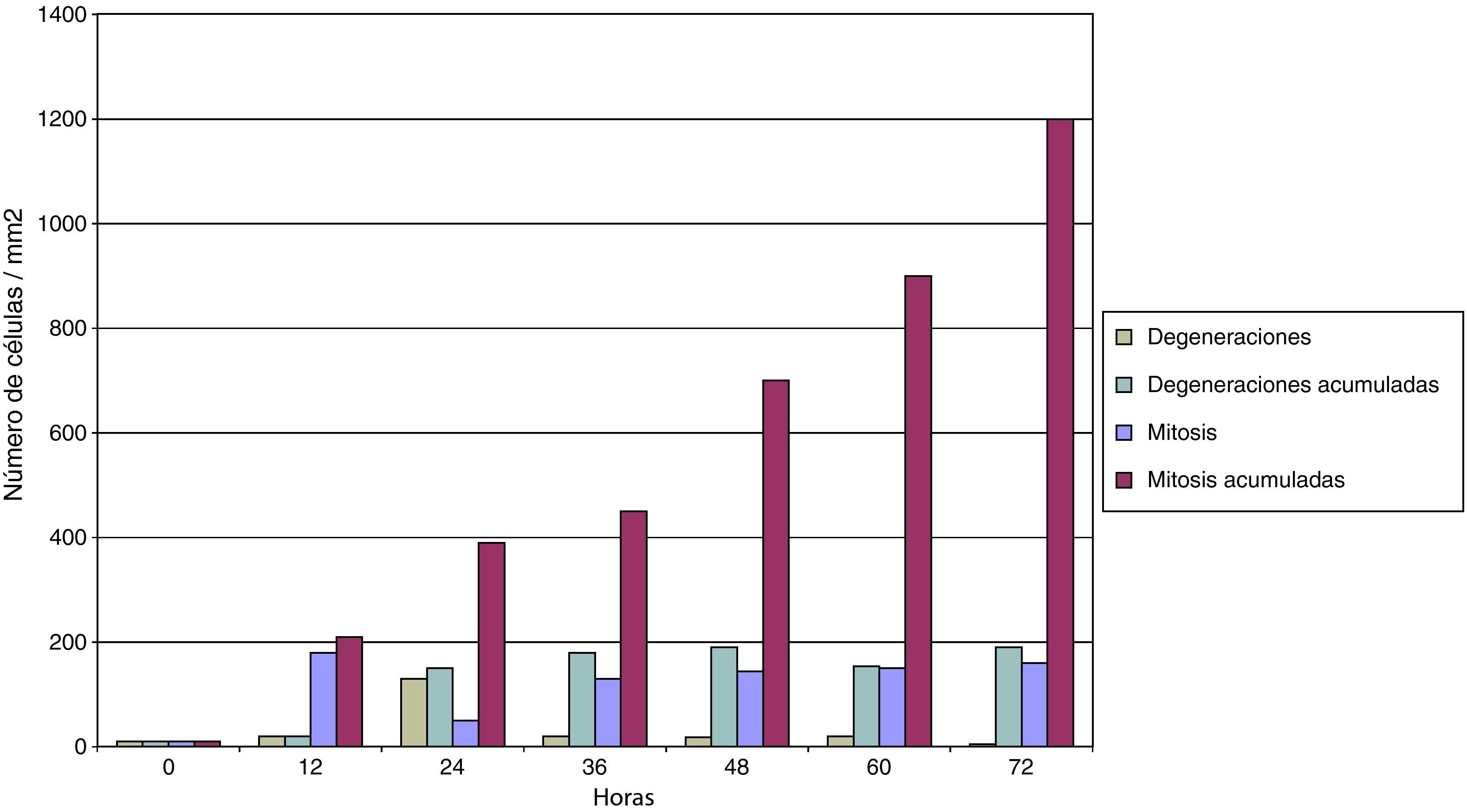
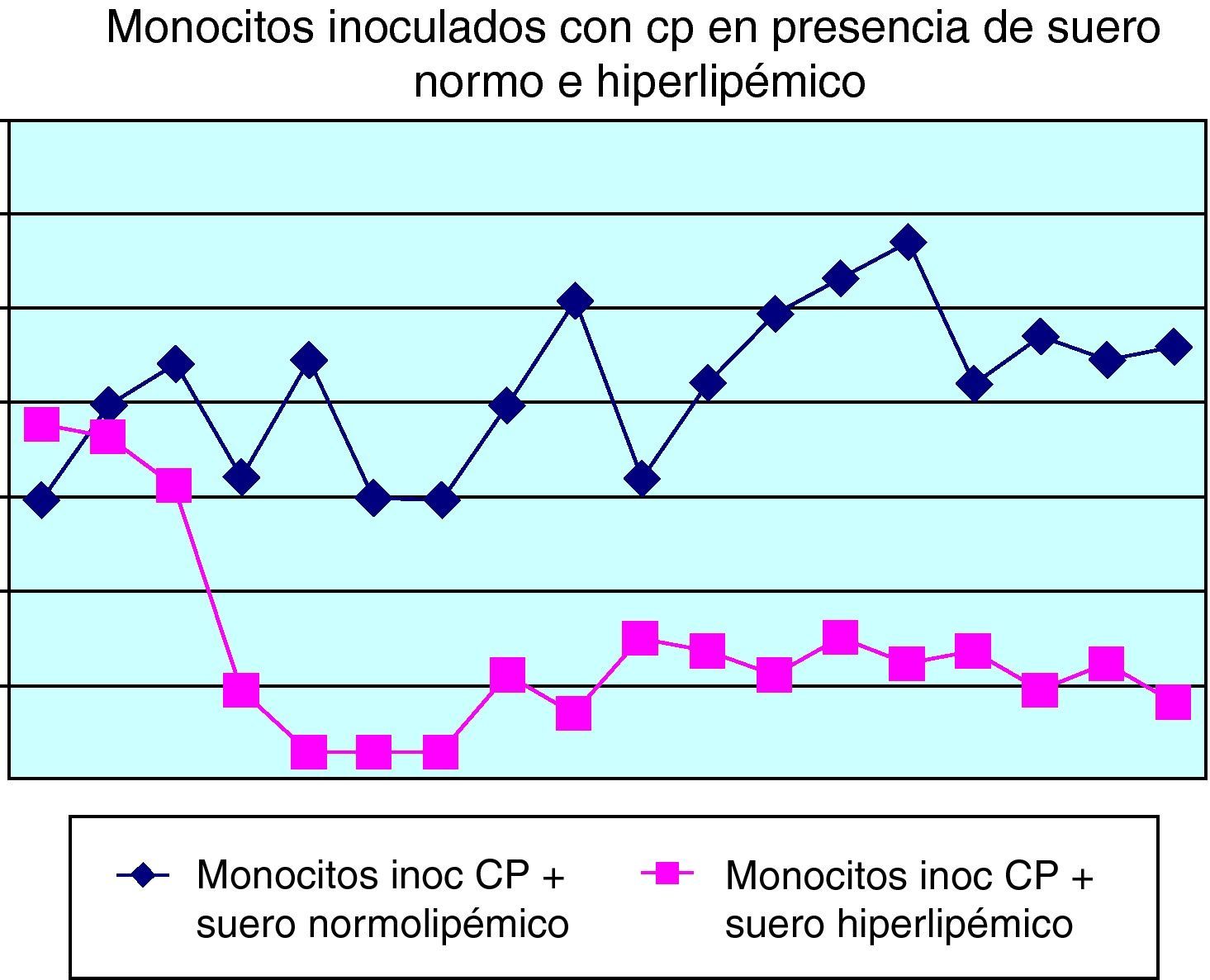
En la figura 6 se puede comprobar el efecto inducido por la adición de suero normo o hiperlipidémico a los cultivos monocitarios infectados por Chlamydia. Como se puede observar, el suero hiperlipidémico induce una respuesta temperada adicional sobre el efecto del germen en el crecimiento celular.
DiscusiónEn los estudios in vitro preparatorios hemos encontrado una muy buena susceptibilidad a la infección por Ch. pneumoniae tanto de las células epiteliales HEp-2 como de la línea de células mononucleares-macrofágicas THP-1. Ello puede permitir disponer de un modelo muy sensible como control para el estudio de otras interacciones célula-agente biológico. Sin embargo, la infección celular crónica y estable in vitro con Ch. pneumoniae ha resultado difícil de mantener por cuanto: a) sólo se afecta un porcentaje de células inoculadas, y b) las células recuperan a largo plazo las características de normalidad. Esto parece indicar que los efectos que cabe esperar que produzca la infección por Ch. pneumoniae en el vaso podrían estar determinados por el hecho de que la infección se encontrara en una fase activa.
También los cultivos primarios de monocitos de sangre periférica han ofrecido resultados muy satisfactorios. Sin embargo, queremos resaltar un hecho de índole práctica, pues en nuestra experiencia tales cultivos no son sensibles a factores de crecimiento in vitro habida cuenta que no hemos observado fenómenos proliferativos significativos cuando los hemos empleado. En estas condiciones, los factores de crecimiento que hemos utilizado parecen comportarse más bien cómo estímulos diferenciadores de la actividad macrofágica, y muy concretamente de su capacidad fagocítica.
Hemos encontrado dos formas de degeneración y muerte celular como consecuencia de la inoculación con Ch. pneumoniae. En un primer tipo, las células mueren pronto con vesiculación y lisis celular; mientras que en el segundo las células pierden adherencia, se vacuolizan y mueren bajo un patrón de apoptosis, haciéndolo de una forma más tardía. En relación con el ciclo infeccioso de Ch. pneumoniae, cabe pensar que cada una de las formas está relacionada con un efecto directo sobre la célula o —en el otro caso— con un efecto asociado a la fase intracelular del germen.
La inoculación celular con Ch. pneumoniae produce efectos en las células estudiadas, pero se observan notables diferencias en la susceptibilidad y en la sensibilidad dependiendo del tipo celular. Los mayores efectos se obtienen en la inoculación de células epiteliales HEp-2, en las que son claramente visibles los cuerpos de inclusión intracitoplasmáticos (algunos en un entorno vacuolizado), por lo que se trata de una cepa especialmente útil para mantener la inoculación.
Ch. pneumoniae fue aislada en 1986 por Grayston et al.26, y su relación con la enfermedad aterosclerótica se basa en una serie de pruebas serológicas, histopatológicas, modelos animales y estudios epidemiológicos.
El primer dato de una posible asociación entre Ch. pneumoniae y arteriopatía coronaria fue publicado en 198817. Los autores cuantificaron los títulos de anticuerpos a Ch. pneumoniae descubriendo que los varones que experimentaban infarto agudo de miocardio o que presentaban arteriopatía coronaria significativa, tenían mayor probabilidad de ser seropositivos para Ch. pneumoniae. La prueba serológica inicial, modificada por Saikku et al.27 en individuos hiperlipidémicos sin cardiopatía comprobada previa, encontró que quienes fueron seropositivos para Ch. pneumoniae tenían 2,6 veces más probabilidad de experimentar enfermedad cardiovascular que los seronegativos.
Desde estos estudios iniciales se han realizado muchos ensayos serológicos, y a pesar de que no todos han sido tan positivos en su relación como los iniciales, en general la mayoría lo confirman. Estudios de casos-controles como el ya señalado previamente de Saikku en 198817 o el de Cook en 199528 presentan resultados claramente positivos, igual que los realizados de forma prospectiva por otros autores en 199929,30. Sin embargo, otros estudios —algunos de ellos de casos-controles27,31 u otros prospectivos32— presentan resultados negativos. Finalmente, algunos estudios son ambiguos en sus resultados, como los publicados a finales de la década pasada como estudios prospectivos33,34.
Ante esta controversia en los resultados serológicos se han empleado otros métodos diagnósticos para discriminar entre infección pasada y activa en pacientes con enfermedad vascular. Es el caso del estudio de ADN específico para Ch. pneumoniae por medio de la reacción en cadena de polimerasa en pacientes con enfermedad coronaria. Algún estudio35 ha demostrado que individuos con arteriopatía coronaria tienen ADN de Ch. pneumoniae en su sangre, y que algunos de ellos —en los que se aísla Ch. pneumoniae en la sangre— son seropositivos con títulos de anticuerpos IgG o IgA dirigidos contra antígenos del agente infeccioso.
Como ya se ha señalado previamente, la relación entre Ch. pneumoniae y la aterosclerosis no sólo se ha estudiado mediante pruebas serológicas. El microorganismo se ha detectado por medio de microscopia electrónica, inmunocitoquímica, inmunofluorescencia directa, hibridación de ácido nucleico con reacción en cadena de polimerasa y cultivo directo del microorganismo15,16. En 199236 se publicaron datos procedentes de estudios histopatológicos, en los que se describían —con microscopia electrónica de placas ateroscleróticas coronarias— partículas dentro de las células congruentes en cuanto a morfología con Ch. pneumoniae, y posteriormente las pruebas inmunocitoquímicas específicas para este microorganismo confirmaron que se trataba de él. Más adelante37 se confirmó este hallazgo inicial en enfermos con aterosclerosis sintomática, y mediante inmunofluorescencia directa se detectó el agente en el 79% de las placas ateroscleróticas. Otros estudios han confirmado también la presencia y la viabilidad de Ch. pneumoniae dentro de la placa aterosclerótica, no sólo en arterias coronarias sino también de otros lechos arteriales principales en los que se desarrolla la enfermedad. En un estudio de 199738 se encontró una incidencia del 100% de Ch. pneumoniae en muestras de aneurisma de aorta abdominal mediante estudios de inmunocitoquímica y reacción en cadena de la polimerasa. Más recientemente, otro autor39, sirviéndose de las mismas técnicas histopatológicas, encontró una incidencia del 64% de Ch. pneumoniae tanto en coronarias como en arterias iliacas.
Aunque los estudios serológicos y patológicos demuestran una relación importante entre Ch. pneumoniae y aterosclerosis, es difícil garantizar una relación causal. Se han realizado estudios en animales40,41, en los que se encontraron lesiones ateroscleróticas en aorta de animales que fueron infectados con Ch. pneumoniae. En 1997 se relacionó, por vez primera, aterosclerosis/metabolismo lipídico/infección con Ch. pneumoniae, demostrando una aceleración del desarrollo de aterosclerosis en aortas de conejos infectados con Ch. pneumoniae sin tratamiento de dicha infección42. Se han estudiado otros modelos animales. Los ratones deficientes en Apo-E43 y en el receptor de LDL44, así como los ratones C57BL/6J45, fueron infectados satisfactoriamente con Ch. pneumoniae; el microorganismo se encontró dentro de las paredes arteriales, con aceleración del desarrollo de aterosclerosis dentro de estos vasos.
Dado que Ch. pneumoniae es sensible a diversos antimicrobianos, se ha valorado una posible relación causal entre el microorganismo y la aterosclerosis mediante ensayos clínicos de tratamiento. En el primero, publicado por Gupta et al.46, se estudió a pacientes tras un infarto de miocardio que fueron seropositivos para Ch. pneumoniae, administrándose en un grupo de ellos azitromicina; en el seguimiento posterior se observó una reducción significativa de complicaciones (necesidad de revascularización, infarto de miocardio, muerte) en los que recibieron tratamiento con antimicrobianos.
En el estudio piloto ROXIS47, en pacientes con angina inestable que recibieron tratamiento con roxitromicina se encontró una disminución significativa de trastornos cardiovasculares recurrentes a los 30 días de seguimiento y con mantenimiento de aquella tras 6 meses de seguimiento48, aunque de forma no significativa. En el estudio ACADEMIC49 se demostró una reducción en los marcadores de la inflamación en pacientes con arteriopatía coronaria conocida, después de ser tratados con azitromicina, aunque falta por determinar si esta reducción se traduce en el descenso de accidentes clínicos adicionales. Sobre la base del resultado de estos estudios, deberían realizarse nuevos estudios clínicos para valorar el papel de Ch. pneumoniae en la aterosclerosis y evaluar la influencia de los diferentes tratamientos sobre los resultados clínicos cardiovasculares.
Se han descrito diversos mecanismos causales por los que Ch. pneumoniae podría iniciar o bien acelerar la progresión de la aterosclerosis. Aunque Ch. pneumoniae puede infectar diversos tipos celulares, parece existir cierto grado de tropismo hacia las células más relacionadas con la aterosclerosis50. De forma específica, Ch. pneumoniae infecta las células endoteliales y los macrófagos51, y en la placa aterosclerótica, en la mayoría de ocasiones, Ch. pneumoniae se halla dentro de los macrófagos espumosos, los cuales parecen tener participación crítica en la patogénesis de las placas ateroscleróticas inestables. Como es bien conocido, los cultivos celulares de monocitos pueden transformarse en macrófagos activados por la adición de LDL oxidada al medio de cultivo52. La infección por Ch. pneumoniae puede acelerar de manera notable el desarrollo de células espumosas y permitir que esta transformación se produzca con valores mucho menores de LDL en el medio de cultivo, por lo que es posible que la infección por Ch. pneumoniae incremente la susceptibilidad de la pared del vaso al daño tóxico por colesterol LDL oxidado53.
En otros estudios de cultivos celulares54 se ha demostrado que la infección de células de músculo liso aumenta su estado procoagulante, por disminución de la producción del activador de plasminógeno tisular y por incremento de la producción del factor hístico, un potente procoagulante, por lo que es posible que la infección de células endoteliales con Ch. pneumoniae estimule el sistema local de coagulación de la pared del vaso y favorezca el potencial para trombosis coronaria. Igualmente, se cree que Ch. pneumoniae induce el desarrollo o la progresión de aterosclerosis por la producción dentro de la placa aterosclerótica de proteínas con propiedades aterógenas como la HSP-6055,56.
Como hemos señalado, Ch. pneumoniae se puede relacionar con la aterosclerosis coronaria de diversas maneras. Según los estudios seroepidemiológicos, coexiste con esta. Se la encuentra en la mayor parte de las placas ateroscleróticas. La inoculación intranasal de Ch. pneumoniae inicia y acelera el desarrollo de aterosclerosis en modelos animales. Finalmente, en varios estudios clínicos se demostró que el tratamiento antimicrobiano contra Ch. pneumoniae tiene efecto positivo en la prevención secundaria de aterosclerosis coronaria conocida. Aún quedan muchos aspectos por conocer sobre el comportamiento biológico de los monocitos y sobre la interacción de estas células con Ch. pneumoniae13,57.
No obstante, de acuerdo con los resultados anteriores, se puede señalar que la infección por Ch. pneumoniae puede estar implicada en las distintas fases del proceso aterogénico: en el inicio de la lesión ateromatosa, en el desarrollo y promoción de esta, y eventualmente en las complicaciones. De nuestros resultados se desprende que los factores con más impacto en la patogenia del proceso parecen ser la degeneración celular inducida por el germen, la activación macrofágica y los fenómenos inflamatorios como consecuencia de la apoptosis. La infección activa por Ch. pneumoniae puede ser un elemento para considerar en la desestabilización de la placa de ateroma, que resulta clave para el desarrollo de aterotrombosis, proceso sobre que el que asienta el síndrome agudo isquémico de origen aterosclerótico.