El abordaje laparoscópico en la cirugía por complicaciones colorrectales es controvertido. Sin embargo, puede proporcionar ventajas sobre la cirugía abierta. El objetivo del estudio es comparar el abordaje laparoscópico vs. el abordaje abierto en la reintervención por complicaciones tras cirugía colorrectal.
MétodosSe han analizado de forma retrospectiva, sobre una base de datos prospectiva, los pacientes intervenidos mediante cirugía laparoscópica colorrectal desde enero de 2006 a diciembre de 2015. Los pacientes que requirieron reintervenciones urgentes por complicaciones en el postoperatorio se dividieron según el abordaje (cirugía laparoscópica [CL] y cirugía abierta [CA]) y según su gravedad clínica (en función del índice de peritonitis de Mannheim [IPM]).
ResultadosDe 763 pacientes, 40 requirieron cirugía urgente (24 CA/16 CL). Se realizaron más ileostomías en el grupo CL (68,7% vs. 29,2%) y más colostomías en el grupo CA (37,5% vs. 6,2%), p<0,05. El IPM fue mayor en el grupo CA (27,31±6,47 [19-35] vs. 18,4±7,2 [11-24], p<0,001). La estancia hospitalaria tras la reintervención, tolerancia oral e infección de herida quirúrgica fueron favorables en CL (p<0,05). En pacientes con un IPM≤26, el abordaje laparoscópico mostró menor estancia hospitalaria, menor permanencia en unidad de críticos, tolerancia oral más temprana y menor infección de herida quirúrgica (p<0,05).
ConclusionesEl abordaje laparoscópico en la reintervención por complicaciones tras cirugía colorrectal laparoscópica asocia una recuperación más rápida objetivada en un inicio precoz de tolerancia oral, menor estancia hospitalaria y menor tasa de hernia incisional en pacientes con bajo índice de gravedad.
The laparoscopic approach in colorectal complications is controversial because of its difficulty. However, it has been proven that it can provide advantages over open surgery. The aim of this study is to compare laparoscopic approach in reoperations for complications after colorectal surgery with the open approach taking into account the severity of the patient prior to reoperation.
MethodsPatients who underwent laparoscopic colorectal surgery from January 2006 to December 2015 were retrospectively reviewed. Patients requiring urgent surgical procedures for complications in the postoperative period were divided in two groups: laparoscopic surgery (LS) and open surgery (OS). To control clinical severity prior to reoperation, The Mannheim Peritonitis Index (MPI) was calculated.
ResultsA total of 763 patients were studied, 40 required urgent surgery (24 OS/16 LS). More ileostomies were performed in the LS group (68.7% vs. 29.2%) and more colostomies in the OS group (37.5% vs. 6.2%), p<0.05. MPI was higher in OS group (27.31±6.47 [19-35] vs. 18.36±7.16 [11-24], p<0.001). Hospital stay after re-intervention, oral tolerance and surgical wound infection, were favorable in LS (p<0.05 in all cases). In patients with MPI score ≤26, laparoscopic approach showed shorter hospital stay after re-intervention, less stay in the critical care unit after re-intervention, earlier start of oral tolerance and less surgical wound infection (p<0.05).
ConclusionsA laparoscopic approach in re-intervention for complications after laparoscopic colorectal surgery associates a faster recovery reflected in a shorter hospital stay, earlier start of oral tolerance and a lower abdominal wall complication rate in patients with low severity index.
El abordaje laparoscópico ha demostrado resultados oncológicos y funcionales similares a los procedimientos abiertos, con claras ventajas en la recuperación postoperatoria en comparación con estos1-8. Los beneficios a corto y largo plazo del enfoque mínimamente invasivo han sido reflejados en un gran número de publicaciones: menor pérdida de sangre intraoperatoria, menos dolor postoperatorio, tolerancia oral más temprana, menor estancia hospitalaria, incorporación precoz a las actividades diarias, menor infección del sitio quirúrgico y menores tasas de hernia incisional2,5,9,10.
La laparoscopia se ha convertido en el estándar para la cirugía colorrectal. Sin embargo, el uso de este abordaje en las complicaciones que ocurren tras la cirugía colorrectal, como hemoperitoneo, obstrucción intestinal o fuga anastomótica, sigue siendo controvertido11. Algunos estudios señalan las dificultades que pueden aparecer durante el transcurso de la laparoscopia para manejar las asas del intestino delgado distendidas y la posibilidad de no lograr una visión de la cavidad abdominal óptima. Otros argumentos contra el abordaje laparoscópico han sido dificultades para encontrar el punto de sangrado en caso de hemoperitoneo o de realizar un lavado abdominal adecuado en caso de peritonitis purulenta o fecaloidea12,13.
Las ventajas del abordaje laparoscópico sobre la cirugía abierta en las reintervenciones tras otros procedimientos abdominales laparoscópicos, como cirugía bariátrica, colecistitis aguda o apendicitis aguda, ya han sido señaladas en otros estudios10,11,14,15. Sin embargo, muy poco se ha publicado sobre la utilidad de la relaparoscopia en el tratamiento de las complicaciones colorrectales16-19.
Uno de los factores pronósticos más importantes antes de la reintervención es la situación clínica inicial del paciente11,17,20. Clásicamente, la cirugía abierta ha sido preferida por la mayoría de los cirujanos en pacientes con peritonitis avanzada o hemodinámicamente inestables. Sin embargo, se ha descrito que el abordaje laparoscópico también puede aportar beneficios en la reoperación de este grupo de pacientes. El abordaje mínimamente invasivo puede disminuir la infección de la herida, la estancia hospitalaria y las tasas de hernia incisional también en este grupo poblacional13,21.
El objetivo de este estudio es comparar la seguridad y viabilidad del abordaje laparoscópico con respecto a la cirugía abierta en la reintervención por complicaciones posteriores a la cirugía colorrectal teniendo en cuenta la gravedad del paciente antes de la misma.
MétodosDiseño del estudio. Se han incluido, de una base de datos prospectiva, todos los pacientes intervenidos de cirugía colorrectal programada mediante abordaje laparoscópico entre enero de 2006 y diciembre de 2015 en el Hospital Universitario Virgen de la Arrixaca para ser analizados de forma retrospectiva.
Se han utilizado como criterios de exclusión la conversión a cirugía abierta y la realización de cualquier otro procedimiento no laparoscópico como anastomosis extracorpórea. De un total de 763 pacientes con abordaje totalmente laparoscópico, se excluyeron los pacientes cuyas complicaciones han sido tratadas con drenaje percutáneo radiológico o reparación transanal. Finalmente, se obtuvo una muestra de 40 pacientes, dividida en dos grupos, cirugía laparoscópica (CL) y cirugía abierta (CA). La decisión del abordaje utilizado en cada caso fue a criterio del cirujano.
Técnica quirúrgica. La cirugía inicial en todos los casos fue un procedimiento laparoscópico colorrectal programado realizado por el mismo equipo quirúrgico de cirujanos colorrectales con amplia experiencia en abordaje laparoscópico. Las reintervenciones fueron realizadas con carácter urgente por el mismo equipo siguiendo los mismos criterios. Para el abordaje laparoscópico, el paciente se colocó en posición de Lloyd-Davies. Los trocares se introdujeron a través de los puertos de inserción previos. El primer trocar se introdujo utilizando el puerto periumbilical bajo visión directa. En los procedimientos abiertos, la posición del paciente fue la misma, realizando una laparotomía media. El cierre de la pared abdominal se realizó con sutura continua de polidioxanona (PDS®).
En los casos de dehiscencia anastomótica, de acuerdo con los hallazgos intraoperatorios y la gravedad clínica del paciente, se realizó reparación primaria o resección anastomótica y nueva anastomosis. La creación de un estoma derivativo fue a criterio del cirujano. En los casos de peritonitis fecaloidea por dehiscencia en anastomosis colorrectal se realizó un Hartmann. Se realizó lavado peritoneal con al menos 3l de solución salina en todos los pacientes. Se colocó un catéter de drenaje adyacente a la anastomosis.
En caso de hemoperitoneo, se realizó el lavado peritoneal hasta lograr una visión adecuada de toda la cavidad abdominal. La hemostasia se realizó con clips, suturas o coagulación bipolar. En estos casos el drenaje se colocó en la pelvis.
Variables del estudio. Se analizaron las variables demográficas y basales relacionadas con la primera cirugía: edad (años), sexo, índice de masa corporal (IMC), clasificación de la Sociedad Americana de Anestesiología (ASA), cirugía y comorbilidades previas, etiología (benigna o maligna) y tipo de intervención. En cuanto a la reintervención quirúrgica, se evaluaron el intervalo hasta la reintervención (tiempo en días desde la cirugía programada hasta la reoperación), gravedad del fallo orgánico antes de la reintervención, número de transfusiones y tiempo operatorio. Tras la reintervención, se recogieron estancia hospitalaria global, estancia en unidad de cuidados intensivos, inicio de la tolerancia oral, complicaciones de la pared abdominal, procedimientos adicionales requeridos (técnica invasiva radiológica, quirúrgica o ambas), fallecimiento y complicaciones durante el seguimiento.
Para establecer grupos comparables en términos de gravedad clínica previa a la reintervención, se calculó el índice de peritonitis de Mannheim (IPM)20. Este índice predice las tasas de mortalidad de la peritonitis evaluando de forma global diferentes parámetros del paciente (incluyendo edad, sexo, existencia de insuficiencia orgánica, origen neoplásico, existencia de sepsis de origen colónico y duración de la peritonitis) y datos intraoperatorios como el tipo y extensión de la peritonitis, consiguiendo aportar una visión global del estado de gravedad del paciente así como de su origen y duración. Se analizaron los pacientes con una puntuación de IPM igual o inferior a 26 (corte previsto como predictor de mortalidad). No se realizó un análisis de pacientes con IPM superior a 26 por el escaso tamaño muestral.
Análisis estadísticoLos datos se analizaron utilizando SPSS Statistics 22.0® (sistemas IBM, Chicago, EE.UU.). Para el análisis comparativo, se utilizó la t de Student para las variables cuantitativas o U de Mann-Whitney cuando fue necesario. Chi-cuadrado y la prueba exacta de Fisher se utilizaron para variables categóricas. Aquellos pacientes en los que se realizó conversión de cirugía laparoscópica a abierta, se incluyeron para el análisis en su grupo original (laparoscópico) realizando un análisis «por intención de tratar» aunque fuese un estudio no aleatorizado. Se consideró estadísticamente significativo un nivel de p<0,05. Para el análisis de los datos, se obtuvo el consentimiento informado de los pacientes y se siguieron las directrices de confidencialidad del centro para el tratamiento de los mismos.
ResultadosUn total de 763 pacientes se intervinieron mediante cirugía laparoscópica colorrectal, 40 de los cuales (5,2%) requirieron cirugía urgente por complicaciones, 24 por CA y 16 por CL. Dos pacientes fueron convertidos a laparotomía (12,5%) por dilatación de asas del intestino delgado.
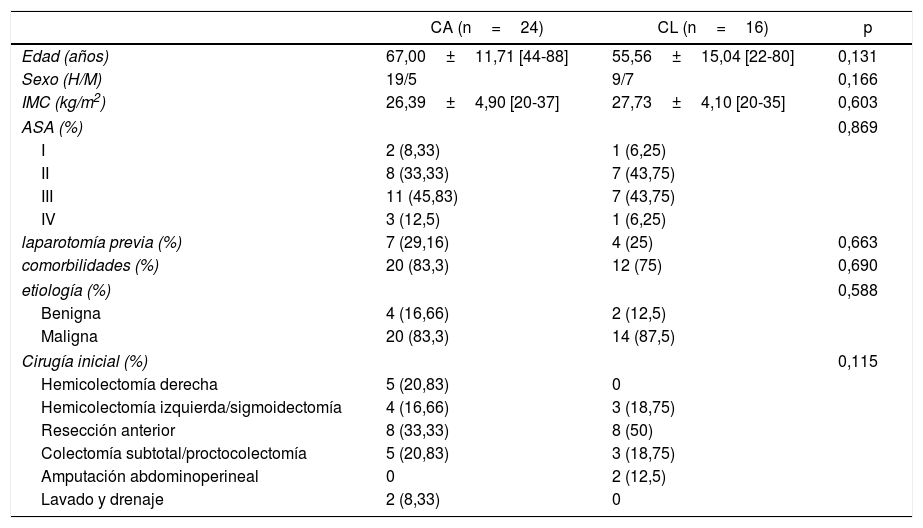
Las tablas 1 y 2 muestran los procedimientos quirúrgicos realizados y las variables basales de los pacientes. No se encontraron diferencias entre ambos grupos.
Cirugías realizadas e indicaciones
| N=763 (100%) | |
|---|---|
| Resección segmentaria | 428 (56,1%) |
| Hemicolectomía derecha | 212 (27,8%) |
| Transversa | 20 (2,6%) |
| Hemicolectomía izquierda | 196 (25,7%) |
| Resección anterior | 205 (26,9%) |
| Colectomía subtotal/proctocolectomía | 62 (8,1%) |
| Hartmann | 53 (6,9%) |
| Otros | 15 (2%) |
| N=763 (100%) | |
|---|---|
| Cáncer de colon | 390 (51,1%) |
| Cáncer de recto | 241 (31,6%) |
| Enfermedad inflamatoria | 73 (9,6%) |
| Poliposis adenomatosa familiar | 38 (4,9%) |
| Otros | 21 (2,8%) |
Variables basales y demográficas
| CA (n=24) | CL (n=16) | p | |
|---|---|---|---|
| Edad (años) | 67,00±11,71 [44-88] | 55,56±15,04 [22-80] | 0,131 |
| Sexo (H/M) | 19/5 | 9/7 | 0,166 |
| IMC (kg/m2) | 26,39±4,90 [20-37] | 27,73±4,10 [20-35] | 0,603 |
| ASA (%) | 0,869 | ||
| I | 2 (8,33) | 1 (6,25) | |
| II | 8 (33,33) | 7 (43,75) | |
| III | 11 (45,83) | 7 (43,75) | |
| IV | 3 (12,5) | 1 (6,25) | |
| laparotomía previa (%) | 7 (29,16) | 4 (25) | 0,663 |
| comorbilidades (%) | 20 (83,3) | 12 (75) | 0,690 |
| etiología (%) | 0,588 | ||
| Benigna | 4 (16,66) | 2 (12,5) | |
| Maligna | 20 (83,3) | 14 (87,5) | |
| Cirugía inicial (%) | 0,115 | ||
| Hemicolectomía derecha | 5 (20,83) | 0 | |
| Hemicolectomía izquierda/sigmoidectomía | 4 (16,66) | 3 (18,75) | |
| Resección anterior | 8 (33,33) | 8 (50) | |
| Colectomía subtotal/proctocolectomía | 5 (20,83) | 3 (18,75) | |
| Amputación abdominoperineal | 0 | 2 (12,5) | |
| Lavado y drenaje | 2 (8,33) | 0 | |
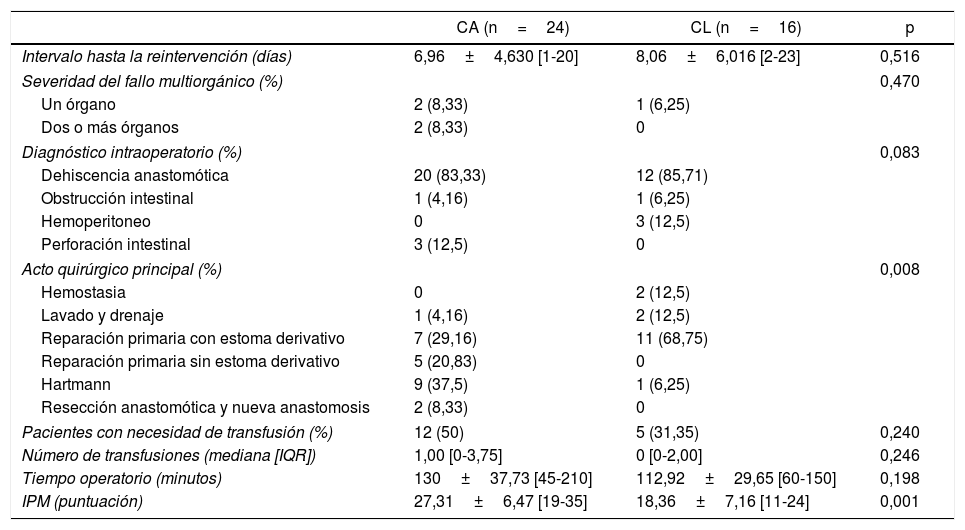
De acuerdo con los resultados tras la reintervención (tabla 3), aunque no se encontraron diferencias en el diagnóstico intraoperatorio entre ambos grupos (p=0,08), existen diferencias en los procedimientos realizados (p=0,008). En pacientes con fuga anastomótica, más pacientes se intervinieron mediante una reparación primaria de anastomosis sin estoma derivativo en el grupo CA (20,83%). Además, en este mismo grupo, se realizaron más procedimientos de Hartmann (9 frente a 1 en CL). El tiempo operatorio fue similar en ambos grupos (130,00±37,73 [45-210] minutos en CA frente a 112,92±29,65 [60-150] minutos en CL, p=0,19). Al analizar la gravedad de los pacientes, el IPM fue diferente en ambos grupos (p=0,001) y los pacientes en el grupo de CA presentaban mayor puntuación.
Resultados durante la reintervención
| CA (n=24) | CL (n=16) | p | |
|---|---|---|---|
| Intervalo hasta la reintervención (días) | 6,96±4,630 [1-20] | 8,06±6,016 [2-23] | 0,516 |
| Severidad del fallo multiorgánico (%) | 0,470 | ||
| Un órgano | 2 (8,33) | 1 (6,25) | |
| Dos o más órganos | 2 (8,33) | 0 | |
| Diagnóstico intraoperatorio (%) | 0,083 | ||
| Dehiscencia anastomótica | 20 (83,33) | 12 (85,71) | |
| Obstrucción intestinal | 1 (4,16) | 1 (6,25) | |
| Hemoperitoneo | 0 | 3 (12,5) | |
| Perforación intestinal | 3 (12,5) | 0 | |
| Acto quirúrgico principal (%) | 0,008 | ||
| Hemostasia | 0 | 2 (12,5) | |
| Lavado y drenaje | 1 (4,16) | 2 (12,5) | |
| Reparación primaria con estoma derivativo | 7 (29,16) | 11 (68,75) | |
| Reparación primaria sin estoma derivativo | 5 (20,83) | 0 | |
| Hartmann | 9 (37,5) | 1 (6,25) | |
| Resección anastomótica y nueva anastomosis | 2 (8,33) | 0 | |
| Pacientes con necesidad de transfusión (%) | 12 (50) | 5 (31,35) | 0,240 |
| Número de transfusiones (mediana [IQR]) | 1,00 [0-3,75] | 0 [0-2,00] | 0,246 |
| Tiempo operatorio (minutos) | 130±37,73 [45-210] | 112,92±29,65 [60-150] | 0,198 |
| IPM (puntuación) | 27,31±6,47 [19-35] | 18,36±7,16 [11-24] | 0,001 |
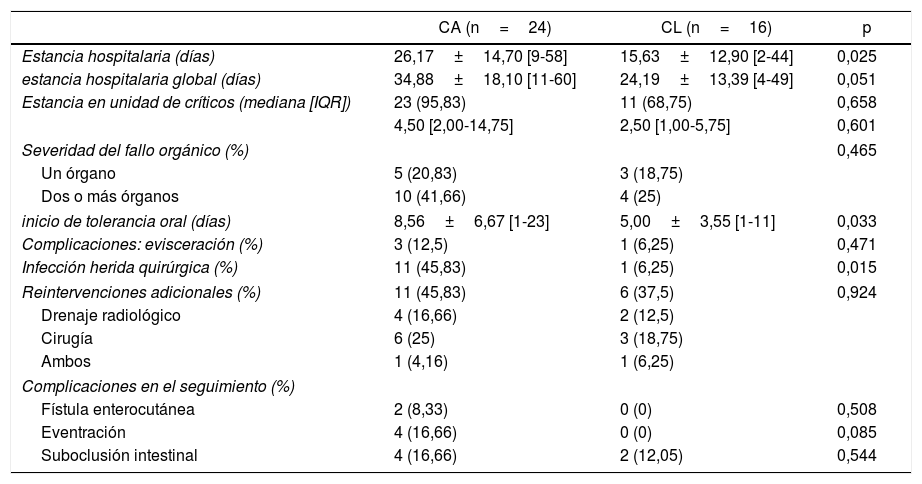
En cuanto a resultados postoperatorios (tabla 4), los pacientes en el grupo CL presentaron una estancia hospitalaria más corta tras la reintervención (26,27±14,70 [9-58] días en el grupo de CA frente a 15,63±12,90 [2-44] días en CL, p=0,02), menor estancia hospitalaria global (34,88±18,10 [11-60] días en el grupo CA frente a 24,19±13,39 [4-49] días en el grupo CL, p=0,05), menos tiempo hasta la primera ingesta oral (8,56±6,67 [1-23] días en CA frente a 5,00±3,55 [1-11] días en el grupo CL, p=0,03), y menores tasas de infección de herida quirúrgica (45,83% en CA frente a 6,25% en CL, p=0,01). Un paciente del grupo CL con conversión a laparotomía tuvo una infección de herida quirúrgica grave con evisceración y necesidad de reintervención.
Resultados postoperatorios
| CA (n=24) | CL (n=16) | p | |
|---|---|---|---|
| Estancia hospitalaria (días) | 26,17±14,70 [9-58] | 15,63±12,90 [2-44] | 0,025 |
| estancia hospitalaria global (días) | 34,88±18,10 [11-60] | 24,19±13,39 [4-49] | 0,051 |
| Estancia en unidad de críticos (mediana [IQR]) | 23 (95,83) | 11 (68,75) | 0,658 |
| 4,50 [2,00-14,75] | 2,50 [1,00-5,75] | 0,601 | |
| Severidad del fallo orgánico (%) | 0,465 | ||
| Un órgano | 5 (20,83) | 3 (18,75) | |
| Dos o más órganos | 10 (41,66) | 4 (25) | |
| inicio de tolerancia oral (días) | 8,56±6,67 [1-23] | 5,00±3,55 [1-11] | 0,033 |
| Complicaciones: evisceración (%) | 3 (12,5) | 1 (6,25) | 0,471 |
| Infección herida quirúrgica (%) | 11 (45,83) | 1 (6,25) | 0,015 |
| Reintervenciones adicionales (%) | 11 (45,83) | 6 (37,5) | 0,924 |
| Drenaje radiológico | 4 (16,66) | 2 (12,5) | |
| Cirugía | 6 (25) | 3 (18,75) | |
| Ambos | 1 (4,16) | 1 (6,25) | |
| Complicaciones en el seguimiento (%) | |||
| Fístula enterocutánea | 2 (8,33) | 0 (0) | 0,508 |
| Eventración | 4 (16,66) | 0 (0) | 0,085 |
| Suboclusión intestinal | 4 (16,66) | 2 (12,05) | 0,544 |
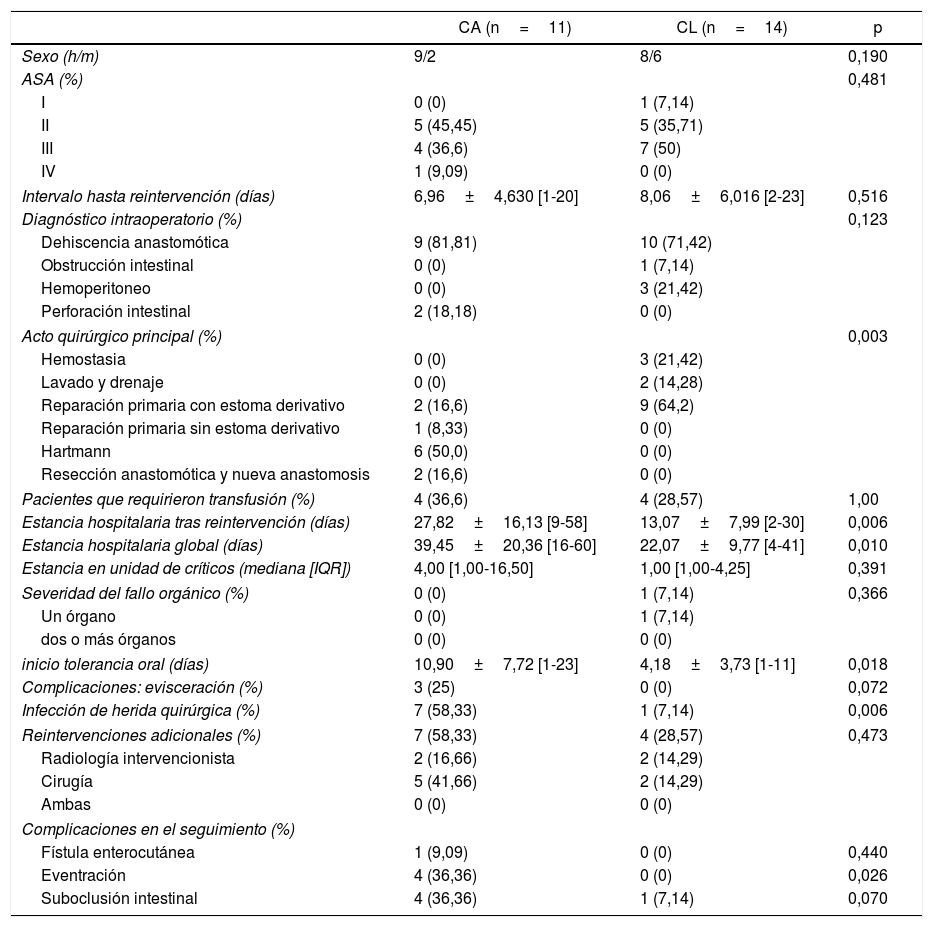
La tabla 5 muestra los resultados de los pacientes con una puntuación de IPM igual o inferior a 26. No se encontraron diferencias significativas en las variables basales. Dos pacientes del grupo CL (14,28%) se convirtieron a cirugía abierta debido a adherencias y dilatación de asas intestinales. Como en el primer grupo, los pacientes con IPM <26 y abordaje laparoscópico presentan menor estancia hospitalaria tras la reintervención, menor estancia hospitalaria general, inicio más precoz de la tolerancia oral y menores tasas de infección de la herida (p=0,006, p=0,01, p=0,01 y p=0,006, respectivamente). Aunque ningún paciente del grupo CL presentó complicaciones de la pared abdominal, no se encontraron diferencias en las tasas de evisceración entre los dos grupos. Un paciente del grupo CL falleció. El seguimiento medio de ambos grupos fue de 35,91±12,91 [12-62] meses en CA frente a 31,00±27,21 [2-84] meses en el grupo CL, p=0,59.
Resultados postoperatorios en pacientes con IPM inferior a 26
| CA (n=11) | CL (n=14) | p | |
|---|---|---|---|
| Sexo (h/m) | 9/2 | 8/6 | 0,190 |
| ASA (%) | 0,481 | ||
| I | 0 (0) | 1 (7,14) | |
| II | 5 (45,45) | 5 (35,71) | |
| III | 4 (36,6) | 7 (50) | |
| IV | 1 (9,09) | 0 (0) | |
| Intervalo hasta reintervención (días) | 6,96±4,630 [1-20] | 8,06±6,016 [2-23] | 0,516 |
| Diagnóstico intraoperatorio (%) | 0,123 | ||
| Dehiscencia anastomótica | 9 (81,81) | 10 (71,42) | |
| Obstrucción intestinal | 0 (0) | 1 (7,14) | |
| Hemoperitoneo | 0 (0) | 3 (21,42) | |
| Perforación intestinal | 2 (18,18) | 0 (0) | |
| Acto quirúrgico principal (%) | 0,003 | ||
| Hemostasia | 0 (0) | 3 (21,42) | |
| Lavado y drenaje | 0 (0) | 2 (14,28) | |
| Reparación primaria con estoma derivativo | 2 (16,6) | 9 (64,2) | |
| Reparación primaria sin estoma derivativo | 1 (8,33) | 0 (0) | |
| Hartmann | 6 (50,0) | 0 (0) | |
| Resección anastomótica y nueva anastomosis | 2 (16,6) | 0 (0) | |
| Pacientes que requirieron transfusión (%) | 4 (36,6) | 4 (28,57) | 1,00 |
| Estancia hospitalaria tras reintervención (días) | 27,82±16,13 [9-58] | 13,07±7,99 [2-30] | 0,006 |
| Estancia hospitalaria global (días) | 39,45±20,36 [16-60] | 22,07±9,77 [4-41] | 0,010 |
| Estancia en unidad de críticos (mediana [IQR]) | 4,00 [1,00-16,50] | 1,00 [1,00-4,25] | 0,391 |
| Severidad del fallo orgánico (%) | 0 (0) | 1 (7,14) | 0,366 |
| Un órgano | 0 (0) | 1 (7,14) | |
| dos o más órganos | 0 (0) | 0 (0) | |
| inicio tolerancia oral (días) | 10,90±7,72 [1-23] | 4,18±3,73 [1-11] | 0,018 |
| Complicaciones: evisceración (%) | 3 (25) | 0 (0) | 0,072 |
| Infección de herida quirúrgica (%) | 7 (58,33) | 1 (7,14) | 0,006 |
| Reintervenciones adicionales (%) | 7 (58,33) | 4 (28,57) | 0,473 |
| Radiología intervencionista | 2 (16,66) | 2 (14,29) | |
| Cirugía | 5 (41,66) | 2 (14,29) | |
| Ambas | 0 (0) | 0 (0) | |
| Complicaciones en el seguimiento (%) | |||
| Fístula enterocutánea | 1 (9,09) | 0 (0) | 0,440 |
| Eventración | 4 (36,36) | 0 (0) | 0,026 |
| Suboclusión intestinal | 4 (36,36) | 1 (7,14) | 0,070 |
La cirugía colorrectal laparoscópica es una práctica rutinaria para muchos cirujanos. Sin embargo, el acceso recomendado actualmente para la reintervención es la cirugía abierta debido a la escasa cantidad y calidad de evidencia científica disponible a favor de la laparoscopia13,17,18. Los avances tecnológicos, y el aumento de la experiencia en este abordaje, pueden tentar a algunos cirujanos a realizar este tipo de reintervenciones por esta vía. En cirugía urgente, ya sea debido a la gravedad clínica del paciente o a las anomalías anatómicas características del abdomen peritonítico o hemorrágico, el abordaje laparoscópico puede ser muy dificultoso y técnicamente demandante. A pesar de que algunos estudios han cuestionado el impacto del neumoperitoneo en el abdomen séptico argumentando que un aumento de la presión intraabdominal podría favorecer la aparición de una endotoxemia22,23, estudios recientes han demostrado que el abordaje laparoscópico es seguro en caso de peritonitis24 e incluso puede reducir el potencial trauma y estrés sistémico debido a la cirugía abierta21-25. En 2006, la Asociación Europea de Cirugía Endoscópica concluyó que la laparoscopia en cirugía de urgencias y en manos expertas puede alcanzar niveles diagnósticos y terapéuticos superiores al 90%11.
La causa más frecuente de reintervención en cirugía colorrectal es la fuga anastomótica, con una incidencia del 1-30% según series y valores óptimos entre el 2-5%26,27. En nuestro estudio, la tasa de reintervención global es del 5,2% y del 4,6% por dehiscencia anastomótica (n=35). De forma similar a Kwak et al.28, en nuestro estudio, el grupo de CL mostró una menor incidencia de infección de la herida y de hernia incisional. Esto apoya nuestra teoría de que la reintervención por vía laparoscópica permite al paciente disfrutar de los beneficios de un abordaje mínimamente invasivo13 a pesar de necesitar una segunda intervención.
En caso de dehiscencia anastomótica, independientemente del grupo y el procedimiento, la cirugía de «bypass», entendiendo como tal la realización de un estoma derivativo, es una opción aceptada en pacientes con dehiscencia de anastomosis menor del 50% de la circunferencia y ausencia de peritonitis difusa debido a su menor morbimortalidad19,29-31. En nuestro estudio, el grupo de CL presentó mayor porcentaje de ileostomías derivativas.
La reparación de la anastomosis con lavado de la cavidad peritoneal fue el procedimiento más frecuente en nuestra serie (49,99% en el grupo CA frente a 68,75% en el grupo CL). En los casos de ileostomía derivativa, esta se realizó a través de uno de los trocares utilizados durante la reintervención. Las ventajas de este manejo de la dehiscencia anastomótica en el abordaje laparoscópico ya han sido descritas por numerosos autores13,19,32. En nuestro caso, esta estrategia fue exitosa en 14 de 16 pacientes (87,5%), lo que supone una tasa similar a la de otros estudios previos32.
Sin embargo, nuestra tasa de conversión duplica la de otros estudios como el de Cuccurrullo et al. (6%)33. Esto puede deberse a que, en nuestra opinión, la conversión precoz es una decisión acertada cuando existen dudas sobre la posibilidad de causar lesiones iatrogénicas. En nuestra serie, dos pacientes se convirtieron en cirugía abierta por dificultad en el manejo de la dilatación de asas del intestino delgado, que es, en nuestra opinión, uno de los principales inconvenientes de este abordaje.
Con respecto a la evaluación del estado clínico del paciente antes de la reintervención, Vennix et al.17 señalan que existe una falta de tales datos en las series publicadas y advierten de probable sesgo de selección en el abordaje quirúrgico. En su artículo, sugieren aplicar un sistema de puntuación de la gravedad de la peritonitis para controlar la homogeneidad entre los grupos. En el estudio publicado recientemente por Lee et al.18 tampoco se analizaron las diferencias clínicas prerreintervención en sus pacientes, ni se describe la presencia de peritonitis purulenta o fecaloidea, datos que consideramos que tienen un importante valor pronóstico y pueden influir significativamente en sus conclusiones20,34,35.
En el primer análisis de nuestro estudio, el tipo de abordaje está claramente influido por la gravedad clínica del paciente. En estas circunstancias, se prefiere la laparotomía, como en estudios anteriores13,16,17. Somos conscientes de que, a la vista de los resultados, existe un sesgo de selección en la elección del abordaje debido a la gravedad clínica. Por ello, para comprobar si la gravedad clínica podría ser un factor de confusión en nuestro estudio, se establecieron grupos homogéneos y se realizó un nuevo análisis.
Aunque existen muchas escalas para predecir la gravedad de los pacientes y el riesgo de muerte postoperatoria36, elegimos el IPM porque tiene en cuenta indicadores como el origen y extensión de la peritonitis, es fácil de aplicar y ha sido validado previamente37,38. Se han encontrado diferencias significativas a favor del grupo CL, confirmando sus ventajas, tal y como señalan Vennix et al.17. Por otra parte, sus conclusiones apoyan nuestros resultados, ya que encontraron diferencias estadísticamente significativas en el grado de contaminación peritoneal, con un mayor porcentaje de peritonitis fecaloidea en el grupo de CA, que es un indicador indirecto de alta severidad con gran importancia en la escala de IPM (12 puntos). Por lo tanto, los pacientes del grupo de CA tendrán peor pronóstico, como se describe con los resultados de IPM de nuestra serie, con mayores tasas de morbimortalidad postoperatoria independientemente del abordaje quirúrgico.
En el segundo análisis, se ha utilizado un punto de corte de 26 puntos en el IPM siguiendo el estudio de Biondo et al.34, en el que se fija esta puntuación como factor predictivo de bajo riesgo de mortalidad. Teniendo en cuenta solo los pacientes con IPM≤26, este estudio intenta proporcionar una comparación entre grupos homogéneos respecto a la gravedad clínica. De nuevo, nuestros resultados ratifican los de estudios anteriores13,18,21, sin embargo, en esta ocasión, en pacientes con similar estado de gravedad.
A pesar de que no existen diferencias estadísticamente significativas en los procedimientos adicionales que se requirieron tras la reintervención en el análisis global ni tampoco en el grupo de IPM<26 puntos, sí que destaca el hecho de que en ambas ocasiones existe una mayor necesidad de procedimientos adicionales en el grupo de CA, lo que, si bien en el análisis global puede considerarse debido a la diferencia en la gravedad clínica de los pacientes entre ambos grupos, tras el ajuste con IPM<26 en grupos homogéneos, consideramos que apoya nuestra hipótesis de que el grupo reintervenido mediante cirugía laparoscópica presenta menor tasa de complicaciones postoperatorias.
Sin embargo, somos conscientes del pequeño tamaño de la muestra, de la ausencia de la aleatorización y del carácter retrospectivo del estudio. Además, en nuestro caso, el equipo quirúrgico se compone de cirujanos con amplia experiencia en cirugía laparoscópica, lo que consideramos que es un factor importante en este tipo de cirugía ya que puede llegar a ser muy compleja y demandante técnicamente. Por todo ello, a pesar de los resultados favorables para el grupo de CL y de la aparición recientemente de dos revisiones sistemáticas39,40 sobre esta materia cuyas conclusiones van en el mismo sentido que las nuestras, consideramos que deben realizarse estudios prospectivos aleatorizados para consolidar estas hipótesis ya que la mayoría de estudios publicados hasta la fecha son descriptivos y/o retrospectivos.
Por último, en nuestra opinión, el abordaje laparoscópico es útil como herramienta diagnóstico-terapéutica en la reintervención por complicaciones tras cirugía colorrectal laparoscópica y asocia una recuperación más rápida que se refleja en una estancia hospitalaria más corta, un inicio precoz de la tolerancia oral y una menor tasa de complicaciones de la pared abdominal en pacientes con bajo índice de gravedad. A pesar de ello, estas reintervenciones son técnicamente exigentes y la conversión temprana debe tenerse en cuenta para evitar lesiones iatrogénicas.
AutoríaAnálisis e interpretación de datos: Ibañez N., Sánchez P., Soriano M.T.
Redacción: Sánchez P., Ibañez N, Abrisqueta J., Arevalo-Pérez J., Parrilla P.
Revisado: Ibañez N., Abrisqueta J., Arevalo-Pérez J., Lujan J., Parrilla P.
Aprobación de la versión final: Lujan J., Parrilla P.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.