La reconstrucción esofágica mediante gastroplastia con anastomosis cervical es una técnica una mayor dehiscencia anastomótica remarcable.. El objetivo de este estudio es analizar la incidencia de dehiscencia anastomótica en pacientes sometidos a gastroplastia con anastomosis cervical tras acondicionamiento isquémico angiográfico del tubo gástrico.
MétodosAnálisis prospectivo de pacientes que se sometieron a acondicionamiento gástrico 2 semanas antes de la reconstrucción esofágica, desde enero de 2001 hasta enero de 2014.
El acondicionamiento se realizó mediante embolización angiográfica de las arterias gástricas izquierda y derecha, y la arteria esplénica.
La variable principal analizada fue la incidencia de dehiscencia anastomótica en pacientes sometidos a gastroplastia con anastomosis cervical.
Las variables secundarias analizadas fueron el éxito del acondicionamiento, las complicaciones tras este procedimiento y postoperatorias, y la duración media de la estancia hospitalaria postacondicionamiento.
ResultadosEl acondicionamiento gástrico se indicó en 97 pacientes, siendo la neoplasia la etiología más frecuente que motivó la reconstrucción esofágica (76%). Se realizaron 96 procedimientos con éxito, la embolización arterial fue completa en 80 (83%). La morbilidad fue del 13%, sin mortalidad. La morbilidad postoperatoria fue del 45%; las complicaciones más frecuentes asociadas a la cirugía fueron los respiratorios. Seis (7%) pacientes presentaron fístula cervical y todos tratados de forma conservadora. La mortalidad postoperatoria fue del 7%.
ConclusionesEn nuestra serie, la incidencia de dehiscencia anastomótica en pacientes sometidos a gastroplastia con anastomosis cervical tras acondicionamiento isquémico angiográfico es del 7%. El acondicionamiento isquémico angiográfico es un procedimiento con una morbilidad aceptable.
Oesophageal reconstruction by gastroplasty with cervical anastomosis has a higher incidence of dehiscence. The aim of the study is to analyse the incidence of anastomotic leakage in patients undergoing gastroplasty with cervical anastomosis following angiographic ischaemic conditioning of the gastric conduit.
MethodsProspective analysis of patients who underwent gastric conditioning two weeks prior to oesophageal reconstruction, from January 2001 to January 2014.
The conditioning was performed by angiographic embolization of the left and right gastric artery, and splenic artery.
The main variable analysed was the incidence of anastomotic leakage in patients undergoing gastroplasty with cervical anastomosis.
Secondary variables analysed were the result of the conditioning, complications arising from that procedure and in the postoperative period, and mean length of postconditioning and postoperative hospital stay.
ResultsGastric conditioning was indicated in 97 patients, with neoplasia being the most frequent aetiology motivating the oesophageal reconstruction (76%). 96 procedures were successfully carried out, arterial embolization was complete in 80 (83%). The morbidity rate was 13%, with no mortality. Postoperative morbidity was 45%; the most frequent complications associated with the surgery were respiratory problems. Six (7%) patients experienced cervical fistula, and all received conservative treatment. The rate of postoperative mortality was 7%.
ConclusionsIn our serie the incidence of anastomotic leakage in patients undergoing gastroplasty with cervical anastomosis following angiographic ischaemic conditioning is 7%.
Angiographic ischaemic conditioning is a procedure with acceptable morbidity
La reconstrucción esofágica mediante gastroplastia con anastomosis torácica o cervical presenta una incidencia de dehiscencia remarcable, debido al riesgo de isquemia de la plastia1–4. El acondicionamiento isquémico gástrico es un tratamiento que precede a la creación de la plastia gástrica y cuyo propósito es prevenir esta eventualidad.
En 1996 y 1998, Akiyama et al. fueron los primeros en publicar sus resultados sobre la embolización arteriográfica de la arteria gástrica izquierda (AGI), arteria gástrica derecha (AGD) y arteria esplénica (AE) como acondicionamiento gástrico previo a la gastroplastia5,6. Los resultados obtenidos mostraron una menor reducción del flujo sanguíneo tisular (33%) y menor dehiscencia anastomótica (2%) respecto al grupo control (67 y 8%, respectivamente). Posteriormente, en 1999, Isomura et al. publicaron los resultados de una serie de 34 pacientes intervenidos de gastroplastia torácica o cervical con acondicionamiento angiográfico previo7. Como en el grupo de Akiyama et al.6, observaron una menor reducción del flujo sanguíneo tisular durante la realización del tubo gástrico, del 27,5% en comparación con el 68,9% del grupo de control (p<0,005), con una dehiscencia anastomótica del 2,9%.
Desde 2006, algunos autores han abogado por el acondicionamiento gástrico laparoscópico8–17, siendo la serie de Schröder et al. la más larga con 419 pacientes. Sin embargo, esta estrategia tiene algunas desventajas: la necesidad de anestesia general y 2 procedimientos quirúrgicos, así como una menor eficacia comparado con el abordaje arteriográfico, como apunta un reciente metaanálisis18.
En la actualidad existe controversia sobre los beneficios del acondicionamiento isquémico. En un artículo reciente19 se cuestiona su recomendación general, aconsejándolo solo en casos seleccionados con alto riesgo de dehiscencia (calcificación aórtica, hipertensión, insuficiencia renal).
El presente estudio es la serie publicada con mayor número de pacientes embolizados arteriográficamente, que pretende dar respuesta al el éxito del acondicionamiento gástrico arteriográfico, su morbilidad y la incidencia de dehiscencia anastomótica cervical.
El objetivo del presente estudio es analizar la incidencia de dehiscencia anastomótica en pacientes sometidos a gastroplastia con anastomosis cervical tras acondicionamiento isquémico angiográfico del tubo gástrico.
Material y métodosDiseño del estudioRealizamos un análisis retrospectivo de la base de datos prospectiva de todos los pacientes derivados para acondicionamiento gástrico arteriográfico desde enero de 2001 hasta enero de 2014 en la Unidad de Cirugía Esofágica del Hospital Universitari de Bellvitge.
Criterios de inclusiónTodos los pacientes sometidos a gastroplastia con anastomosis cervical, ya fuera inmediatamente después de una resección esofágica (procedimiento transhiatal o de McKeown) de forma.
En los casos de cáncer esofágico, la embolización se indicó después de una revaluación del estadio del cáncer esofágico por un comité de expertos. En pacientes que recibieron tratamiento neoadyuvante, la embolización se indicó una vez se descartó la progresión tumoral.
Todos los pacientes dieron su consentimiento informado sobre los riesgos y beneficios del procedimiento.
Criterios de exclusiónHasta 2009 los criterios de exclusión eran los mismos que los descritos por Akiyama et al.5: úlcera gastroduodenal, antecedentes de pancreatitis, edad superior a los 75 años o anomalía vascular conocida que excluía la oclusión angiográfica de las arterias. Desde enero de 2010, el único criterio de exclusión es el último enumerado.
Objetivos del estudioEl objetivo principal del estudio fue analizar la incidencia de dehiscencia anastomótica en pacientes sometidos a gastroplastia con anastomosis cervical tras acondicionamiento isquémico angiográfico del tubo gástrico.
Los objetivos secundarios fueron el éxito del acondicionamiento, las complicaciones durante dicho procedimiento y el posoperatorio, y la estancia hospitalaria postacondicionamiento.
VariablesLos datos descriptivos incluyeron las características demográficas, comorbilidades (cardiopatía, enfermedad pulmonar, insuficiencia renal), diagnóstico etiológico y tipo de técnica quirúrgica empleada.
Definimos el resultado de acondicionamiento como: técnica completa para la correcta embolización de las 3 arterias (AGI, AGD, AE), técnica incompleta para una o 2 arterias y fracaso de la técnica en caso de ninguna arteria embolizada.
La morbilidad tras la embolización incluían: pancreatitis, absceso, seudoquiste, infarto esplénico (diagnosticada mediante TC o ecografía abdominal y que requería algún tratamiento), isquemia hepática (diagnosticada mediante TC o ecografía abdominal), hemorragia, disección arterial y seudoaneurisma arterial.
Mortalidad postoperatoria: durante la hospitalización y/o en los 30 días posteriores a la cirugía.
Las morbilidades mayores y menores tras el procedimiento quirúrgico se evaluaron de acuerdo con la clasificación Clavien-Dindo20. Estas incluyen: complicaciones pulmonares, quilotórax (diagnosticado macroscópicamente o mediante análisis bioquímico), infección de la herida, disfonía, íleo paralítico (que conlleva algún tratamiento y hemorragia (hemotórax, hemoperitoneo).
La dehiscencia de la anastomosis esofagogástrica se consideró cuando se presentaron una o más de las siguientes condiciones: confirmación radiológica mediante un estudio con contraste hidrosoluble o TC toracoabdominal con contraste oral de la dehiscencia de la anastomosis esofagogástrica, salida por el drenaje torácico de contenido esofagogástrico o azul de metileno, confirmación por el cirujano durante una reintervención, confirmación endoscópica de la dehiscencia anastomótica.
Se consideró dehiscencia anastomótica esofagogástrica de tipo IV (isquemia de la plastia)21 cuando se presentaron uno o más de los siguientes criterios: evidencia endoscópica de isquemia de la mucosa gástrica o evidencia de baja captación de la plastia en una TC toracoabdominal con contraste intravenoso que obligaba a una reintervención con exéresis de la misma.
Técnica de acondicionamiento gástricoLos pacientes se sometieron a acondicionamiento isquémico 2 semanas antes de la cirugía. Se practicó un angiograma del tronco celíaco vía acceso femoral antes y después del procedimiento.
La embolización en la raíz de la AE ayuda a mantener el riego sanguíneo del bazo a través de la circulación colateral, previniendo la necrosis esplénica. De este modo, la embolización de esta arteria se realizó inicialmente con coils de 8,89mm (0,035 pulgadas) (Cook, IN, EE.UU.), facilitada por la oclusión con balón de la AE en posición proximal (Boston Scientific, MA, EE.UU.). Se embolizó la arteria en la porción media del tronco principal utilizando una vaina de 5Fr de longitud y un dispositivo Amplatzer® (AGA Medical, MN, EE.UU.).
Asimismo, la AGI se embolizó con coils de 8,89mm y/o un dispositivo Amplatzer®, colocados desde el tronco principal hasta el primer punto de ramificación. Cuando estaban presentes ramas gástricas izquierdas (lo que ocurre a menudo cuando la AGI tiene origen en la arteria hepática izquierda), estas también se cateterizaron y embolizaron.
Dado que durante la cirugía puede ser necesario la sección de la AGD para permitir una movilización libre de tensión del tubo gástrico, preferimos embolizar también esta arteria.
Para su embolización selectiva se insertó un microcatéter vía arterógrada. Si dicho abordaje no era factible, se intentaba la cateterización retrógrada a través de la arcada en la menor curvatura con un microcatéter, insertando un catéter Simmons o Cobra de 4 o 5Fr (Terumo Europe NV, Lovaina, Bélgica) en la AGI para utilizarlo como guía. También colocamos coils o microcoils proximalmente en la arteria (desde el tronco principal hasta el primer punto de ramificación). La angiografía celíaca final confirmó tanto la embolización como la ausencia de riego sanguíneo gástrico a partir de arterias distintas de la arteria gastroepiploica derecha.
Técnica quirúrgicaEn todos los pacientes con reconstrucción esofágica inmediata (procedimiento transhiatal o de McKeown), la vía de ascenso de la plastia fue el mediastino posterior. En los pacientes con reconstrucción diferida se realizó a través del mediastino anterior.
La anastomosis cervical se realizó término-lateral manual con puntos simples y suturas reabsorbibles (VICRYL™ 3/0, Johnson & Johnson International, Lieja, Bélgica) en todos los casos.
Método estadísticoLos resultados categóricos se expresaron en forma de porcentajes. Para los análisis de la incidencia de dehiscencia se empleó la prueba de Chi-cuadrado con corrección de Fisher. El umbral de significación estadística se estableció en p<0,05.
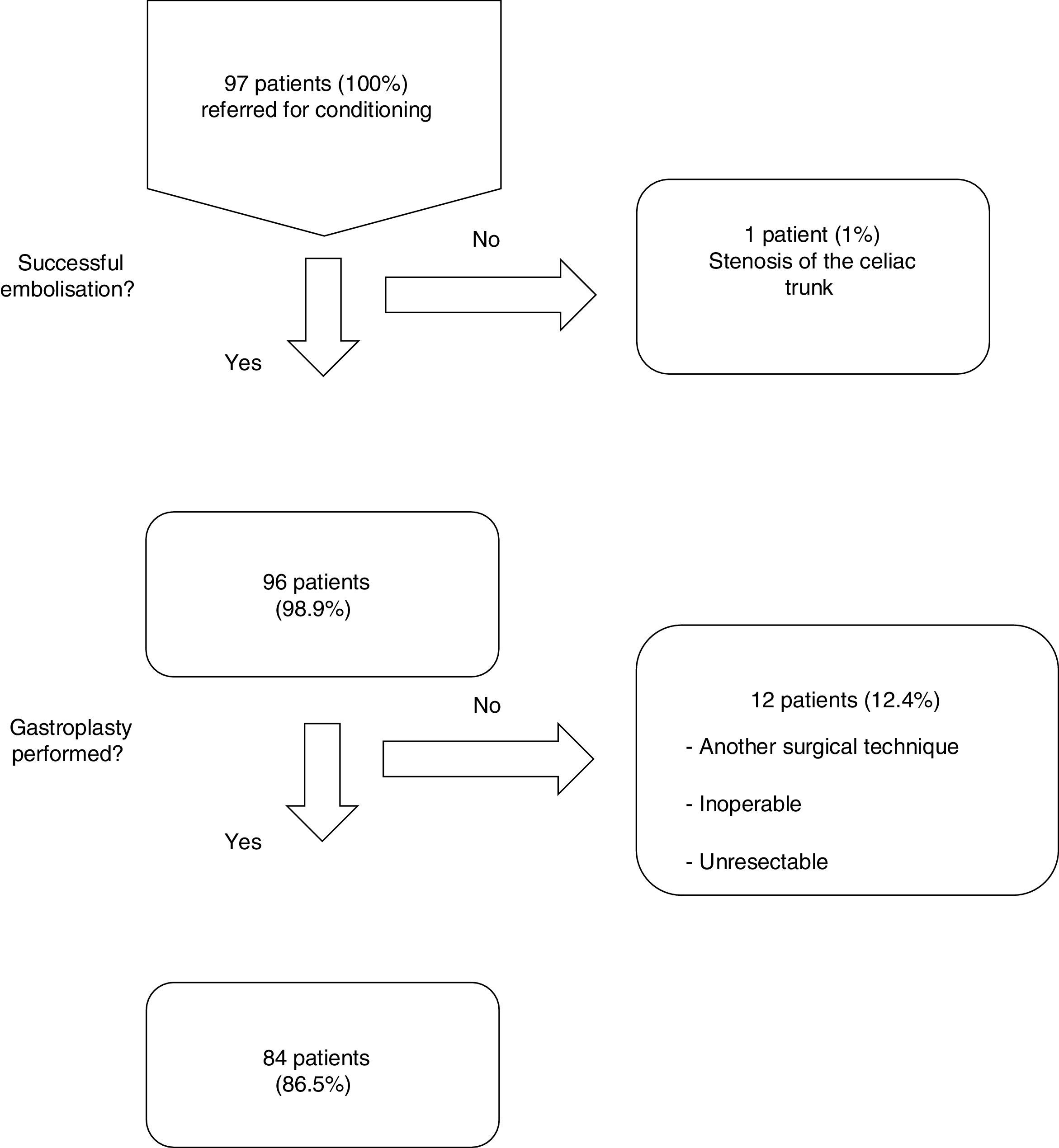
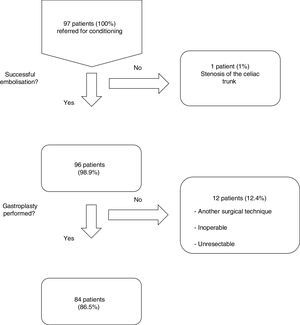
ResultadosDesde enero de 2001 hasta enero de 2014, 97 pacientes consecutivos fueron derivados para acondicionamiento isquémico del tubo gástrico previo a la realización de una gastroplastia con anastomosis cervical. De ellos, 79 (81%) eran varones y 18 (18%) mujeres, con una media de edad de 59,9±11,4 años. El diagnóstico etiológico más frecuente fue seguido de la patología benigna en los 23 restantes (tabla 1). De los 97 pacientes, sólo se practicó el procedimiento completo (gastroplastia cervical con acondicionamiento gástrico previo) en 84 (fig. 1). En 13 casos no se realizó la gastroplastia: 8 casos por inoperabilidad/irresecabilidad, 1 caso por conversión quirúrgica intraoperatoria a gastrectomía total, y en 3 casos debido a conversión a esofaguectomía transtorácica. Las técnicas quirúrgicas empleadas en los 84 pacientes fueron las siguientes: 39, esofaguectomía en 3 campos (46%); 34, esofaguectomía transhiatal (41%); y 11, reconstrucción diferida (12%).
De los 96 procedimientos que se realizaron con éxito, la embolización arterial fue completa en 80 (83%) e incompleta en 16 (17%). La causa más frecuente de embolización incompleta fue la dificultad en la cateterización de la arteria gástrica derecha, que ocurrió en 9 casos (56%). La morbilidad asociada a la técnica fue del 13% y no hubo mortalidad (tabla 2). Los casos de lesión de la arteria femoral se trataron en el mismo procedimiento arteriográfico. Los casos de pancreatitis e infarto esplénico se diagnosticaron mediante tomografía computarizada (TC) a raíz de dolor abdominal, y todos fueron tratados de forma conservadora, con evolución favorable. La estancia media hospitalaria tras el procedimiento fue de 1,3±0,6 días. El tiempo transcurrido entre el acondicionamiento gástrico y la cirugía fue de 20,4±5 días en los casos de enfermedad neoplásica.
La morbilidad postoperatoria fue del 45%. La complicación más frecuente fue la infección pulmonar en 9 casos (11%). Se observó fístula cervical en 6 pacientes (7%), que se trataron de forma conservadora con antibioterapia de amplio espectro, dieta absoluta y nutrición enteral. La etiología en 5 de los 6 pacientes con dehiscencia fue la neoplásica. En 2 casos (2%) hubo dehiscencia de tipo 421 (necrosis del tubo gástrico) que requirió exéresis de la plastia (tabla 3).
Morbilidad postoperatoria
| N.° (%) | |
|---|---|
| Neumonía | 9 (11) |
| Fuga anastomótica esofagogástrica | 6 (7) |
| Empiema | 4 (5) |
| Infección de la herida | 4 (5) |
| Atelectasia | 3 (4) |
| Isquemia del tubo gástrico | 2 (2) |
| Fuga en la línea de grapas de la gastroplastia | 2 (2) |
| Quilotórax | 2 (2) |
| Tromboembolia pulmonar | 2 (2) |
| Disfonía | 1 (1) |
| Íleo paralítico | 1 (1) |
| Hemotórax | 1 (1) |
| Hemoperitoneo | 1 (1) |
| Clasificación de Clavien-Dindo | |
| Grado I | 9 (11) |
| Grado II | 6 (7) |
| Grado IIIa | 6 (7) |
| Grado IIIb | 8 (9) |
| Grado IV | 3 (3) |
| Grado V | 6 (7) |
La mortalidad postoperatoria fue del 7%.
Cuando comparamos la incidencia de dehiscencia anastomótica entre los grupos que se habían sometido a acondicionamiento completo con aquellos que habían recibido acondicionamiento incompleto, no observamos diferencias significativas. Los 6 pacientes que presentaron deshidencia pertenecían al grupo de acondicionamiento completo.
DiscusiónLa reconstrucción del conducto esofágica mediante gastroplastia es una técnica con un elevado riesgo de isquemia, debido a la movilización y devascularización gástrica para la creación de la plastia1,4. Esto conlleva un alto riesgo de dehiscencia anastomótica.
En 2002, Schröder et al. estudiaron los cambios en la microcirculación gástrica asociados a la formación del tubo gástrico en un modelo animal con cerdos3, mostrando una reducción significativa (p<0,0001) de la perfusión tisular y la presión tisular parcial de oxígeno a nivel de fundus gástrico del tubo gástrico que se había creado.
Para resolver este problema se han realizado numerosos estudios sobre el acondicionamiento isquémico del tubo gástrico. Investigaciones realizadas en modelos animales han notificado sus beneficios cuando se realiza antes de la creación del tubo gástrico. En 1995, Urschel mostró una recuperación significativa y gradual de la perfusión del tejido gástrico, de hasta el 81% del valor basal, 14 días después de la ligadura vascular (delay phenomenon) en ratas22.
Sin embargo, el papel del acondicionamiento gástrico es en la actualidad objeto de debate. En un metaanálisis reciente19 sobre 1.215 pacientes, no se observaron diferencias en la incidencia dehiscencia anastomótica entre el grupo con acondicionamiento gástrico y el grupo de control. Sin embargo, sí se observó (aunque es necesario un análisis más exhaustivo) que las dehiscencias en el grupo acondicionado tenían menos repercusión clínica con menor necesidad de reintervención que en el grupo control. Los autores recomendaron el uso de esta técnica solo en aquellos pacientes con un mayor riesgo medio de dehiscencia (calcificación aórtica o cuando las mediciones intraoperatorias muestran mala perfusión del fundus gástrico tras la ligadura arterial). No obstante, al analizar los 5 estudios que comprenden 245 pacientes sobre los que se basan los resultados del acondicionamiento arteriográfico, estos incluyen esofaguectomías con anastomosis cervical e intratorácica. Nuestra serie incluye anastomosis cervical exclusivamente, porque es donde creemos que el beneficio del acondicionamiento arteriográfico podría ser mayor.
También es motivo de controversia el tiempo de espera para construir el tubo gástrico. Nuestro grupo (Lamas et al.) basándonos en nuestro estudio experimental, considera el momento óptimo 15 días después del acondicionamiento23, lo que está en consonancia con los resultados descritos por Urschel22. En línea con esos resultados, todos los pacientes de nuestra serie fueron operados como mínimo 15 días después de la embolización, con una media de 20,4±5,0 días en los pacientes con enfermedad neoplásica. Sin embargo, otros grupos consideran que la formación del tubo gástrico es segura y eficaz a los 3-7 días12. Kechagias et al.19 observaron mejores resultados con el acondicionamiento gástrico arteriográfico en comparación con la ligadura arterial laparoscópica, debido en parte al breve intervalo transcurrido entre el acondicionamiento gástrico y la esofaguectomía en el grupo de acondicionamiento laparoscópico.
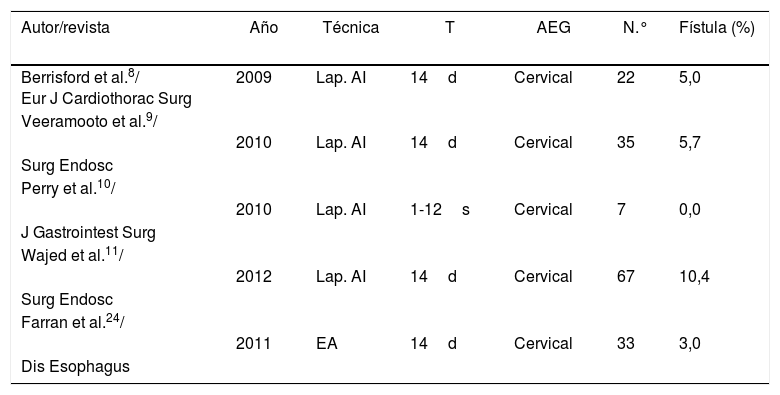
En 2011, nuestro grupo publicó los resultados de morbimortalidad y dehiscencia anastomótica en 33 pacientes tras acondicionamiento isquémico para gastroplastia con anastomosis cervical24. La morbilidad global asociada al acondicionamiento fue del 18%, con un 3% de fístula cervical. En la presente serie, la morbilidad ha descendido al 13%, probablemente gracias a la mayor experiencia de los angiorradiólogos. La dehiscencia se sitúa en el 7,1%, sin haber modificado el procedimiento de acondicionamiento gástrico o la técnica quirúrgica. Estos resultados son comparables a los de otros grupos con acondicionamiento, con una dehiscencia que varía entre el 011 y el 10%11 (tabla 4). En el metaanálisis de Boshier et al. sobre 1.777 pacientes sometidos a esofaguectomía transhiatal con anastomosis cervical sin acondicionamiento gástrico la incidencia de dehiscencia anastomótica fue del 17%(25). Recientemente, algunos grupos han desarrollado otras técnicas para evaluar la vascularización de la plastia gástrica de forma intraoperatoria, como el verde de indocianina. El objetivo no es mejorar la vascularización de la plastia, sino comprobar su irrigación y decidir cuál es el lugar óptimo para realizar la anastomosis. En este sentido, aunque algunos autores26 han publicado resultados alentadores (dehiscencia del 0%)). Una reciente revisión27 sobre pacientes a los que se aplica el verde de indocianina reporta una dehiscencia del 14%, aunque sin incluir estudios aleatorizados. A pesar de ser una herramienta prometedora, son necesarios ensayos controlados y aleatorizados para analizar su beneficio.
Publicaciones sobre acondicionamiento gástrico isquémico con anastomosis cervical
| Autor/revista | Año | Técnica | T | AEG | N.° | Fístula (%) |
|---|---|---|---|---|---|---|
| Berrisford et al.8/ Eur J Cardiothorac Surg | 2009 | Lap. AI | 14d | Cervical | 22 | 5,0 |
| Veeramooto et al.9/ | 2010 | Lap. AI | 14d | Cervical | 35 | 5,7 |
| Surg Endosc | ||||||
| Perry et al.10/ | 2010 | Lap. AI | 1-12s | Cervical | 7 | 0,0 |
| J Gastrointest Surg | ||||||
| Wajed et al.11/ | 2012 | Lap. AI | 14d | Cervical | 67 | 10,4 |
| Surg Endosc | ||||||
| Farran et al.24/ | 2011 | EA | 14d | Cervical | 33 | 3,0 |
| Dis Esophagus |
AEG: anastomosis esofagogástrica; AI: acondicionamiento isquémico; EA: embolización arteriográfica; T: tiempo.
En cuanto a la técnica para realizar el acondicionamiento isquémico, hay autores que abogan por el abordaje laparoscópico (tabla 4). Nuestro grupo considera que el acondicionamiento isquémico vía arteriográfica es un procedimiento seguro con una morbilidad aceptable (tabla 2) y una elevada eficacia (1% de fracasos). Es cierto que tras la embolización con coils se origina una periarteritis local, que dificulta la disección de los troncos arteriales durante la cirugía. Sin embargo, esto no ha implicado una mayor morbilidad intraoperatoria (sangrado intraoperatorio), sino sólo una disección más laboriosa al estar las arterias ya ocluidas. Además, el acondicionamiento gástrico laparoscópico requiere 2 procedimientos quirúrgicos.
Las limitaciones de este estudio residen en su naturaleza descriptiva no comparativa. Son necesarios ensayos aleatorizados para conocer el beneficio real de la embolización en la prevención de la dehiscencia anastomótica cervical.
La contribución más interesante del presente estudio es que se trata de la serie publicada con el mayor número de pacientes intervenidos de gastroplastia cervical y acondicionamiento arteriogáfico previo, mostrando una baja morbilidad de esta técnica. A diferencia de los estudios publicados anteriormente, nuestra serie se centra en pacientes sometidos a gastroplastia con anastomosis cervical, ya que creemos que esta es la anastomosis con mayor riesgo de dehiscencia25.
ConclusionesEn nuestra serie, la incidencia de dehiscencia anastomótica en pacientes sometidos a gastroplastia con anastomosis cervical tras acondicionamiento isquémico angiográfico es del 7%.
El acondicionamiento isquémico del tubo gástrico mediante embolización arterial angiográfica es un procedimiento con morbilidad aceptable.
Son necesarios estudios prospectivos aleatorizados para demostrar sus beneficios en la prevención de la dehiscencia anastomótica esofagogástrica.
AutoríasMònica Miró: análisis de datos, autor redactor y revisión de la versión final.
Leandre Farran: diseño del estudio, autor redactor y revisión crítica.
Fernando Estremiana: recogida de datos y análisis de datos.
Jordi Miquel y Elena Escalante: recogida de datos y diseño del manuscrito.
Humberto Aranda y Carla Bettonica: recogida de datos, análisis de datos e interpretación de los resultados.
Maica Galán: revisión crítica y diseño del estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.