La asociación de quimiorradioterapia preoperatoria y cirugía endoscópica transanal en el cáncer rectal T2-T3 superficial presenta resultados prometedores en pacientes seleccionados. El objetivo principal es evaluar la recurrencia locorregional y sistémica a largo plazo y los objetivos secundarios son aportar resultados de morbilidad postoperatoria y la correlación entre la respuesta patológica completa y clínica completa.
MétodosEstudio observacional retrospectivo de una serie consecutiva de pacientes diagnosticados de cáncer de recto T2-T3 superficial, N0, M0 que se trataron con quimiorradioterapia neoadyuvante y escisión transanal del tumor (2008-2016). Se recogieron los datos de forma prospectiva. El tratamiento consistió en quimioterapia preoperatoria (5-fluorouracilo o capecitabina) combinada con radioterapia (50,4Gy) y cirugía endoscópica transanal tras 8semanas. Se analizaron las variables preoperatorias, quirúrgicas, patológicas y los resultados oncológicos a largo plazo.
ResultadosDe los 24 pacientes incluidos, 2requirieron rescate a cirugía radical por resultados patológicos desfavorables. Con un seguimiento mediano de 45 meses, se observó recurrencia local en un paciente (4,5%) y 2pacientes presentaron recurrencias sistémicas (9%). La respuesta clínica tumoral completa se logró en 12 pacientes (50%) y la respuesta patológica tumoral completa en 9 pacientes (37,5%). Las complicaciones postoperatorias se apreciaron en 5 pacientes (20,8%), todas leves excepto una. No hubo mortalidad postoperatoria.
ConclusionesEn este estadio del cáncer rectal, nuestros resultados parecen apoyar esta estrategia, principalmente cuando se logra una respuesta patológica tumoral completa. La respuesta clínica tumoral completa no coincide con la respuesta patológica tumoral. Se deben llevar a cabo estudios prospectivos aleatorizados para estandarizar este tratamiento.
The association of preoperative chemoradiotherapy and transanal endoscopic surgery in T2 and superficial T3 rectal cancers presents promising results in selected patients. The main objective is to evaluate the long-term loco-regional and systemic recurrence and, as secondary objectives, to provide results of postoperative morbidity and the correlation between complete clinical and pathological response.
MethodsThis is a retrospective observational study including a consecutive series of patients with T2-T3 superficial rectal cancer, N0, M0 who refused radical surgery (2008-2016). The treatment consisted of preoperative chemotherapy (5-fluorouracil or capecitabine) combined with radiotherapy (50, 4Gy) and transanal endoscopic surgery after 8weeks. Preoperative, surgical, pathological and long-term oncologic results were analyzed.
ResultsTwenty-four patients were included in the study. Two of them required rescue radical surgery for unfavorable pathological results. A local recurrence (4.5%) was observed and 2patients presented systemic recurrence (9%), with a median follow-up of 45 months. A complete clinical tumor response was achieved in 12 patients (50%), and complete pathological tumor response in 9 patients (37.5%). Postoperative complications were observed in 5 patients (20.8%), and they were mild except one. There was no postoperative mortality.
ConclusionsIn this stage of rectal cancer, our results seem to support this strategy, mainly when a complete pathological response is achieved. The complete clinical tumor response does not coincide with the pathological tumor response. Randomized prospective studies should be performed to standardize this treatment.
La cirugía local del cáncer de recto con estadio clínico T2-T3 superficial (T2-3s), N0, M0 está limitada por su afectación ganglionar, que alcanza un 12-28%1. La recidiva tras la exéresis local se encuentra con valores superiores al 20%, considerados no admisibles. Recientes metaanálisis sobre la cirugía local en estos tumores combinada con tratamiento adyuvante no mejoran excesivamente los resultados (11-19%)2. Por ello, el tratamiento de elección para el cáncer de recto T2-3s, N0, M0 en el tercio medio e inferior sigue siendo la escisión total del mesorrecto (ETM), con cifras de recurrencia local entre el 2 y el 11% y sistémica entre el 2 y el 13%. Sin embargo, la tasa de morbilidad y mortalidad asociada a esta técnica es alta, del 30-40 y 2%, respectivamente3.
Durante casi una década, la combinación de quimiorradioterapia (QRT) preoperatoria y escisión local se ha propuesto como alternativa menos agresiva que la ETM, con resultados similares4,5. Sin embargo, varias de las cuestiones aún siguen sin respuesta, como, por ejemplo, confirmar si existe un mayor porcentaje de respuesta patológica tumoral completa (RPTC) tras la QRT en los estadios precoces del adenocarcinoma de recto, y si obtiene resultados oncológicos favorables6,7. Debemos, además, establecer si la respuesta clínica tumoral completa (RCTC) permite una política de «esperar y ver», o si es necesario confirmar la RPTC mediante la realización de la resección local8. El objetivo principal de nuestro estudio es evaluar la recurrencia locorregional y sistémica a largo plazo en pacientes con cáncer de recto T2-3s tratado con QRT y escisión local. Como objetivos secundarios, aportar resultados sobre la morbilidad postoperatoria y apreciar la correlación entre la RPTC y la RCTC.
MétodosEstudio observacional retrospectivo que incluye una serie consecutiva de pacientes diagnosticados de cáncer de recto T2-3s, N0, M0, desde 2008 hasta 2016. Se recogieron los datos de forma prospectiva. La descripción del estudio ha seguido las directrices de Strengthening the reporting of observational studies in epidemiology (STROBE) para estudios de cohortes9. Los pacientes tributarios a cirugía endoscópica transanal fueron tratados según el protocolo de nuestra Unidad, previamente descrito10. Los tumores T3 se subdividen en 2grupos: superficiales (T3s) con invasión del mesorrecto ≤5mm y profundos11. Se considera el T3s con el mismo pronóstico que el T2, por lo que ambos se asocian en el mismo grupo. Como se ha descrito en estudios previos, los pacientes intervenidos con escisión local se clasificaron en 5grupos de tratamiento preoperatorio10: grupo I (intención curativa): adenomas con estadio clínico (c), cT0, cN0 (tumores benignos); grupo II (también con intención curativa): adenocarcinomas, de bajo grado estadios cT0-1, cN0; grupo III (grupo de consenso): adenocarcinomas de bajo a moderado grado de diferenciación, cT2-T3s, cN0; grupo IV (intención paliativa) y grupo V (indicación atípica).
En el presente análisis se incluyeron los pacientes del grupo III que rechazaron la cirugía radical y aceptaron escisión local tras consentimiento informado. Se excluyeron los pacientes del grupo III incluidos en el ensayo clínico prospectivo multicéntrico4, rechazo de la estrategia de tratamiento indicado u otra clasificación preoperatoria.
La QRT preoperatoria establecida fue 5-fluorouracilo o capecitabina. El 5-fluorouracilo se administró por vía intravenosa en infusión continua a una dosis de 300mg/m2 al día, 5días a la semana durante 5semanas. La capecitabina se administró por vía oral cada 12 h a una dosis de 825mg/m2 durante los días de radioterapia. La radioterapia preoperatoria se administró en fracciones diarias de 1,8Gy 5días a la semana durante 5semanas, de acuerdo con el protocolo estándar12. La dosis total fue de 45Gy más un plus de 5,4Gy en el área del tumor (total 50,4Gy). La morbimortalidad de la neoadyuvancia fue seguida hasta el día 30 después de la cirugía según los criterios de la Common terminology criteria for adverse events (CTCAE)13. En la séptima semana se evaluó la respuesta clínica que se define según la diferencia de tamaño entre la resonancia magnética y la rectoscopia pre- y post-QRT: reducción de ≤50%, reducción de>50% y ausencia de lesión14.
La cirugía se realizó 8semanas después del final de la QRT. Las técnicas utilizadas para la escisión local fueron de forma indistinta la microcirugía endoscópica transanal (TEM, Richard Wolf, Knittlingen, Alemania)15 o la operación endoscópica transanal (TEO, Karl Storz GmbH, Tüttlingen, Alemania). En todos los casos, la escisión fue del espesor total de la pared rectal, como se ha descrito previamente10. Se cerraron todos los defectos mediante sutura continua, siempre y cuando estuvieran sin tensión, en tal caso se realizaron suturas parciales. La morbilidad postoperatoria fue registrada después de 30 días utilizando el sistema de clasificación Dindo-Clavien16.
El estudio anatomopatológico se llevó a cabo por el mismo patólogo en todos los casos. Se registraron los siguientes datos: tamaño de la lesión (diámetro máximo y mínimo en mm), grado de diferenciación del adenocarcinoma, grado de respuesta a la QRT según el grado de regresión (GR) de Bouzourene17, estadio del tumor después de la radioterapia (ypT), presencia de infiltración venosa, linfática o perineural y márgenes de la pieza quirúrgica (márgenes laterales y profundos en mm). Los tipos de resección (R) se clasificaron de la siguiente manera: R0 (escisión con márgenes >1mm); R≤1 (márgenes ≤1mm); Rx (fragmentación de la pieza quirúrgica sin márgenes definidos) y R1 (márgenes afectados)18.
La ausencia de respuesta patológica o estadio superior (≥ypT3s o GR4) en la pieza de resección aconsejó el rescate quirúrgico a cirugía radical entre las 4 y 6 semanas de la cirugía. El seguimiento de los pacientes comprendió la realización de rectosigmoidoscopia-biopsia y determinación de CEA cada 4meses durante el primer y segundo años. Las mismas pruebas cada 6meses del tercer al quinto año. Colonoscopia completa, TC abdominal y resonancia magnética pélvica anualmente hasta el quinto año. El estudio se halla inscrito en el Research Registry UIN: researchregistry256 y fue aprobado por el Cómité de Ética local.
Para la descripción de las variables se utilizó la versión 20 del programa SPSS (Statistical Package for the Social Sciences, Inc, Chicago, Illinois, EE. UU.). Las variables cuantitativas se expresaron como medias con desviación estándar e intervalo de confianza del 95% cuando presentan una distribución normal. En caso contrario, se calcularon la mediana y rango. Las variables categóricas se expresan como números absolutos y porcentajes. No existen datos perdidos («missing data») debido a la introducción prospectiva de los datos. La supervivencia acumulada sin recidiva local, supervivencia libre de enfermedad y global se estimó con el método actuarial y las curvas de Kaplan-Meier.
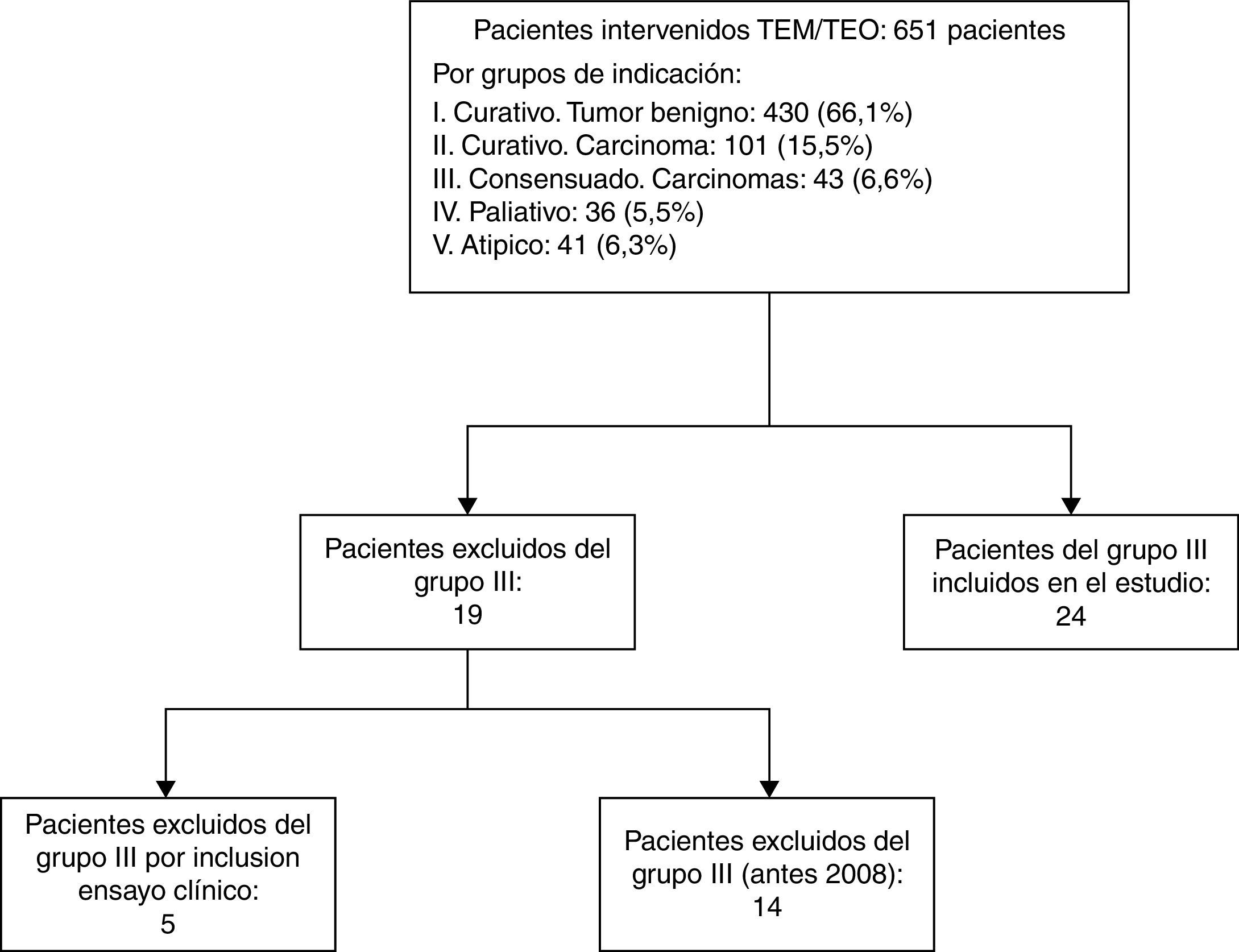
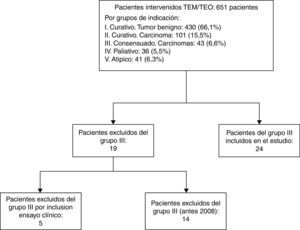
ResultadosEntre junio de 2004 y junio de 2016, 651 pacientes fueron intervenidos en nuestra unidad mediante TEM/TEO. En la figura 1 se describe el diagrama de flujo de los pacientes por grupos de indicación terapéutica. En 2008, debido a los malos resultados del grupo III respecto al tratamiento mediante TEM/TEO y adyuvancia4, se decidió que aquellos pacientes pertenecientes a este grupo que no aceptaban la indicación estándar de cirugía radical fueran tratados mediante QRT y cirugía local. De los 43 pacientes del grupo III, 14 fueron operados entre 2004 y 2008, 5fueron incluidos en el ensayo clínico multicéntrico y los 24 pacientes restantes fueron analizados en este estudio.
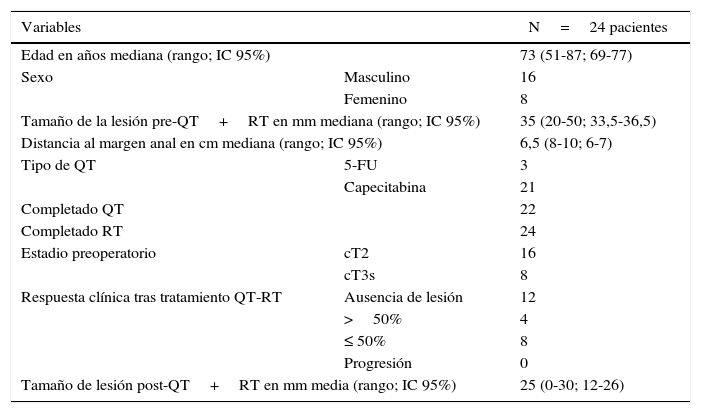
Las características demográficas de estos 24 pacientes que han recibido QRT y TEM/TEO se muestran en la tabla 1. La mayoría de los pacientes (21 de los 24) recibieron capecitabina como quimioterapia. Todos los pacientes finalizaron la neoadyuvancia, excepto 2 que no finalizaron la quimioterapia debido a efectos adversos severos. Fueron diagnosticados de cT2 16 pacientes. Tras QRT se observó RCTC en 12 de los 24 pacientes (50%) y en ningún paciente se apreció progresión de la enfermedad.
Características demográficas y lesiones de los pacientes
| Variables | N=24 pacientes | |
|---|---|---|
| Edad en años mediana (rango; IC 95%) | 73 (51-87; 69-77) | |
| Sexo | Masculino | 16 |
| Femenino | 8 | |
| Tamaño de la lesión pre-QT+RT en mm mediana (rango; IC 95%) | 35 (20-50; 33,5-36,5) | |
| Distancia al margen anal en cm mediana (rango; IC 95%) | 6,5 (8-10; 6-7) | |
| Tipo de QT | 5-FU | 3 |
| Capecitabina | 21 | |
| Completado QT | 22 | |
| Completado RT | 24 | |
| Estadio preoperatorio | cT2 | 16 |
| cT3s | 8 | |
| Respuesta clínica tras tratamiento QT-RT | Ausencia de lesión | 12 |
| >50% | 4 | |
| ≤ 50% | 8 | |
| Progresión | 0 | |
| Tamaño de lesión post-QT+RT en mm media (rango; IC 95%) | 25 (0-30; 12-26) | |
5-FU: 5-fluorouracilo; cT2: estadio clínico T2; cT3: estadio clínico T3; IC 95%: intervalo de confianza del 95%; RT: radioterapia; QT: quimioterapia.
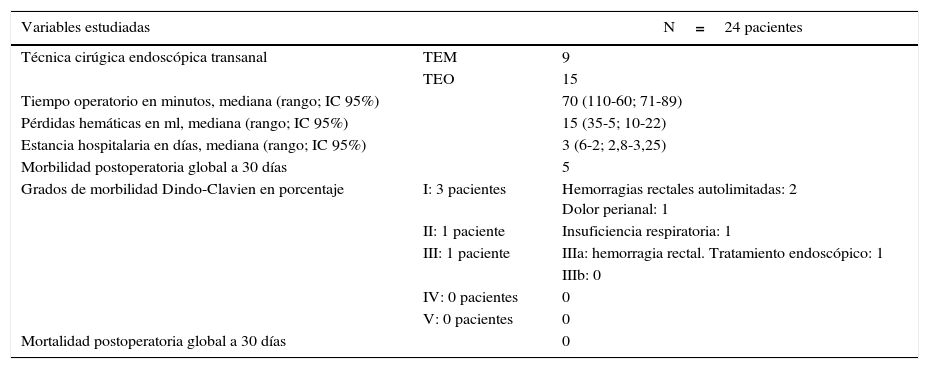
La cirugía mediante TEM/TEO fue realizada de forma indistinta con una u otra técnica. El tiempo mediano fue ligeramente superior a la hora, con mínimas pérdidas hemáticas durante el procedimiento. Ningún paciente necesitó reconversión a cirugía abdominal. La estancia hospitalaria media fue de 3 días. Solo 5pacientes de 24 sufrieron morbilidad postoperatoria a 30 días según la clasificación de Dindo-Clavien16 y solo un paciente tuvo una complicación del tipo iiia, que necesitó tratamiento endoscópico para control del sangrado quirúrgico. Ningún paciente sufrió complicaciones grado IV ni V (tabla 2).
Variables intraoperatorias, morbilidad postoperatoria y seguimiento
| Variables estudiadas | N=24 pacientes | |
|---|---|---|
| Técnica cirúgica endoscópica transanal | TEM | 9 |
| TEO | 15 | |
| Tiempo operatorio en minutos, mediana (rango; IC 95%) | 70 (110-60; 71-89) | |
| Pérdidas hemáticas en ml, mediana (rango; IC 95%) | 15 (35-5; 10-22) | |
| Estancia hospitalaria en días, mediana (rango; IC 95%) | 3 (6-2; 2,8-3,25) | |
| Morbilidad postoperatoria global a 30 días | 5 | |
| Grados de morbilidad Dindo-Clavien en porcentaje | I: 3 pacientes | Hemorragias rectales autolimitadas: 2 Dolor perianal: 1 |
| II: 1 paciente | Insuficiencia respiratoria: 1 | |
| III: 1 paciente | IIIa: hemorragia rectal. Tratamiento endoscópico: 1 | |
| IIIb: 0 | ||
| IV: 0 pacientes | 0 | |
| V: 0 pacientes | 0 | |
| Mortalidad postoperatoria global a 30 días | 0 |
IC 95%: intervalo de confianza del 95%; TEM: transanal endoscopic micro surgery; TEO: transanal endoscopic operation.
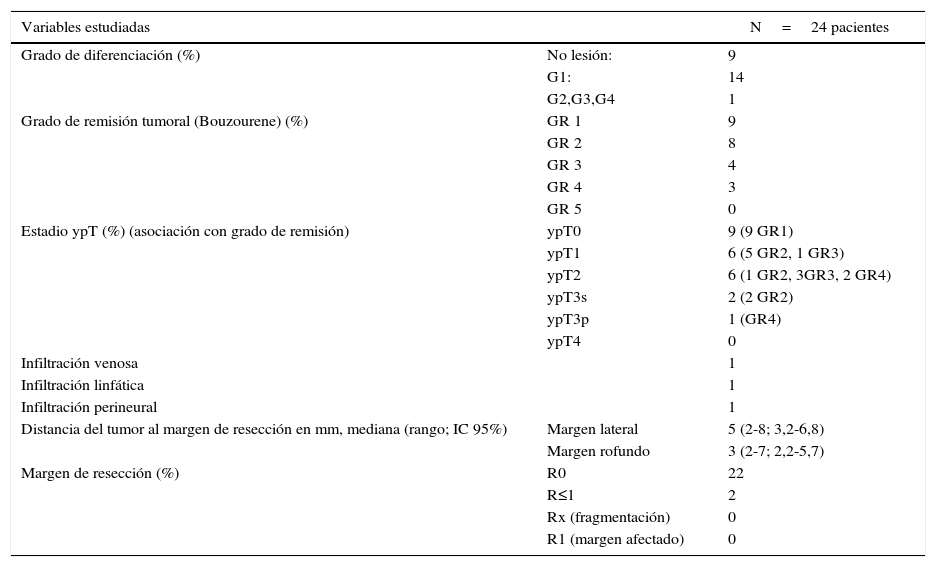
En la tabla 3 se describen las características anatomopatológicas de las lesiones. No existieron márgenes afectos ni fragmentación de la pieza en la serie estudiada. Únicamente en 2pacientes los márgenes fueron inferiores a 1mm. Se halló RPTC (ypT0) en 9 de los 24 pacientes, que corresponde al 37,5%. Se encontró ausencia de tumor residual (GR1) o células tumorales residuales (GR2) en 17 de los 24 pacientes. No se encontró progresión tumoral en ningún paciente (GR5), comparado con la resonancia magnética preoperatoria. En los 2pacientes que no finalizaron la neoadyuvancia, uno presentó un GR2 con ypT1, el otro un GR4 ypT2.
Características anatomopatológicas de las lesiones
| Variables estudiadas | N=24 pacientes | |
|---|---|---|
| Grado de diferenciación (%) | No lesión: | 9 |
| G1: | 14 | |
| G2,G3,G4 | 1 | |
| Grado de remisión tumoral (Bouzourene) (%) | GR 1 | 9 |
| GR 2 | 8 | |
| GR 3 | 4 | |
| GR 4 | 3 | |
| GR 5 | 0 | |
| Estadio ypT (%) (asociación con grado de remisión) | ypT0 | 9 (9 GR1) |
| ypT1 | 6 (5 GR2, 1 GR3) | |
| ypT2 | 6 (1 GR2, 3GR3, 2 GR4) | |
| ypT3s | 2 (2 GR2) | |
| ypT3p | 1 (GR4) | |
| ypT4 | 0 | |
| Infiltración venosa | 1 | |
| Infiltración linfática | 1 | |
| Infiltración perineural | 1 | |
| Distancia del tumor al margen de resección en mm, mediana (rango; IC 95%) | Margen lateral | 5 (2-8; 3,2-6,8) |
| Margen rofundo | 3 (2-7; 2,2-5,7) | |
| Margen de resección (%) | R0 | 22 |
| R≤1 | 2 | |
| Rx (fragmentación) | 0 | |
| R1 (margen afectado) | 0 | |
G: grado de diferenciación; GR 1: sin evidencia de tumor residual; GR 2: pocas células tumorales residuales; GR 3: predominio de fibrosis sobre células tumorales; GR 4: predominio de tumor sobre fibrosis; GR 5: sin regresión del tumor; R≤1: margen de resección ≤1mm; R0: margen de resección>1mm; R1: margen de resección afectado por el tumor; Rx: fragmentación de la pieza; ypT: estadio patológico del tumor tras QT+RT.
La mediana de seguimiento de la serie fue de 45 meses (tabla 4). A 4pacientes con resultados patológicos desfavorables se les aconsejó ETM de rescate. Dos de ellos lo rechazaron (ypT3s), los otros 2(ypT2-GR4 e ypT3profundo GR4) fueron rescatados mediante cirugía radical, por lo que el total de seguimiento de QRT y cirugía local es sobre 22 pacientes. En el primero de ellos se realizó una resección abdominoperineal con resultado de la pieza pT0, pN1. En el segundo, se realizó resección anterior baja e ileostomía, con resultado anatomopatológico de pT0, pN0, hasta la fecha ambos siguen libres de enfermedad.
Resultados oncológicos a largo plazo tras neoadyuvancia+TEM/TEO
| Seguimiento | |
|---|---|
| Tiempo en meses, mediana (rango; IC 95%) | 45 (1-108; 31,6-52,4) |
| Recurrencias locales (pacientes) | 1 |
| Recurrencias sistémicas (pacientes) | 2 |
| Rescate (pacientes) | 2 |
| Mortalidad (pacientes) | 4 |
| Mortalidad por cáncer de recto (pacientes) | 2 |
| Libres de enfermedad (pacientes) | 20 |
Un total de 22 pacientes analizados.
Solo uno de los 22 pacientes presentó una recidiva local (4,5%). Esta fue una paciente de 85 años que finalizó su tratamiento de neoadyuvancia sin incidencias; la exéresis de la lesión fue de pared completa con márgenes de resección mínimo lateral y profundo de 8mm y 4mm, respectivamente. Su estudio anatomopatológico fue de ypT1, sin factores de mal pronóstico. Presentó la recidiva al primer control de los 4 meses. Se realizó resección anterior baja mediante NOTES-transanal con ileostomía de protección, sin incidencias. Dos pacientes (9%) que completaron la neoadyuvancia con estadio ambos de ypT2 (GR2 y GR3) desarrollaron múltiples metástasis a los 8 y 12 meses del postoperatorio y fallecieron al año y medio y 2años, respectivamente.
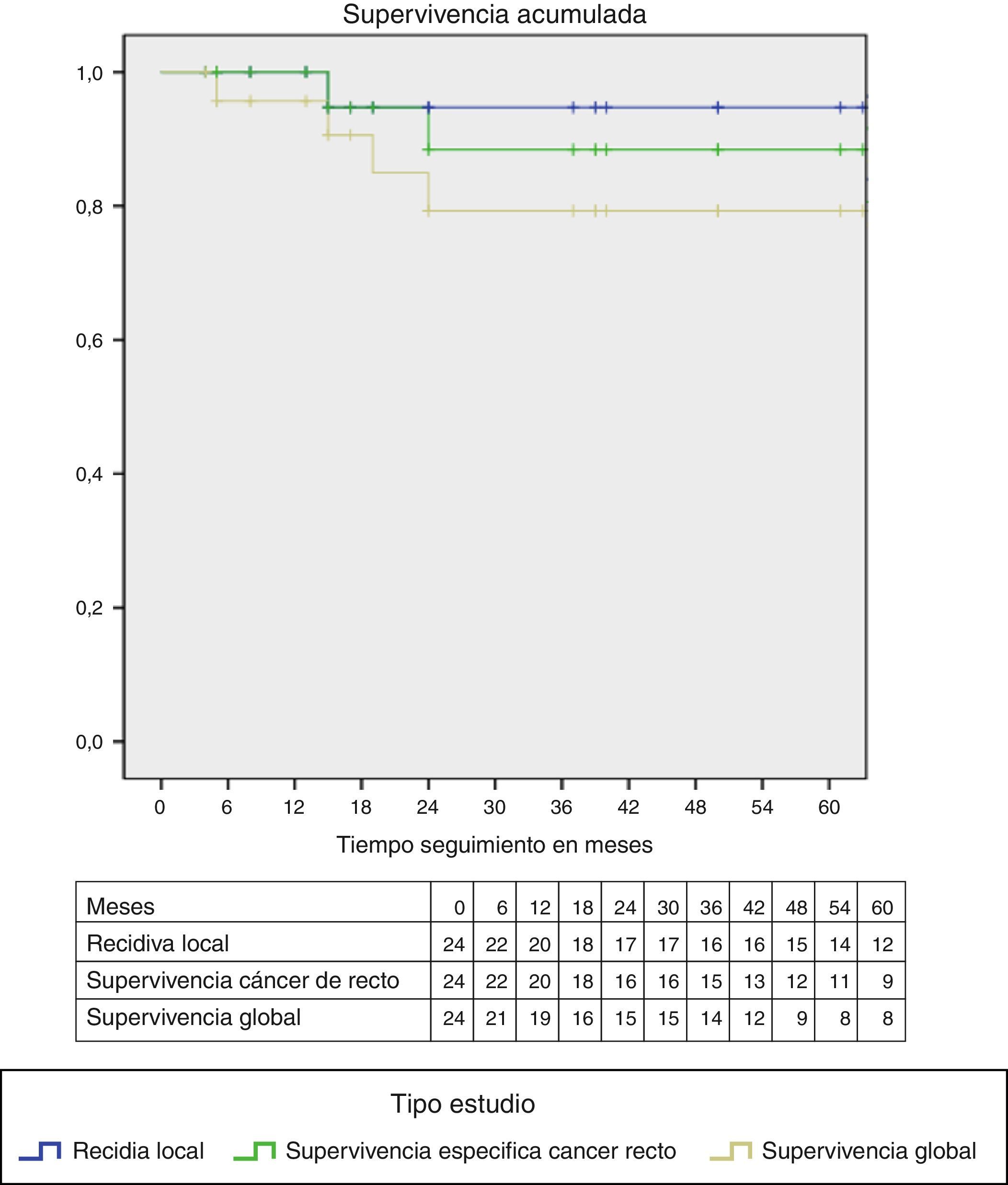
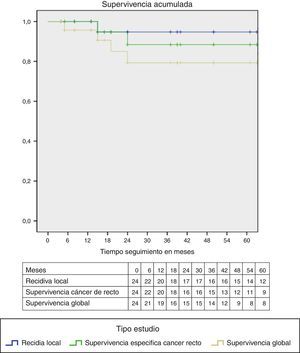
Dos pacientes fallecieron por causas diferentes al cáncer de recto. En la figura 2 se aprecian las curvas de Kaplan-Meier, que muestran una curva de supervivencia acumulada al final del periodo de seguimiento con ausencia de recidiva local del 90%, supervivencia específica del cáncer de recto del 88% y global del 79%.
DiscusiónEl objetivo principal después del tratamiento neoadyuvante es lograr la RPTC. Los valores de RPTC publicados en la literatura para el cáncer de recto localmente avanzados oscilan entre el 15 y el 27%19. En el T2 y T3 varían ampliamente, entre el 11,7 y el 73%32. En nuestro estudio hallamos 9 de 24 pacientes (37,5%), lo que está dentro del rango de valores publicados y es superior a la media del cáncer localmente avanzado. La gran mayoría de estas RPTC han sido publicadas en la literatura con ciclos largos de QRT, similares al descrito en nuestro estudio. Los ciclos cortos de QRT no obtienen los mismos resultados, con una mayor morbilidad postoperatoria20. Se deben tener en cuenta los efectos adversos relacionados con la toxicidad de la QRT, como hemos publicado previamente21. En nuestra serie, 2pacientes tuvieron que abandonar el tratamiento. Algunos autores han cambiado los esquemas de QRT en un intento por mejorar los resultados de la RPTC. Por ejemplo, combinando capecitabina en dosis estándar y oxaliplatino con radioterapia, García Aguilar et al.22 alcanzaron una tasa de RPTC del 48%. Sin embargo, el 44% de los pacientes presentaron efectos adversos de grado ≥3 que obligaron a una reducción de la dosis de capecitabina. Con la dosis reducida, se obtuvo una tasa de RPTC del 36% y la incidencia de efectos adversos de grado ≥3 cayó al 30%. Una reciente publicación sobre los resultados de este estudio, con una media de seguimiento de 56 meses, observa que, sobre 79 pacientes, se da un 6% de metástasis a distancia y un 4% de recurrencia local23.
La RCTC no siempre coincide con la RPTC. En nuestra serie, 12 pacientes (50%) presentaron RCTC con respecto a 9 de 24 pacientes (37,5%) que presentaron RPTC. Teniendo en cuenta nuestra experiencia, 3 pacientes de 24 considerados con RCTC hubieran recidivado si hubiéramos considerado la política del «esperar y ver», por lo que consideramos esta estrategia peligrosa y que actualmente se debe realizar la exéresis de la lesión para confirmar la RPTC. Existen estudios que han intentado determinar factores predictivos (clínicos, radiológicos) de RPTC, sin poder dar conclusiones definitivas22,24,25. En nuestras indicaciones, incluyendo el T3s, hemos obtenido resultados similares a los del T2. Así, de los 9 pacientes en los que obtuvimos RPTC, 3 procedían de cT3s y los otros 6 de cT2. En la literatura también se describen buenos resultados en T3, aunque no se especifican si superficial o profundo26,27.
Es competencia del cirujano realizar una exéresis de pared completa de la lesión sin fragmentación y con márgenes ≥1mm. Cuando no se cumplen estas condiciones, las frecuencias de recidiva local son muy superiores. En nuestra serie, utilizando la técnica TEM/TEO, todos los pacientes excepto 2 presentaron estas características quirúrgicas. La cirugía endoscópica transanal se recomienda preferentemente a la escisión local convencional, ya que logra mejores resultados en cuanto a los márgenes de resección y calidad de la muestra28. No existen diferencias técnicas en cuanto al uso de TEM o TEO29. No hemos tenidos mortalidad postoperatoria y la estancia hospitalaria es corta, con una mediana de 3 días, según se describe también en otras series30.
Algunos autores han descrito una morbilidad superior en la neoadyuvancia y la cirugía local de estos tumores respecto a la simple exéresis mediante TEM/TEO. Así, Pérez et al.31 observaron una alta morbilidad que alcanza el 44% y un reingreso hospitalario del 30%. Coco et al.32 obtuvieron porcentajes de complicación del 16% tras TEM y del 36,4% tras neoadyuvancia y TEM, aunque sin diferencias estadísticamente significativas. En nuestro estudio, la morbilidad postoperatoria no fue tan importante: se observó en 5 de los 24 pacientes (20,8%), en 4con grados I-II de Dindo-Clavien y un solo paciente desarrolló una complicación de grado iiia. En nuestra experiencia, la complicación más frecuente fue la hemorragia rectal, en 3pacientes. Sin embargo, otros autores han descrito como complicaciones más importantes la dehiscencia de sutura y el dolor perianal31,33.
La combinación de tratamiento neoadyuvante y cirugía local (TEM/TEO) en cáncer rectal T2-T3s, N0, M0 parece una alternativa posible a la ETM. En nuestro estudio, con un período medio de seguimiento de casi 4años, solo un paciente de 24 (4,5%) ha presentado una recidiva local y 2pacientes (9%), recidiva sistémica. Estudios recientes en la literatura describen una recurrencia local por debajo del 10%30. El estudio multicéntrico de Yu et al.27 describió el 2,5% en 40 pacientes, y en un ensayo prospectivo aleatorizado de Lezoche et al.14 encontraron el 8% en 50 pacientes. Estos mismos estudios informaron de recurrencia sistémica del 7,5 y del 4%, respectivamente.
Las limitaciones del estudio vienen derivadas de su diseño observacional con un número limitado de pacientes, aunque son pacientes consecutivos con estrictos criterios de indicación. Igualmente, la inclusión de los pacientes está basada en la ecografía endorrectal y la resonancia magnética, que no tienen una fiabilidad completa respecto al estadio del tumor (T2-T3s) y tampoco pueden descartar completamente la presencia de adenopatías (N).
Nuestros resultados parecen indicar que en este grupo de pacientes las recurrencias locales y sistémicas con este tipo de estrategia son similares a las de la ETM. La RPTC tras neoadyuvancia es superior en estos estadios tempranos. No se puede equiparar la RCTC a la RPTC, por lo que no defendemos la política de «esperar y ver» en aquellos casos de RCTC. La morbilidad postoperatoria tras neoadyuvancia y TEM/TEO, aunque ligeramente superior a la TEM/TEO, parece ser muy inferior a la ETM.
Estos resultados, aunque positivos y esperanzadores, no permiten generalizar, ya que no existe suficiente evidencia científica en estudios prospectivos y aleatorizados. Desde 2010, nuestro grupo lidera un ensayo clínico multicéntrico para arrojar luz sobre estas preguntas (NCT01308190). Otros estudios dentro del ámbito europeo como el UK-TREK de la Universidad de Birmingham y el GRECCAR 2 francés, aunque con diseños diferentes, buscan el mismo objetivo. Todos ellos deberán confirmar si esta estrategia de menor agresividad terapéutica y mejor calidad de vida consigue los mismos resultados oncológicos a largo plazo que el tratamiento convencional con ETM.
Autoría/colaboracionesXavier Serra-Aracil: Diseño del estudio, adquisición y recogida de datos, análisis e interpretación de los resultados, redacción del artículo, revisión crítica y aprobación de la versión final.
Carlos Pericay: Diseño del estudio, adquisición y recogida de datos, análisis e interpretación de los resultados, revisión crítica y aprobación de la versión final.
Laura Mora-Lopez: Adquisición y recogida de datos, análisis e interpretación de los resultados, revisión crítica y aprobación de la versión final.
Juan Carlos García Pacheco: Adquisición y recogida de datos, análisis e interpretación de los resultados, revisión crítica y aprobación de la versión final.
José Isaac Latorraca: Adquisición y recogida de datos, análisis e interpretación de los resultados y aprobación de la versión final.
Julio Ocaña-Rojas: Adquisición y recogida de datos, análisis e interpretación de los resultados y aprobación de la versión final.
Alex Casalots: Adquisición y recogida de datos, análisis e interpretación de los resultados y aprobación de la versión final.
Eva Ballesteros: Adquisición y recogida de datos, análisis e interpretación de los resultados y aprobación de la versión final.
Salvador Navarro-Soto: Adquisición y recogida de datos, análisis e interpretación de los resultados, revisión crítica y aprobación de la versión final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses..
A todos los miembros de nuestra Unidad de Coloproctología y del Comité Multidisciplinar de Tumores de Colon y Recto de nuestro hospital. A Cristina Gómez Vigo por la corrección en la redacción del texto.