Los programas de rehabilitación multimodal precoz son estrategias estandarizadas perioperatorias con el objetivo de mejorar la recuperación del paciente, disminuir las complicaciones, la estancia hospitalaria y el coste sanitario.
El aspecto nutricional es un componente esencial de la rehabilitación multimodal precoz, recomendándose realizar un cribado nutricional previo al ingreso hospitalario, evitar el ayuno prequirúrgico mediante una sobrecarga oral de hidratos de carbono, e iniciar de manera precoz la ingesta oral posquirúrgica. Sin embargo, no existen protocolos estandarizados de progresión de dieta en cirugía pancreática.
Se realiza una revisión de las diferentes estrategias nutricionales publicadas desde 2006 hasta 2016 en la rehabilitación multimodal precoz de este tipo de cirugía y sus posibles implicaciones en la evolución postoperatoria.
Los estudios evaluados son muy heterogéneos por lo que no se pueden extraer resultados concluyentes sobre el protocolo de dieta a implementar, su influencia en variables clínicas ni la necesidad o no de nutrición artificial concomitante.
Multimodal rehabilitation programs are perioperative standardized strategies with the objective of improving patient recovery, and decreasing morbidity, hospital stay and health cost.
The nutritional aspect is an essential component of multimodal rehabilitation programs and therefore nutritional screening is recommended prior to hospital admission, avoiding pre-surgical fasting, with oral carbohydrate overload and early initiation of oral intake after surgery. However, there are no standardized protocols of diet progression after pancreatic surgery.
A systematic review was been performed of papers published between 2006 and 2016, describing different nutritional strategies after pancreatic surgery and its possible implications in postoperative outcome.
The studies evaluated are very heterogeneous, so conclusive results could not be drawn on the diet protocol to be implemented, its influence on clinical variables, or the need for concomitant artificial nutrition.
Las investigaciones recientes en cirugía están enfocadas en reducir el estrés quirúrgico perioperatorio con el fin de disminuir las complicaciones postoperatorias y así conseguir una mejor y más rápida recuperación del paciente, menor estancia media y coste sanitario1. En este contexto, surgen los programas «enhanced recovery after surgery» (ERAS) o programas de recuperación acelerada tras la cirugía, también conocidos como «fast track programs» o programas de rehabilitación multimodal precoz (RMP) que incluyen estrategias de cuidados estandarizados y de abordaje multidisciplinar, entre los que están la evaluación y terapia nutricional2. Dentro de las estrategias nutricionales se encuentran la abolición del ayuno preoperatorio, la sobrecarga con hidratos de carbono orales prequirúrgicos y el establecimiento precoz de la nutrición oral posquirúrgica3. La aplicación de estos protocolos en la cirugía pancreática resulta más compleja dada la mayor dificultad de las técnicas quirúrgicas y la elevada morbilidad postoperatoria4.
Entre las complicaciones más frecuentes tras cirugía pancreática se encuentran el retraso del vaciamiento gástrico (25-50%), la aparición de fístulas5 (pancreática, biliar o gastrointestinal) e infecciones posquirúrgicas, que pueden influir en el estado nutricional del paciente al aumentar los requerimientos nutricional y dificultar la alimentación por vía oral, teniendo que emplear habitualmente nutrición artificial total o complementaria. Además, la posible aparición de diabetes mellitus de origen multifactorial (insulinorresistencia debido al estrés posquirúrgico, insulinopenia, uso de análogos de somatostatina, etc.) hace más complejo aún el manejo de estos pacientes.
La prevalencia de desnutrición en pacientes oncológicos que van a ser sometidos a procesos quirúrgicos es elevada, y en cirugía pancreática el porcentaje puede ser incluso mayor6, por lo que se recomienda realizar un cribado nutricional preoperatorio estos pacientes. Así, las guías ESPEN7 recomiendan con el máximo grado de evidencia aportar soporte nutricional durante 10-14 días antes de la cirugía a pacientes desnutridos graves (al menos uno de los siguientes parámetros: pérdida de peso del 10-15% en 6 meses; IMC<18,5kg/m2; albúmina sérica<3g/dl, valoración global subjetiva grado C), retrasando incluso el acto quirúrgico si fuese necesario8.
Otro aspecto determinante es la sobrecarga prequirúrgica con hidratos de carbono. No es preciso realizar un ayuno antes de la cirugía, de forma que se pueden tomar alimentos sólidos hasta 6h antes de la cirugía, y hasta 2h antes si son alimentos líquidos. Esta abolición del ayuno no aumenta el volumen residual gástrico, de forma que no se han observado en general más episodios de vómitos ni broncoaspiraciones. Como ventajas, se reduce la ansiedad del paciente con disminución de la sed y el hambre, mejorando su sensación de bienestar, pudiendo además mejorar la función inmunitaria, disminuir la insulinorresistencia, y las pérdidas de nitrógeno y masa muscular, permitiendo así una recuperación más rápida del paciente9,10.
Un pilar fundamental en el protocolo de RMP es el inicio precoz de alimentación en las primeras 24h. Convencionalmente, se recomendaba mantener dieta absoluta hasta la aparición de ruidos intestinales y eliminación de gases y/o heces para evitar náuseas, vómitos, íleo paralítico o fuga de la anastomosis. Sin embargo, se ha observado que el inicio de la ingesta precoz y su progresión es factible y seguro dentro de un protocolo multimodal que lo favorezca11. Sin embargo, la alta incidencia de gastroparesia en la cirugía pancreática obliga a que se progrese la dieta con mayor cautela, precisando incluso suspenderla y la colocación de sonda nasogástrica en ciertos casos. Otro factor que va a retrasar o dificultar la tolerancia oral es la aparición de fístulas pancreáticas, de forma que habría que valorar también en estos casos un soporte nutricional artificial2.
Las particularidades de los procedimientos quirúrgicos pancreáticos y sus complicaciones hacen que los protocolos nutricionales de RMP descritos en otras cirugías, como la colorrectal, deban ser adaptados y se precise de estrategias específicas. Al no existir protocolos estandarizados sobre los aspectos nutricionales de RMP tras cirugía pancreática, se realiza una revisión de la literatura.
MetodologíaSe consultaron varias bases de datos médicas y científicas incluyendo Pubmed, The Cochrane library y Medline. La búsqueda fue diseñada para identificar material publicado entre 2006 y 2016 en inglés y en español. Los términos clave empleados, en todas las combinaciones posibles, fueron: páncreas, cirugía pancreática, duodenopancreatectomía, rehabilitación multimodal precoz, fast track, nutrición, estado nutricional, nutrición enteral, nutrición parenteral, malnutrición y vía clínica combinándolos con los conectores y/o así como empleando sinónimos de estos términos. Además, se revisó la bibliografía de otras revisiones sistemáticas o metaanálisis12–14 encontrados tras la búsqueda inicial.
Los estudios elegidos fueron aquellos que reunían los siguientes criterios: estudios llevados a cabo en adultos sometidos a resección pancreática; aquellos que incluían descripción de un protocolo de RMP, así como de la progresión de dieta oral postoperatoria; evaluación de al menos uno de los siguientes resultados: cumplimiento del protocolo nutricional, estancia media hospitalaria, morbilidad, mortalidad y tasa de reingresos. Se excluyeron aquellos estudios en los que se llevó a cabo cirugía de urgencia, estudios descriptivos y revisiones sistemáticas.
La respuesta primaria estudiada fue la evaluación de progresión de dieta. Las respuestas secundarias fueron: adherencia al protocolo de progresión de dieta oral postoperatoria, morbilidad, mortalidad, tasa de reingresos, incidencia retraso vaciamiento gástrico y estancia media hospitalaria.
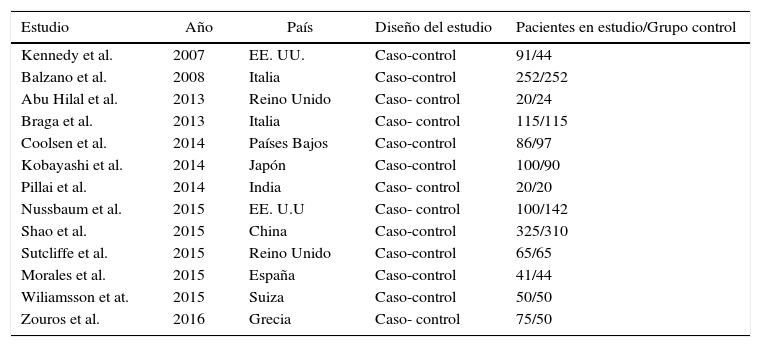
ResultadosSe obtuvieron un total de 1315–27 estudios que reunían los criterios previamente descritos y cuyas características principales pueden observarse en la tabla 1. No se encontraron estudios diseñados como ensayos clínicos. Todos los estudios incluidos tienen un diseño de tipo casos y controles y el tipo de cirugía que se llevó a cabo fue la duodenopancreatectomía.
Características de los estudios
| Estudio | Año | País | Diseño del estudio | Pacientes en estudio/Grupo control |
|---|---|---|---|---|
| Kennedy et al. | 2007 | EE. UU. | Caso-control | 91/44 |
| Balzano et al. | 2008 | Italia | Caso-control | 252/252 |
| Abu Hilal et al. | 2013 | Reino Unido | Caso- control | 20/24 |
| Braga et al. | 2013 | Italia | Caso- control | 115/115 |
| Coolsen et al. | 2014 | Países Bajos | Caso-control | 86/97 |
| Kobayashi et al. | 2014 | Japón | Caso-control | 100/90 |
| Pillai et al. | 2014 | India | Caso- control | 20/20 |
| Nussbaum et al. | 2015 | EE. U.U | Caso- control | 100/142 |
| Shao et al. | 2015 | China | Caso-control | 325/310 |
| Sutcliffe et al. | 2015 | Reino Unido | Caso-control | 65/65 |
| Morales et al. | 2015 | España | Caso-control | 41/44 |
| Wiliamsson et at. | 2015 | Suiza | Caso-control | 50/50 |
| Zouros et al. | 2016 | Grecia | Caso- control | 75/50 |
De los estudios analizados se objetiva que no existe un protocolo estándar de progresión de dieta oral como se observa en la tabla 2. Braga et al.18 llevan a cabo una progresión rápida de la ingesta iniciando tolerancia oral a líquidos en el primer día posquirúrgico y a sólidos en el segundo día posquirúrgico. Siguiendo un protocolo similar, Coolsen et al.19 proponen iniciar la tolerancia hídrica el mismo día de la cirugía y completar una dieta normal en el segundo día postoperatorio. Sin embargo, otros autores realizan una progresión de ingestas más paulatina, como Balzano et al.16, que no inician la tolerancia oral hasta el tercer día posquirúrgico y a sólidos hasta el cuarto día tras la cirugía completando una ingesta de 1.000kilocalorías en el octavo día. Otros autores proponen la progresión de la ingesta oral conjuntamente con la administración de nutrición artificial: en el caso de Morales et al.25 emplean nutrición parenteral total hasta el séptimo día posquirúrgico; Sutcliffe et al.24 y Shao et al.23 emplean nutrición enteral. Además, Sutcliffe et al.24 presentan un protocolo de progresión de ingesta oral diferenciado para aquellos pacientes que tienen alto riesgo de desarrollar fístula pancreática. Para estos propone un protocolo más conservador en el que la nutrición enteral se prolonga hasta el quinto día tras la cirugía combinándose solo con ingesta hídrica. Sin embargo, para los pacientes con bajo riesgo, proponen mantener la nutrición enteral solo las primeras 24h postoperatorias e iniciar la dieta oral el segundo día. El resto de los estudios proponen esquemas intermedios entre los referidos en los que la ingesta se inicie entre los días 2 y 3, y en los días 4 y cinco se progrese a una dieta completa17,21,22,26,27.
Modelos de progresión dieta oral en cada estudio y principales resultados obtenidos
| Estudio | Introducción ingesta vía oral y adherencia | Soporte nutricional artificial/sueroterapia | Resultados |
|---|---|---|---|
| Kennedy et al. (2007) | Día 1: Tolerancia agua <30 ml/h Día 2: Dieta líquida Día 3: Dieta normal | Fluidos intravenosos Suspender en día 4 | Morbilidad 37 vs. 44%; mortalidad 1,1 vs. 2,3%; tasa reingreso 7,7 vs. 7%; estancia media 7 vs. 13,5 días, p<0,0001 |
| Balzano et al. (2008) | Día 3: Líquidos claros Día 4: Tolerancia sólidos Días 5-7: Aumento progresivo de dieta en 5-6 tomas/día Día 8: Tolerancia dieta de 1.000kcal | Fluidos intravenosos. (30ml/kg/día) de solución hidroelectrolítica más glucosa 5% Suspensión tras buena tolerancia oral | Disminución retraso de vaciado gástrico (13,9 vs. 24,6%, p<0,005). Reducción estancia media (13 vs. 15 días, p<0,001) |
| Braga et al. (2013) | Día 1: Líquidos (55%) Día 2: Tolerancia a sólidos (53%) | Fluidos intravenosos (20mL/kg/día). Descenso progresivo de volumen hasta suspensión día 4 | Un 70% de pacientes con retraso tolerancia oral presentaron complicaciones Reducción de estancia media (11,2 vs. 13,7 días, p<0,001) |
| Abu Hilal et al. (2013) | Día 0: Sorbos de agua (30ml/h) Día 1: 60-100ml/h incluyendo bebidas energéticas Día 2: Líquidos claros incluyendo bebidas energéticas y zumos (55%) Día 3: Dieta blanda Día 4: Dieta normal (65%) | Fluidos intravenosos Suspender día 4 | Introducción dieta oral más precozmente: líquida 2 vs. 5 días, p<0,0001; sólida 4 vs. 9 días, p=0,015 Disminución retraso vaciado gástrico (12 vs. 30%, p=0,14) Reducción estancia media (8,5 vs. 13 días, p=0,015) |
| Coolsen et al. (2014) | Día 0: Agua y patatas fritas heladas Día 1: Bebida libre hasta 1,5l Día 2: Dieta normal (60%) | Fluidos intravenosos Suspender día 3 | Reducción estancia media (14 vs. 20 días, p=0,001). |
| Kobayashi et al. (2014) | Día 1: Dieta hídrica Día 2: Dieta elemental Día 3: Papilla de arroz | Disminución incidencia de infecciones (14 vs. 28,9%, p=0,019) Disminución incidencia fístula pancreática (9 vs. 27,8%, p=0,001) Reducción estancia media (21,9 vs. 36,3 días, p<0,001) | |
| Pillai et al. (2014) | Día 1: Nutrición enteral por yeyunostomía Día 3: Líquidos claros Día 4: Dieta blanda Día 5: Aumento progresivo diariamente | Introducción dieta oral más precozmente: líquida 4 vs. 8,5 días, p=0,0005; sólida 7 vs. 10,5 días, p=0,001 Disminución retraso vaciado gástrico (38 vs 75%, p=0,02). Reducción estancia media (14 vs 18,5 días, p=0,007) | |
| Nussbaum et al. (2015) | Día 1: Sorbos de hielo y agua Día 2: Sorbos de líquidos claros Día 3: Líquidos claros Día 4: Dieta blanda | Fluidos intravenosos 125ml/h Disminución progresiva hasta suspensión día 4 | Introducción dieta oral más precozmente: 5 vs. 8,5 días, p<0,001 Reducción estancia media (11 vs. 13 días, p=0,015) |
| Shao et al. (2015) | Tras la cirugía: 6h: 100-150ml de agua 24h: infusión de NE 24-48h: dieta líquida 500ml 48-72h: dieta semilíquida 1.000ml 72-96h: dieta normal | Nutrición enteral vía sonda nasogástrica en las primeras 24h poscirugía | Reducción incidencia complicaciones (39,1 vs. 55,8% p<0,001) Reducción estancia media (13.94 vs. 17,6 días, p<0,001) |
| Sutcliffe et al. (2015) | - Si alto riesgo fístula pancreática: NE por SNY día 1-5+sorbos de agua. Dieta oral día 6 -Si bajo riesgo fístula pancreática: NE por SNY día 1. Dieta oral día 2 | En el grupo de alto riesgo fluidos intravenosos hasta tolerancia dieta oral | En pacientes de alto riesgo no diferencias respecto al grupo control En pacientes de bajo riesgo disminución de estancia media (7 vs. 9 días, p=0,03), disminución reingresos a los 30 días (2 vs. 17%, p=0,04) |
| Morales et al. (2015) | Día 1: Sorbos de agua fría Día 2: Dieta líquida (agua, infusiones) Día 3: Dieta líquida (caldos) Día 4: Dieta triturada sin grasas Día 5-6: Dieta fácil masticación sin grasas Día 7: Dieta blanda sin grasas | Día 0: Fluidoterapia intravenosa Día 1: Nutrición parenteral total día Día 7: Suspender nutrición parenteral total | Disminución morbilidad (32 vs. 48%, p=0,072) Reducción estancia media (14,2 vs. 18,7 días, p=0,014) |
| Wiliamsson et al. (2015) | Día 0: Sorbos de líquidos claros (300ml) Día 1: Dieta líquida (500ml) Día 2: Dieta líquida (1.000ml) y yogur Día 3: Dieta líquida, yogur y tostadas (48%) Día 4: Dieta normal (4%) | Disminución retraso vaciado gástrico (26 vs. 48%, p=0,03). Reducción estancia media (10 vs. 14 días, p<0,001) | |
| Zouros et al. (2016) | Día 2: Líquidos claros (90,7%) Día 3: Dieta blanda (97%). Día 4. Tolerancia sólidos (94,4%) | Fluidos intravenosos. Descenso progresivo de volumen hasta suspensión día 4. | Introducción dieta oral más precozmente: líquida 2,4 vs. 4,3 días, p<0,001; sólida 4,6 vs. 6.1días, p<0,001 Disminución retraso vaciado gástrico (12 vs. 30%, p=0,14) Reducción estancia media (10,6 vs. 14,3 días, p<0,001) |
Respecto a la adherencia presentada a estos protocolos de progresión de ingesta oral son pocos los estudios que los reflejan, existiendo una importante variabilidad de los resultados obtenidos17–19,26,27. Braga et al.18 describen que el 55% de los pacientes toleró la ingesta a líquidos en el primer día postoperatorio y el 53% la ingesta a sólidos en el segundo día. Además, observan una relación inversa entre la tolerancia oral y la aparición de complicaciones posquirúrgicas (el 70% de los pacientes con retraso en la tolerancia oral presentaron complicaciones posquirúrgicas). Abu Hilal et al.17 exponen que se consiguió una tolerancia a la dieta líquida en el segundo día en el 55% de los casos y en el 65% de dieta normal en el cuarto día. Los datos más heterogéneos son los referidos por: Wiliamsson et al.26 que describen que el 48% completó una dieta líquida en el tercer día y solo un 4% dieta normal en el cuarto día, y Zouros et al.27 que describen tolerancia a líquidos al segundo día del 90,7%; día 3 dieta blanda del 3 97% y dieta sólida en el cuarto día del 94,4%.
No se observaron diferencias significativas entre los grupos en mortalidad y tasa de reingresos. Sí se percibió una disminución significativa de la estancia media hospitalaria en el grupo RPM en todos los estudios con cifras que oscilaron entre 7-21 vs. 13,5-36 días15–27.
Varios estudios describen una disminución estadísticamente significativa de la incidencia de retardo del vaciamiento gástrico en los pacientes en el grupo en el que se implementó el protocolo de RMP16,17,21,26,27. Kobayashi et al.20 describen una disminución de la incidencia de infecciones estadísticamente significativa.
DiscusiónLa implementación de programas de RMP se ha desarrollado de manera muy amplia en el área de la cirugía colorrectal, consiguiendo resultados favorables2 como la disminución de la morbilidad, reducción de la estancia hospitalaria, mejoría del bienestar del paciente y la reducción de costes. Sin embargo, la aplicación de estos protocolos en la cirugía pancreática resulta más compleja dada la mayor dificultad de las técnicas quirúrgicas y la elevada morbilidad postoperatoria. Pese a la mejoría de la técnica de la duodenopancreatectomía cefálica, la morbilidad posquirúrgica sigue siendo elevada con una incidencia en torno al 40-50%3,4 y, consecuentemente, presenta una estancia hospitalaria media prolongada, estimada entre 14 y 28 días.
Dentro los protocolos existentes, el componente nutricional es un elemento esencial en el manejo perioperatorio del paciente. Es bien conocido que el estado nutricional de un paciente sometido a cirugía va a condicionar un factor pronóstico del mismo, especialmente si esta es oncológica. Por tanto, es esencial implementar cribados nutricionales prequirúrgicos para detectar al paciente con malnutrición o riesgo de desarrollarla y así optimizar su estado nutricional en el momento de la cirugía7.
El cribado nutricional y la sobrecarga oral con hidratos de carbono hasta 2h antes de la cirugía para evitar el ayuno prequirúrgico son aspectos universales que incluyen los protocolos de RMP en cualquier cirugía. Sin embargo, el aspecto más controvertido es el del inicio y progresión de la dieta tras la intervención. La elevada incidencia de gastroparesia y fístulas pancreáticas hace que dicha progresión no pueda ser similar a las encontradas en protocolos de RMP de otras cirugías. La gastroparesia supone la principal causa de morbilidad y de prolongación de la estancia hospitalaria, y es uno de los factores predominantes en la readaptación de la progresión de la dieta posquirúrgica en la RMP pancreática5,28.
En los estudios analizados observamos una gran heterogeneidad respecto al método de introducción de la dieta oral, complicando de este modo el análisis de los resultados. Observamos cómo algunos estudios emplean protocolos de progresión rápida en los cuales el mismo día de la cirugía se inicia la tolerancia oral, generalmente con agua, progresando el segundo día a líquidos, y finalmente, completando una dieta con tolerancia a sólidos el segundo día tras la cirugía19. Otros trabajos emplean protocolos de progresión más conservadores en los que se mantiene al paciente en dieta absoluta hasta el tercer día tras la cirugía y se progresa paulatinamente hasta una dieta completa en el octavo día16. Por último, existen protocolos intermedios entre estos modelos, en los que la tolerancia se inicia desde el día de la cirugía pero progresan de forma más lenta tolerando una dieta completa entre los días cuarto y quinto17.
Según los trabajos realizados, no solo no se observan aumentos en la morbimortalidad con ninguno de los protocolos, sino que algunos trabajos describen disminución de las principales complicaciones secundarias a la cirugía pancreática15,23,25.
En este sentido, se observa una disminución de la incidencia del retraso del vaciamiento gástrico en varios trabajos16,17,21,26,27 en los que se describen incidencias en el grupo control que varían entre el 24 y el 48% e incidencias en el grupo RMP de entre el 12 y el 26% (con una reducción general aproximada del 50% en su incidencia en realizar RMP). Por otro lado, Kobayashi et al20. refieren una disminución de la incidencia de fístulas pancreáticas (9 vs. 27,8%, p=0,001) y de infecciones (14 vs. 28,9%, p=0,019), siendo este el único estudio que describe la aparición de estas complicaciones. Es destacable el hallazgo descrito por Braga et al.18 en el que se observa una relación entre la aparición de complicaciones y el retraso en la tolerancia oral respecto al protocolo propuesto.
Del mismo modo, tampoco podríamos asociar la adherencia a la velocidad de progresión de la dieta, por un lado, porque pocos estudios la describen, y por otro, por la heterogeneidad de los escasos datos reportados por los estudios, ya que por ejemplo en el de Zouros et al.27 refieren una excelente adherencia (en torno al 90%) completando la dieta oral en el cuarto día, y en cambio, Williamsson et al.26 describen una adherencia de tan solo el 4% completando la misma progresión.
Consideramos este un aspecto muy relevante, ya que la aparición de complicaciones posquirúrgicas es la principal limitación en la correcta aplicación de la RMP, y esto ayudaría a establecer el apropiado ritmo de progresión en la dieta. Sin embargo, no existe la suficiente evidencia de asociación entre la aparición de las complicaciones posquirúrgicas y el ritmo de progresión de dieta por lo que se hace difícil el elegir un adecuado protocolo de dieta.
La estancia media es otro parámetro ampliamente estudiado en los protocolos de RMP. En la mayor parte de los estudios analizados se describe una disminución de la estancia media entre 2 y 5 días respecto al grupo control sin observarse una mayor reducción en los estudios en los que se ha empleado un protocolo de progresión rápida de la dieta. Por lo tanto, no pueden extraerse conclusiones acerca de si protocolos más precoces o aquellos más conservadores se asocian con mayor disminución de la estancia media.
Otro aspecto a destacar es la indicación de nutrición artificial durante la pauta de progresión dietética. La mayoría de los estudios proponen administrar fluidoterapia intravenosa15–19,22,24,27 hasta alcanzar una dieta completa, sin embargo, son pocos los que indican iniciar nutrición artificial. De los estudios en los que se propone nutrición artificial, 2 de ellos emplean nutrición enteral y solo uno nutrición parenteral. En el caso de la nutrición enteral, Shao et al.23 emplean la nutrición enteral por sonda nasogástrica solo en las primeras 24h acompañándola de tolerancia hídrica. Sutcliffe et al.24 diferencian en pacientes de alto riesgo de desarrollo de fístula pancreática para los que emplean nutrición enteral por sonda nasoyeyunal durante los primeros 5 días (en combinación con ingesta hídrica), y pacientes de bajo riesgo en los cuales la nutrición enteral solo se administra las primeras 24h tras la cirugía. Respecto a la nutrición parenteral es el grupo español de Morales25 quien propone una nutrición parenteral durante la primera semana postoperatoria hasta completar la dieta oral. Los resultados obtenidos en estos estudios no difieren entre sí, ni respecto a los que no emplean nutrición artificial.
Ningún estudio describe si se consiguen aportar los requerimientos nutricionales necesarios para mantener un balance al menos neutro y no favorecer el catabolismo metabólico y proteico del paciente, tan relevante en las cirugías pancreáticas. Es coherente aportar únicamente sueroterapia si la progresión de la dieta es rápida y se consiguen alcanzar los requerimientos nutricionales del paciente en los primeros 4 días posquirúrgicos, pero si el protocolo es más conservador, pensamos indicado el uso de nutrición artificial asociada, como realiza el propio grupo de Morales et al.25 Sin embargo, también habría que valorar la adición de suplementos orales nutricionales a la dieta una vez esta sea tolerada, ya que puede ser una ayuda importante de cara a alcanzar los requerimientos nutricionales y poder evitar el uso de nutrición artificial o suspender esta con mayor antelación evitando las complicaciones propias de la misma. Sin embargo, este aspecto tampoco es valorado por ninguno de los estudios.
Salvo el estudio de Kobayashi et al.20 en el que se describe la evolución de la albúmina y prealbúmina a la semana y a las 2 semanas tras la cirugía sin observarse diferencias significativas respecto al grupo control, ningún estudio evalúa los cambios en parámetros nutricionales como el peso o proteínas viscerales, y teniendo en cuenta que las estancias medias en general son superiores a 10 días, estos nos darían una información importante de la variación en el estado nutricional del paciente.
Por su parte, cabe destacar que el grupo español de rehabilitación multimodal (GERM)29 propone un esquema diferenciado de progresión de tolerancia oral dependiendo del tipo de cirugía realizada: en pacientes sometidos a duodenopancreatectomía cefálica con anastomosis pancreatogástrica recomiendan iniciar tolerancia hídrica en el tercer día postoperatorio con posterior progresión de la misma mientras que en aquellos en los que se ha realizado una duodenopancreatectomía cefálica con anastomosis pancreaticoyeyunal o una pancreatectomía corporocaudal recomiendan comenzar dieta hídrica a las 6h tras la cirugía y completar un dieta normal en el tercer día posquirúrgico.
Como en cualquier otro tipo de cirugía, es preciso la aplicación de cribados nutricionales previos a la misma para detectar al paciente malnutrido o con riesgo de malnutrición, así como un protocolo para la sobrecarga oral con hidratos de carbono hasta 2h antes de la cirugía. En cambio, la cirugía pancreática tiene peculiaridades intrínsecas de la técnica y de sus complicaciones que hacen que el inicio precoz de la dieta oral posquirúrgica y su progresión probablemente deba ser diferenciado.
Al no existir guías específicas con buen nivel de evidencia en este ámbito, los estudios evaluados en este trabajo son muy diferentes unos de otros en cuanto a la progresión de la dieta, y no aportan en general suficiente información acerca de aspectos tan relevantes como la incidencia de complicaciones como las fístulas o la relación del retraso del vaciamiento gástrico con el ritmo de progresión de la dieta (aunque la aplicación de protocolo RMP sí lo disminuyen). Asimismo, tampoco existen suficientes datos expuestos sobre el estado y evolución nutricional de los pacientes, así como de los aportes energéticos y proteicos que se le aportan, incluyendo el uso o no de suplementos orales nutricionales.
Los resultados son tan dispares que no existe un patrón generalizado en el que los pacientes con progresión más rápida presenten más complicaciones y disminuya la adherencia, o si disminuyen más la estancia media que con protocolos más conservadores. Tampoco queda clara la coadministración de nutrición artificial los primeros días de progresión dietética, aunque parece lógico pensar que en protocolos más rápidos en los que se consiguen requerimientos precozmente, la sueroterapia aislada puede ser suficiente.
En conclusión, con los resultados obtenidos tras el análisis de los estudios descritos, en nuestro medio, proponemos llevar a cabo una tolerancia oral precoz y progresión rápida de dieta aunque de forma más paulatina que las descritas en cirugía colorrectal. De este modo, recomendamos iniciar la tolerancia hídrica a las 6h tras la finalización de la cirugía, no forzando la misma en el que caso de que el paciente se encuentre nauseoso o somnoliento. Posteriormente, el día uno tras la cirugía se progresaría a dieta líquida desde el almuerzo, y al segundo día se iniciaría dieta semilíquida y se reintroducirían los suplementos orales nutricionales si el paciente los recibía previamente a la cirugía. El tercer día posquirúrgico se pautaría una dieta semisólida de fácil digestión, y el cuarto día se progresaría a dieta blanda astringente que se mantendría hasta el alta hospitalaria. En el caso de que se cumpliese el protocolo propuesto, presentando una buena tolerancia a la progresión oral, consideramos indicado suspender la sueroterapia el segundo día tras la cirugía no precisando la administración de nutrición artificial parenteral ni enteral. Solo si se presentase alguna complicación que condujese a un retraso en la tolerancia oral, por lo que no fuera previsible administrar los requerimientos nutricionales del paciente en sucesivos días, consideramos indicado el inicio de dicha nutrición.
Conflicto de interesesLos autores declaramos que no ha habido ninguna fuente de financiación ni conflicto de intereses.