El adenocarcinoma de duodeno es una neoplasia poco frecuente, sobre la que existen pocas experiencias publicadas de los resultados tras su resección. El objetivo es analizar los resultados obtenidos en nuestro centro tras la resección curativa del adenocarcinoma duodenal (AD).
MétodosEstudio retrospectivo de los pacientes intervenidos con resección curativa por AD entre 1990 y 2017 en nuestro hospital.
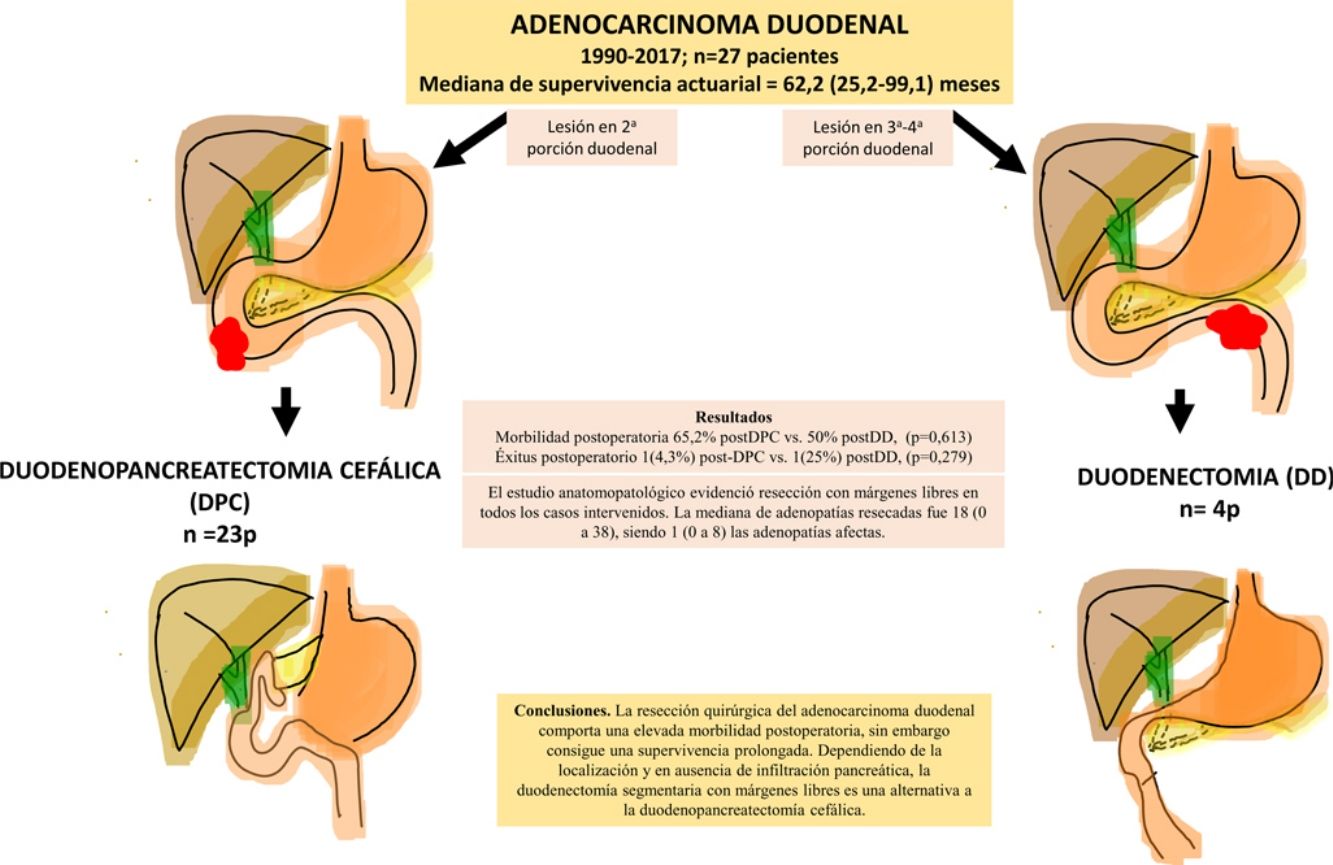
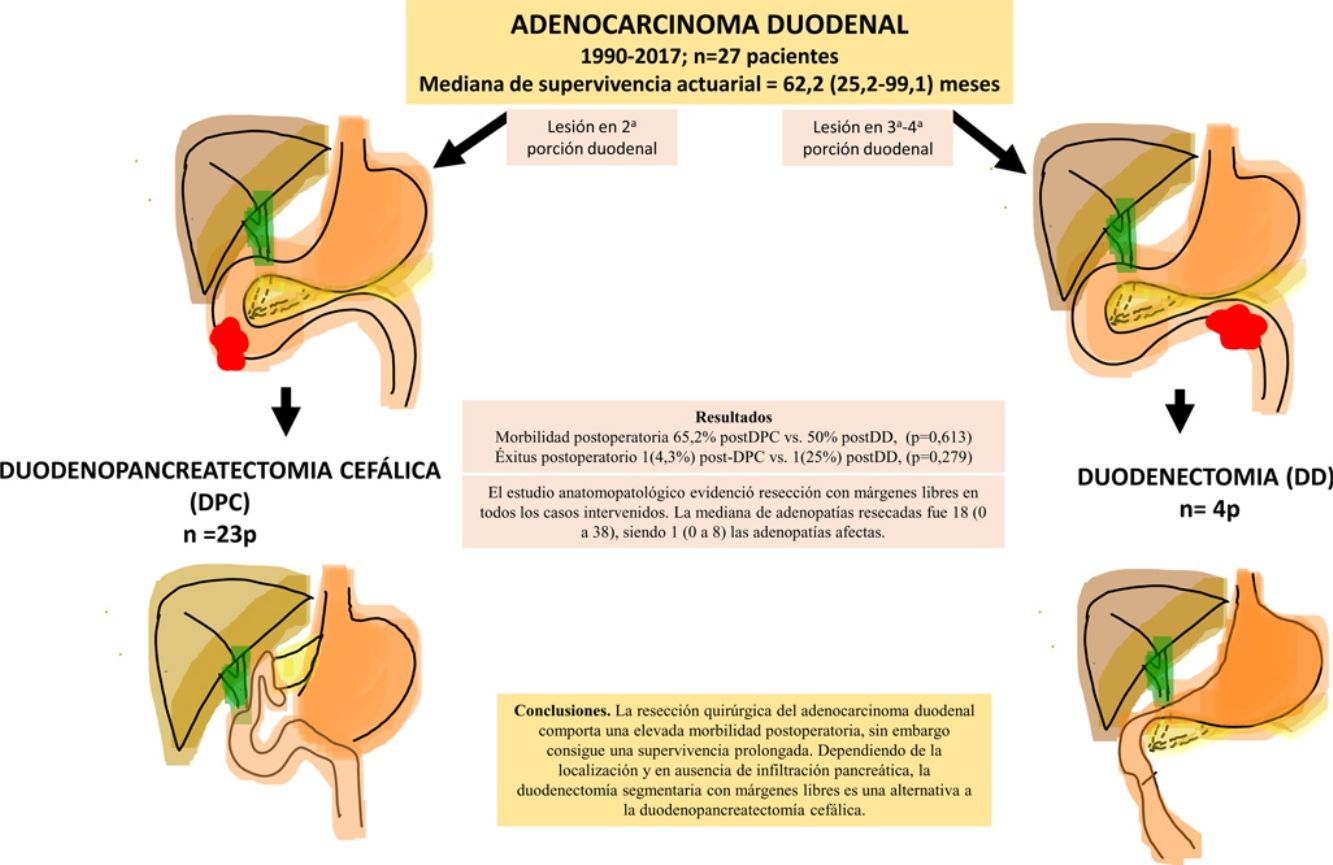
ResultadosSe intervino a 27 pacientes. En 23 casos (85%) se realizó duodenopancreatectomía cefálica (DPC) y en 4 casos (15%) con localización en la 3.ª-4.ª porción duodenal se realizó duodenectomía (DD) segmentaria. La morbilidad postoperatoria global fue del 67% (18 pacientes). La mortalidad postoperatoria global fue 7% (2 pacientes), sin embargo, la mortalidad postoperatoria relacionada con la cirugía fue de 4% (un paciente). El estudio anatomopatológico evidenció resección con márgenes libres en todos los casos intervenidos. La mediana de adenopatías resecadas fue 18 (0 a 38), siendo 1 (0 a 8) las adenopatías afectadas. Tras una mediana de seguimiento de 23 (9-69,7) meses, la supervivencia actuarial fue de 62,2 (25,2 a 99,1) meses y la supervivencia actuarial libre de enfermedad fue de 49 (0 a 133) meses.
ConclusionesLa resección quirúrgica del AD comporta una elevada morbilidad postoperatoria, sin embargo, consigue una supervivencia prolongada. Dependiendo de la localización y en ausencia de infiltración pancreática, la DD segmentaria con márgenes libres es una alternativa a la DPC.
Duodenal adenocarcinoma is a rare malignancy. Given the rarity of the disease, there is limited data related to resection results. The objective is to analyze results at our hospital after the curative resection of duodenal adenocarcinoma (DA).
MethodsThe variables were retrospectively collected from patients operated on between 1990 and 2017 at our hospital.
ResultsA total of 27 patients were treated. Twenty-three patients (85%) underwent pancreaticoduodenectomy, and 4 patients (15%) with tumors located in the third and fourth portions of the duodenum underwent segmental duodenal resection. The overall postoperative morbidity was 67% (18 patients). Postoperative mortality was 7% (2 patients); however, postoperative mortality related to surgery was 4% (1 patient). All patients had negative resection margins. A median of 18 lymph nodes (range, 0-38) were retrieved and evaluated, with a median of 1 involved node (range, 0-8). Median follow up was 23 (9-69.7) months. Actuarial overall survival was 62.2 (25.2-99.1) months. Actuarial disease-free survival was 49 (0-133) months.
ConclusionsThe surgical treatment of duodenal adenocarcinoma is associated with a high morbidity, although it achieves considerable survival. Depending on the tumor location and if there is no pancreatic infiltration, segmental duodenal resection with negative margins is an alternative to cephalic pancreaticoduodenectomy.
El adenocarcinoma duodenal (AD) es una neoplasia infrecuente, siendo el duodeno la localización más habitual dentro de los adenocarcinomas de intestino delgado1-4. La mayoría de AD se localizan en la segunda porción duodenal (D2), seguido por la 3.ª y 4.ª porción (D3-D4), siendo excepcional la localización en primera porción duodenal3. Los síntomas son inespecíficos, como dolor abdominal, náuseas, vómitos, astenia o pérdida de peso, siendo el dolor abdominal el más frecuente. En casos de enfermedad avanzada, puede aparecer ictericia, obstrucción intestinal o anemia. Debido a la inespecificidad de los síntomas, el diagnóstico de la enfermedad suele ser tardío. El diagnóstico de sospecha se confirmará mediante endoscopia digestiva alta con biopsia. La tomografía computarizada multicorte abdominal será imprescindible para el estudio de extensión5. El tratamiento de elección es la resección quirúrgica. Respecto a la técnica, inicialmente, el tratamiento que se consideraba estándar era la duodenopancreatectomía cefálica (DPC)6. A partir de entonces, la resección segmentaria o duodenectomía (DD) quirúrgica, se plantea como una opción válida para este tipo de tumores, dependiendo de su localización, márgenes de resección y linfadenectomía quirúrgica4,7-9. Ahora bien, no existe consenso al respecto, y algunos autores apoyan la DPC como técnica de elección en todos los casos10,11. El objetivo de este estudio es analizar los resultados obtenidos en nuestro centro tras la resección curativa del AD mediante DPC y DD.
MétodosEntre 1990 y 2017 registramos de forma retrospectiva a los pacientes a los que se realizó cirugía con intención curativa por AD en el Hospital Universitari de Bellvitge. Se recogieron variables demográficas, clínicas, quirúrgicas, anatomopatológicas, así como la evolución postoperatoria y a largo plazo. El período de inclusión finalizó en marzo del 2017. Los pacientes fueron controlados en consultas externas de cirugía, finalizando el seguimiento en marzo del 2018.
Estudio preoperatorioTodos los pacientes fueron estudiados mediante endoscopia digestiva alta con biopsia y tomografía computarizada. Se definieron como criterios de irresecabilidad la presencia de metástasis a distancia y la invasión arterial (arteria mesentérica superior, arteria hepática o tronco celíaco). En cuanto a la afectación venosa, no se realizaron resecciones en casos con tumor duodenal de gran tamaño, que implicaran obliteración de la vena mesentérica superior. Ni la edad avanzada del paciente ni el tamaño tumoral fueron motivo de contraindicación para la cirugía.
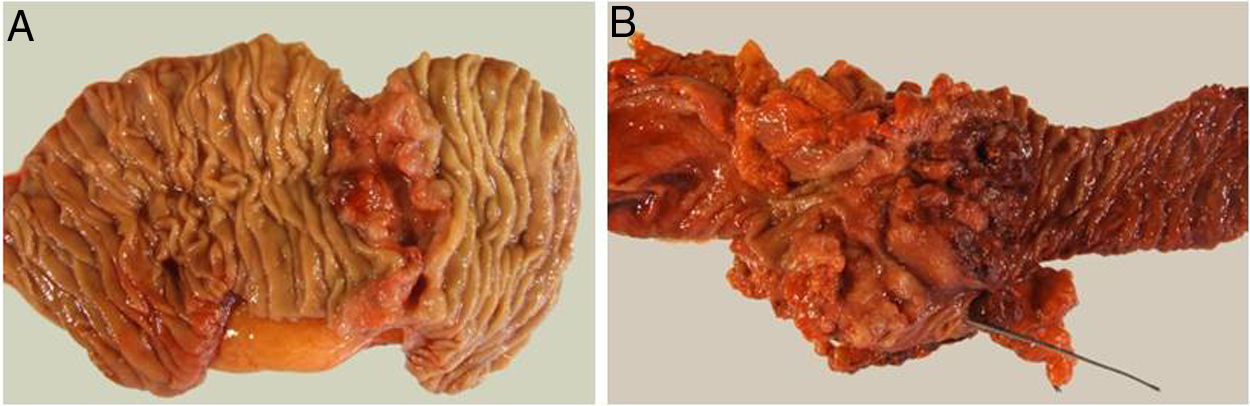
Técnica quirúrgica y estudio anatomopatológicoLas técnicas quirúrgicas empleadas fueron la DPC en aquellos casos en los que la tumoración afectaba a D2 o presentaba infiltración pancreática, y DD para aquellos con afectación de D3-D4. En los tumores a los que por su localización se les practicó una DPC, se realizó una linfadenectomía locorregional estándar (adenopatías peripancreáticas, hilio hepático y margen derecho de la arteria mesentérica superior). El estudio anatomopatológico analizó el grado de diferenciación tumoral, el tamaño del tumor, la afectación del margen de resección, el número de adenopatías afectadas y resecadas y se estableció la estadificación TNM (7th edición del American Joint Committee on Cancer [AJCC] Staging system for small bowell adenocarcinoma12). En la DD y en la DPC se consideró como margen de resección el margen intestinal. Se definió la ratio ganglionar como el número de ganglios linfáticos afectados sobre la cantidad total de ganglios resecados.
Morbilidad postoperatoriaLa morbilidad postoperatoria se registró de acuerdo con la clasificación de Clavien-Dindo13. Se definió mortalidad postoperatoria aquella ocurrida durante el ingreso o hasta 90 días tras la intervención. Se definió vaciamiento gástrico lento (VGL) como la imposibilidad para tolerar la dieta oral tras la primera semana postoperatoria, siguiendo la definición del grupo internacional de estudio sobre la cirugía pancreática (International Study Group of Pancreatic Surgery [ISGPS])14. Se consideró fístula pancreática a la salida de líquido por drenajes con contenido rico en amilasas (amilasa×3 en comparación con el valor normal en sangre) a partir del día 3 postoperatorio, aplicando la clasificación del ISGPS15. Todos los pacientes fueron seguidos por algún miembro del equipo quirúrgico tras el alta hospitalaria.
Análisis estadísticoSe utilizó el paquete estadístico Stata v.13®. Inicialmente, se realizó un análisis descriptivo de la serie mediante medidas de tendencia central (mediana) y de dispersión (rango y rango intercuartílico) para las variables cuantitativas. A continuación, se dividió la serie en 2grupos de estudio según la técnica utilizada, DPC y DD, y se compararon los 2grupos mediante test de Fisher para variables cualitativas y U de Mann-Whitney para variables cuantitativas. Se consideró un nivel de significación estadística p<0,05. Se calcularon las supervivencias actuariales (global y libre de enfermedad) para cada grupo de estudio mediante test de Kaplan-Meier. Se realizó un estudio de factores de riesgo de mortalidad y recidiva mediante modelos de regresión de Cox univariante. Para el análisis multivariante se seleccionaron las variables significativas en el estudio univariante, la variable de estudio (técnica quirúrgica), así como las variables demográficas (edad y sexo).
ResultadosDurante el período de estudio se intervino a 27 pacientes. En 23 casos (85%) se realizó DPC y en 4 casos (15%) se realizó DD (tabla 1). La mediana de edad fue de 63,4 (50,8-74,1) años, sin diferencias significativas entre los 2grupos. Se intervinieron 13 mujeres (48%), 11 en el grupo DPC (48%) y 2 en el grupo DD (50%).
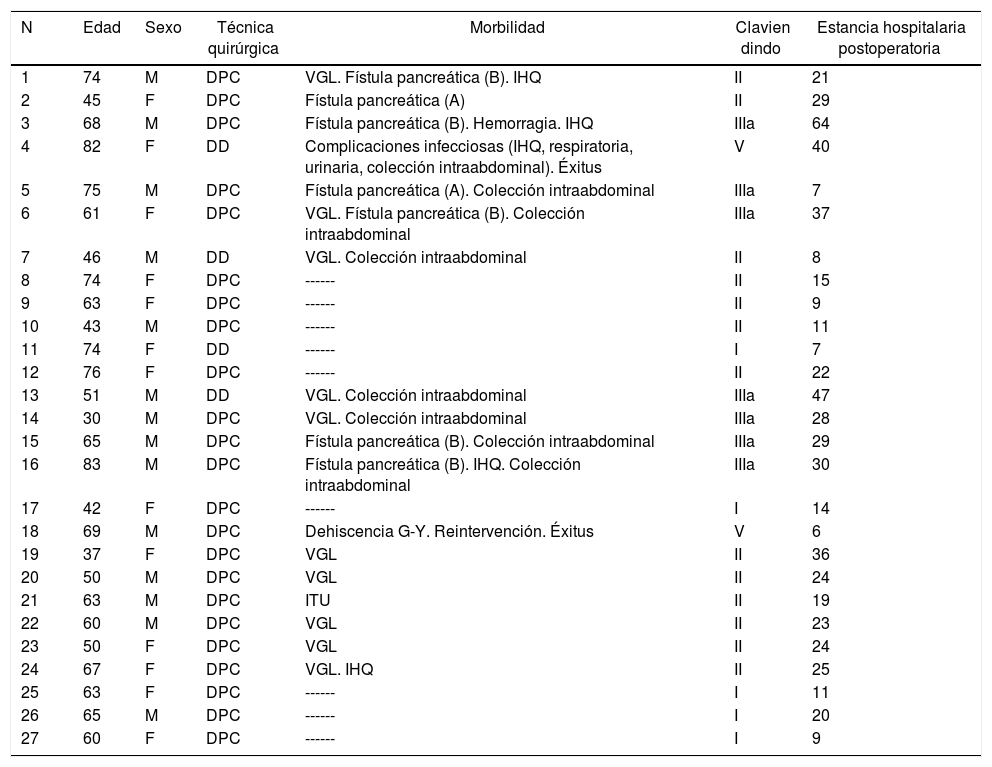
Adenocarcinoma duodenal. Resultados del tratamiento quirúrgico. Detalles de la técnica operatoria y morbilidad postoperatoria
| N | Edad | Sexo | Técnica quirúrgica | Morbilidad | Clavien dindo | Estancia hospitalaria postoperatoria |
|---|---|---|---|---|---|---|
| 1 | 74 | M | DPC | VGL. Fístula pancreática (B). IHQ | II | 21 |
| 2 | 45 | F | DPC | Fístula pancreática (A) | II | 29 |
| 3 | 68 | M | DPC | Fístula pancreática (B). Hemorragia. IHQ | IIIa | 64 |
| 4 | 82 | F | DD | Complicaciones infecciosas (IHQ, respiratoria, urinaria, colección intraabdominal). Éxitus | V | 40 |
| 5 | 75 | M | DPC | Fístula pancreática (A). Colección intraabdominal | IIIa | 7 |
| 6 | 61 | F | DPC | VGL. Fístula pancreática (B). Colección intraabdominal | IIIa | 37 |
| 7 | 46 | M | DD | VGL. Colección intraabdominal | II | 8 |
| 8 | 74 | F | DPC | ------ | II | 15 |
| 9 | 63 | F | DPC | ------ | II | 9 |
| 10 | 43 | M | DPC | ------ | II | 11 |
| 11 | 74 | F | DD | ------ | I | 7 |
| 12 | 76 | F | DPC | ------ | II | 22 |
| 13 | 51 | M | DD | VGL. Colección intraabdominal | IIIa | 47 |
| 14 | 30 | M | DPC | VGL. Colección intraabdominal | IIIa | 28 |
| 15 | 65 | M | DPC | Fístula pancreática (B). Colección intraabdominal | IIIa | 29 |
| 16 | 83 | M | DPC | Fístula pancreática (B). IHQ. Colección intraabdominal | IIIa | 30 |
| 17 | 42 | F | DPC | ------ | I | 14 |
| 18 | 69 | M | DPC | Dehiscencia G-Y. Reintervención. Éxitus | V | 6 |
| 19 | 37 | F | DPC | VGL | II | 36 |
| 20 | 50 | M | DPC | VGL | II | 24 |
| 21 | 63 | M | DPC | ITU | II | 19 |
| 22 | 60 | M | DPC | VGL | II | 23 |
| 23 | 50 | F | DPC | VGL | II | 24 |
| 24 | 67 | F | DPC | VGL. IHQ | II | 25 |
| 25 | 63 | F | DPC | ------ | I | 11 |
| 26 | 65 | M | DPC | ------ | I | 20 |
| 27 | 60 | F | DPC | ------ | I | 9 |
DD: duodenectomía; DPC: duodenopancreatectomía cefálica; F: femenino; IHQ: infección herida quirúrgica; ITU: infección tracto urinario; M: masculino; VGL: vaciamiento gástrico lento.
M masculino; F femenino; DPC duodenopancreatectomía cefálica; DD duodenectomía; VGL vaciamiento gástrico lento; IHQ infección herida quirúrgica; ITU infección tracto urinario; Morbilidad según clasificación Clavien-Dindo (Dindo, Ann Surg 2004). Estancia hospitalaria (días)
Morbilidad según clasificación Clavien-Dindo30. Estancia hospitalaria (días).
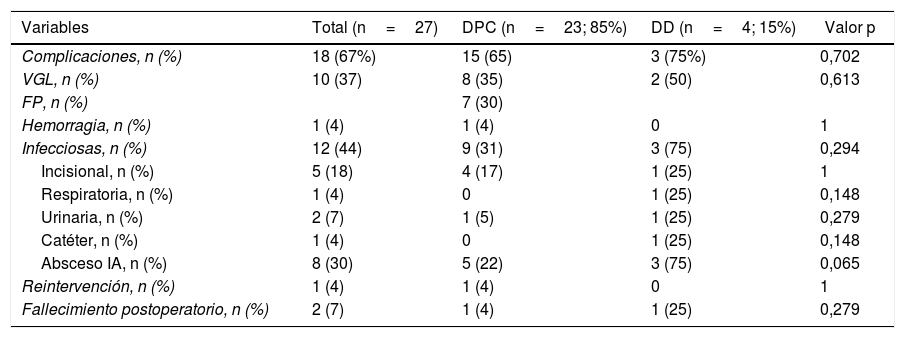
La morbilidad postoperatoria global fue del 63% (17 pacientes). Tres pacientes (11%) presentaron una complicación superior a iiia, según la clasificación de Clavien-Dindo13. Si analizamos las complicaciones según la técnica realizada, la morbilidad postoperatoria fue del 65% tras DPC (15 de 23 pacientes) y del 75% tras DD (3 de 4 pacientes), sin diferencias estadísticamente significativas entre ellas (tabla 2). La complicación más frecuente en toda la serie fue el VGL, siendo del 37% (10 enfermos), sin diferencias estadísticamente significativas entre ambas técnicas. Las complicaciones sépticas representaron un 44% (12 enfermos). Por último, la fístula pancreática tras DPC fue del 30% (7 enfermos, 2 tipo A y 5 tipo B). La mediana de estancia postoperatoria fue de 22 (11-29) días, siendo similar en ambos grupos. Del total de la serie, un paciente (4%) tuvo que ser reintervenido por dehiscencia de la anastomosis gastroyeyunal, realizando sutura y colocación de drenaje. La mortalidad postoperatoria fue del 7% (2 enfermos). Un paciente del grupo DPC falleció por fallo multiorgánico tras ser reintervenido por dehiscencia anastomótica y otro paciente del grupo DD falleció a los 40 días de la cirugía por encefalopatía por hiperamoniemia e insuficiencia respiratoria, sin presentar complicaciones intraabdominales. No se hallaron diferencias estadísticamente significativas en cuanto a mortalidad postoperatoria entre ambos grupos de estudio (p=0,279) (tabla 2).
Morbilidad postoperatoria: comparación entre los 2grupos de estudio
| Variables | Total (n=27) | DPC (n=23; 85%) | DD (n=4; 15%) | Valor p |
|---|---|---|---|---|
| Complicaciones, n (%) | 18 (67%) | 15 (65) | 3 (75%) | 0,702 |
| VGL, n (%) | 10 (37) | 8 (35) | 2 (50) | 0,613 |
| FP, n (%) | 7 (30) | |||
| Hemorragia, n (%) | 1 (4) | 1 (4) | 0 | 1 |
| Infecciosas, n (%) | 12 (44) | 9 (31) | 3 (75) | 0,294 |
| Incisional, n (%) | 5 (18) | 4 (17) | 1 (25) | 1 |
| Respiratoria, n (%) | 1 (4) | 0 | 1 (25) | 0,148 |
| Urinaria, n (%) | 2 (7) | 1 (5) | 1 (25) | 0,279 |
| Catéter, n (%) | 1 (4) | 0 | 1 (25) | 0,148 |
| Absceso IA, n (%) | 8 (30) | 5 (22) | 3 (75) | 0,065 |
| Reintervención, n (%) | 1 (4) | 1 (4) | 0 | 1 |
| Fallecimiento postoperatorio, n (%) | 2 (7) | 1 (4) | 1 (25) | 0,279 |
DD: duodenectomía; DPC: duodenopancreatectomía cefálica; IA: intraabdominal; FP: fístula pancreática; VGL: vaciamiento gástrico lento.
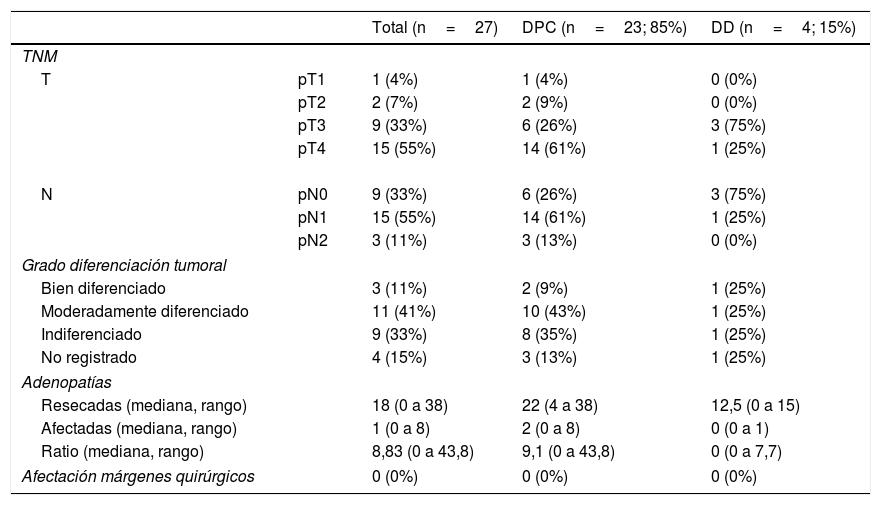
El estudio anatomopatológico evidenció que la mayor parte de pacientes fueron pT4 (15 enfermos, 55%), con afectación ganglionar pN1 (15 enfermos, 55%) según la clasificación TNM (7th edición del AJCC12) (tablas 3 y 4) (fig. 1). En 4 pacientes el estudio anatomopatológico no pudo ser recuperado de forma completa. El grado de diferenciación tumoral más frecuentemente registrado fue moderadamente diferenciado (41%). El tamaño tumoral fue mayor de 30mm en el 59% (16 casos). En todos los casos intervenidos la resección se realizó con márgenes libres. La mediana de adenopatías resecadas fue 18 (0-38), siendo en la DPC de 22 (4-38) y en la DD de 12,5 (0-15), diferencias estadísticamente significativas (p=0,016).
Resultados de anatomía patológica
| Total (n=27) | DPC (n=23; 85%) | DD (n=4; 15%) | ||
|---|---|---|---|---|
| TNM | ||||
| T | pT1 | 1 (4%) | 1 (4%) | 0 (0%) |
| pT2 | 2 (7%) | 2 (9%) | 0 (0%) | |
| pT3 | 9 (33%) | 6 (26%) | 3 (75%) | |
| pT4 | 15 (55%) | 14 (61%) | 1 (25%) | |
| N | pN0 | 9 (33%) | 6 (26%) | 3 (75%) |
| pN1 | 15 (55%) | 14 (61%) | 1 (25%) | |
| pN2 | 3 (11%) | 3 (13%) | 0 (0%) | |
| Grado diferenciación tumoral | ||||
| Bien diferenciado | 3 (11%) | 2 (9%) | 1 (25%) | |
| Moderadamente diferenciado | 11 (41%) | 10 (43%) | 1 (25%) | |
| Indiferenciado | 9 (33%) | 8 (35%) | 1 (25%) | |
| No registrado | 4 (15%) | 3 (13%) | 1 (25%) | |
| Adenopatías | ||||
| Resecadas (mediana, rango) | 18 (0 a 38) | 22 (4 a 38) | 12,5 (0 a 15) | |
| Afectadas (mediana, rango) | 1 (0 a 8) | 2 (0 a 8) | 0 (0 a 1) | |
| Ratio (mediana, rango) | 8,83 (0 a 43,8) | 9,1 (0 a 43,8) | 0 (0 a 7,7) | |
| Afectación márgenes quirúrgicos | 0 (0%) | 0 (0%) | 0 (0%) | |
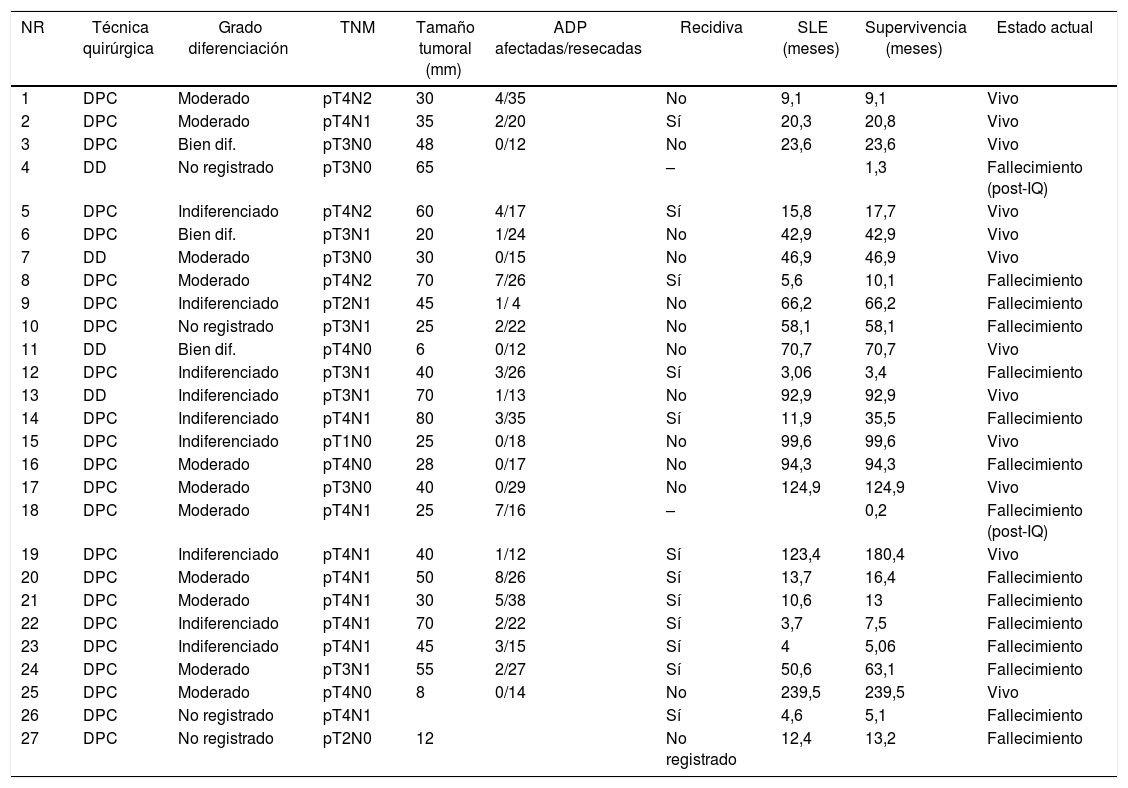
Adenocarcinoma duodenal. Resultados del tratamiento quirúrgico. Estudio anatomopatológico y evolución a largo plazo
| NR | Técnica quirúrgica | Grado diferenciación | TNM | Tamaño tumoral (mm) | ADP afectadas/resecadas | Recidiva | SLE (meses) | Supervivencia (meses) | Estado actual |
|---|---|---|---|---|---|---|---|---|---|
| 1 | DPC | Moderado | pT4N2 | 30 | 4/35 | No | 9,1 | 9,1 | Vivo |
| 2 | DPC | Moderado | pT4N1 | 35 | 2/20 | Sí | 20,3 | 20,8 | Vivo |
| 3 | DPC | Bien dif. | pT3N0 | 48 | 0/12 | No | 23,6 | 23,6 | Vivo |
| 4 | DD | No registrado | pT3N0 | 65 | – | 1,3 | Fallecimiento (post-IQ) | ||
| 5 | DPC | Indiferenciado | pT4N2 | 60 | 4/17 | Sí | 15,8 | 17,7 | Vivo |
| 6 | DPC | Bien dif. | pT3N1 | 20 | 1/24 | No | 42,9 | 42,9 | Vivo |
| 7 | DD | Moderado | pT3N0 | 30 | 0/15 | No | 46,9 | 46,9 | Vivo |
| 8 | DPC | Moderado | pT4N2 | 70 | 7/26 | Sí | 5,6 | 10,1 | Fallecimiento |
| 9 | DPC | Indiferenciado | pT2N1 | 45 | 1/ 4 | No | 66,2 | 66,2 | Fallecimiento |
| 10 | DPC | No registrado | pT3N1 | 25 | 2/22 | No | 58,1 | 58,1 | Fallecimiento |
| 11 | DD | Bien dif. | pT4N0 | 6 | 0/12 | No | 70,7 | 70,7 | Vivo |
| 12 | DPC | Indiferenciado | pT3N1 | 40 | 3/26 | Sí | 3,06 | 3,4 | Fallecimiento |
| 13 | DD | Indiferenciado | pT3N1 | 70 | 1/13 | No | 92,9 | 92,9 | Vivo |
| 14 | DPC | Indiferenciado | pT4N1 | 80 | 3/35 | Sí | 11,9 | 35,5 | Fallecimiento |
| 15 | DPC | Indiferenciado | pT1N0 | 25 | 0/18 | No | 99,6 | 99,6 | Vivo |
| 16 | DPC | Moderado | pT4N0 | 28 | 0/17 | No | 94,3 | 94,3 | Fallecimiento |
| 17 | DPC | Moderado | pT3N0 | 40 | 0/29 | No | 124,9 | 124,9 | Vivo |
| 18 | DPC | Moderado | pT4N1 | 25 | 7/16 | – | 0,2 | Fallecimiento (post-IQ) | |
| 19 | DPC | Indiferenciado | pT4N1 | 40 | 1/12 | Sí | 123,4 | 180,4 | Vivo |
| 20 | DPC | Moderado | pT4N1 | 50 | 8/26 | Sí | 13,7 | 16,4 | Fallecimiento |
| 21 | DPC | Moderado | pT4N1 | 30 | 5/38 | Sí | 10,6 | 13 | Fallecimiento |
| 22 | DPC | Indiferenciado | pT4N1 | 70 | 2/22 | Sí | 3,7 | 7,5 | Fallecimiento |
| 23 | DPC | Indiferenciado | pT4N1 | 45 | 3/15 | Sí | 4 | 5,06 | Fallecimiento |
| 24 | DPC | Moderado | pT3N1 | 55 | 2/27 | Sí | 50,6 | 63,1 | Fallecimiento |
| 25 | DPC | Moderado | pT4N0 | 8 | 0/14 | No | 239,5 | 239,5 | Vivo |
| 26 | DPC | No registrado | pT4N1 | Sí | 4,6 | 5,1 | Fallecimiento | ||
| 27 | DPC | No registrado | pT2N0 | 12 | No registrado | 12,4 | 13,2 | Fallecimiento |
Bien dif.: bien diferenciado; DD: duodenectomía; DPC: duodenopancreatectomía cefálica; post-IQ: postoperatorio; SLE: supervivencia libre enfermedad.
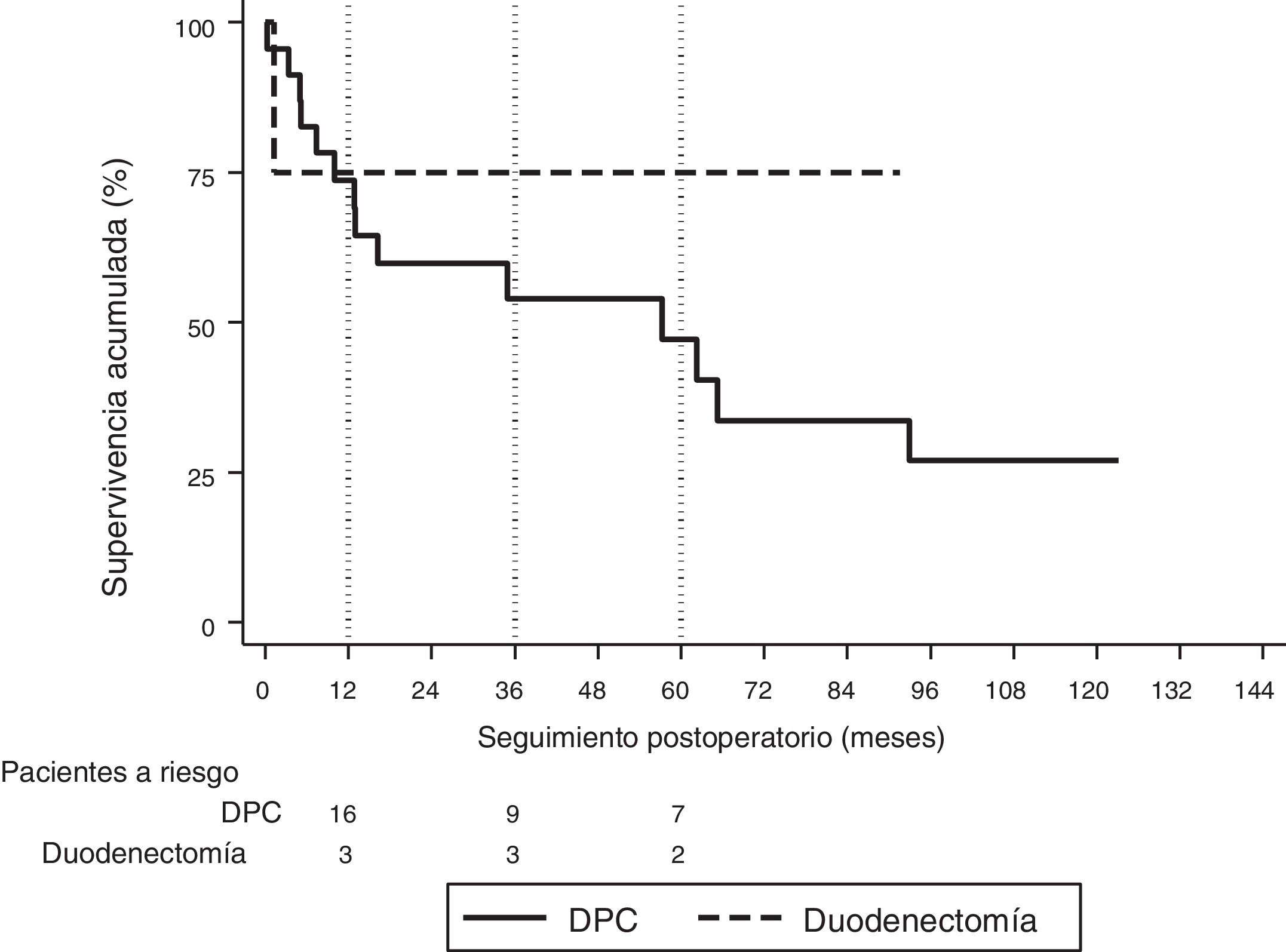
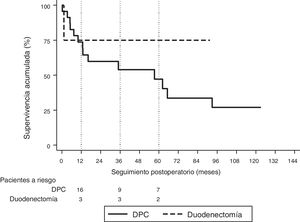
La mediana de seguimiento fue de 23 (9-69,7) meses. Durante este período, 15 (55%) pacientes han fallecido (14 DPC y 1 DD) y 12 (44%) pacientes están vivos (9 DPC y 3 DD). La supervivencia global a 1, 3 y 5 años en la DPC fue del 74, el 54 y el 47%, respectivamente, mientras que en la DD fue del 75%, tanto al año como a los 3 y 5 años. No se hallaron diferencias estadísticamente significativas entre ambas técnicas (fig. 2).
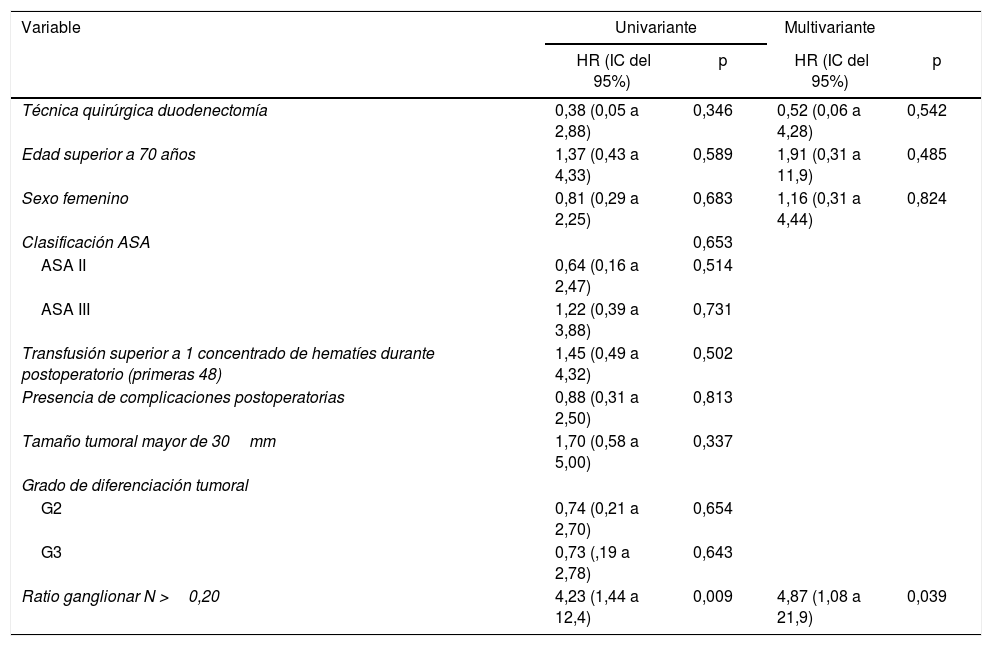
La mediana de supervivencia global fue de 62,2 (25,2 a 99,1) meses. De todas las variables analizadas en el estudio univariante, únicamente la ratio ganglionar mayor de 0,20 fue factor de riesgo de mortalidad a largo plazo (p=0,009), confirmándose este resultado en el análisis multivariante (tabla 5).
Estudio de factores de riesgo de mortalidad a largo plazo tras cirugía por adenocarcinoma duodenal. Hospital Universitari de Bellvitge (1990-2017)
| Variable | Univariante | Multivariante | ||
|---|---|---|---|---|
| HR (IC del 95%) | p | HR (IC del 95%) | p | |
| Técnica quirúrgica duodenectomía | 0,38 (0,05 a 2,88) | 0,346 | 0,52 (0,06 a 4,28) | 0,542 |
| Edad superior a 70 años | 1,37 (0,43 a 4,33) | 0,589 | 1,91 (0,31 a 11,9) | 0,485 |
| Sexo femenino | 0,81 (0,29 a 2,25) | 0,683 | 1,16 (0,31 a 4,44) | 0,824 |
| Clasificación ASA | 0,653 | |||
| ASA II | 0,64 (0,16 a 2,47) | 0,514 | ||
| ASA III | 1,22 (0,39 a 3,88) | 0,731 | ||
| Transfusión superior a 1 concentrado de hematíes durante postoperatorio (primeras 48) | 1,45 (0,49 a 4,32) | 0,502 | ||
| Presencia de complicaciones postoperatorias | 0,88 (0,31 a 2,50) | 0,813 | ||
| Tamaño tumoral mayor de 30mm | 1,70 (0,58 a 5,00) | 0,337 | ||
| Grado de diferenciación tumoral | ||||
| G2 | 0,74 (0,21 a 2,70) | 0,654 | ||
| G3 | 0,73 (,19 a 2,78) | 0,643 | ||
| Ratio ganglionar N >0,20 | 4,23 (1,44 a 12,4) | 0,009 | 4,87 (1,08 a 21,9) | 0,039 |
ASA: American Society of Anesthesiologists; IC intervalo de confianza; HR: hazard ratio.
Del total de la serie, 13 pacientes (48%) han presentado recidiva, 10 fallecieron y 3 siguen vivos; todos ellos habían sido tratados mediante DPC. La supervivencia actuarial libre de enfermedad a 1, 3 y 5 años fue del 71, el 55 y el 49%, respectivamente. Y la mediana de supervivencia libre de enfermedad fue de 49 (0 a 133) meses (tabla 4). Ninguna de las variables analizadas fue factor de riesgo de recidiva a largo plazo en el estudio univariante ni multivariante.
DiscusiónEn la literatura existen pocas publicaciones acerca de los resultados quirúrgicos del AD16. La elección de la técnica quirúrgica (DPC vs. DD) se basa en la localización del tumor y en la presencia de infiltración pancreática. Clásicamente, la técnica de elección para el AD era la DPC6 por ser considerada la única que podía ofrecer resultados oncológicos aceptables. Posteriormente, surgieron publicaciones con resultados comparables en términos de supervivencia para DD y DPC4,17,18. Aun así, sigue habiendo controversia sobre cuál es el abordaje oncológico más apropiado y existen autores en la actualidad que defienden la DPC como el mejor tratamiento11. En nuestra experiencia, la morbilidad tras la resección por AD es del 65% en el grupo DPC y el 75% en el grupo DD, sin diferencias estadísticamente significativas, resultados similares a otros autores4,19. Ahora bien, diversos grupos19,20 defienden la DD como técnica con similar morbilidad postoperatoria. Respecto a la mortalidad postoperatoria en nuestra serie es del 7%, similar a la publicada por otros1,4,19,21-23. De acuerdo con nuestros resultados, otros autores compararon la mortalidad postoperatoria entre DPC y DD, sin hallar diferencias estadísticamente significativas4,19. La mortalidad postoperatoria en el grupo DD por adenocarcinoma es elevada (1 de 4 pacientes); sin embargo, la causa de muerte del paciente que falleció en este grupo no estaba relacionada con la técnica quirúrgica. Revisando nuestra experiencia en la DD por diferentes indicaciones, hemos demostrado una mortalidad menor (4%)24,25.
Los factores pronósticos demostrados que influyen en la supervivencia del AD son numerosos. Algunos de ellos se refieren a la edad del paciente23,26, el sexo27, la diferenciación tumoral10,26 y el estadio tumoral26. Las variables relacionadas con el pronóstico del AD hasta el momento, en cuanto al estudio anatomopatológico, son la afectación del margen de resección1,4,10,18,21, el número de adenopatías resecadas, la afectación de adenopatías resecadas y la ratio ganglionar4,7,21,22,26,28,29. En nuestra serie, la afectación del margen de resección es nula en ambos grupos de estudio, con una supervivencia actuarial tras la resección del 52% a los 5 años. Varios autores han demostrado que la supervivencia se ve afectada si hay afectación de los márgenes de resección. En este sentido, Sohn et al.10 publican una supervivencia a 5 años del 58% en caso de R0 y del 0% en caso de R1. Valores similares son descritos por Poultsides et al.21, con una supervivencia a 5 años del 55% en R0 y del 0% en R1. La importancia de la linfadenectomía está bien documentada en la literatura, a pesar de no haber consenso sobre el número de ganglios a resecar4,7,21,22,26. Así, el AJCC recomienda resecar un mínimo de 6 ganglios en la cirugía del AD, a pesar de que hay autores que consideran que este número debe ser mayor para poder realizar una mejor estadificación3,21,28. Sarela et al.23 encontró diferencias estadísticamente significativas en supervivencia a 5 años entre aquellos pacientes pN0 y pN+cuando el número de ganglios resecados fue igual o mayor de 15. Por contra, si el número de ganglios resecados fue inferior a 15, los resultados de supervivencia a 5 años eran similares entre ambos grupos. En nuestro estudio, registramos un mayor número de ganglios tras la DPC comparado con la DD (22 vs. 12,5; p=0,016), a pesar de que esto no implicó mejor supervivencia. Otros autores demostraron resultados similares a nuestra experiencia. Así, Sakamoto et al.11 publicó una serie con una media de 26 ganglios resecados en el grupo DPC vs. 14 ganglios en el grupo DD (p=0,001), sin diferencias en supervivencia entre ambos grupos. En la misma línea, Cloyd et al.26 mostraron resultados de una linfadenectomía con mayor número de ganglios en la DPC respecto a la DD (11 ± 8,9 vs. 6,8 ± 7,8; p <0,0001), sin cambios en la supervivencia a largo plazo entre ambos grupos. Varios autores evidenciaron que la ratio ganglionar (ganglios afectados/ganglios resecados) es el predictor pronóstico más apropiado21,26,28,29. En esta línea, en nuestra serie la ratio ganglionar fue la única variable que ha demostrado ser un factor pronóstico de mortalidad a largo plazo. Finalmente, no hemos evidenciado diferencias en cuanto a supervivencia al comparar las 2técnicas quirúrgicas (DPC y DD)4,11,26. En nuestra serie, la supervivencia global tras la resección por AD es de 62,2 meses, siendo a los 5 años del 52%; resultados ligeramente superiores a los publicados, con una supervivencia entre 30-45 meses4,19,22,27 y una supervivencia a los 5 años entre el 23-48%1,4,19,21,22.
Al tratarse de una entidad poco frecuente, el número de pacientes es bajo a pesar de un período de estudio prolongado, por tanto, es difícil sacar conclusiones, siendo una de las limitaciones del estudio. Ahora bien, tras el análisis de nuestra experiencia y la de otros autores, podemos tener en cuenta ambas opciones quirúrgicas dependiendo de la localización tumoral y el grado de afectación pancreática.
ConclusiónLa resección quirúrgica del AD comporta una elevada morbilidad postoperatoria, sin embargo, consigue una supervivencia prolongada. Dependiendo de la localización y en ausencia de infiltración pancreática, la DD segmentaria con márgenes libres es una alternativa a la DPC.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.