La tasa de donación en España durante 2017 fue de 43,3 por millón de habitantes, gracias a un incremento del 30% de la donación en asistolia, a expensas de la donación en asistolia controlada (DAc)1. Otra manera de optimizar el número de injertos hepáticos es el trasplante dominó (THD). En este procedimiento, el receptor del trasplante es, a su vez, donante vivo de su propio hígado. La polineuropatía amiloidótica familiar (PAF) es una enfermedad metabólica autosómica dominante en la que se sintetiza transtiretina mutada2. Dado que el 95% de la transtiretina mutada se sintetiza en el hígado y la función hepática es rigurosamente normal, se planteó el TH como primer tratamiento curativo3. A su vez, el hígado PAF se puede utilizar como injerto en un segundo receptor2. El Domino Liver Transplant Registry, creado en 1999, contabiliza un total de 1187 trasplantes dominó realizados en 63 centros diferentes de 21 países hasta el 31 de diciembre de 20174. El programa THD en nuestro hospital comenzó en 2004. El desafío técnico de este procedimiento reside en la necesidad de reconstruir el drenaje venoso suprahepático en el hígado PAF y evitar el desarrollo de un síndrome de Budd-Chiari5.
Presentamos el caso clínico de un trasplante hepático dominó con un injerto procedente de donante en asistolia controlada. Mujer de 62 años con PAF estadio funcional «Coutinho 1» (deambulación sin alteraciones, principalmente neuropatía sensorial, motora y autónoma leve en las extremidades inferiores). Inicialmente, se le propuso tafamidis 20mg/24h vo. (Vyndaqel®, Pfizer Inc., Nueva York, NY, EE. UU.)2. Debido a que su hermano con PAF se había sometido años atrás a un TH, decidió optar por este procedimiento. Dio su consentimiento para donar su hígado completo y poder llevar a cabo un THD. Recibió un injerto hepático de un DAc, un varón de 45 años con anoxia cerebral secundaria a un infarto de miocardio masivo. Su familia aceptó la propuesta de limitación del esfuerzo terapéutico. La consulta para la donación multiorgánica fue un proceso independiente del consentimiento para retirar el apoyo. Al no disponer en ese momento de la bomba para la perfusión regional en normotermia (PRN), realizamos la extracción hepática y renal tras canulación ultrarrápida. El tiempo de isquemia caliente funcional (minutos transcurridos entre la presión arterial sistólica <60mmHg hasta que se inició la perfusión fría de los órganos) fue de 11min, y el hígado se perfundió con Celsior (3 L a través de la aorta y 2 L a través de la vena mesentérica inferior). El peso del injerto fue de 1,114kg, y no hubo variantes anatómicas arteriales.
La paciente afectada de PAF recibió el injerto de DAc después de un tiempo de isquemia fría (TIF) de 290min. Las velocidades de flujo arterial y portal fueron de 193ml/min y 754ml/min, respectivamente. La colédoco-coledocostomía no se tutorizó con tubo en T. No se precisaron hemoderivados intraoperatorios. No se objetivó síndrome de reperfusión, atendiendo a los criterios previamente publicados6. El receptor del injerto con PAF (segundo receptor del THD) fue un varón de 66 años con cirrosis alcohólica. La reconstrucción de las venas suprahepáticas del injerto con PAF se realizó según técnica descrita previamente en banco7. En este caso, el TIF fue de 255min y las velocidades de flujo arterial y portal fueron de 197ml/min y 1800ml/min, respectivamente. Ambos procedimientos cursaron sin incidencias desde el punto de vista técnico. El régimen inmunosupresor fue similar para los dos receptores (tacrolimus, micofenolato y esteroides).
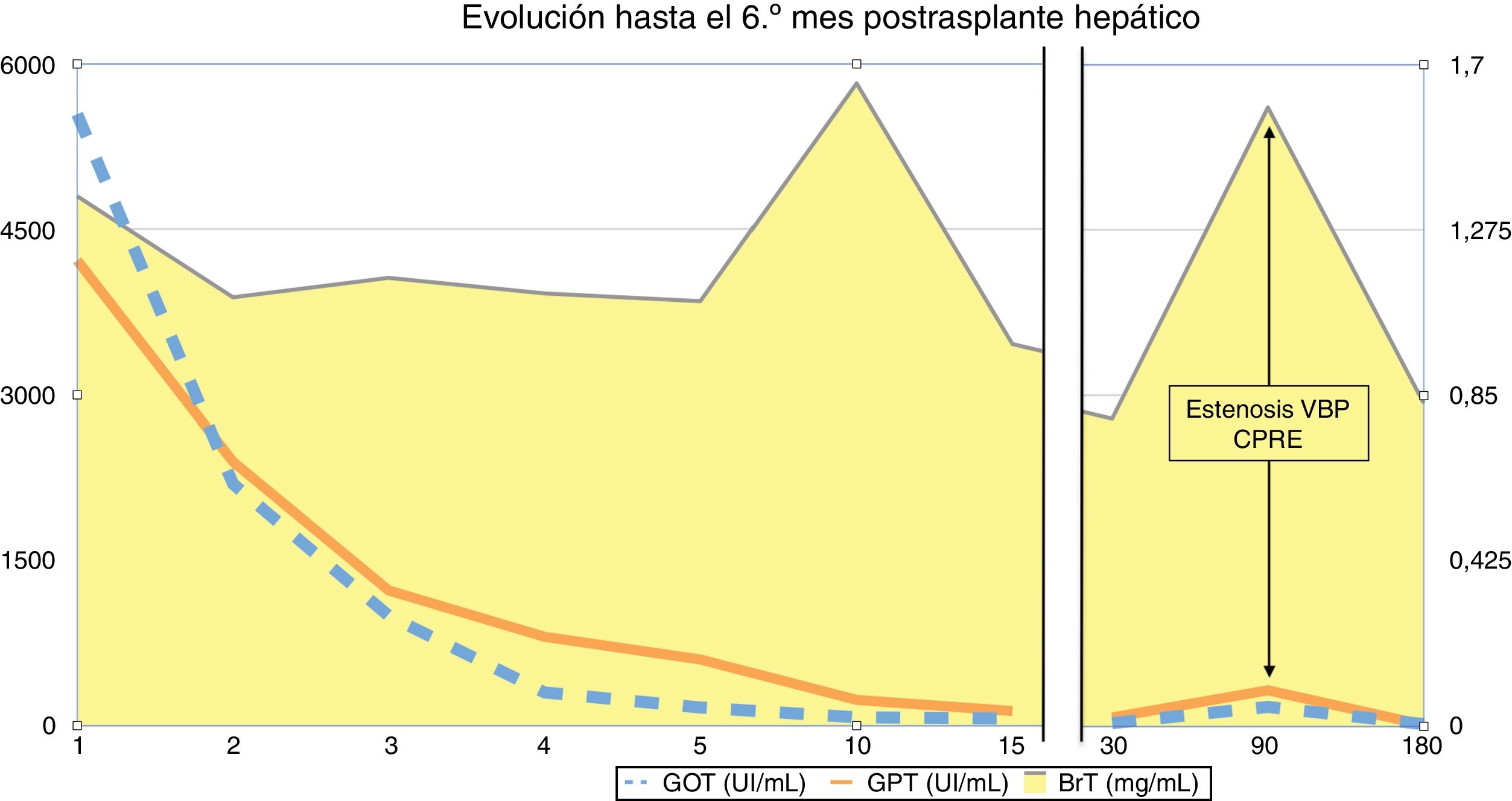
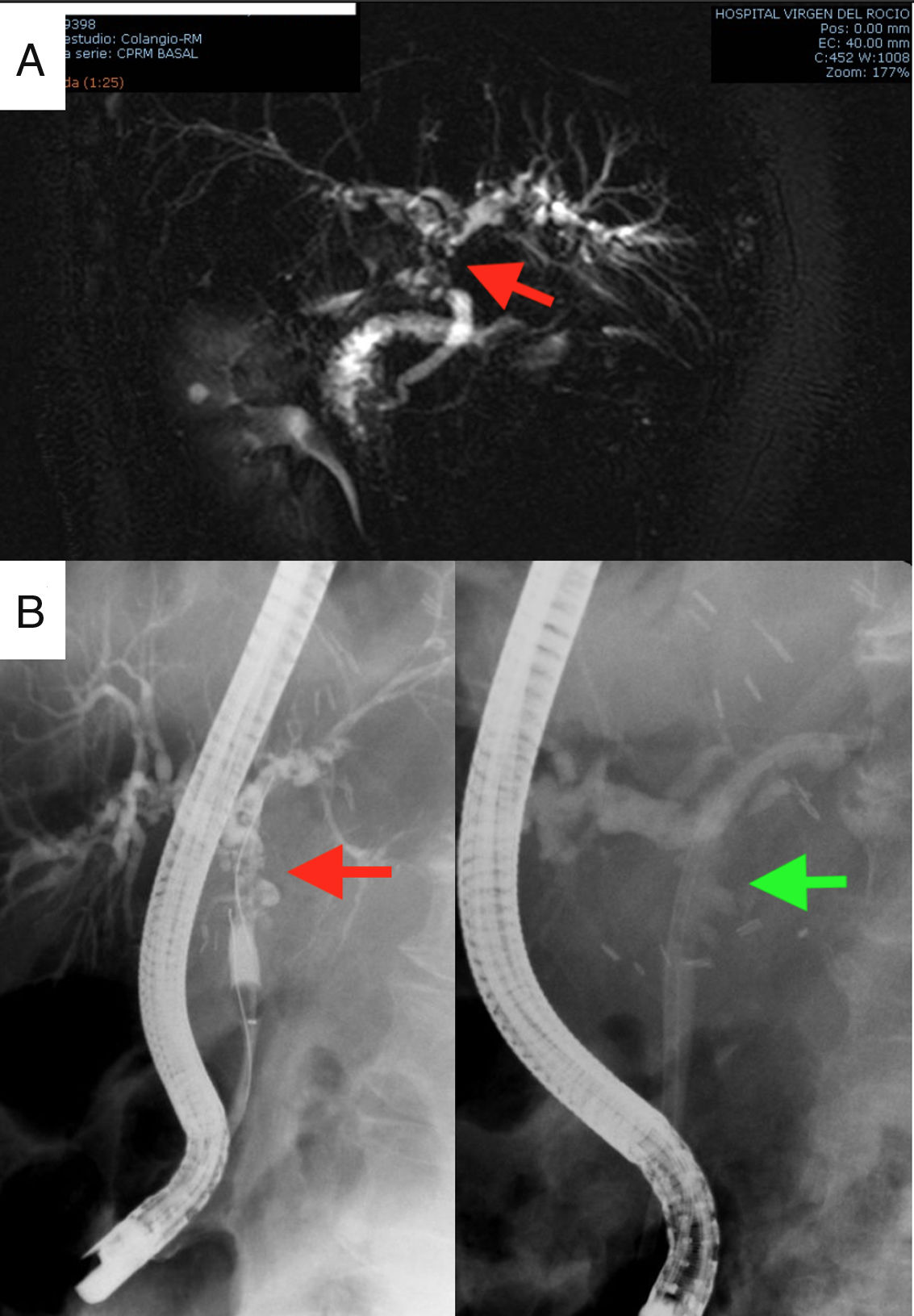
En relación a la paciente afectada de PAF cumplió criterios de disfunción hepática de Olthoff8, con un pico de transaminasas que se normalizó en los 5 primeros días postrasplante (fig. 1). La ecografía Doppler mostró permeabilidad del injerto de DAc (arteria hepática, vena porta y venas hepáticas). Se dio de alta el 19.° día postoperatorio. En el 3.er mes postrasplante, la paciente presentó colestasis e ictericia leve, motivo por el cual indicamos una colangio-RMN (fig. 2A). Fue informada como estenosis anastomótica sin datos de colangiopatía isquémica. Se colocó una endoprótesis plástica con éxito mediante endoscopia (fig. 2B). La bioquímica hepática a los 6 meses de seguimiento es normal (fig. 1). No se ha repetido la colangio-RMN puesto que no ha presentado nuevos datos que hagan sospechar colangiopatía isquémica.
Pruebas complementarias. Colangiorresonancia que diagnostica la estenosis anastomótica, señalada con la flecha roja A), y colangiopancreatografía retrógrada endoscópica terapeútica para la colocación de endoprótesis plástica biliar. La flecha de la imagen de la izquierda muestra la estenosis y en la imagen de la derecha la estenosis tutorizada mediante prótesis plástica B).
Gracias al Real Decreto 1723/2012 (BOE n.° 313, 29 de diciembre de 2012) se legisla la limitación del esfuerzo terapéutico en España. De esta manera, la tasa de TH con DAc ha registrado un incremento evidente hasta nuestros días. La mayoría de los centros españoles han abandonado paulatinamente la canulación ultrarrápida en beneficio de la PRN ya que presenta mejores resultados en términos de eficacia (supervivencia del paciente y del injerto) y seguridad (menor tasa de colangiopatía isquémica). Basándonos en la reciente evidencia científica disponible, nuestro grupo también emplea la PRN desde 2017 para la DAc9,10. Hasta donde tenemos conocimiento, esta es la primera descripción del uso de un DAc para un THD. El injerto de un DAc es una opción segura para THD bajo estrictos criterios de selección.