El estudio de los ganglios linfáticos supone el factor pronóstico más importante en el cáncer colorrectal sin metástasis. La técnica del ganglio centinela identifica el ganglio que mejor predice el estado ganglionar de un paciente y permite realizar en él técnicas de estudio intensivo que mejoran la estadificación. El objetivo del trabajo es estudiar la eficacia de la técnica del ganglio centinela en la estadificación del cáncer de colon.
Material y métodosEstudio prospectivo con 125 pacientes diagnosticados preoperatoriamente de cáncer de colon sin metástasis a distancia desde septiembre de 2009 hasta diciembre de 2011 en el Hospital Universitario de Álava-Txagorritxu en Álava. Realizamos la técnica del ganglio centinela ex vivo y con azul de metileno. El ganglio centinela se estudió realizando secciones múltiples y técnicas de inmunohistoquímica, además de hematoxilina-eosina. Realizamos un estudio comparativo con un grupo control con 170 pacientes estudiado de forma convencional mediante sección única y tinción de hematoxilina-eosina.
ResultadosIdentificamos el ganglio centinela en el 98% de los casos, con una tasa de falsos negativos del 5,6%. La supraestadificación lograda en el grupo con estudio del ganglio centinela se encuentra en el 14,2% con respecto al grupo estudiado convencionalmente (p = 0,006).
ConclusionesEl estudio del ganglio centinela realizado ex vivo y con azul de metileno predice el estado ganglionar de los pacientes con cáncer de colon. Esta técnica supraestadifica, pasando al estadio iii a pacientes que el estudio convencional determinaba como estadios i y ii, permitiendo que accedan a un tratamiento quimioterápico que podría mejorar su pronóstico.
The level of lymph node involvement is the most important factor in staging colorectal cancer without metastasis. Sentinel lymph node mapping identifies the node(s) that most accurately reflect the lymph node status of patients, and intensive techniques that improve staging can be focused on these nodes. The aim of this study was to assess the efficacy of ex vivo sentinel lymph node mapping in the staging of colon cancer.
Materials and methodsA prospective study was conducted on 125 patients from the Alava-Txagorritxu University Hospital Health Region (Alava), who were diagnosed prior to surgery with colon cancer without distant metastasis from September 2009 to December 2011. Ex vivo sentinel lymph node mapping with methylene blue was use in these patients to study the sentinel nodes with multiple slices using immunohistochemical techniques and haematoxylin-eosin staining. A comparative study was also performed based on a control group of 170 patients staged with conventional techniques, and involving a single slice and haematoxylin-eosin staining.
ResultsThe sentinel lymph node identification rate was 98%, with 5.6% false negatives. Upstaging occurred in 14.2% of cases compared to the group studied using conventional techniques (P=.006).
ConclusionsEx vivo sentinel lymph node mapping with methylene blue accurately reflects the lymph node status of patients with colon cancer. This approach upstages patients classified as stages i and ii by conventional techniques to stage iii, indicating chemotherapy that may improve their prognosis.
El estadio tumoral, incluyendo una evaluación adecuada de las metástasis ganglionares, constituye el factor pronóstico más importante en el cáncer colorrectal (CCR). Dependiendo de la estadificación TNM, los pacientes tienen una tasa de supervivencia diferente. Así, estadios precoces (i y ii) presentan tasas de supervivencia entre el 93 y el 82%, mientras que la presencia de metástasis ganglionares (estadio iii) disminuye la supervivencia a un 59% a los 5 años1.
El 50% de enfermos con CCR se encuentra en estadios iniciales sin metástasis ganglionares y son tratados con cirugía potencialmente curativa. Sin embargo, un 20-30% morirán por su enfermedad en los primeros 5 años2. Este elevado porcentaje puede explicarse en parte por la infraestadificación que sufren estos pacientes al no lograrse un estudio ganglionar correcto. Debemos tener en cuenta que el tratamiento con quimioterapia de los enfermos con ganglios infiltrados ha mejorado su supervivencia, disminuyendo la mortalidad más del 30%3.
La AJCC recomienda estudiar al menos 12 ganglios para lograr una correcta estadificación2. Para mejorar la estadificación de pacientes con CCR se propone realizar técnicas de estudio intensivo en los ganglios. Sin embargo, el gran consumo de recursos que se precisaría para su realización en todos los ganglios no lo hace viable.
El concepto de ganglio centinela (GC) se basa en la progresión organizada de células tumorales por el drenaje linfático desde el tumor primario hasta ese primer ganglio. Así, el GC es el que mayor riesgo tiene de metástasis y el que mejor puede predecir el estado ganglionar del paciente. La identificación del GC permite realizar en él técnicas intensivas rentabilizando su uso. El objetivo principal del estudio es determinar la eficacia de la técnica del GC realizada ex vivo y con colorante en la estadificación del cáncer de colon (CC).
Material y métodosEstudio transversal, cruzado y unicéntrico en el que se determina la eficacia del estudio del GC en la estadificación del CC. Se incluyó a 125 pacientes del área sanitaria del Hospital Universitario de Álava-Txagorritxu en Álava. La selección de la cohorte fue prospectiva desde septiembre de 2009 hasta diciembre de 2011, incluyendo todos los casos sin realizar aleatorización. El diagnóstico se realizó mediante colonoscopia, TC abdominopélvica y radiografía de tórax. La técnica del GC fue realizada por 5 cirujanos con experiencia previa en la técnica del GC en el CC con 10 casos por cirujano. Los criterios de inclusión fueron: CC, cirugía electiva, cirugía curativa y mayor de 18 años. Se excluyeron el estadio iv, la cirugía urgente y paliativa y el cáncer de recto.
Realizamos de forma adicional un estudio comparativo con una muestra control en la que solo se realizó estudio anatomopatológico convencional (sección única y tinción con hematoxilina-eosina). Este grupo comprendió 170 pacientes intervenidos consecutivamente desde febrero de 2009 hacia atrás en el tiempo hasta junio de 2006. Fueron intervenidos por los mismos cirujanos y cumplían los mismos criterios de inclusión que los del estudio del GC. El estudio anatomopatológico no fue realizado por los anatomopatólogos que estudiaron el grupo con técnica del GC. La información requerida de este grupo de pacientes se obtuvo mediante revisión de historias clínicas.
La variable principal fue la modificación de la estadificación debida al estudio del GC. Otras variables fueron la edad y sexo del paciente, localización y clasificación T y N tumoral, número total de ganglios y de GC, número de ganglios infiltrados en el estudio convencional y en el estudio del GC, así como el tipo de afectación.
Los procedimientos cumplen los principios de la Declaración de Helsinki de 1964, enmendada en 2008 en Seúl. Este estudio ha sido aprobado por el Comité Ético de Investigación Clínica del Hospital Universitario Álava-Txagorritxu.
Identificación del ganglio centinelaSe realiza ex vivo, tras la resección de la pieza quirúrgica. Infiltramos peritumoralmente y en la subserosa 1-2mL de azul de metileno, dependiendo del tamaño del tumor. Realizamos un masaje durante 5-10 min, consiguiendo que el colorante se disemine por los conductos linfáticos y tiña los ganglios. La disección del mesocolon se inicia próxima a la tumoración, siguiendo los trayectos teñidos. Consideramos GC los primeros 1-4 ganglios teñidos y aquellos a los que, aun sin estar teñidos, llega directa y claramente un conducto linfático que sí lo está4.
Estudio intensivo del ganglio centinelaSe realizaron cortes de 2mm de grosor. En ganglios menores de 5mm se realizó un único corte. Tras fijación en formol tamponado al 4% durante 24 h se realizaron 6 secciones de 4μm. Se aplicaron secuencialmente técnicas de tinción de hematoxilina-eosina y de inmunohistoquímica (anticuerpo monoclonal anticitoqueratina CAM 5.2), de forma que 3 secciones fueron estudiadas con cada técnica.
Interpretación del estudio anatomopatológicoSegún la clasificación de la AJCC5 consideramos metástasis la afectación mayor de 2mm, micrometástasis entre 2mm y 0,2mm y grupos tumorales de colonias y células aisladas la afectación igual o menor de 0,2mm. La presencia de metástasis y micrometástasis modificó la estadificación al considerarse pN1 y pN1mi respectivamente. Las lesiones de 0,2mm o menores no la modificaron, debiendo ser consideradas pN0(i+). El resto de ganglios se estudió de forma convencional mediante sección única y tinción con hematoxilina-eosina.
Análisis estadísticoSe describieron las variables cuantitativas mediante medias y desviaciones estándar y las cualitativas mediante frecuencias y porcentajes. La similitud de las muestras se comprobó mediante las pruebas de la T de Student y Chi cuadrado. Esta última prueba se utilizó también para la comparación entre proporciones de ganglios infiltrados y supraestadificación. Se hizo el análisis de la validez de la prueba diagnóstica, obteniendo la sensibilidad y especificidad y los correspondientes intervalos de confianza, respecto del patrón de oro (estudio convencional de los ganglios). Se ha establecido la significación estadística en 0,05.
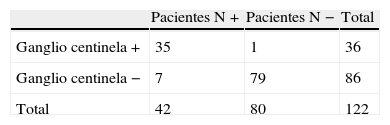
ResultadosGrupo estudiado con técnica del ganglio centinelaLa identificación del GC se logró en 122 (97,6%) de los 125 pacientes, determinándose un 2,4% de fallo de la técnica. El estudio del GC detectó infiltración del GC en 36 (29,5%) de los 122 pacientes (tabla 1). El GC predice el estado ganglionar total en 115 de los 122 casos, con lo que la exactitud de la prueba fue del 93,4% (IC 95%: 89,1-97,8%), mientras que la sensibilidad fue del 83,3% (IC 95%: 72,1-94,6%) y la especificidad del 98,8% (IC 95%: 96,3-100%).
El estudio del GC detectó metástasis ganglionares en 18 de los 25 pacientes con metástasis en el estudio convencional (ganglios +) (tabla 2). Así, existen 7 de 122 pacientes con ausencia de metástasis en los GC y, al menos, otro ganglio afectado. Por tanto, la tasa de falsos negativos fue de 5,7%.
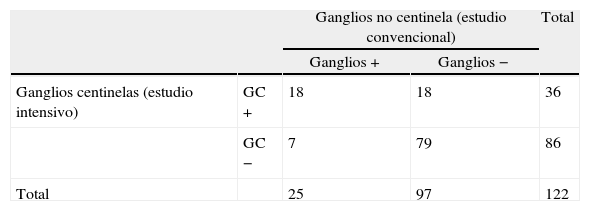
Grupo estudiado con técnica del ganglio centinela. Distribución de pacientes por el resultado anatomopatológico de los ganglios linfáticos según la técnica empleada: estudio convencional/estudio intensivo (técnica ganglio centinela)
| Ganglios no centinela (estudio convencional) | Total | |||
| Ganglios + | Ganglios − | |||
| Ganglios centinelas (estudio intensivo) | GC + | 18 | 18 | 36 |
| GC − | 7 | 79 | 86 | |
| Total | 25 | 97 | 122 | |
El estudio del GC demostró afectación ganglionar en 18 (18,6%) de los 97 pacientes sin metástasis en el estudio convencional (ganglios −) (tabla 2). El estudio intensivo de los GC en estos 18 pacientes detectó metástasis en 12, micrometástasis en 5 y un único paciente con células tumorales aisladas (CTA). Así, la supraestadificación lograda con la técnica del GC en este grupo fue de 18,6%.
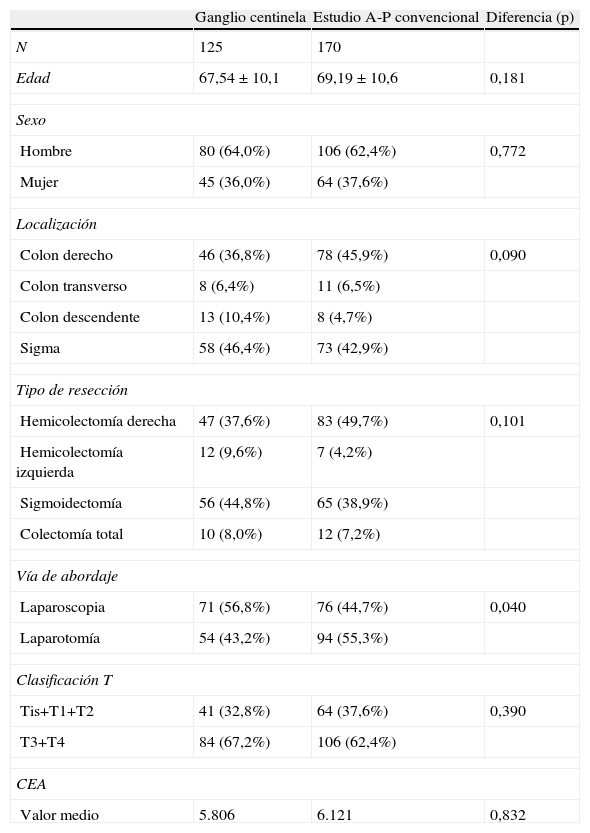
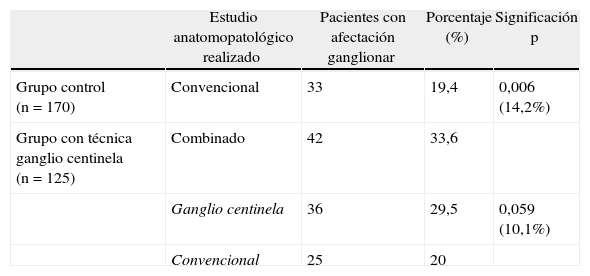
Comparación entre el grupo con técnica del ganglio centinela y el grupo con estudio convencionalEn la tabla 3 se comprueba la homogeneidad de los 2 grupos comparados, encontrándose la única diferencia entre ambas muestras en la vía de abordaje. En el grupo control, estudiado de forma convencional, detectamos metástasis ganglionares en 33 (19,4%) de los 170 pacientes (tabla 4), mientras que en el grupo con estudio del GC detectamos infiltración ganglionar en 42 (33,6%) de los 125 pacientes. Es decir, el estudio del GC encontró un 14,2% más de pacientes con infiltración ganglionar, siendo la diferencia estadísticamente significativa. Por tanto, la supraestadificación lograda mediante la técnica del GC fue de 14,2%. En la tabla 4 se muestra que en el grupo con técnica del GC, el estudio del GC detecta por sí solo afectación ganglionar en 36 (29,5%) de los 125 pacientes. Esto supone un 10% más de pacientes con infiltración ganglionar con respecto al grupo control (19,4%). Por el contrario, el estudio convencional detectó un porcentaje casi idéntico de pacientes con metástasis ganglionares en los 2 grupos (19,4 y 20% respectivamente).
Características de los pacientes del grupo con estudio del ganglio centinela y del grupo control
| Ganglio centinela | Estudio A-P convencional | Diferencia (p) | |
| N | 125 | 170 | |
| Edad | 67,54 ± 10,1 | 69,19 ± 10,6 | 0,181 |
| Sexo | |||
| Hombre | 80 (64,0%) | 106 (62,4%) | 0,772 |
| Mujer | 45 (36,0%) | 64 (37,6%) | |
| Localización | |||
| Colon derecho | 46 (36,8%) | 78 (45,9%) | 0,090 |
| Colon transverso | 8 (6,4%) | 11 (6,5%) | |
| Colon descendente | 13 (10,4%) | 8 (4,7%) | |
| Sigma | 58 (46,4%) | 73 (42,9%) | |
| Tipo de resección | |||
| Hemicolectomía derecha | 47 (37,6%) | 83 (49,7%) | 0,101 |
| Hemicolectomía izquierda | 12 (9,6%) | 7 (4,2%) | |
| Sigmoidectomía | 56 (44,8%) | 65 (38,9%) | |
| Colectomía total | 10 (8,0%) | 12 (7,2%) | |
| Vía de abordaje | |||
| Laparoscopia | 71 (56,8%) | 76 (44,7%) | 0,040 |
| Laparotomía | 54 (43,2%) | 94 (55,3%) | |
| Clasificación T | |||
| Tis+T1+T2 | 41 (32,8%) | 64 (37,6%) | 0,390 |
| T3+T4 | 84 (67,2%) | 106 (62,4%) | |
| CEA | |||
| Valor medio | 5.806 | 6.121 | 0,832 |
Comparación de pacientes con infiltración ganglionar según el tipo de estudio anatomopatológico realizado en los 2 grupos (Grupo control/Grupo técnica GC)
| Estudio anatomopatológico realizado | Pacientes con afectación ganglionar | Porcentaje (%) | Significación p | |
| Grupo control (n = 170) | Convencional | 33 | 19,4 | 0,006 (14,2%) |
| Grupo con técnica ganglio centinela (n = 125) | Combinado | 42 | 33,6 | |
| Ganglio centinela | 36 | 29,5 | 0,059 (10,1%) | |
| Convencional | 25 | 20 |
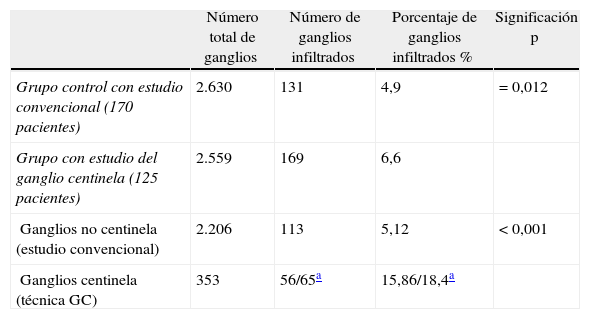
En el grupo de estudio del GC se extrajeron una media de 20,5 ganglios (rango: 3-58), mientras que en el grupo control la media fue de 15,5 ganglios (rango: 0-62), siendo esta diferencia estadísticamente significativa (p < 0,001). En la tabla 5 se muestra que en el grupo con estudio del GC se detectó infiltración ganglionar en 169 (6,6%) de los 2.559 ganglios examinados, mientras que en el grupo control detectamos metástasis en 131 (4,9%) de los 2.630 ganglios encontrados. Así, en el grupo con estudio del GC se detectó un mayor porcentaje de ganglios infiltrados que en el estudio convencional del grupo control, siendo la diferencia estadísticamente significativa (p = 0,012). El estudio convencional detectó un porcentaje similar de ganglios infiltrados en los 2 grupos estudiados (4,9 y 5,1%).
Comparación de la infiltración metastásica ganglionar según el tipo de estudio anatomopatológico en los 2 grupos (grupo control/grupo estudio GC)
| Número total de ganglios | Número de ganglios infiltrados | Porcentaje de ganglios infiltrados % | Significación p | |
| Grupo control con estudio convencional (170 pacientes) | 2.630 | 131 | 4,9 | = 0,012 |
| Grupo con estudio del ganglio centinela (125 pacientes) | 2.559 | 169 | 6,6 | |
| Ganglios no centinela (estudio convencional) | 2.206 | 113 | 5,12 | < 0,001 |
| Ganglios centinela (técnica GC) | 353 | 56/65a | 15,86/18,4a |
Además, en la tabla 5 se muestra la diferencia en la afectación ganglionar dentro del grupo con estudio del GC. El estudio de los 353 GC detectó mayor afectación ganglionar que el estudio convencional de los 2.206 ganglios no centinelas, siendo la diferencia estadísticamente significativa (p < 0,001).
DiscusiónLa afectación ganglionar es el factor pronóstico aislado más importante en el CCR. Existen estudios6–9 que demuestran que la supervivencia aumenta al incrementar el número de ganglios estudiados, especialmente si estos son negativos. Una correcta estadificación del CCR incluye identificar al menos 12 ganglios, de forma que un número menor puede suponer infraestadificación y peor pronóstico, al no beneficiarse el paciente del tratamiento adyuvante.
El número de ganglios detectados en la pieza quirúrgica depende de múltiples factores, entre ellos las limitaciones del estudio anatomopatológico. A la dificultad intrínseca de la técnica se añade que el 70% de los ganglios infiltrados miden menos de 5mm, siendo probable que no sean detectados10. Además, el estudio mediante sección única permite el análisis únicamente del 1% del tejido ganglionar, por lo que lesiones tumorales de pequeño tamaño con localización subcapsular pueden pasar inadvertidas11.
La técnica del GC aporta un ganglio que puede predecir con fiabilidad el estado ganglionar total del paciente, permitiendo su estudio con técnicas intensivas sin un importante consumo de recursos. Numerosos estudios4,11–14 ofrecen resultados de supraestadificación del 10-20% con el empleo de técnicas de inmunohistoquímica y de biología molecular (reacción en cadena de la polimerasa con transcriptasa inversa [RT-PCR]). La realización de secciones múltiples mejora la estadificación hasta un 9%15.
El empleo de radioisótopos es la norma en el cáncer de mama y melanoma. Sin embargo, está descrito que el empleo del colorante es una buena alternativa16. Desde nuestro punto de vista, la técnica con colorante es más sencilla ya que no precisa la colaboración de servicios como Medicina Nuclear y Digestivo. Además, evitamos los riesgos de la colonoscopia necesaria para infiltrar el radiotrazador. Por ello, y dada la no existencia de estudios que confirmen que el empleo de radiotrazadores logra mejores resultados, creemos que el empleo de colorantes como el azul de metileno es la técnica más recomendable en el estudio del GC en el CCR.
El drenaje linfático aberrante y una mejor circulación linfática cuando la pieza no ha sido resecada son los argumentos a favor de la técnica in vivo. El primero supone la existencia de metástasis ganglionares fuera de los límites de la resección estándar. Sin embargo, su frecuencia es baja, oscilando entre el 2 y el 8%, no siendo pocos los grupos que ni siquiera la detectan17,18. En lo referente al drenaje linfático en la pieza extirpada, la experiencia en el cáncer de mama y el melanoma sirven para confirmar que un masaje sobre la zona infiltrada permite una diseminación adecuada del colorante por la circulación linfática19. Además, la resección quirúrgica interrumpe el mecanismo neurológico que regula la constricción de los conductos linfáticos, facilitando la circulación linfática20.
Wong et al21 publicaron en 2001 la primera serie larga de pacientes estudiados con técnica del GC ex vivo. Los resultados logrados en este estudio y en otros publicados posteriormente son similares a los logrados cuando se emplea la técnica in vivo20–23. Como argumentos a favor de la técnica ex vivo podemos decir que evita el riesgo de perforación y diseminación de células tumorales por la manipulación de la neoplasia en el paciente, evita reacciones anafilácticas del contraste, no modifica la técnica quirúrgica y permite su realización por un cirujano ajeno a la intervención, permitiendo una curva de aprendizaje más corta. Además, la principal ventaja es, desde nuestro punto de vista, su mayor sencillez, lo cual tiene una especial importancia en neoplasias de gran tamaño o localizadas en el recto, y en la cirugía laparoscópica. Así, grupos que emplean habitualmente la técnica in vivo, la realizan ex vivo en los casos anteriormente referidos24,25.
La tasa de identificación del GC varía entre el 58 y el 100%, refiriendo la mayoría de los autores20–27 valores superiores al 95%, mientras que la tasa de falsos negativos se encuentra entre el 0 y el 10%. Estos resultados dependen fundamentalmente de la experiencia del equipo que realiza la técnica, así como de la cantidad de colorante infiltrada13. El tipo de técnica, ya sea in vivo o ex vivo, ya sea con radiotrazadores o colorantes, no parece influir en estos resultados20,28. En el cáncer de mama los parámetros de validación recomiendan al menos un 95% de tasa de identificación del GC y una tasa de falsos negativos del 5% o menor29. La curva de aprendizaje de la técnica del GC en el CCR es desconocida pero parece menor que en el cáncer de mama, siendo precisos entre 5 y 10 casos por cirujano30,31. Nuestro estudio ha sido realizado por cirujanos con una experiencia previa en 10 casos y logramos una identificación del GC en el 98% de los casos y una tasa de falsos negativos prácticamente del 5%.
La supraestadificación lograda en nuestro trabajo es del 14% en la comparación con el grupo control estudiado de forma convencional. Este valor es comparable a los publicados por grupos con más experiencia11–14,27. El estudio anatomopatológico convencional detecta un porcentaje similar de pacientes con ganglios infiltrados en los 2 grupos comparados (tabla 4). Por tanto, la supraestadificación lograda en el grupo con estudio del GC puede ser atribuida a la técnica del GC. Queremos reseñar que el objetivo del estudio del GC no es modificar la cirugía evitando la linfadenectomía. Así, logramos rescatar los casos responsables de la tasa de falsos negativos gracias al estudio convencional. El estudio anatomopatológico combinado se beneficia de la supraestadificación del estudio del GC, mientras que el estudio convencional resuelve los falsos negativos.
Queremos reseñar que el estudio convencional detecta en los 2 grupos comparados un porcentaje similar de ganglios con infiltración, por lo que el mayor número de ganglios infiltrados totales detectados en el grupo del GC puede ser atribuido a la técnica del GC (tabla 5).
Debemos finalizar remarcando que el valor pronóstico de las micrometástasis en los ganglios en la supervivencia del CC no es claro, siendo precisos estudios con mayor seguimiento evolutivo en estos pacientes32,33.
Concluimos que la técnica del GC realizada ex vivo y con azul de metileno predice el estado ganglionar de los pacientes con CC. La técnica del GC supraestadifica, pasando al estadio iii a pacientes que el estudio convencional clasificaba como estadios 0, i y ii, permitiendo que accedan a un tratamiento quimioterápico que podría mejorar su pronóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.