Durante los últimos años las técnicas de mastectomía y reconstrucción han evolucionado hacia procedimientos menos agresivos, mejorando la satisfacción y calidad de vida de la mujer. Por ello, la mastectomía se ha convertido en una opción válida tanto para mujeres con cáncer de mama como en mujeres de alto riesgo. El objetivo de este estudio es analizar la seguridad de la mastectomía y reconstrucción inmediata prepectoral con implante de poliuretano en mujeres con cáncer de mama y reducción de riesgo.
MétodosEstudio prospectivo observacional para evaluar la factibilidad y seguridad de la reconstrucción inmediata mediante implante prepectoral de poliuretano. Se incluyeron todas las mujeres (con cáncer de mama o alto riesgo para cáncer de mama) intervenidas mediante una mastectomía preservadora de piel o piel y pezón con reconstrucción inmediata con implante de poliuretano prepectoral. Se excluyeron las mujeres con sarcomas de mama, progresión de la enfermedad durante el tratamiento sistémico primario, reconstrucción diferida, autóloga o retropectoral y aquellas pacientes que no desearon participar en el estudio. Los procedimientos quirúrgicos fueron realizados tanto por cirujanos senior como junior. Todas las pacientes recibieron los tratamientos complementarios correspondientes. Se analizaron todos los eventos adversos acontecidos durante el seguimiento y los factores de riesgo para desarrollarlos.
ResultadosSe realizaron 159 reconstrucciones en 102 mujeres, el 80,4% por un carcinoma mamario. Catorce pacientes desarrollaron complicaciones, siendo el seroma y la dehiscencia de la herida las más frecuentes. Ocho mujeres precisaron una reintervención (5%), 7 de ellas por exposición del implante. Cuatro reconstrucciones (2,5%) culminaron con pérdida del implante. Tres pacientes presentaron progresión de su proceso oncológico: una recaída local en el colgajo de la mastectomía, una progresión axilar y una progresión sistémica.
ConclusionesLa reconstrucción prepectoral con implante de poliuretano es un procedimiento con una baja incidencia de complicaciones postoperatorias (8,8%) y pérdida de implante (2,5%). Su utilización es segura con los tratamientos perioperatorios oncológicos (quimioterapia neoadyuvante y radioterapia).
In recent years, mastectomy and reconstruction techniques have evolved towards less aggressive procedures, improving the satisfaction and quality of life of women. For this reason, mastectomy has become a valid option for both women with breast cancer and high-risk women. The objective of this study is to analyze the safety of mastectomy and immediate prepectoral reconstruction with polyurethane implant in women with breast cancer and risk reduction.
MethodObservational prospective study to evaluate the feasibility and safety of immediate reconstruction using prepectoral polyurethane implant. All women (with breast cancer or high risk for breast cancer) who underwent skin-sparing or skin-and-nipple-sparing mastectomy with immediate reconstruction with a prepectoral polyurethane implant were included. Women with breast sarcomas, disease progression during primary systemic therapy, delayed, autologous or retropectoral reconstruction, and those who did not wish to participate in the study were excluded. Surgical procedures were performed by both senior and junior surgeons. All patients received the corresponding complementary treatments. All adverse events that occurred during follow-up and the risk factors for developing them were analyzed.
Results159 reconstructions were performed in 102 women, 80.4% due to breast carcinoma. Fourteen patients developed complications, the most frequent being seroma and wound dehiscence. Eight women required a reoperation (5.0%), seven of them due to implant exposure. Four reconstructions (2.5%) resulted in loss of the implant. Three patients progressed from their oncological process: a local relapse in the mastectomy flap, an axillary progression and a systemic progression.
ConclusionsPrepectoral reconstruction with a polyurethane implant is a procedure with a low incidence of postoperative complications (8.8%) and implant loss (2.5%). Its use is safe with perioperative cancer treatments (neoadjuvant chemotherapy and radiotherapy).
Actualmente la mastectomía constituye un procedimiento quirúrgico necesario en la cirugía oncológica (CO) y en la cirugía de reducción de riesgo (CRR). Diferentes estudios1–3 han demostrado que la planificación de una reconstrucción inmediata tras mastectomía mejora la satisfacción y calidad de vida de la mujer y por ello se ha convertido en una opción que debe discutirse durante el proceso de la toma compartida de decisiones con la paciente.
Durante los últimos años las técnicas de mastectomía y reconstrucción mamaria han evolucionado hacia procedimientos menos agresivos y con una mayor preservación de los elementos anatómicos. Así, las mastectomías orientadas a una reconstrucción inmediata persiguen la preservación del envoltorio cutáneo de la mama, el surco inframamario y, en ocasiones, el complejo aréola-pezón (CAP). Por su parte, los procedimientos reconstructivos se han orientado a la colocación prepectoral del implante mamario que ha permitido una menor morbilidad postoperatoria y una reconstrucción más natural. Inicialmente estos implantes prepectorales se han cubierto con una malla, biológica o sintética, para mejorar su integración subcutánea si bien algunos autores4 han publicado recientemente el uso de implantes de poliuretano (IP) para evitar el uso de dichas mallas. En cualquier caso, diversos estudios5,6 han demostrado que la asociación de una mastectomía preservadora de piel (MPP) a una reconstrucción inmediata prepectoral (RIP) garantiza buenos resultados tanto en la CO como en la CRR.
A pesar de estas mejoras, actualmente persisten diversas incógnitas sobre la seguridad de la RIP tanto en el contexto de la CO como de la CRR. El objetivo de este estudio es analizar la seguridad de la mastectomía y RIP con IP en mujeres con cáncer de mama y reducción de riesgo, en términos de complicaciones quirúrgicas y pérdidas de implante, así como la seguridad oncológica y compatibilidad con los tratamientos adyuvantes. Para ello se presentan los resultados iniciales de un estudio prospectivo de la unidad de mama.
MétodosEstudio prospectivo observacional para evaluar la factibilidad y seguridad de la RIP mediante IP en mujeres con cáncer de mama y alto riesgo intervenidas desde noviembre de 2018 a octubre de 2021. El estudio ha sido valorado y aprobado por el comité ético asistencial del hospital con el código PreQ-20 y el número de referencia 2020/295. Posteriormente el protocolo del estudio ha sido registrado en la web ClinicalTrials.gov con el código NCT046425087.
Criterios de inclusión y exclusión. Se incluyeron mujeres mayores de edad intervenidas mediante una MPP o piel-pezón (MPPP), uni- o bilateral, y una RIP con IP. La población a estudio incluye 2 grupos de pacientes:
- -
Mujeres con carcinoma de mama. Pacientes con diagnóstico de carcinoma mamario (carcinoma infiltrante o ductal in situ) que precisan una mastectomía como tratamiento quirúrgico.
- -
Mujeres de alto riesgo para cáncer de mama. Mujeres con síndrome hereditario para cáncer de mama y ovario, con lesiones histológicas de alto riesgo asociado a antecedentes familiares o con diagnóstico previo de carcinoma de mama que durante su seguimiento han sido diagnosticadas de alto riesgo para cáncer de mama. Evaluadas en la consulta de alto riesgo y cuya CRR haya sido aprobada por el comité de tumores.
Se excluyeron las mujeres con sarcomas de mama, progresión de la enfermedad durante el tratamiento sistémico primario (TSP), reconstrucción diferida, autóloga o retropectoral) y aquellas pacientes que no desearon participar en el estudio. Se realizó una reconstrucción autóloga en mujeres con una mastectomía previa y radioterapia de pared, que realizaron una reconstrucción diferida. Se indicó una reconstrucción retropectoral en pacientes que precisan una resección amplia de tejido cutáneo, cuyo remanente cutáneo no permite albergar un implante.
Valoración prequirúrgica. Todas las pacientes fueron valoradas por el equipo quirúrgico de la unidad que indicó la mastectomía preservadora y valoró su viabilidad en cada paciente. Posteriormente esta propuesta fue aprobada por el comité multidisciplinar de mama. Además del estudio mamográfico y ecográfico, a todas las pacientes del estudio se les realizó una resonancia magnética (RM) para confirmar el tamaño y dispersión tumoral, valorar la distribución del tejido glandular y la grasa subcutánea, así como las transiciones grasas subclaviculares y esternales.
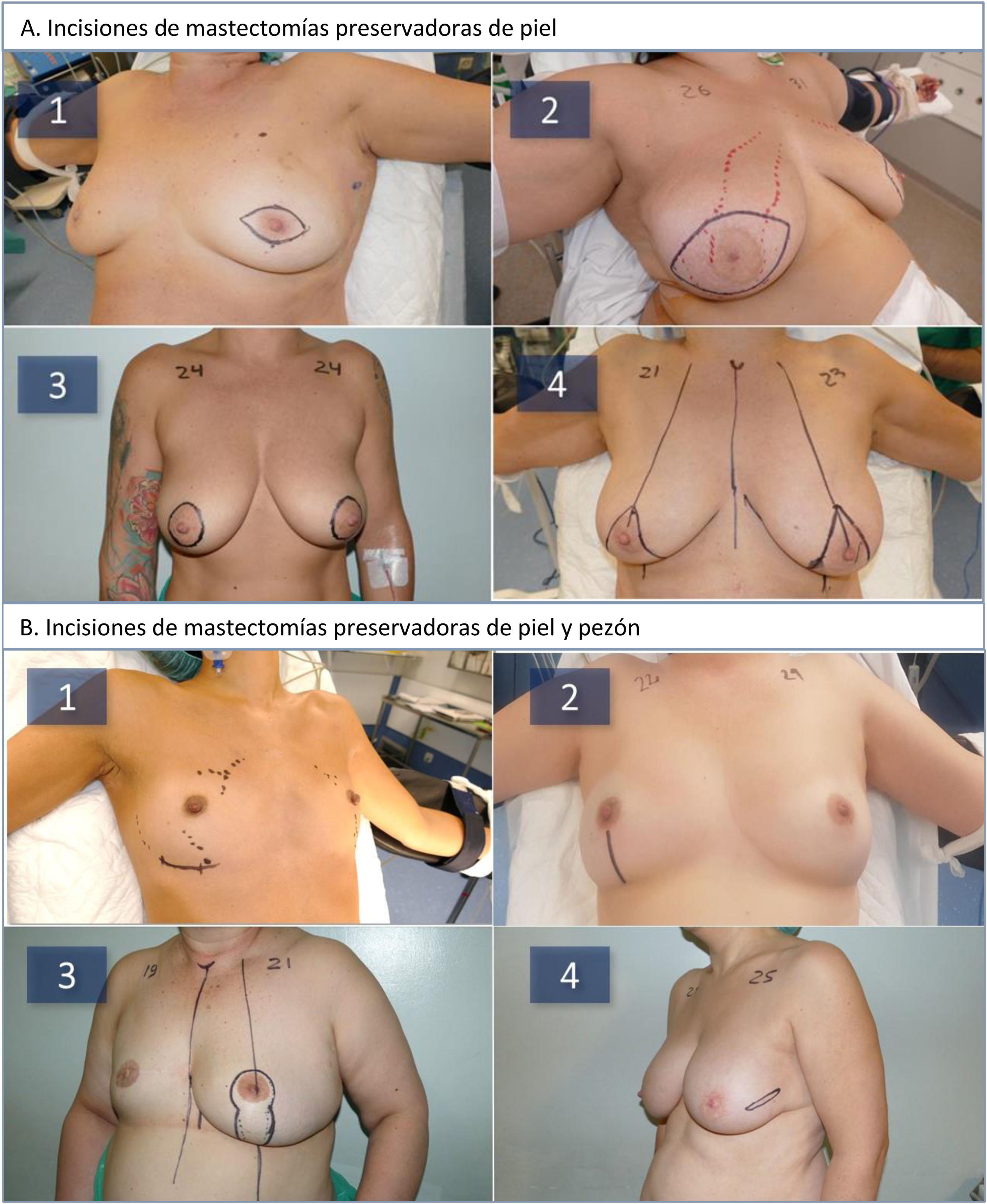
Método quirúrgico. En todas las pacientes se practicó una MPP o una MPPP de acuerdo a las características anatómicas de la mama (volumen, ptosis), del proceso oncológico (localización, distancia a la piel y CAP) y atendiendo a los criterios expuestos por Nava et al.8 (fig. 1A). Según estos criterios, las pacientes con volumen mamario pequeño o mediano fueron tratadas de una MPPP, excepto si el proceso neoplásico lo impedía o si la distancia del CAP a la horquilla esternal era superior a 25cm. Las pacientes con mamas voluminosas fueron tratadas con una MPP tipo 4 de Carlson9. La incisión inframamaria se orientó a mujeres con mama pequeña/moderada, la incisión vertical a mujeres con mama de tamaño moderado y el patrón vertical a mujeres con ptosis mamaria (fig. 1B). La mastectomía se practicó atendiendo a la distribución del proceso neoplásico en las pacientes oncológicas y a la distribución de la grasa subcutánea mostrada en la RM prequirúrgica. El grosor del colgajo cutáneo se evaluó según la clasificación de Rancati («Breast tissue coverage classification»)10; 1cm para el tipo 1; 2-3cm para el tipo 2; 3 o más centímetros para el tipo 3, y se talló según la anatomía específica de cada enferma y la localización del tumor. En las pacientes con tumores próximos al colgajo cutáneo se dejaron clips de titanio para marcar la localización del proceso neoplásico. En las MPPP se practicó la limpieza del tejido retroareolar mediante la técnica de Folli11. En las pacientes oncológicas se realizó una biopsia intraoperatoria de la base del pezón y se extirpó el mismo cuando se demostró su afectación neoplásica. La reconstrucción mamaria se realizó mediante la colocación de un implante de silicona recubierto de espuma de poliuretano (MicrothaneTM, POLYTECH Health & Aesthetics Dieburg, Alemania) en posición prepectoral. En todas las intervenciones se utilizó profilaxis antibiótica con cefazolina intravenosa durante las primeras 24h y se colocó un drenaje aspirativo.
A: Tipos de mastectomías preservadoras de piel (MPP) utilizadas durante el estudio: huso periareolar (1), huso central (2), bolsa de tabaco (3), patrón en T invertida tipo 4 de Carlson (4). B: Tipos de mastectomías preservadoras de piel y pezón (MPPP) utilizadas durante el estudio: incisión inframamaria (1), vertical inferior (2), patrón vertical (3), lateral (4).
Todas las mastectomías y reconstrucciones fueron realizadas por los 5 cirujanos/ginecólogas de la unidad (2 seniors y 3 juniors) o por residentes bajo supervisión. Uno de los cirujanos senior se encargó de la supervisión de los procedimientos quirúrgicos y la orientación para el tratamiento de las complicaciones.
Cuidados posquirúrgicos. Todas las pacientes estuvieron ingresadas al menos 24h. El día siguiente de la intervención se confirmó la ausencia de hematoma y se recomendó el uso de una camiseta sin necesidad de sujetador compresivo. El drenaje aspirativo se retiró cuando su débito fue menor de 50mL/día.
Tratamientos complementarios. Los tratamientos se consensuaron en el comité multidisciplinar según las guías clínicas. En las pacientes con tumores que expresaron receptores hormonales se indicó terapia hormonal durante 5-10 años. Aquellas que precisaron tratamiento quimioterápico (primaria o adyuvante) realizaron un esquema secuencial de adriamicina y ciclofosfamida seguido de paclitaxel. En aquellas pacientes con sobreexpresión de Her2 se prescribió trastuzumab y pertuzumab.
Las pacientes con tumores mayores de 4cm y/o afectación ganglionar recibieron radioterapia de pared torácica y/o cadenas ganglionares. Aquellas pacientes con afectación microscópica del margen superficial de la mastectomía fueron evaluadas por el comité para la realización de una ampliación en el tejido subcutáneo o la realización de tratamiento radioterápico.
Seguimiento posquirúrgico. Las pacientes fueron valoradas semanalmente durante el primer mes para la detección temprana de complicaciones. Posteriormente el seguimiento se realizó semestralmente en las pacientes oncológicas y anualmente en la CRR. A todas las pacientes se les realizó una RM mamaria al año de la intervención para valorar tejido residual glandular.
Definición de las complicaciones. Se analizan las complicaciones inmediatas (primeros 3 meses tras la cirugía) relacionadas con la técnica de la mastectomía y la reconstrucción.
- -
Sangrado posquirúrgico. Aparición de cualquier cantidad de sangre durante los primeros 7 días postoperatorios que modifique el ingreso hospitalario (prolongar la estancia o reintervención).
- -
Seroma. Acumulación de líquido periprotésico que requiere mantener el drenaje más de 10 días o precisa la colocación de un nuevo drenaje.
- -
Infección. Necesidad de antibióticos en los primeros 30 días postoperatorios, excluyendo la profilaxis antibiótica.
- -
Dehiscencia de herida. Separación de los bordes de una herida quirúrgica que precisa alguna acción por el cirujano.
- -
Necrosis cutánea. Se definió como la aparición de áreas de piel sin vascularización que condiciona la muerte celular. Se incluyen todas las necrosis que aparecen durante los primeros 3 meses desde la cirugía y que precisan alguna intervención (cita en consulta o en quirófano).
- -
Pérdida del implante. Necesidad de retirar la prótesis por cualquier causa.
Justificación del tamaño muestral. Asumiendo un 5% de pérdidas de implante, con un nivel de confianza del 95% y una precisión del 5%, y asumiendo un 10% de posibles pérdidas durante el seguimiento, se estimó un tamaño muestral de 81 pacientes.
Análisis estadísticoSe realizó un análisis descriptivo de las variables incluidas en el estudio. Todas las variables cuantitativas se expresan con su media y desviación estándar. Las variables cualitativas se expresan en proporciones y sus respectivos intervalos de confianza. La comparación de medias se realizó mediante la T de Student o test de Mann-Whitney y test de Kruskal-Wallis o ANOVA, según procediera tras comprobar la normalidad con el test de Kolgomorov-Smirnov. La asociación de variables cualitativas se estimó mediante el estadístico Chi-cuadrado. El análisis estadístico se realizó utilizando la versión 24 del programa estadístico IBM SPSS y epidat 4.1.
ResultadosDurante el período a estudio se realizaron 159 reconstrucciones en 102 mujeres. Un total de 82 mujeres (80,4%) se intervinieron por un carcinoma mamario mientras que en 20 mujeres (19,6%) la mastectomía se indicó por alto riesgo personal o genético (tabla 1). En 57 pacientes (55,9%) se realizó una mastectomía bilateral, 4 de ellas por carcinoma mamario bilateral y en las 53 mujeres restantes por reducción de riesgo. No se evidenciaron diferencias estadísticamente significativas en edad, IMC y distancia clavícula/CAP entre la CO y la CRR. La mutación más frecuente fue en el gen BRCA1 (14,7%).
Características clínicas de las pacientes
| PacientesN=102n.o (%) | OncológicasN=82n.o (%) | Reducción de riesgoN=20n.o (%) | p | |
|---|---|---|---|---|
| Causa de la mastectomía | ||||
| Oncológica | 43 (42,2) | 43 (52,4) | - | - |
| Oncológica/reductora de riesgo | 39 (38,2) | 39 (47,5) | - | |
| Reductora de Riesgo | 20 (19,6) | - | 20 (100) | |
| Mastectomía bilateral | 57 (55,9) | 43 (52,4) | 14 (70) | 0,156 |
| Edad (años) | ||||
| Media | 46,8±7,8 | 46,9±7,5 | 46,7±9,1 | 0,676 |
| Rango | 30-67 | 30-65 | 33-67 | |
| IMC (kg/cm2) | ||||
| Medio | 23,9±4,4 | 24,2±4,6 | 22,5±2,1 | 0,368 |
| Rango | 17,8-42,1 | 17,8-42,1 | 19,5-26,1 | |
| Distancia esternón/CAP (cm) | ||||
| Mama derecha | ||||
| Media | 19,9±2,9 | 20,0±2,9 | 19,3±2,6 | 0,528 |
| Rango | 15-28 | 15-28 | 16-24 | |
| Mama izquierda | 0,337 | |||
| Media | 20,1±3,1 | 20,3±3,2 | 19,2±2,6 | |
| Rango | 15-31 | 15-31 | 16-24 | |
| Estudio genético | ||||
| No solicitado | 4 (39,2) | 38 (46,3) | 2 (10) | |
| BRCA1 | 15 (14,7) | 5 (6,1) | 10 (50) | - |
| BRCA2 | 9 (8,8) | 4 (4,9) | 5 (25) | |
| PALB2 | 3 (2,9) | 3 (3,7) | 0 (0) | |
| RAD51 | 1 (1) | 1 (1,2) | 0 (0) | |
| Negativo | 22 (21,5) | 19 (23,2) | 3 (15) | |
| Pendiente resultado | 12 (11,8) | 12 (14,6) | 0 (0) | |
| Mama previamente irradiada | 14 (13,7) | 9 (10,9) | 5 (25) | 0,142 |
| Estancia hospitalaria (días) | 1,9±0,8 | 1,9±0,7 | 1,9±1,3 | 0,353 |
CAP: complejo aréola-pezón; IMC: índice de masa corporal.
Descripción quirúrgica. La MPPP fue el tipo de mastectomía más utilizado (69,8%) tanto en la CO (68%) como en la CRR (76,5%). Las incisiones más empleadas fueron el abordaje inframamario (34,6%) y la incisión vertical (34,6%) (tabla 2). Un 13,7% de las pacientes presentaban irradiación previa en la mama tras una cirugía conservadora. La duración media de las cirugías fue de 187min (DT: ±62,5), siendo significativamente mayor en las mastectomías bilaterales. El tiempo quirúrgico fue significativamente superior en la mastectomía unilateral oncológica que en la unilateral por reducción de riesgo (p=0,007). El peso medio de las piezas quirúrgicas fue de 290,6 (±230,3) sin diferencias entre grupos. La estancia hospitalaria media fue de 1,9 días (±0,8), sin diferencias entre los grupos.
Características quirúrgicas de toda la serie
| ReconstruccionesN=159n.o (%) | Reconstrucciones oncológicasN=125n.o (%) | Reconstrucciones reducción de riesgoN=34n.o (%) | p | |
|---|---|---|---|---|
| Tipo de mastectomía | ||||
| MPP tipo I | 23 (14,5) | 19 (15,2) | 4 (11,8) | 0,515 |
| MPP tipo IV | 25 (15,7) | 21 (16,8) | 4 (11,8) | |
| MPPP vertical | 55 (34,6) | 46 (36,8) | 9 (26,5) | |
| MPPP tipo II (lateral) | 1 (0,6) | 1 (0,8) | 0 (0) | |
| MPPP surco inframamario | 55 (34,6) | 38 (30,4) | 17 (50) | |
| Tiempo quirúrgico (min) | ||||
| Media | 165±58 | 168,6±55,1 | 153,2±64,5 | 0,196 |
| Rango | 55-330 | 75-330 | 55-300 | |
| Tiempo Qx bilateral | 0,507 | |||
| Media | 187,5±62,5 | 192,1±60,2 | 178,1±61,8 | |
| Rango | 100-330 | 100-330 | 110-300 | 0,007 |
| Tiempo Qx unilateral | ||||
| Media | 138,4±38,4 | 144,5±36,5 | 99,2±27,9 | |
| Rango | 55-240 | 75-240 | 55-120 | |
| Peso pieza quirúrgica (g) | ||||
| Media | 290,6±230,3 | 318,3±250,9 | 216,9±102,8 | 0,123 |
| Rango | 50-1660 | 50-1660 | 90-500 | |
MPP: mastectomía preservadora de piel; MPPP: mastectomía preservadora de piel y pezón; Qx: quirúrgico.
Pacientes oncológicas. La tabla 3 muestra las características anatomopatológicas de las pacientes intervenidas por un carcinoma mamario. Un 30,5% de las pacientes recibió TSP y un 39% radioterapia de la pared torácica tras la reconstrucción. El carcinoma ductal infiltrante fue el tipo histológico más frecuente (73,2%) y el subtipo más común fue el luminal B Her2 negativo (36,6%). Un 40,2% de las pacientes presentaban un tumor multifocal y un 25% multicéntrico. El estudio anatomopatológico mostró afectación del margen superficial de la mastectomía en 10 pacientes (12,1%), en 8 de estas pacientes la afectación fue focal y no precisaron ampliación quirúrgica. Las otras 2 pacientes presentaron afectación extensa del margen y precisaron ampliación del margen quirúrgico guiada por los clips de marcaje. Siete de estas 10 pacientes recibieron radioterapia en pared torácica. En 5 mujeres (6,1%) se evidenció afectación de la base del pezón, precisando su exéresis, 3 de ellas de forma diferida.
Características clínicas de las pacientes con un carcinoma mamario
| PacientesN=82n.o (%) | |
|---|---|
| Tipo histológico | |
| CDis | 11 (13,4) |
| CDI | 60 (73,2) |
| CLI | 11 (13,4) |
| Dispersión | |
| Unifocal | 28 (34,1) |
| Multifocal | 33 (40,2) |
| Multicéntrico | 21 (25,7) |
| Tamaño tumoral (cm) | |
| Media | 2,1±1,8 |
| Rango | 0-9 |
| Tamaño tumoral (TNM) | |
| Tiss | 10 (12,2) |
| T1a | 5 (6,1) |
| T1b | 11 (13,4) |
| T1c | 10 (24,4) |
| T2 | 22 (26,8) |
| T3 | 4 (4,9) |
| Tx | 10 (12,2) |
| Afectación axilar (TNM) | |
| N0 | 50 (60,9) |
| N1 | 22 (26,8) |
| N2 | 4 (4,9) |
| N3 | 3 (3,7) |
| No valorable | 3 (3,7) |
| Subtipo tumoral | |
| Luminal A | 18 (22,0) |
| Luminal B Her2− | 30 (36,6) |
| Luminal B Her2+ | 11 (13,4) |
| Her2+ | 1 (1,2) |
| Triple negativo | 12 (14,6) |
| No válido | 10 (12,2) |
| Tumor metacrónico | 9 (11,0) |
| Tratamiento complementario | |
| Quimioterapia neoadyuvante | 25 (30,5) |
| Quimioterapia postoperatoria | 24 (29,3) |
| Radioterapia | 32 (39,0) |
| Hormonoterapia | 59 (71,9) |
| Anti-Her2 | 12 (14,6) |
| Márgenes | |
| Libre (>2mm) | 64 (78,0) |
| <1mm | 3 (3,7) |
| Contacto focal | 8 (9,8) |
| Contacto amplio | 2 (2,4) |
| Afectación de pezón | 5 (6,1) |
CDI: carcinoma ductal infiltrante; CDis: carcinoma ductal in situ; CLI: carcinoma lobulillar infiltrante.
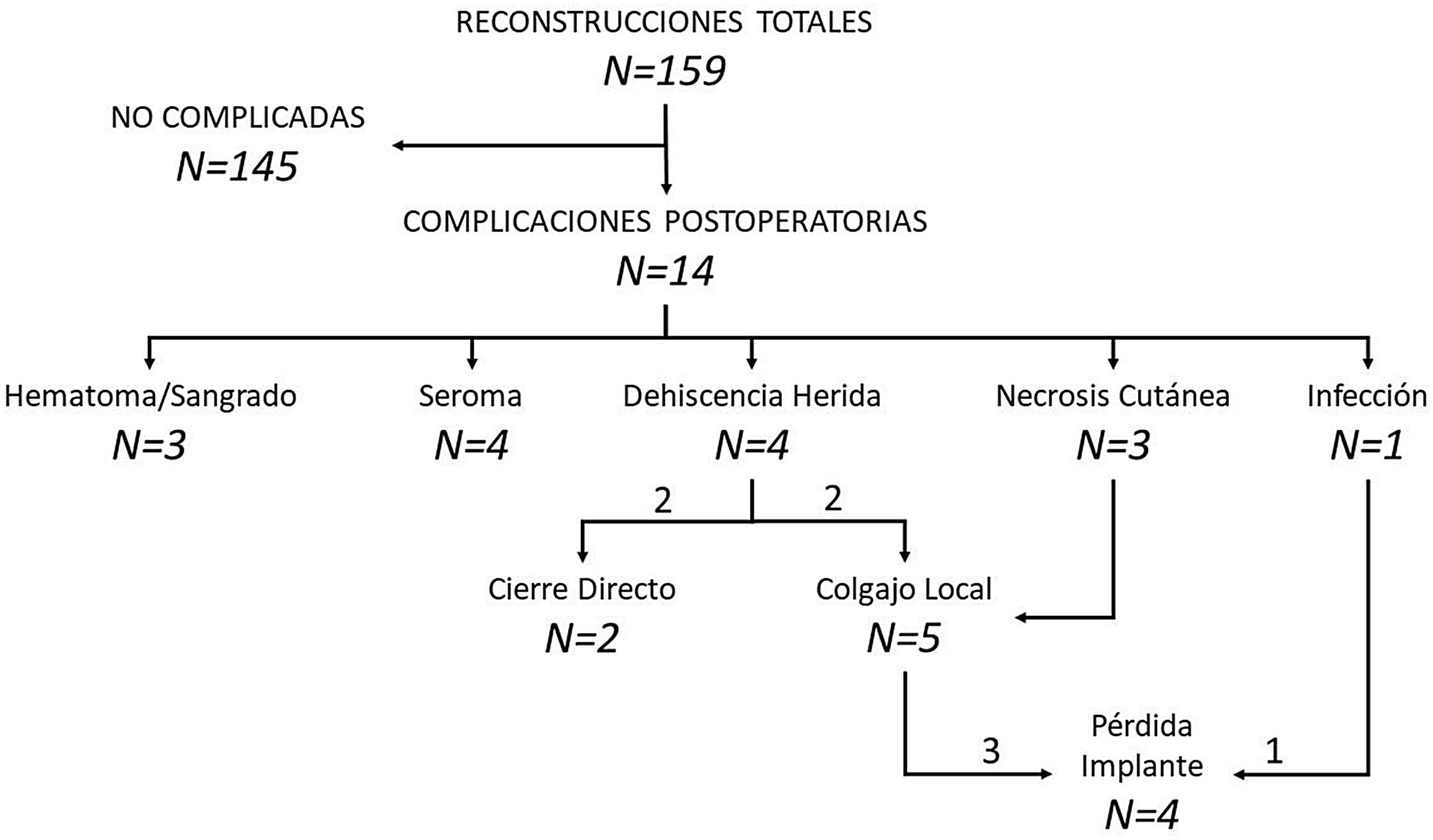
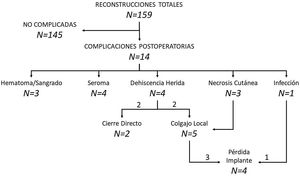
Complicaciones. El seguimiento medio de la serie fue de 11 meses (rango: 1-34 meses). Durante el mismo, 14 pacientes presentaron complicaciones postoperatorias (8,8% de las reconstrucciones), siendo el seroma y la dehiscencia de la herida las complicaciones más frecuentes (tabla 4). Todas las dehiscencias acontecieron en pacientes oncológicas y en mastectomías con incisión vertical (3 mastectomías tipo iv y una con incisión vertical). Ocho mujeres precisaron una reintervención (5% de las reconstrucciones), 7 de ellas por exposición del implante debido a una necrosis cutánea, dehiscencia de herida o infección del implante. Dos de las necrosis cutáneas se produjeron en mujeres irradiadas previamente. En 5 de las 7 exposiciones de implante se realizó un colgajo local para cobertura, siendo efectivo en 3 pacientes. Cuatro reconstrucciones (2,5%) culminaron con pérdida del implante, 3 por contaminación del implante que no se solucionó con el colgajo local y otra para la continuación de la quimioterapia adyuvante (fig. 2).
Complicaciones
| ReconstruccionesN=159n.o (%) | Reconstrucciones oncológicasN=125n.o (%) | Reconstrucciones reducción de riesgo N=34n.o (%) | p | |
|---|---|---|---|---|
| Complicaciones | 14 (8,8) | 11 (8,8) | 3 (8,8) | 1 |
| Tipo de complicación | ||||
| Hematoma | 2 (1,3) | 1 (0,8) | 1 (2,9) | |
| Seroma | 4 (2,5) | 2 (1,6) | 2 (5,9) | |
| Dehiscencia de herida | 4 (2,5) | 4 (3,2) | 0 (0) | |
| Necrosis cutánea | 3 (1,9) | 3 (2,4) | 0 (0) | |
| Sangrado | 1 (0,6) | 1 (0,8) | 0 (0) | |
| Reintervención | 8 (5,0) | 7 (5,6) | 1 (2,9) | - |
| Causa de reintervención | ||||
| Exposición del implante | 7 (4,4) | 7 (5,6) | 0 (0) | |
| Sangrado mamario | 1 (0,6) | 0 (0) | 1 (2,9) | - |
| Pérdida de implante | 4 (2,5) | 4 (3,2) | 0 (0,0) | - |
Eventos oncológicos. Durante el seguimiento 3 pacientes presentaron progresión de su proceso oncológico: una recaída local en el colgajo de la mastectomía a los 10 meses de la cirugía por un tumor Her2, una progresión axilar a los 6 meses de la mastectomía en una paciente con un tumor triple negativo y TSP con respuesta anatomopatológica completa, y una progresión metastásica cerebral al mes de la cirugía en una paciente con un tumor triple negativo que falleció 5 meses más tarde.
Seguimiento. A 24 de las 102 pacientes incluidas en el estudio se les ha realizado la RM de control al año de la mastectomía, 2 de ellas (8,3%) presentan una lámina de 1cm de tejido residual glandular.
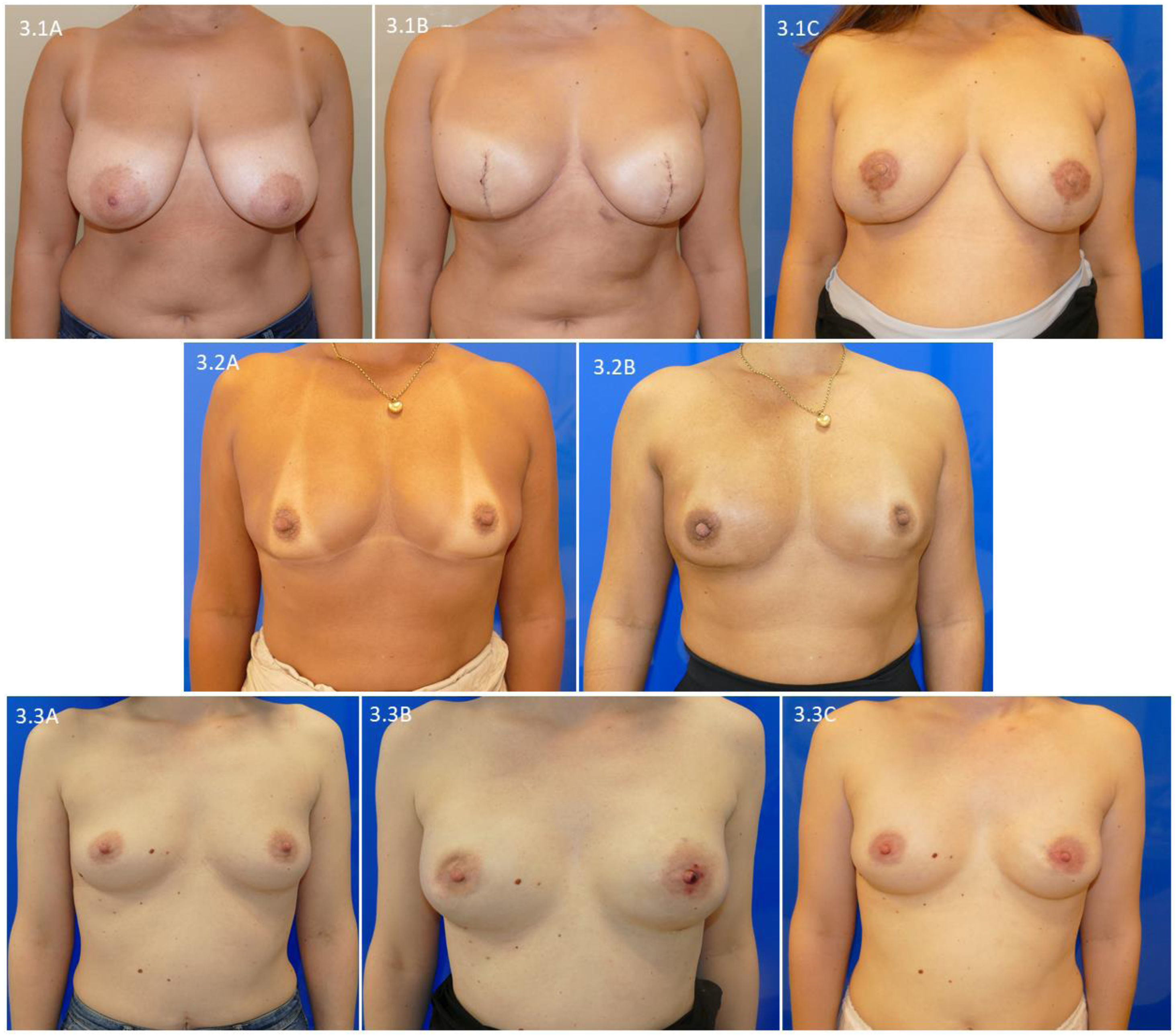
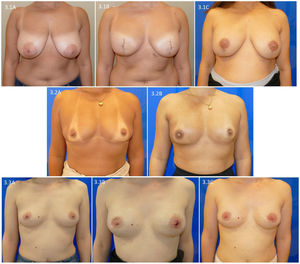
En la figura 3 presentamos la evolución al año de la intervención de pacientes que han finalizado la reconstrucción y sus tratamientos complementarios. La figura 3.1 presenta una mujer con una mastectomía bilateral ahorradora de piel tipo iv y su evolución tras la reconstrucción del pezón y el tatuaje de la aréola (fig. 3.1C). La figura 3.2 muestra una paciente con mastectomía bilateral preservadora de piel y pezón por un carcinoma infiltrante de mama derecha con indicación de radioterapia de pared torácica y el resultado tras un año de finalizar la radioterapia (fig. 3.2B). Finalmente, se presenta una paciente con carcinoma ductal in situ extenso de mama derecha que realizó una mastectomía bilateral preservadora de piel y pezón, y tras ampliación del margen superficial retroareolar de mama derecha presentó deformidad del CAP derecho y necrosis superficial del pezón izquierdo (fig. 3.3B). Esta deformidad se solucionó al año de la intervención (fig. 3.3C).
Evolución al año de la intervención de pacientes con una mastectomía preservadora y reconstrucción prepectoral. 3.1: mujer con una mastectomía ahorradora de piel tipo iv; 3.1C: evolución después de realizar reconstrucción del pezón y tatuaje de la aréola. 3.2A: paciente con carcinoma infiltrante de mama derecha con indicación de radioterapia de pared torácica; 3.2B: evolución tras un año de finalizar radioterapia de pared torácica derecha. 3.3A: paciente con carcinoma ductal extenso de mama derecha; 3.3B: deformidad del CAP derecho tras ampliación de margen superficial retroareolar de mama derecha; 3.3C: evolución al año de la intervención.
Durante los últimos 10 años se han producido cambios científicos, sanitarios y sociales que sitúan la mastectomía como la piedra angular de la reconstrucción mamaria y de todas sus dimensiones: oncológica, calidad de vida y sostenibilidad. Por un lado, el avance en el tratamiento sistémico ha propiciado un mejor control local del proceso y la desescalada en su estadio clínico inicial lo que permite la oferta de mastectomías preservadoras con una mayor seguridad oncológica. Por otro lado, el efecto Jolie ha impulsado una mayor concienciación social sobre el riesgo genético en el cáncer con un incremento de los estudios genéticos y de la CRR12. Finalmente, la evaluación de los resultados cosméticos en mujeres con reconstrucción mamaria ha puesto de manifiesto la caducidad de los procedimientos reconstructivos, especialmente los vinculados a implantes retropectorales, así como diferencias en la satisfacción y calidad de vida de las mujeres13. La mejora de estos resultados se ha centrado en el uso de mastectomías ultrapreservadoras, con el fin de aportar una estructura anatómica más estable y duradera en la mama reconstruida, y el uso de dispositivos prepectorales para disminuir la agresividad local del procedimiento reconstructivo. En este sentido las mastectomías preservadoras han mostrado una seguridad oncológica similar a la mastectomía radical modificada tal como han demostrado los metaanálisis de Lanitis et al.14 y de De la Cruz et al.15 en los que tanto la MPP como la MPPP no presentaron diferencias en los eventos adversos oncológicos durante el seguimiento de pacientes en etapas tempranas de la enfermedad. Pero esta filosofía en el uso de las mastectomías preservadoras orientadas a la reconstrucción precisa de nuevos enfoques para incrementar su seguridad, disminuir las secuelas cosméticas y mejorar la percepción de la paciente. Para ello se necesita una valoración preoperatoria de las posibilidades individuales de cada mama para la preservación de elementos anatómicos, la selección de una técnica de mastectomía adaptada a la mama y, finalmente, la valoración del tejido residual tras la intervención quirúrgica. El estudio PreQ-20 ha sido diseñado para la evaluación de la seguridad de la RIP mediante mastectomías ultrapreservadoras, para el conocimiento de la satisfacción y calidad de vida reportada por las pacientes mediante el cuestionario BreastQ, y para valorar las secuelas cosméticas a medio plazo.
Se ha considerado al IP como un implante macrotexturizado, obviando los criterios de la clasificación de «International Organization for Standardization» (ISO)16 que no los incluye como tales, y alertando sobre una mayor relación con el linfoma anaplásico de células gigantes. Al igual que Hamdi17, creemos que el IP no puede considerarse un implante macrotexturizado porque la espuma de poliuretano que recubre el implante de silicona es una matriz tridimensional que se incorpora a la carcasa y se convierte, después de algunos años, en parte integral de la cápsula. Esta es la razón de su baja incidencia de contractura capsular. Otro parámetro a tener en cuenta en esta discusión son las diferencias en la estabilidad de la espuma de poliuretano. Así, la experiencia clínica ha mostrado que la degradación de esta espuma es diferente en los IP de los 2 principales fabricantes, mostrando un mayor reporte de casos con delaminación del poliuretano en los implantes de Silimed respecto a los dispositivos de Polytech. Estas diferencias pueden explicar la baja incidencia de notificaciones de delaminación y linfoma anaplásico de células gigantes en Alemania, país en donde se fabrican los implantes Polytech y en donde existe una amplia utilización de los mismos. El estudio prospectivo que se presenta ha seleccionado el IP de Polytech por ser el que actualmente se encuentra autorizado por las Agencias Europea y Española del Medicamento con el fin de valorar también su impacto en la seguridad de la RIP.
Actualmente existen 4 estudios que han evaluado el uso de IP en la RIP4,18–20, todos ellos retrospectivos. El estudio de De Vita et al.4 analiza la evolución de 21 pacientes intervenidas para CRR o CO con un seguimiento medio de 4 meses. Los estudios de Coyette et al.18 y Salgarello et al.19 se centraron en el uso del IP en mujeres con CRR y concluyen en una baja incidencia de complicaciones postoperatorias y una aceptable puntuación en los cuestionarios de calidad de vida, respectivamente. Finalmente, el estudio de Franceschini et al.20 compara de forma retrospectiva a pacientes con cáncer de mama con reconstrucción mamaria retromuscular y RIP con poliuretano. Este estudio concluye que la colocación del IP en posición prepectoral asociada a una MPPP es segura y eficaz desde el punto de vista oncológico, es sencilla de realizar, reduce el tiempo quirúrgico, disminuye las complicaciones quirúrgicas y contribuye a la eficiencia en el mantenimiento de costes respecto al uso de mallas periprotésicas. Cuando se comparan estas experiencias con otras en las que se han utilizado mallas sintéticas21–23 o biológicas24–30 (tabla 5) se observa que la RIP con IP presenta una menor incidencia de infección del implante y de pérdida de la reconstrucción. Así, en las experiencias con malla biológica la infección y pérdida del implante pueden afectar al 1,9-7,3% y al 2,4-10,2% de las pacientes, respectivamente, mientras que para las mallas sintéticas la incidencia de infección ha oscilado entre el 0,8-6% y la pérdida de implante entre el 1,2-8%. No obstante, estos datos deben ser evaluados con cautela ya que la mayoría de estos estudios son retrospectivos y con deficiencias en su metodología. Actualmente PreQ-20 es el único estudio que evalúa de forma prospectiva la seguridad de la RIP con IP y el dato más destacable es la baja incidencia de complicaciones asociadas al implante en el seguimiento inicial a corto plazo. La escasa incidencia de seroma e infección con el IP puede estar relacionada con el fenómeno de integración de la espuma de poliuretano al tejido subcutáneo que permite la adherencia del implante y el crecimiento tisular en su estructura tridimensional. Otra ventaja añadida en las pacientes de este estudio ha sido la resistencia a la infección en aquellos casos con exposición del implante por dehiscencia o necrosis cutánea. Esta característica ha permitido el mantenimiento de la reconstrucción mediante el uso de colgajos locales.
Complicaciones postoperatorias en diferentes series con reconstrucción prepectoral
| Autor | N | Implante | Hematoma (%) | Seroma (%) | Dehiscencia herida (%) | Necrosis piel (%) | Infección (%) | Pérdida implante (%) |
|---|---|---|---|---|---|---|---|---|
| Ian Ng et al.21 | 50 | TiLOOP | 4,0 | 14,0 | - | 2,0 | 6,0 | 8,0 |
| Nguyen et al.22 | 63 | TiLOOP | 3,2 | 11,1 | 3,2 | 3,2 | 4,8 | 7,0 |
| Casella et al.23 | 250 | TiLOOP | 0,4 | - | 0,4 | 0,8 | 0,8 | 1,2 |
| Baker et al.24 | 43 | Strattice | - | 2,3 | 8,1 | 4,7 | 2,3 | 4,7 |
| Urquia et al.25 | 136 | Cortiva | 2,2 | 2,2 | 0,7 | - | 7,3 | 10,2 |
| Ribuffo et al.26 | 207 | ADM | 1,4 | 4,3 | 1,9 | - | 1,9 | 2,4 |
| Highton et al.27 | 113 | ADM | - | 3,0 | - | 4,4 | 4,2 | 4,4 |
| Sigalove et al.28 | 353 | ADM | - | 2,0 | - | 2,5 | 4,5 | - |
| Masiá et al.29 | 1450 | Braxon | 2,1 | 7,7 | 4,6 | 3,2 | 4,8 | 6,5 |
| Chandarana et al.30 | 406 | Braxon | 2,5 | 7,1 | 2,0 | 5,2 | 3,2 | 4,9 |
| de Vita et al.4 | 34 | Poliuretano | 0 | 0 | 0 | 0 | 0 | 0 |
| Salgarello et al.19 | 70 | Poliuretano | 0 | 0 | 0 | 0 | 0 | 0 |
| Franceschini et al.20 | 82 | Poliuretano | 0 | 0 | 0 | 1,2 | 0 | 1,2 |
| Coyette et al.18 | 64 | Poliuretano | 3,1 | 1,5 | 3,1 | 1,5 | 1,5 | 3,1(a) |
| Acea et al.* | 159 | Poliuretano | 1,8 | 2,5 | 2,5 | 1,8 | 0,6 | 2,5 |
N: número de mastectomías.
(a): 2 implantes fueron sustituidos por expansores por infección.
El metaanálisis de Li et al.31 demuestra que la RIP presenta una incidencia similar de complicaciones postoperatorias, pérdida de implante y supervivencia libre de enfermedad respecto a la reconstrucción retropectoral. El estudio PreQ-20 muestra que la reconstrucción prepectoral con IP es compatible con los tratamientos oncológicos. Por un lado, el TSP con quimioterapia (30% de las pacientes oncológicas en nuestro estudio) no ha conllevado un incremento de las complicaciones postoperatorias ni de las recaídas locales. Recientemente Wu et al.32,33 han demostrado que la reconstrucción inmediata tras MPPP en pacientes con quimioterapia primaria presenta una incidencia similar de recaída local y supervivencia global respecto a las pacientes con mastectomía sin reconstrucción. Por otra parte, la radioterapia posmastectomía (39% de las pacientes oncológicas de nuestra serie) tampoco se ha relacionado con un incremento en las complicaciones o pérdida del implante. Diversos autores6,34,35 han evaluado el impacto de la radioterapia postoperatoria en la RIP con resultados dispares en la evolución de las pacientes. Aunque la experiencia de Sigalove 6 no muestra alteraciones relevantes en la evolución de la mama reconstruida, en el estudio de Sinnott et al.34 encuentran una mayor incidencia de retracción capsular durante el seguimiento que puede afectar hasta al 19% de las pacientes. En el estudio PreQ-20 no se ha detectado la presencia de contractura capsular en las pacientes irradiadas posiblemente debido al escaso tiempo de seguimiento.
Este estudio presenta varias limitaciones. Por un lado, el seguimiento medio de la serie es escaso para conocer la seguridad oncológica de la reconstrucción prepectoral con IP en pacientes oncológicas. Por otro lado, la baja tasa de complicaciones no permite el cálculo de factores de riesgo asociados a cada evento. Finalmente, la ausencia de un grupo control impide la comparación de la RIP con IP con otras técnicas quirúrgicas o implantes mamarios.
En conclusión, los datos preliminares de este estudio prospectivo confirman que la RIP con IP es un procedimiento con una baja incidencia de complicaciones postoperatorias (8,8%) y una baja incidencia de pérdida de implante (2,5%). Los casos de exposición del implante pueden ser manejados mediante el uso de colgajos locales que la mayoría de las veces evitará la pérdida de la reconstrucción. En el contexto oncológico su utilización es segura en pacientes con TSP, así como en aquellas que precisan radioterapia posmastectomía. La baja incidencia de complicaciones postoperatorias del IP en mujeres con CRR indica que este dispositivo es una buena opción en este contexto clínico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.