Durante los procedimientos oncoplásticos se modifica la vascularización y perfusión de los colgajos cutáneos, incrementando así la posibilidad de necrosis cutánea.
El objetivo del artículo es evaluar la eficacia de la angiografía con verde de indocianina (A-VIC) para determinar necrosis cutánea intraoperatoria tras una cirugía oncoplástica o una mastectomía preservadora de piel o piel-pezón (MPPP).
Pacientes y métodoEstudio prospectivo observacional para evaluar la sensibilidad, especificidad y valores predictivos positivo y negativo de la A-VIC en mujeres con cáncer de mama y alto riesgo.
ResultadosSe incluyeron 98 mujeres en el estudio y 156 mamas. Un total de 20 mujeres (20,4%) presentaron imagen de isquemia en la A-VIC. 21 mujeres (21,4%) presentaron eventos isquémicos en el posoperatorio, el 71,4% de estos eventos habían sido detectados en la tercera A-VIC. Tres de estas pacientes (3,1%) presentaron una complicación grave que precisó reintervención. La sensibilidad y especificidad de la A-VIC fue de 71,4% y 93,5%, respectivamente.
ConclusionesLa A-VIC tiene una alta especificidad y valor predictivo negativo (VPN) para detectar áreas de baja perfusión. En unidades de mama con cirugía de alta complejidad puede ser útil para planificar cirugías extremas e identificar áreas cutáneas de baja perfusión.
During oncoplastic procedures, the vascularization and perfusion of the skin flaps is modified, thus increasing the possibility of skin necrosis.
The objective of this study is to evaluate the effectiveness of indocyanine color green angiography (ICG-A) to determine intraoperative skin necrosis after oncoplastic surgery or skin-sparing or nipple-skin sparing mastectomy (NSSM).
Patients and methodProspective observational study to evaluate the sensitivity, specificity and positive and negative predictive values of the ICG-A in women with high-risk breast cancer.
Results98 women and 156 breasts were included in the study. A total of 20 women (20.4%) presented an image of ischemia in the ICG-A. 21 women (21.4%) presented ischemic events in the postoperative period, 71.4% of these events had been detected in the third ICG-A. Three of these patients (3.1%) presented a serious complication that required reintervention. The sensitivity and specificity of the A-VIC was 71.4% and 93.5%, respectively.
ConclusionsICG-A has high specificity and negative predictive value for detecting areas of low perfusion. In breast units with highly complex surgery, it can be useful to plan extreme surgeries and identify skin areas of low perfusion.
La cirugía oncoplástica y las mastectomías preservadoras constituyen dos procedimientos técnicos que han mejorado el resultado oncológico y cosmético tras cirugía conservadora y reconstrucción inmediata en mujeres con cáncer de mama o alto riesgo para cáncer de mama. Durante la realización de estas técnicas quirúrgicas se produce una alteración significativa en la perfusión del envoltorio cutáneo de la mama que puede producir áreas de sufrimiento vascular de la piel y necrosis de la misma. La necrosis cutánea constituye el evento adverso más importante en la cirugía oncoplástica y reconstructiva de la mama, ya que ocasiona demoras en los tratamientos adyuvantes a la cirugía, empeoramiento del resultado cosmético y en ocasiones pérdida del implante1,2.
La angiografía con verde de indocianina (A-VIC) se ha propuesto como una alternativa diagnóstica para conocer la perfusión vascular del envoltorio cutáneo de la mama durante el acto quirúrgico, lo que permitiría extirpar el tejido con riesgo de necrosis para evitar esta complicación durante el posoperatorio3–6. Sin embargo, la literatura no permite actualmente una adecuada valoración de este procedimiento diagnóstico debido a la ausencia de estudios prospectivos que hayan evaluado su sensibilidad, especificidad y valores predictivos.
El objetivo de este estudio prospectivo es describir la A-VIC en los colgajos cutáneos de la mama en mujeres con cáncer de mama o alto riesgo para cáncer de mama en quienes se practica una cirugía oncoplástica o una mastectomía con preservación de piel (MPP) o piel-pezón. A partir de los resultados de este estudio se pretende evaluar la sensibilidad, especificidad y valores predictivos de esta técnica para la predicción de eventos adversos durante el posoperatorio.
MétodoEstudio prospectivo observacional para evaluar la eficacia de la A-VIC en mujeres con cáncer de mama y alto riesgo intervenidas entre mayo de 2023 y mayo de 2024. El estudio ha sido valorado y aprobado por el comité ético asistencial de nuestro hospital (gBREAST22 2022/398) y ha sido registrado en la web ClinicalTrials.gov (NCT05910931)7.
Criterios de inclusión y exclusiónLa población a estudio incluye dos grupos de pacientes:
- a.
Procedimientos oncoplásticos para conservación mamaria. Este grupo está constituido por mujeres con cáncer de mama en quienes el comité de tumores recomendó un procedimiento quirúrgico de conservación mamaria. Las técnicas incluidas para este estudio son mamoplastia vertical y horizontal y colgajos locales. Se excluyen las pacientes intervenidas mediante tumorectomía/cuadrantectomía, resecciones laterales y técnica de round-block.
- b.
MPP o MPPP con reconstrucción mamaria inmediata. Este grupo lo constituyen pacientes con diagnóstico de carcinoma mamario que precisaron una mastectomía, así como aquellas mujeres con una mastectomía reductora de riesgo para cáncer de mama. Las técnicas quirúrgicas incluidas en este grupo son las MPP tipo 1 y 4 de Carlson8 y MPPP mediante accesos inframamarios o con patrón vertical. Se excluyeron las pacientes con reconstrucción diferida y/o retropectoral o sin reconstrucción.
- a)
Técnica de cirugía oncoplástica. En las pacientes intervenidas mediante una mamoplastia vertical se diseñó un patrón vertical de Wise y la selección del pedículo se realizó según la localización de la resección tumoral y la distancia del complejo areola-pezón (CAP) a su nueva ubicación.
- b)
Técnica de mastectomía. Se realizó una mastectomía adaptada a la mama optimizando la preservación de elementos originales de la misma (surco inframamario, envoltorio cutáneo, transiciones grasas, CAP) según las posibilidades anatómicas y oncológicas de cada paciente. El grosor del colgajo cutáneo de la mastectomía se evalúa según la clasificación de Rancati9. En todas las MPPP se practicó la limpieza del tejido retroareolar una vez extirpada la mama mediante la técnica de Folli10. La reconstrucción se realizó mediante la colocación de un implante de poliuretano en posición prepectoral.
- c)
Técnica de A-VIC. La ampolla de 25mg de verde de indocianina (VIC) en polvo fue diluida en 10cc de agua destilada. Se utilizaron bolos endovenosos de 2,5cc de VIC seguidos de 10cc de suero fisiológico. Para la visualización de la perfusión cutánea se utilizó la plataforma SPY System con el SPY-Q software (Stryker®) que mediante la emisión de luz láser estimula el VIC para emitir energía infrarroja dentro de los dos minutos posteriores a la inyección intravenosa.
Durante la intervención quirúrgica se realizaron tres inyecciones de solución de VIC para la evaluación de tres angiografías:
- -
Una primera inyección con la enferma dormida antes de iniciar la intervención para visualizar la anatomía vascular de cada enferma y valorar los pedículos e incisiones.
- -
Un segundo bolo tras la resección mamaria para valorar la viabilidad de los colgajos cutáneos y pedículos glandulares.
- -
Una tercera inyección para la obtención de una angiografía tras la colocación del implante y el cierre de heridas.
Durante la realización de las angiografías los cirujanos compararon los hallazgos de las mismas con la exploración clínica. Únicamente se indicó la resección de piel cuando el hallazgo clínico intraoperatorio era altamente sospechosos de isquemia, independientemente de los hallazgos angiográficos. Si la angiografía era sospechosa de isquemia, pero la exploración clínica no lo corroboraba, no se realizó resección cutánea. Todas las intervenciones fueron realizadas por los cinco cirujanos de la unidad y las angiografías fueron grabadas en video para su visualización en caso de isquemias posoperatorias.
DefinicionesNecrosis cutánea superficial. Pérdida de epidermis, parcial de dermis y/o formación de escara que no se extendió o expuso la grasa subcutánea.
Necrosis cutánea profunda. Pérdida de la dermis y epidermis de la piel con exposición de la grasa subcutánea.
Complicación quirúrgica grave. Aquella complicación que precisa intervención quirúrgica para solventarse.
Análisis estadísticoJustificación del tamaño muestral. Asumiendo una sensibilidad de la exploración clínica intraoperatoria del 60% y la intención de alcanzar una sensibilidad con la angiografía del 90%. Con un intervalo de confianza (IC) del 95% y un poder estadístico del 80%, estimando unas pérdidas del 15%, se valoró en 49 angiografías el tamaño muestral.
Se realizó un análisis descriptivo de las variables incluidas en el estudio. Todas las variables cuantitativas se expresan con su media y desviación estándar. Las variables cualitativas se expresan en proporciones y sus respectivos intervalos de confianza. La recogida de datos y el análisis estadístico se realizó utilizando la versión 24 del programa estadístico IBM SPSS Statistics 21.
Se utilizaron las siguientes fórmulas para validar la prueba diagnóstica:
- •
Valor predictivo positivo (VPP)=verdaderos positivos (VP) / VP+falsos positivos (FP).
- •
Valor predictivo negativo (VPN)=verdaderos negativos (VN) / VN+falsos negativos (FN).
- •
Sensibilidad=VP / total de enfermos.
- •
Especificidad=VN / total no enfermos.
- •
FN=individuos enfermos con test negativo / todos los enfermos.
- •
FP=individuos sanos con tes positivo / todos los sanos.
Durante el periodo a estudio 98 mujeres cumplieron los criterios de inclusión. En 75 mujeres se realizó una mastectomía con reconstrucción prepectoral y en 23 pacientes se realizó una cirugía oncoplástica. En 58 mujeres el procedimiento fue bilateral permitiendo el análisis de 156 mamas (fig. 1).
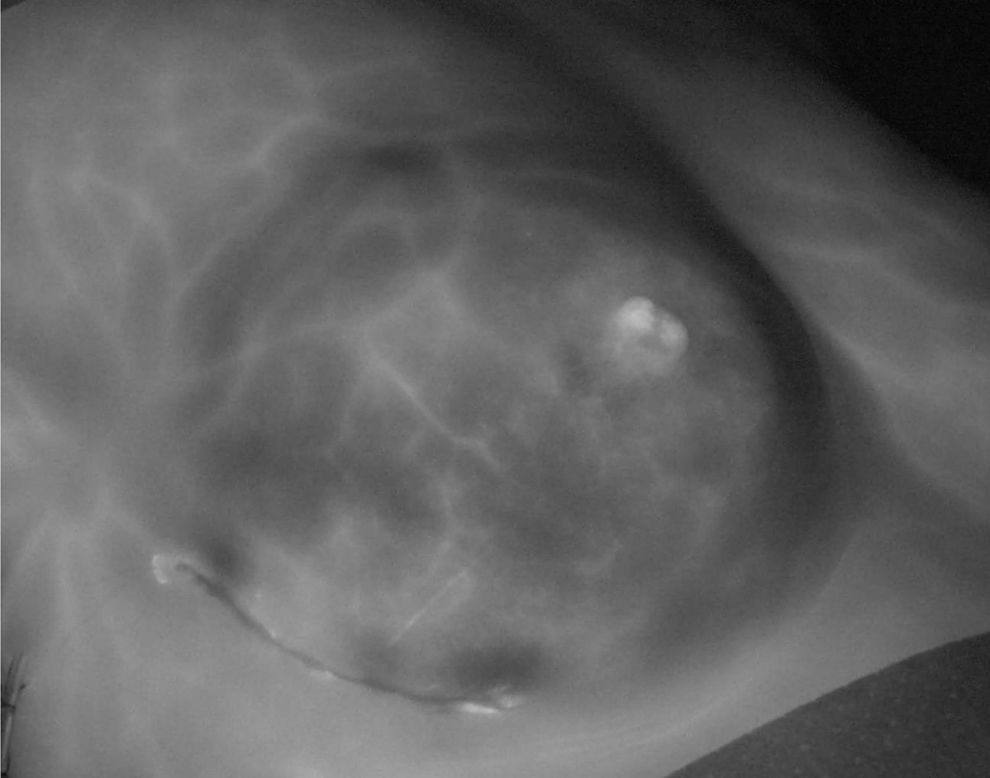
En todas las pacientes se realizó la primera angiografía tras realizar el diseño de la incisión evidenciando una adecuada vascularización de la piel de la mama en el 100% de las mujeres, incluso en las ocho mujeres (8,2%) incluidas que tenían antecedente de cirugía conservadora y radioterapia. En ocho pacientes (8,2%) se modificó la planificación inicial por los hallazgos de la vascularización durante la angiografía prequirúrgica. En 22 mujeres (22,4%) las angiografías mostraron una falsa imagen de necrosis, definida como la aparición de áreas sin captación de contraste delimitada por vasos que captan contraste (fig. 2). En 22 pacientes (22,4%) se detectó baja perfusión de VIC tras la segunda angiografía, perpetuándose tras el cierre (tercera angiografía) en 16 (72,7%) de ellas. Un total de 20 mujeres (20,4%) presentaron imagen de isquemia en la angiografía final (fig. 3).
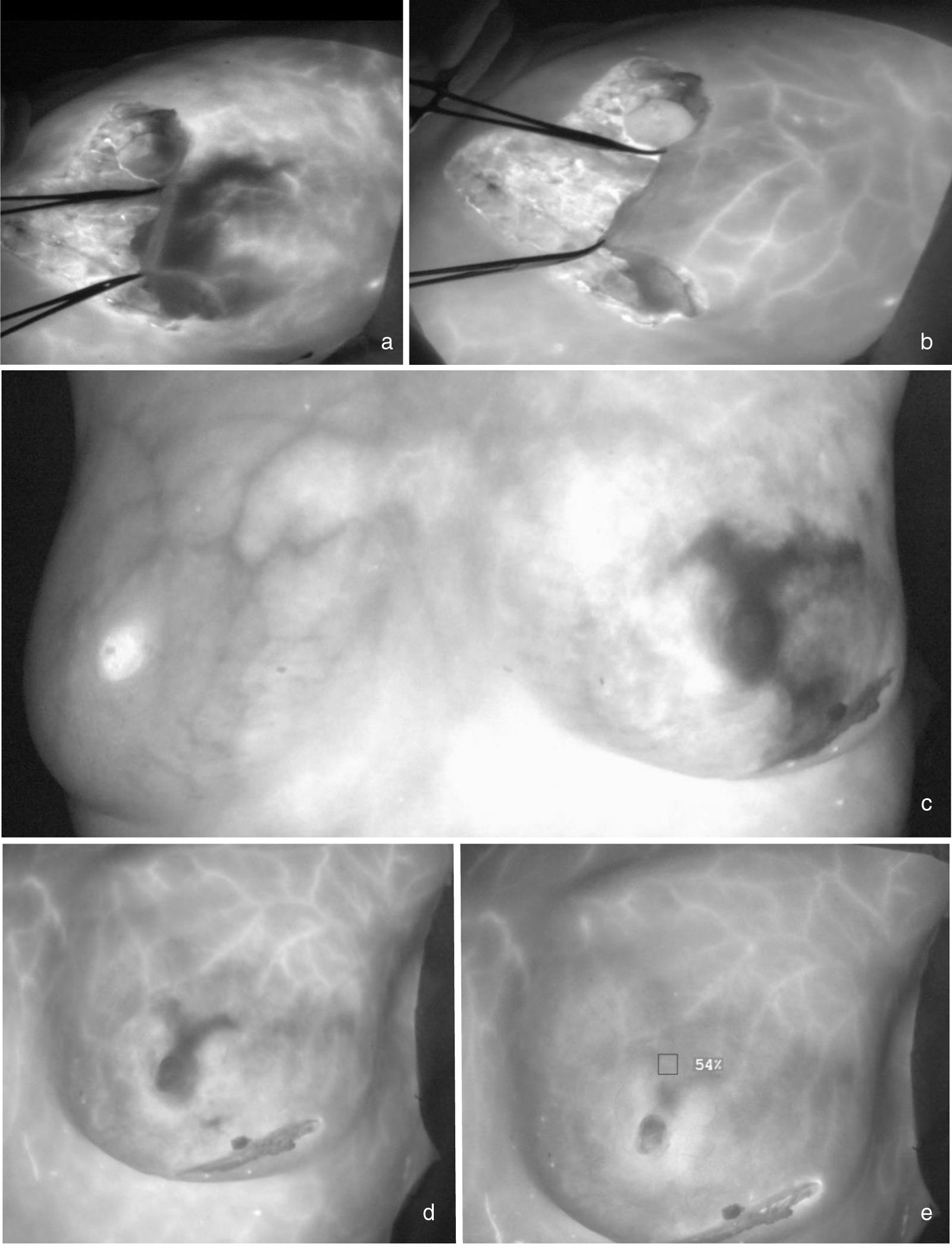
Isquemia precoz con recuperación tardía. a) Mujer con una mamoplastia reductora extrema que presenta hipoperfusión distal en el colgajo lateral a los 30 segundos del bolo de VIC. B) A los 140 segundos se observa la recuperación de la perfusión en dicha área. c) Paciente con una mastectomía preservadora de piel y pezón izquierda que presenta área extensa de isquemia en polos superior e inferior de la mama que se recupera a los dos minutos del bolo de VIC (d, e).
Durante el posoperatorio 27 mujeres (27,6%) presentaron alguna complicación, de las cuales 21 (21,4%) fueron eventos isquémicos. En 15 de las pacientes con eventos isquémicos (71,4%) la tercera angiografía detectó algún área de mala perfusión (tabla 1). En todas ellas la imagen de la angiografía se correspondió con la imagen anatómica de la isquemia cutánea (fig. 4). El 85,7% de los eventos isquémicos fueron necrosis superficiales que no precisaron reintervención. Tres pacientes presentaron complicaciones graves (3,1%), ninguna de ellas en cirugía conservadora. Todas las complicaciones graves fueron detectadas mediante A-VIC. Estas pacientes precisaron una intervención quirúrgica. Una paciente con MPPP a través del surco inframamario y extirpación del complejo areola-pezón (CAP) por infiltración neoplásica presentó dehiscencia de herida secundaria a necrosis realizándose cambio del implante por un expansor. Dos pacientes con MPPP mediante un patrón vertical de pedículo superior precisaron intervención, en una de ellas se resecó el tejido mal vascularizado y cierre de la herida; y en la otra paciente se realizó un colgajo toracoepigástrico.
Complicaciones durante el posoperatorio en las pacientes a estudio
| Tipo de complicaciones | Pacientes (n = 98) | Mamas (n = 156) |
|---|---|---|
| Seroma axilarSeroma mamarioInfecciónNecrosis cutáneaNecrosis parcial del CAPNecrosis total del CAP | 1 (1,0%)1 (1,0%)3 (3,1%)6 (6,1%)14 (14,3%)2 (2,0%) | 1 (0,6%)1 (0,6%)3 (1,9%)6 (3,8%)22 (14,1%)2 (1,3%) |
CAP: complejo areola-pezón.
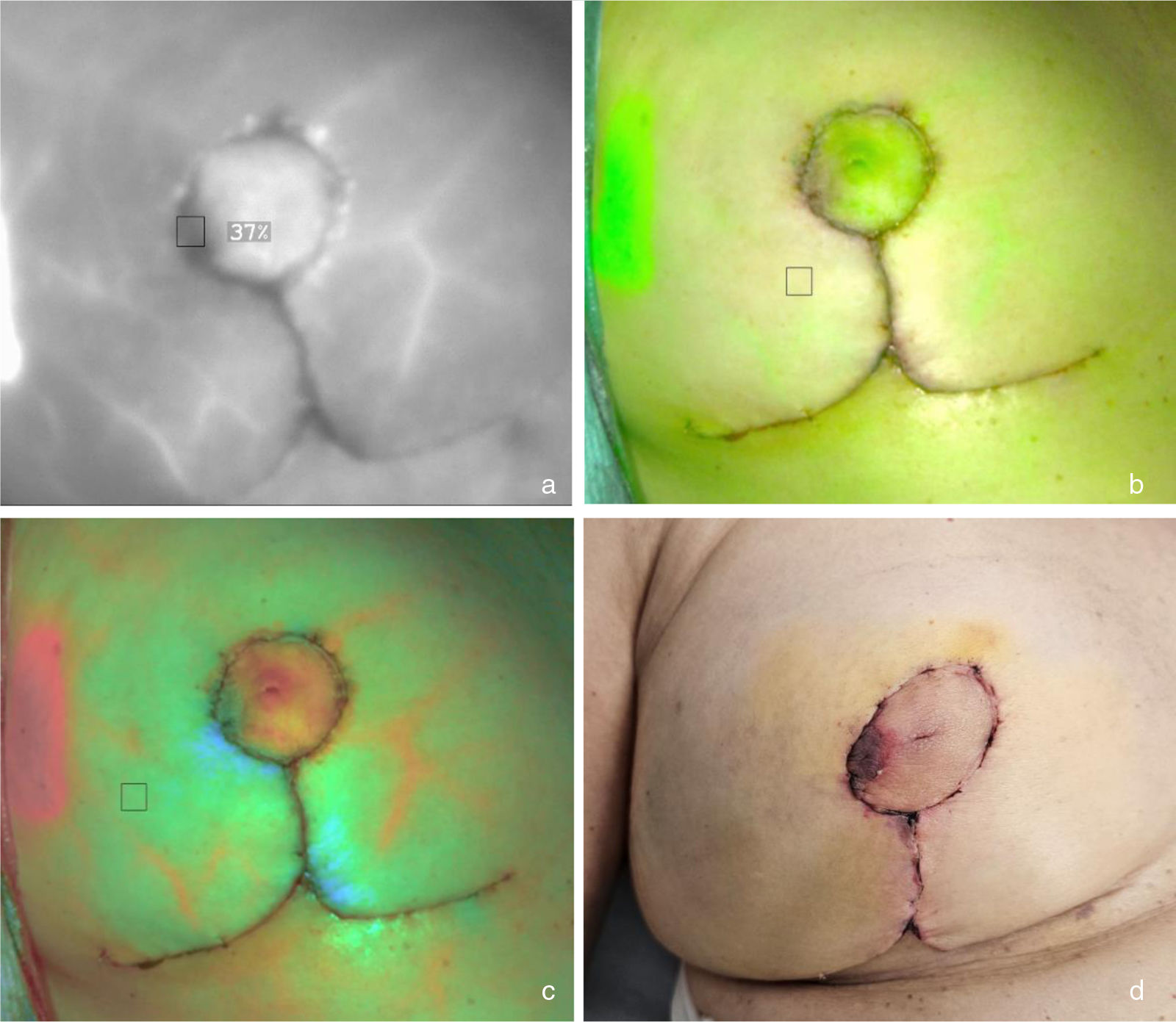
Isquemia en área lateral de areola derecha. La angiografía con VIC identifica un área de sufrimiento vascular en la periferia lateral de la areola derecha visible en el modo de fluorescencia (ausencia de contraste [a]), de superposición (ausencia de verde [b]) y de fluorescencia segmentada por color (ausencia de rojo [c]). Durante el posoperatorio la paciente sufrió una epidermiólisis superficial en dicha área que no precisó intervención quirúrgica (d).
Indicadores estadísticos por paciente. El VPP de la A-VIC fue del 75%, un VPN del 92%, una sensibilidad del 71,4% y una especificidad del 93,5% (tabla 2). La tasa de FN es de 28,6% y la de FP de 6,5%. El VPP es de 77,8% si se incluyen únicamente las cirugías de alto riesgo de necrosis (mama irradiada, oncoplastia vertical de pedículo inferior, oncoplastia extrema o mastectomías tipo I, IV y preservadoras de piel y pezón con incisión vertical).
Comparación de los resultados obtenidos en las angiografías intraoperatorias y los eventos posoperatorios
| Eventos por paciente | ||||
|---|---|---|---|---|
| Criterio diagnóstico | TOTAL | |||
| Necrosis en posoperatorio | No necrosis en posoperatorio | |||
| Angiografía con VIC | Isquemia en VIC | 15 (VP) | 5 (FP) | 20 |
| No isquemia en VIC | 6 (FN) | 72 (VN) | 78 | |
| TOTAL | 21 | 77 | 98 | |
| Eventos por mama | ||||
|---|---|---|---|---|
| Criterio diagnóstico | TOTAL | |||
| Necrosis en posoperatorio | No necrosis en posoperatorio | |||
| Angiografía con VIC | Isquemia en VIC | 18 (VP) | 6 (FP) | 24 |
| No isquemia en VIC | 11 (FN) | 121 (VN) | 132 | |
| TOTAL | 29 | 127 | 156 | |
FN: falsos negativos; FP: falsos positivos; VN: verdaderos negativos; VP: verdaderos positivos; VIC: verde de indocianina.
Indicadores estadísticos por mamas. El VPP de la A-VIC fue del 75%, el VPN de 91,7%, una sensibilidad del 62% y una especificidad del 95,2% (tabla 2). La tasa de FN es 37,9% y la de FP de 4,7%.
DiscusiónDiversos estudios han evaluado a la A-VIC como método diagnóstico en la perfusión de los colgajos cutáneos de la mastectomía. La mayoría de estos estudios han sido incluidos recientemente en una revisión de la Cochrane Library11, cuyo objetivo fue evaluar la capacidad de la A-VIC para la prevención de la necrosis en los colgajos cutáneos de la mastectomía en las mujeres con una reconstrucción inmediata tras MPP. En esta revisión se encontraron nueve estudios que compararon el número de complicaciones posoperatorias en mujeres a las que se les realizó una evaluación VIC de la piel de la mama comparada con la evaluación clínica. En dichos estudios se evaluaron un total de 1.589 mujeres con 2.199 reconstrucciones mamarias y en los mismos se informó del número de complicaciones por paciente o por mama. Los principales resultados de esta revisión referidos a las pacientes fueron que el VIC puede reducir las tasas de reoperación y que existe incertidumbre sobre si el VIC disminuye las tasas de necrosis de la piel mamaria, de infección, del hematoma y del seroma. Por su parte los principales resultados referidos a la mama fueron que el VIC puede reducir la necrosis de la piel mamaria, las tasas de reintervención e infección, y que existe incertidumbre sobre si el VIC tiene un efecto sobre las tasas de hematoma y seroma. La evidencia de los estudios evaluados durante esta revisión se consideró de muy baja calidad ya que no existen estudios prospectivos aleatorizados. Esta revisión hace hincapié en la necesidad de estudios prospectivos en la cirugía oncoplástica y reconstructiva de la mama12,13.
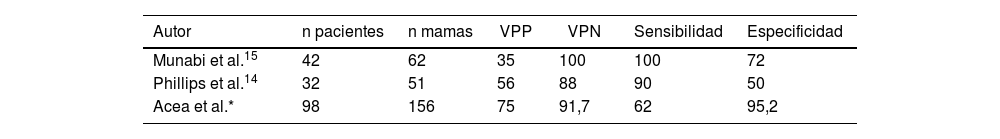
En nuestro conocimiento solo dos estudios prospectivos no aleatorizados14,15 han evaluado la sensibilidad, especificidad y valores predictivos de esta técnica. El estudio de Phillips et al.14 evaluaron este procedimiento en 51 reconstrucciones inmediatas con expansores para la predicción de necrosis cutánea posoperatoria. La sensibilidad, especificidad, VPP y VPN fueron del 90%, 50%, 56% y 88%, respectivamente. Por su parte, en el estudio de Munabi et al.15 estos valores fueron del 88%, 83%, 44% y 98%, respectivamente. En este último estudio los autores descubrieron que el tabaquismo y la inyección de epinefrina disminuían la especificidad de este método diagnóstico del 98% al 83%. Estos estudios presentan dos limitaciones. La primera se refiere a que han sido realizados en pacientes con una reconstrucción mamaria mediante expansor retropectoral. Actualmente este tipo de reconstrucción ha sido sustituida por la reconstrucción prepectoral con implante directo y por ello carecemos de información en esta nueva modalidad quirúrgica. Por otro lado, no existen estudios que hayan evaluado la A-VIC en mujeres con procedimientos oncoplásticos. La tabla 3 resume los resultados de estos autores y del presente estudio. La disparidad en los valores predictivos, sensibilidad y especificidad pueden estar relacionados con el número de pacientes/mamas de cada estudio, la complejidad técnica utilizada en cada serie y la subjetividad para determinar baja perfusión durante la angiografía.
Resultados de los estudios prospectivos para la evaluación de la eficacia de la angiografía con VIC en la perfusión cutánea
El objetivo principal de nuestro estudio ha sido aportar información sobre la sensibilidad, especificidad y valores predictivos de la A-VIC para identificar aquellas pacientes en quienes este procedimiento diagnóstico aporta un valor añadido en su planificación y ejecución quirúrgica. En este sentido nuestro estudio confirma que la cirugía mamaria de alta complejidad es el mejor escenario para el uso de la A-VIC porque constituye un contexto de alto riesgo para la isquemia cutánea. Así, la cirugía oncoplástica tipo 2 (mamoplastia oncoreductora) y las MPPP se benefician de esta tecnología para identificar áreas de hipoperfusión que precisarán una evaluación clínica durante el posoperatorio. En nuestra experiencia, la A-VIC no es idónea para la realización de una resección cutánea durante el intraoperatorio, ya que la extensión y profundidad de la isquemia se concretarán durante el posoperatorio, y porque la mayoría de estas necrosis serán superficiales y no precisarán una intervención quirúrgica. Solo se benefician de una rección cutánea intraoperatoria aquellas pacientes en quienes tanto la angiografía como la inspección clínica durante la cirugía demuestran con claridad una isquemia irreversible de la piel. En el resto de las pacientes es aconsejable una vigilancia posoperatoria para conocer tanto el alcance de la isquemia como los resultados patológicos del proceso y así concretar una reintervención (si fuese necesaria) que contemple ambos aspectos. Por otra parte, el alto VPN de la técnica (91,7% en nuestro estudio) tiene su aplicación práctica en la cirugía extrema de la mama porque permite mantener la planificación prevista una vez comprobada la vascularización de la piel o del CAP. Así, en pacientes con una oncoplastia extrema, con disección amplia del colgajo cutáneo o del CAP, o con una mastectomía reductora con pedículo inferior, la A-VIC puede demostrar la perfusión del colgajo cutáneo o del CAP y mantener la planificación inicial. Por todas estas consideraciones la A-VIC está orientada a equipos quirúrgicos que utilicen técnicas avanzadas en cirugía oncoplástica y reconstructiva de la mama porque tanto la cirugía oncoplástica tipo 1 como las técnicas de mastectomía no preservadoras presentan un bajo riesgo de necrosis cutánea.
Este estudio nos has proporcionado cuatro aprendizajes sobre el uso y la interpretación del VIC en la angiografía de la cirugía mamaria. La primera, la oportunidad de identificar la vascularización del CAP. La visualización del retorno venoso durante la primera angiografía, previa a la cirugía, permite identificar el papel de las perforantes de la pared torácica superior en la vascularización de cada uno de los CAP. Este hecho es importante para el diseño de pedículos adaptados a cada CAP en mamoplastias verticales de pedículo superior, ginecomastias a través de abordajes periareolares y mastectomías con preservación del CAP mediante un patrón vertical. La segunda, la posibilidad de diferenciar las áreas de baja perfusión originadas por una mala vascularización y aquellas situaciones con irrigación correcta, pero con una mala fluorescencia del VIC. Esta segunda situación se ha producido en pacientes en las que el colgajo cutáneo es demasiado fino, ya sea por una excesiva disección del colgajo o por la ausencia de espesor subcutáneo. Esta falsa infravascularización puede ser detectada mediante la presencia de vasos subcutáneos con colorante que demuestran la existencia de perfusión vascular. La tercera, este estudio ha aportado información sobre el efecto del cierre de heridas sobre la perfusión cutánea y del CAP. Algunos autores16 han llamado la atención sobre el impacto que provoca la presión del cierre cutáneo sobre la circulación cutánea y su relación con eventos necróticos durante el posoperatorio. En ninguna de las pacientes evaluadas en este estudio se ha objetivado un efecto pernicioso del cierre cutáneo sobre la perfusión cutánea: las pacientes con buena perfusión tras la mastectomía también la presentaron después del cierre, y aquellas con defectos de perfusión tras la mastectomía presentaron la misma intensidad y extensión del defecto durante el cierre. Finalmente, el estudio ha permitido visualizar el efecto de las cicatrices previas en la circulación cutánea demostrando que no existe una barrera vascular en las mismas y que, por el contrario, existe una permeación vascular en la mayoría de ellas.
Este estudio presenta diversas limitaciones. En primer lugar, la baja incidencia de eventos adversos (necrosis cutánea) limita una valoración más precisa de este procedimiento para analizar la relación entre los hallazgos intraoperatorios y posoperatorios. En segundo lugar, el bajo número de pacientes con mastectomías preservadoras tipo 4 limitan la experiencia en un grupo de enfermas con mayor riesgo de necrosis/dehiscencia en la herida vertical.
En conclusión, la A-VIC es una técnica útil para la planificación y evaluación de la perfusión cutánea en la cirugía oncoplástica y reconstructiva de la mama. Su alta especificidad (95,2%) ayuda a identificar las áreas con perfusión defectuosa. La mayoría de estas áreas serán necrosis superficiales que no precisarán reintervención y por ello no se aconseja su extirpación durante la cirugía. Su elevado VPN (91,7%) permite mantener la planificación inicial en cirugías extremas de alta complejidad. El uso de esta tecnología se centra en equipos quirúrgicos con experiencia para realizar cirugía mamaria de alta complejidad técnica.
FinanciaciónNo se ha recibido financiación para realizar este estudio.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.












![Isquemia en área lateral de areola derecha. La angiografía con VIC identifica un área de sufrimiento vascular en la periferia lateral de la areola derecha visible en el modo de fluorescencia (ausencia de contraste [a]), de superposición (ausencia de verde [b]) y de fluorescencia segmentada por color (ausencia de rojo [c]). Durante el posoperatorio la paciente sufrió una epidermiólisis superficial en dicha área que no precisó intervención quirúrgica (d). Isquemia en área lateral de areola derecha. La angiografía con VIC identifica un área de sufrimiento vascular en la periferia lateral de la areola derecha visible en el modo de fluorescencia (ausencia de contraste [a]), de superposición (ausencia de verde [b]) y de fluorescencia segmentada por color (ausencia de rojo [c]). Durante el posoperatorio la paciente sufrió una epidermiólisis superficial en dicha área que no precisó intervención quirúrgica (d).](https://static.elsevier.es/multimedia/0009739X/0000010200000011/v1_202411060455/S0009739X24001994/v1_202411060455/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)


