Como consecuencia de los procedimientos quirúrgicos, se produce una respuesta de estrés oxidativo con liberación de citoquinas y especies reactivas de oxígeno que activan la Heat Shock Response (HSR, ‘respuesta de choque térmico’) o respuesta al estrés, con un incremento en la síntesis de Heat Shock Proteins (HSP, ‘proteínas de choque térmico’).
ObjetivoEstudiar la biología de las Hsps70 intraleucocitarias y la IL-6 como posibles biomarcadores de la inflamación postquirúrgica, y una potencial respuesta anti-Hsp70, en pacientes sometidos a 2 situaciones quirúrgicas de distinta intensidad.
Material y métodosEstudio longitudinal de cohortes, con un grupo de pacientes sometidos a toracotomía bajo anestesia general (n=11), un grupo de pacientes sometidos a herniorrafia inguinal bajo anestesia locoregional (n=10) y un grupo de donantes voluntarios sanos (n=6). Se analizaron Hsps70 intraleucocitarias, Ac anti-hsp70 e IL-6 inmediatamente antes y a las 24h de la cirugía.
ResultadosLos pacientes toracotomizados mostraron una disminución significativa de Hsp70 intraleucocitaria y de Ac anti-Hsp70 en el postoperatorio inmediato. Los pacientes con mayores descensos de Hsp70 postoperatoria presentaron diversas complicaciones postquirúrgicas. Ambos grupos presentaron un significativo aumento postoperatorio de los niveles de IL-6.
ConclusionesCuanto más agresiva es la cirugía, mayor reducción de Hsp70 se produce en el postoperatorio, especialmente en pacientes con peor evolución, lo que ha llevado a proponer a la Hsp70 como marcador pronóstico postquirúrgico. El significativo incremento de IL-6 en ambos grupos, permite concluir que la dispar respuesta al estrés quirúrgico entre ambos grupos se debe no a la respuesta inflamatoria sistémica, sino a la HSR.
During and after surgical procedures, there is an oxidative stress response that releases cytokines and reactive oxygen species. This can activate Heat Shock Response (HSR), leading to an increase in Heat Shock Proteins (HSPs) expression proportional to the intensity of the stimulus.
ObjectiveThis study examined the biology of intraleucocyte Hsps70 and IL-6 as potential biomarkers of postoperative inflammatory stress, and a potential antiHsp70 autoimmune reaction in patients undergoing two surgical procedures of different severity.
Material and methodsLongitudinal cohort study including a group of patients undergoing thoracotomy under general anaesthesia (n=11), a group of patients undergoing inguinal hernia repair under regional anaesthesia (n=10), and a group of healthy controls (n=6). Intraleucocyte Hsps70, antiHsp70 antibodies and IL-6 were analysed, just before and 24h after surgery.
ResultsPatients undergoing thoracotomy showed a significant decrease in intraleucocyte Hsp70 and antiHsp70 antibodies in the early postoperative period; patients with the greatest Hsp70 decreases after surgery showed the lowest pre-surgical Hsp70 levels and these patients also experienced various postoperative complications. A significant postoperative increase in IL-6 levels in both groups was observed.
ConclusionsPatients undergoing a more aggressive surgery showed a significant Hsp70 reduction in the postoperative period. Patients with the lowest values of Hsp70 in the immediate postoperative period had the worst clinical course, which has led to propose use of Hsp70 as a prognostic post-surgical marker. The postoperative decrease in intracellular Hsp70 is parallel to the decrease in circulating autoantibodies. The different response of both groups to surgical stress is not due to systemic inflammatory response, but to HSR.
Durante el desarrollo de los procedimientos quirúrgicos y tras finalizar los mismos, se produce una respuesta de estrés oxidativo que comprende tanto la activación de mediadores inflamatorios, metabólicos, endocrinos e inmunológicos, entre ellos la Interleuquina-6 (IL-6)1 como la denominada Heat Shock Response (HSR, ‘respuesta de choque térmico’) o respuesta al estrés2; esta produce un incremento en la síntesis de las Heat Shock Proteins (HSP, ‘proteínas de choque térmico’), inducción que es proporcional a la intensidad del estímulo3. Las HSP se clasifican en familias de acuerdo con su peso molecular, de las cuales la familia HSP70 es la más ampliamente estudiada y contiene miembros que se expresan de forma constitutiva, Hsc70 (HSPA8), y miembros que lo hacen de forma inducida, Hsp70 (HSPA1A). El papel citoprotector de Hsp70, está ampliamente documentado en enfermedades humanas4. Aunque clásicamente conceptuadas como proteínas intracelulares, recientemente se ha descrito su liberación al torrente circulatorio, bien por un mecanismo pasivo desde células necróticas como en la cirugía5 o bien por mecanismos activos desde células viables. Las Hsps circulantes son moléculas inmunomoduladoras que actúan como potentes autoantígenos6. Su reconocimiento por linfocitos T desencadena una respuesta autoinmune que se ha relacionado con patologías como la ateroesclerosis7.
Las diferentes técnicas anestésicas modulan la respuesta al estrés: en las técnicas con bloqueo de la transmisión nerviosa (anestesia locorregional) se interrumpe la conexión neuroinmunoendocrina y no existe inhibición cortical cerebral; en la anestesia general se silencia la actividad cortical pero sigue siendo operativa la conexión señalada8.
Los leucocitos polimorfonucleares neutrófilos (PMN), pertenecen a la primera línea de reconocimiento y de defensa ante agresiones externas gracias a receptores toll que los convierte en una de las células comprometidas en la respuesta inmune innata9. El estrés oxidativo activa los PMN e induce en ellos la síntesis de HSP las cuales tendrían un importante papel en la autoprotección de estas células productoras a su vez de radicales libres de oxígeno10,11.
El objetivo de este trabajo fue estudiar la biología de las Hsps70 intraleucocitarias y la IL-6 como posibles biomarcadores de la inflamación postquirúrgica en pacientes sometidos a 2 situaciones quirúrgicas de distinta intensidad: a) toracotomía (agresión mayor con anestesia general, y b) cirugía de herniorrafia (agresión menor con anestesia locorregional). Además se analizó una posible reacción autoinmune antiHsp70 en respuesta a los 2 distintos grados de agresión quirúrgica.
Material y métodosDiseño del estudioEstudio longitudinal de cohortes, con un grupo de pacientes sometidos a toracotomía bajo anestesia general, un grupo de pacientes sometidos a una reparación de hernia inguinal con anestesia regional y otro de controles sanos. El tamaño muestral se calculó en términos de potencia estadística por el departamento de epidemiología del Hospital General Universitario Gregorio Marañón de Madrid (HGUGM) de acuerdo a los resultados obtenidos previamente en un estudio piloto12.
Se incluyeron 21 pacientes varones ingresados en los departamentos de cirugía y de anestesia y reanimación del HGUGM. Seis varones controles voluntarios sanos pareados por edad, proporcionaron los valores de referencia. El estudio fue aprobado por la comisión de investigación y la comisión de ética de la investigación clínica. Los pacientes y voluntarios fueron asignados a uno de los siguientes grupos: grupo I, controles voluntarios sanos (n=6); grupo II, pacientes sometidos a toracotomía para la realización de lobectomía bajo anestesia general (n=11); grupo III: pacientes sometidos a una reparación de hernia inguinal con anestesia regional (n=10). A todos los participantes se les realizó una anamnesis, exploración física y determinaciones analíticas para comprobar que clínicamente se encontraban libres de enfermedad infecciosa y/o autoinmune, así como una revisión de la historia clínica y del preoperatorio. Inmediatamente antes de la cirugía se extrajeron 5ml de sangre en tubos no heparinizados para la obtención de suero y 20ml de sangre en tubos con EDTA para aislamiento de leucocitos polimorfonucleares neutrófilos. 24h después de concluir la cirugía se obtuvo una segunda muestra de características similares, en los grupos de estudio.
Métodos analíticos- 1.
Obtención de suero
Tras la extracción de la sangre, se dejaron los tubos durante 15min a temperatura ambiente para permitir la formación del coágulo. Se centriguraron 15min a 3.500rpm a 4°C y se tomó el sobrenadante. Las muestras de suero se guardaron a −70°C hasta su procesamiento.
- 2.
Aislamiento de leucocitos polimorfonucleares neutrófilos (PMN)
La sangre se obtuvo por venopunción en tubos de vacío venoJect™ conteniendo EDTA 0,47mM/l, 21 w/v % (se excluyeron otros anticoagulantes que activan los polimorfonucleares como el citrato o la heparina). El aislamiento de PMN se realizó por gradiente, centrifugando la sangre a 450–500g, durante 30min en Polymorphprep™ (Nycomed, Oslo, Norway). Se tomó la banda de los PMN y se depositó sobre 10ml de una solución tamponada de fosfatos, PBS (17.11mM NaCl, 0,335mM KCl, 0,44mM KH2PO4, 1,016mM Na2HPO4); se centrifugó 5min a 450g. Para evitar posible contaminación por eritrocitos, se sometieron las células a choque osmótico añadiendo agua destilada estéril fría. Se centrifugaron 5min a 450–500g y se decantó el sobrenadante. El precipitado con los PMN se resuspendió en 100μl de tampón de ruptura RIPA suplementado con inhibidores de proteasas y fosfatasas: PMSF 1mM, ortovanadato sódico 1mM, leupeptina 10μg/ml, aprotinina 10μg/ml y pepstatina 10μg/ml. Los lisados celulares se homogenizaron mediante 40 pases de homogenizador Kontes y se centrifugaron a 12.000g durante 15min a 4°C. Se guardó el sobrenadante a −70°C hasta su posterior procesamiento.
- 3.
Valoración del contenido proteico de los lisados celulares
El contenido en proteínas de la fracción soluble se valoró por el método de microensayo de Lowry, utilizando el kit para valoración de proteínas Bio-Rad frente a una curva patrón de albúmina (0–10μg/ml) (albúmina sérica bobina, BSA, Bio-Rad).
- 4.
Inmunoblotting
Tras realización de una electroforesis monodimensional en gel de poliacrilamida en condiciones desnaturalizantes (PAGE-SDS), se identificaron la Hsc70 y la Hsp70 intracelulares mediante western-blot. Brevemente, los geles de poliacrilamida son trasferidos a membranas de PVDF (Inmobilon, Millipore) y en estas se bloquean las uniones inespecíficas por incubación con leche en polvo desnatada 3% (p/v) en PBS- tween 20 (Bio-Rad, 0.05% (v/v). Se lavan 3 veces con PBS- Tween 20 0,05% (v/v) y posteriormente se incuban con Ac monoclonales (Streessgen, SPA 815 –Hsc70-, SPA 810 –Hsp70) diluídos 1:1.000 en 0,05% PBS-Tween 20 (v/v)-0,5% BSA (p/v). Se lavan 3 veces y se incuban con un segundo Ac anti IgG de ratón conjugado con biotina (Amersham). La señal se amplifica mediante incubación con HPR (horseradish peroxidase streptavidin) (Amersham). Se revelan con 4-cloro-1-naphtol (Sigma) como sustrato. La identificación de las proteínas en estudio se completó por su peso molecular, tomando como referencia las bandas coloreadas de los patrones, que se corren paralelos a las muestras (Rainbow Markers Amersham).
Las imágenes de las bandas se digitalizaron con un escáner SCANJET-II CX (Hewlett-Packard) y se procesaron mediante software Scil-Image. El gris total de las muestras problema se normalizan a la media de los grises de las muestras control y la cuantificación del contenido en Hsc70 y Hsp70 de las muestras problema se expresaron en Unidades Arbitrarias (UA).
- 5.
Cuantificación de Ac antiHsp70
Los Ac antiHsp70 se cuantificaron en suero diluido 1:1000 utilizando un kit comercial de ELISA siguiendo las instrucciones del fabricante (EKS-750, Anti Human Hsp70 (IgG/IgM/IgA) ELISA Kit, Stressgen). Los resultados obtenidos se expresan en micro μg/ml. La linealidad fue 31,25–1.000μg/ml y la sensibilidad, 6,79μg/ml. Los coeficientes de variación intra e interensayo fueron<10%.
- 6.
Cuantificación de interleuquina 6 (IL-6)
La concentración de IL-6 sérica se midió mediante un kit comercial de ELISA (MedSystems Diagnostics GMBH, BMS213/2®). La concentración de IL-6 de cada muestra se calculó por interpolación en una curva estándar y se expresa en in pg/ml. Los valores séricos normales están en un rango de 0–14,1pg/ml, con una media de 1,3pg/ml y una desviación estándar de 3,2pg/ml.
- 7.
Estudio estadístico
Todos los procedimientos se hicieron al menos por duplicado. Los resultados se expresaron como media±error estándar de la media (SEM) y se compararon mediante los tests de Kolmogorov-Smirnov, t de Student para datos apareados y ANOVA para datos ajustados a la normalidad y los test de Wilconox, Mann-whitney y Kruskal Wallis para datos no paramétricos. Se aceptó una significación estadística cuando p<0,05. Se utilizó el paquete estadístico SPSS 12.0 para Windows.
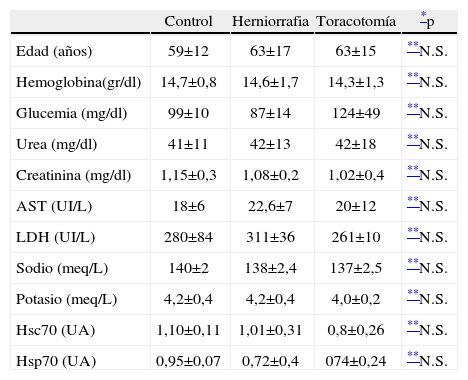
Los 3 grupos fueron homogéneos tanto en variables sociodemográficas (edad, peso, talla), como en parámetros analíticos (glucemia, urea, creatinina, aspartatoaminotransferasa, lactotodeshidrogenasa, sodio, potasio y hemoglobina); también lo fueron en el contenido de Hsc70 y Hsp70 basal (tabla 1).
Valores demográficos, analíticos y contenido en Hsps 70 preoperatorios (media±desviación típica)
| Control | Herniorrafia | Toracotomía | *p | |
| Edad (años) | 59±12 | 63±17 | 63±15 | **N.S. |
| Hemoglobina(gr/dl) | 14,7±0,8 | 14,6±1,7 | 14,3±1,3 | **N.S. |
| Glucemia (mg/dl) | 99±10 | 87±14 | 124±49 | **N.S. |
| Urea (mg/dl) | 41±11 | 42±13 | 42±18 | **N.S. |
| Creatinina (mg/dl) | 1,15±0,3 | 1,08±0,2 | 1,02±0,4 | **N.S. |
| AST (UI/L) | 18±6 | 22,6±7 | 20±12 | **N.S. |
| LDH (UI/L) | 280±84 | 311±36 | 261±10 | **N.S. |
| Sodio (meq/L) | 140±2 | 138±2,4 | 137±2,5 | **N.S. |
| Potasio (meq/L) | 4,2±0,4 | 4,2±0,4 | 4,0±0,2 | **N.S. |
| Hsc70 (UA) | 1,10±0,11 | 1,01±0,31 | 0,8±0,26 | **N.S. |
| Hsp70 (UA) | 0,95±0,07 | 0,72±0,4 | 074±0,24 | **N.S. |
UA: Unidades Arbitrarias tomadas de la normalización del gris total de las bandas de inmunoblot de las muestras problema con respecto a las muestras control.
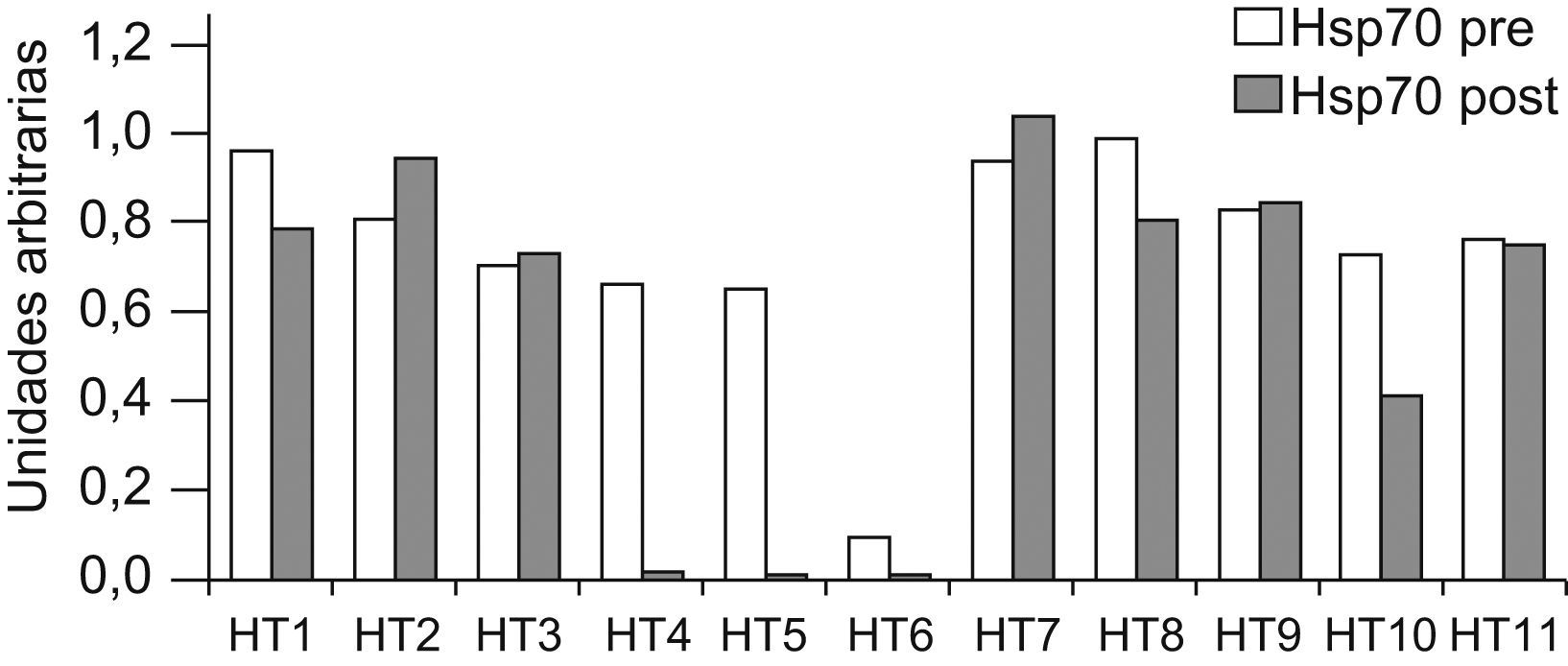
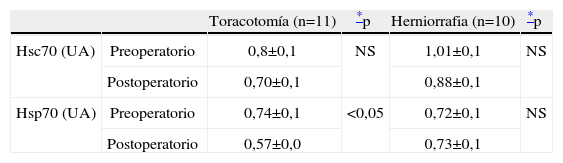
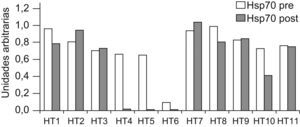
En el postoperatorio inmediato, se aprecia una tendencia al descenso de la concentración de Hsps70 intraleucocitarias, que es estadísticamente significativa para la Hsp70 en pacientes toracotomizados, mientras permanecen sin alteraciones en los pacientes sometidos a herniorrafia inguinal (tabla 2). Los 4 pacientes del grupo II con los máximos descensos de Hsps70 tras la intervención quirúrgica, tenían los menores niveles de Hsps70 preoperatoria (fig. 1) y eran portadores de patologías inflamatorias previas (TB, colitis ulcerosa, quimioterapia). Fueron además los pacientes con diversas complicaciones postoperatorias.
Contenido en Hsc70 y Hsp70 antes y después de la intervención quirúrgica, en pacientes sometidos a cirugía de toracotomía (n=11) y en pacientes sometidos a herniorrafia inguinal (n=10)
| Toracotomía (n=11) | *p | Herniorrafia (n=10) | *p | ||
| Hsc70 (UA) | Preoperatorio | 0,8±0,1 | NS | 1,01±0,1 | NS |
| Postoperatorio | 0,70±0,1 | 0,88±0,1 | |||
| Hsp70 (UA) | Preoperatorio | 0,74±0,1 | <0,05 | 0,72±0,1 | NS |
| Postoperatorio | 0,57±0,0 | 0,73±0,1 |
UA:Unidades Arbitrarias tomadas de la normalización del gris total de las bandas de inmunoblot de las muestras problema con respecto a las muestras control. Resultados expresados como media±SEM.
Contenido individualizado de Hsp70 (HSPA1A) antes y después de la intervención de toracotomía. Los pacientes con menor contenido de Hsp70 preoperatoria, eran portadores de patologías inflamatorias previas, y presentaron los mayores descensos en el posoperatorio así como complicaciones postquirúrgicas.
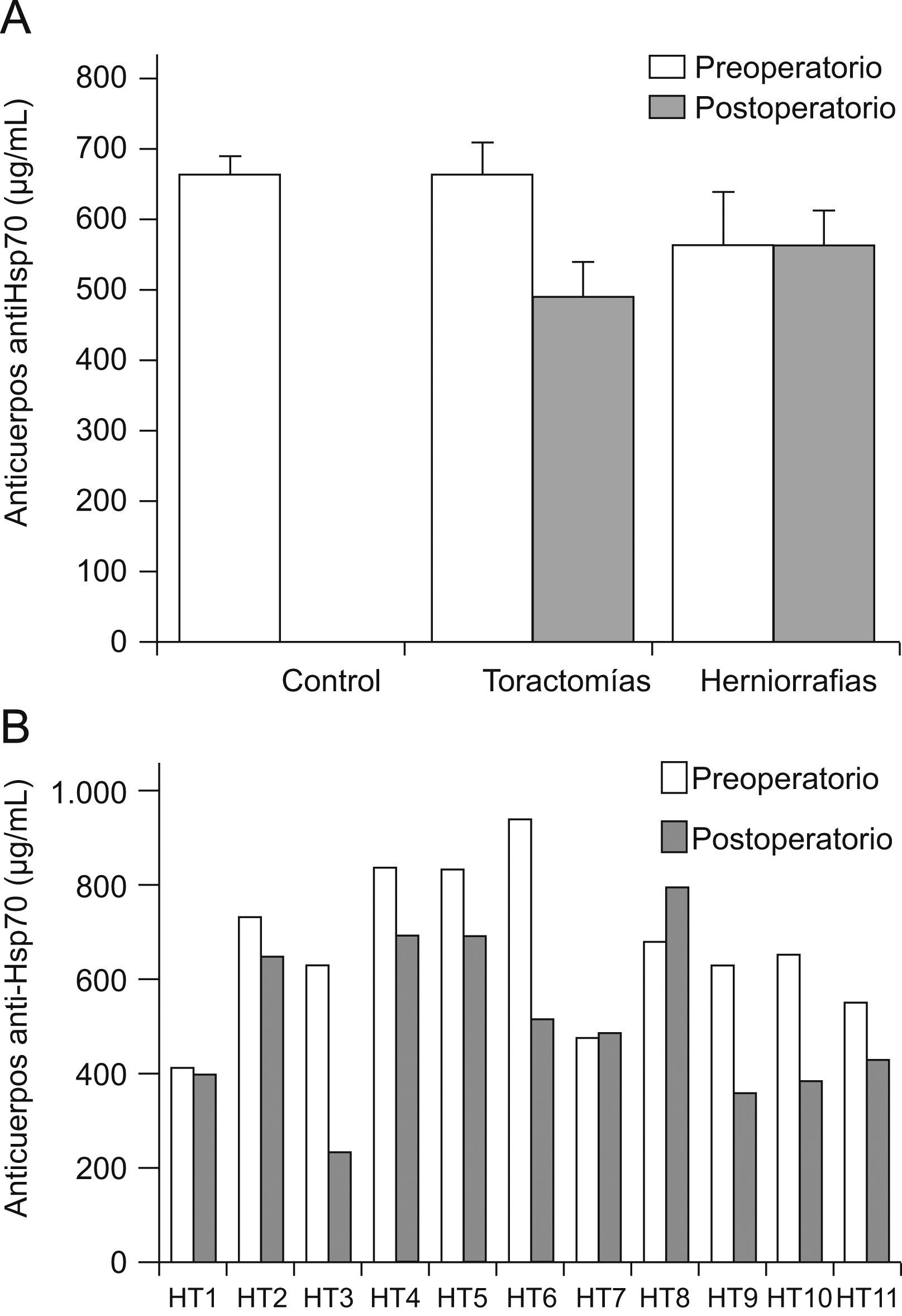
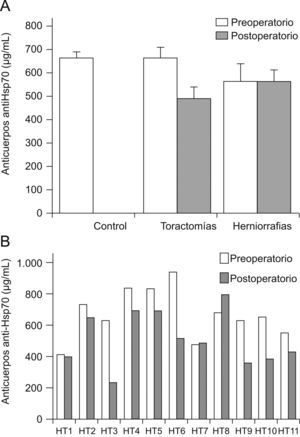
Igualmente se objetivó que los pacientes operados de hernia inguinal presentaron niveles de Ac antiHsp70 estables antes y después de la intervención, mientras que se demuestró un descenso postoperatorio significativo en los pacientes sometidos a toracotomía (tabla 3, fig. 2). De forma semejante, los pacientes de este grupo con patología inflamatoria previa, presentaban los niveles de Ac más altos previamente a la intervención.
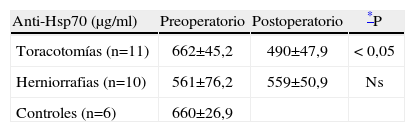
Cuantificación de Abs antiHsp70 antes y después de la intervención quirúrgica, en pacientes sometidos a cirugía de toracotomía (n=11) y en pacientes sometidos a herniorrafia inguinal (n=10)
| Anti-Hsp70 (μg/ml) | Preoperatorio | Postoperatorio | *P |
| Toracotomías (n=11) | 662±45,2 | 490±47,9 | < 0,05 |
| Herniorrafias (n=10) | 561±76,2 | 559±50,9 | Ns |
| Controles (n=6) | 660±26,9 |
Resultados expresados como media ± SEM (μg/ml).
A) Cuantificación de Ac antiHsp70 antes y después de la cirugía. Resultados expresados en μg/ml (media±SEM). * p<0,05 referido al efecto del tratamiento según el Test de Student para datos apareados. B) Cuantificación individualizada de Ac anti-Hsp70 antes y después de la intervención de toracotomía.
El análisis de interleuquina 6 reveló una elevación significativa de la misma en el postoperatorio en ambos grupos sin que existan diferencias significativas entre ambos grupos entre sí (tabla 4).
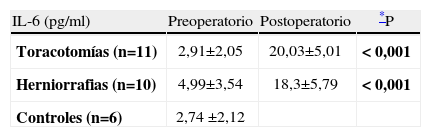
Cuantificación de IL-6 antes y después de la intervención quirúrgica, en pacientes sometidos a cirugía de toracotomía (n=11) y en pacientes sometidos a herniorrafia inguinal (n=10)
| IL-6 (pg/ml) | Preoperatorio | Postoperatorio | *P |
| Toracotomías (n=11) | 2,91±2,05 | 20,03±5,01 | < 0,001 |
| Herniorrafias (n=10) | 4,99±3,54 | 18,3±5,79 | < 0,001 |
| Controles (n=6) | 2,74 ±2,12 |
Resultados expresados como media ± SEM (pg/ml).
La respuesta al estrés quirúrgico y anestésico incluye tanto una respuesta de estrés oxidativo como una respuesta de choque térmico con activación de los genes hsps y especialmente de hsp7013, cuya intensidad está en función de la severidad de la agresión quirúrgica14. Pese a ello, en el presente estudio se ha objetivado una significativa disminución postoperatoria de Hsps70 en el grupo de pacientes sometidos a la mayor agresión quirúrgica. Ello podría explicarse porque el estrés anestésico quirúrgico intenso y prolongado, desencadenaría una rápida respuesta de estrés que induciría la síntesis inmediata de grandes cantidades de Hsp70. La sobreexpresión de Hsp70 inhibe la activación del factor de trascripción de choque térmico (Heat Shock Factor, HSF) y en consecuencia, la trascripción génica con disminución consecuente de la traducción proteica15. La disminución postoperatoria de los niveles de Hsp70 detectada en este grupo de enfermos podría ser también, consecuencia de un excesivo consumo dado el específico papel de Hsp70 de los PMN en la neutralización de las especies reactivas de oxígeno16.
Una de las características diferenciales en el estudio de la biología de las proteínas de choque térmico en humanos, es la gran variabilidad interindividual de su síntesis basal17. Entre los factores que podrían contribuir a la expresión diferencial de Hsps basales figuraría el status antioxidante del paciente, el cual modula la activación del HSF a través de los niveles de los radicales libres de oxígeno18. Los pacientes que tenían los menores niveles de Hsps70 antes de la intervención eran portadores de enfermedades inflamatorias previas, lo cual puede determinar un menor estado prooxidante por sobreestimulación del sistema19. El grado de síntesis basal de Hsps70 se correlaciona con el porcentaje de inducción de síntesis de Hsps70 tras un estímulo bien ex-vivo, o in vivo, lo que explica la diferente tolerancia al estrés y la dispar susceptibilidad individual a la enfermedad20. En el presente estudio, los pacientes con menores niveles de Hsps70 preoperatorios presentaron también los valores más bajos en el postoperatorio inmediato, y además fueron los de peor evolución clínica. Hsp70 posee propiedades antiinflamatorias debido a su inhibición en la expresión de citoquinas proinflamatorias21 y de factores de trascripción proinflamatorios como el factor nuclear κβ22, lo que protegería a las células de los efectos deletéreos de la respuesta inflamatoria y niveles bajos de Hsp70 promoverían un estado proinflamatorio; ello ha llevado a proponer la Hsp7020 como marcador pronóstico, en individuos en riesgo, de desarrollar complicaciones postoperatorias. Su monitorización podría permitir a cirujanos y anestesistas modificar actuaciones quirúrgicas, e incluso intentar incrementar sus niveles antes de la intervención para mejorar la evolución postoperatoria. Actualmente se ha demostrado que pequeños cambios en el estilo de vida, incluyendo el ejercicio físico, tienen probados efectos en el incremento de los niveles de Hsp7023 y el tratamiento de ciertos tumores con vacunas-Hsp70 es ya un hecho contrastado24.
Se ha descrito que Hsp70 participa también en la respuesta inmune innata interaccionando con receptores toll-like25 así como en fenómenos de autoinmunidad; ello se justifica por un doble mecanismo, de una parte por la liberación de Hsps desde células necróticas26, y de otro, por el trasporte desde células viables de Hsps del citosol a la membrana celular con su posterior secreción al medio extracellular27. El grupo de pacientes sometido a herniorrafia inguinal mediante raquianestesia mantuvo valores de Ac antiHsp70 estables antes y después de la intervención quirúrgica. Ello se explica por 2 vías diferentes pero simultáneas: por una parte, la anestesia epidural reduce el estrés intraoperatorio y con ello atenúa el empeoramiento postoperatorio la respuesta inmune28. Por otra, la cirugía poco invasiva que supone una herniorrafia inguinal, no altera la respuesta endocrina metabólica del estrés quirúrgico y reduce la respuesta inflamatoria y la supresión inmune29. En el grupo de pacientes sometidos a toractomía bajo anestesia general, se objetivó una significativa disminución de la respuesta autoinmunitaria antiHsp70, que fue simultánea a la disminución del contenido de Hsp70 intracelular. En este grupo de pacientes expuestos a una mayor agresión quirúrgica, se produciría una inmediata HSR con síntesis de grandes cantidades de Hsps70 intracelulares y su liberación al torrente circulatorio con la consiguiente producción de autoanticuerpos antiHsp70. Los Ac tienden a concentrarse en el área de la agresión quirúrgica con una disminución de sus concentraciones plasmáticas26. Por otra parte, el aumento de los niveles de Hsp70 sérica, incrementaría la formación de inmunocomplejos antígeno-anticuerpo, disminuyendo la concentración de Ac antiHsp70i circulantes detectables30 como se ha evidenciado en este estudio. Dicha disminución podría también reflejar un cierto estado de inmunosupresión tras una severa agresión31.
Los niveles séricos de IL-6 fueros significativamente superiores 24h después de las intervenciones quirúrgicas, con independencia de las técnicas anestésicas empleadas, lo cual coincide con otros trabajos32. Dado que la IL-6 juega un papel mayor en la respuesta de fase aguda y esta es similar en ambos grupos, y dado que en los pacientes sometidos a herniorrafia inguinal, cirugía mínimamente invasiva, no se ha podido demostrar la presencia de una HSR, podemos sospechar que la disminución tanto de los niveles postoperatorios de Hsps70 intracelulares como de autoAc circulantes antiHsp70 en pacientes sometidos a toracotomía, responden a una respuesta celular de estrés que estaría modulada por el grado y la intensidad de lesión, y no a la respuesta inflamatoria sistémica.
En resumen, cuanto mayor es la agresión quirúrgica, mayor es la disminución de Hsp70 intracelular en el postoperatorio inmediato. Dicha disminución es aún más importante en los pacientes con peor evolución postoperatoria, lo que ha llevado a proponer a la Hsp70 como marcador pronóstico postquirúrgico. La reducción del contenido intracelular de Hsp70 es paralela a la disminución de Ac antiHsp70, bien por la formación de inmunocomplejos circulantes, bien por su acúmulo en él area lesional y podría reflejar un cierto estado de inmunosupresión tras una severa agresión. El significativo incremento de Il-6 en ambos grupos de pacientes, los sometidos tanto a cirugía mayor como los sometidos a cirugía menor, nos permite concluir que la diferente respuesta al estrés quirúrgico no es debido a la respuesta inflamatoria sistémica sino a la respuesta de choque térmico.
FinanciaciónEste trabajo ha sido financiado con una ayuda FIS 03/1308 y una ayuda de la Fundación Mutua Madrileña.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A María Jesús Sánchez por su inestimable colaboración en el procesamiento de las muestras.
Parte de la información de este manuscrito ha sido presentada en el 2009 Annual Meeting of the Society for the Leukocyte Biology, International Cytokine Society & International Society for Interferon and Citokyne Research. Lisboa, Portugal, 18–21 de octubre de 2009.