Las metástasis hepáticas de carcinoma de mama (MHCM) se consideran una enfermedad sistémica cuyo tratamiento principal está basado en la quimioterapia, mientras que el papel de la resección quirúrgica sigue sin estar bien definido.
El objetivo de este estudio fue analizar la supervivencia y los factores pronósticos predictivos de mortalidad en las pacientes con MHCM tratadas con resección hepática.
Material y métodosEntre 1998–2008 intervinimos a 21 pacientes, realizando resección hepática en 12. Recogimos distintas variables retrospectivamente.
ResultadosLa edad media fue de 48 años. El estadio más frecuente del tumor primario fue el i, con cirugía curativa en todos los casos, y recibió tratamiento adyuvante la mayoría (66,7%). Las MHCM fueron fundamentalmente metacrónicas (83,3%). Recibió tratamiento neoadyuvante el 66,7%. La resección hepática fue R0 en todos los casos con una morbilidad nula y una mortalidad a largo plazo del 8,3%. Recibió quimioterapia adyuvante el 66,7%. La supervivencia estimada fue del 67% al año y del 23% a los 5 años. Un periodo libre de enfermedad entre el tumor primario y la aparición de metástasis menor de 24 meses se asoció a peor supervivencia.
ConclusionesLa resección de las MHCM dentro del manejo multimodal es un tratamiento seguro en pacientes seleccionadas.
Breast cancer liver metastases (BCLM) are considered as a systemic disease which is mainly treated with chemotherapy, while the role of surgical resection still remains to be well defined.
The aim of the study is to analyse the survival and prognostic factors predictive of mortality in patients with BCLM treated by liver resection.
Material and methodsA total of 21 patients were operated on between 1998–2008, with liver resection being performed on 12. We retrospectively collected several variables.
ResultsThe mean age was 48 years. The most frequent stage was I, with curative surgery in all cases, and the majority (66.7%) received adjuvant treatment. The BCLM were mainly meta metachronic (83.3%). The majority (66.7%) received neoadjuvant treatment. The liver resection was R0 in all cases with no morbidity and a mortality in the long term of 8.3%. Two-thirds received chemotherapy. The estimated survival at one year was 67% and 23% at 5 years. A disease free period of less than 24 months between the primary tumour and the appearance of metastasis was associated with a worse survival.
ConclusionsResection of BCLM within a multimodal treatment is safe in selected patients.
Aunque el hígado es lugar frecuente de metástasis, los mecanismos de desarrollo de estas son diferentes, dependiendo de la localización del tumor primario. En pacientes con tumores primarios gastrointestinales, el hígado actúa como filtro y las metástasis hepáticas (MH) asientan en él a través del drenaje venoso portal o de los canales linfáticos intraabdominales, no considerándose enfermedad sistémica. Actualmente, se acepta que el mejor tratamiento de las MH de carcinoma colorrectal (MHCCR) se obtiene con la combinación de la resección quirúrgica y la quimioterapia (QT), estimando que la supervivencia de los pacientes no resecados es nula a 5 años, mientras que en los pacientes tratados con resección hepática es del 35–58% en las series de los últimos 10 años1,2.
Por otra parte, las MH de tumores primarios extraabdominales deben su desarrollo a la diseminación tumoral por vía sistémica, por lo que la resección hepática en estos casos es muy discutida. Entre ellas se encuentran las MH de carcinoma de mama (MHCM), que desarrollarán el 5–12% de las pacientes diagnosticadas de cáncer de mama3,4. La mayoría recibe tratamiento quimioterápico únicamente, consiguiendo medianas de supervivencia de 22–27 meses3.
Los estudios que evalúan la eficacia de la resección hepática en tumores primarios extraabdominales no presentan conclusiones claras debido a la heterogeneidad de estos tumores primarios, al limitado número de pacientes y a la asociación del tratamiento quirúrgico a la QT5–8. Sin embargo, en estos últimos años, y probablemente animados por los buenos resultados obtenidos con la resección quirúrgica en pacientes con MHCCR, han surgido varios trabajos que muestran que esta opción terapéutica constituye un tratamiento seguro en pacientes seleccionadas y que puede aportar un aumento de la supervivencia en comparación con el tratamiento basado únicamente en QT, administrado en la mayoría de los casos9–11.
El objetivo de este estudio fue analizar los resultados y los factores pronósticos asociados a una peor supervivencia en nuestra serie de pacientes con MHCM en las que indicamos resección quirúrgica hepática , y así poder seleccionar mejor a aquellas que pueden beneficiarse de esta opción terapéutica.
Material y métodosEntre noviembre de 1998 y noviembre de 2008 intervinimos a 21 pacientes diagnosticadas de MHCM en la Unidad de Cirugía y Trasplante Hepático del Hospital Universitario La Fe, realizando resección hepática en 12 de ellas.
Se propuso la intervención quirúrgica en aquellas pacientes que cumplían dos requisitos: una buena situación clínica que no contraindicara una resección hepática y la posibilidad de realizar una resección R0 según las exploraciones complementarias de imagen preoperatorias. Se realizó tomografía computarizada y/o resonancia magnética en todas las pacientes y, en casos seleccionados con mayor riesgo de enfermedad peritoneal o hepática oculta, se realizó también una tomografía por emisión de positrones en el último periodo del estudio. Durante el acto quirúrgico, se realizaron en todos los casos una exploración completa de la cavidad abdominal para excluir carcinomatosis o adenopatías locorregionales y una ecografía hepática intraoperatoria. A las pacientes en las que intraoperatoriamente se consideró imposible efectuar una resección R0 no se les realizó hepatectomía y fueron excluidas del análisis estadístico final.
Los esquemas de QT administrados fueron diferentes, siendo Taxol®, ciclofosfamida, epirrubicina y metotrexato los agentes más empleados.
Las variables analizadas se recogen en la tabla 1.
Datos recogidos de las pacientes
| Tumor primario | Metástasis hepáticas |
| Estadio | Periodo libre de enfermedad (meses) |
| Esquema de quimioterapia neoadyuvante y número de ciclos | Presencia de otras metástasis sincrónicas |
| Tipo de cirugía (conservadora/mastectomía) | Esquema de quimioterapia neoadyuvante y número de ciclos |
| Esquema de quimioterapia adyuvante y número de ciclos | Respuesta al tratamiento neoadyuvante (completa/parcial/ninguna) |
| Radioterapia postoperatoria | Recidiva (sí/no) |
| Estado hormonal del tumor (positivo/negativo) | Tipo de hepatectomía (mayor/menor) |
| Tamaño de las metástasis | |
| Metástasis (n) | |
| Tipo de resección (R0/R1/R2) | |
| Morbilidad | |
| Estancia hospitalaria (días) | |
| Esquema de quimioterapia adyuvante y número de ciclos | |
| Estado hormonal de las metástasis (positivo/negativo) | |
| Supervivencia libre de enfermedad (meses) | |
| Localización de la recidiva | |
| Periodo de seguimiento (meses) | |
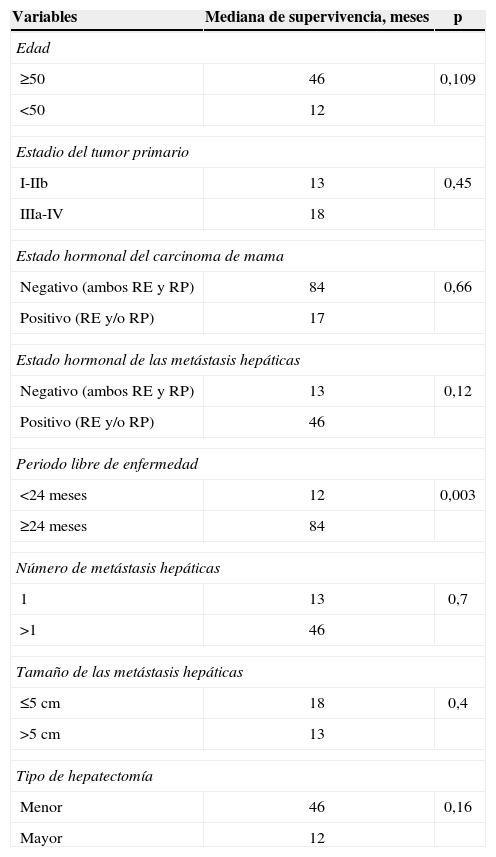
El análisis estadístico se realizó con el programa SPSS® versión 11.0. Para el análisis de supervivencias se utilizaron las curvas de Kaplan Meier y para el análisis univariado de la supervivencia se utilizó el método de logrank; en este análisis se estudiaron la influencia de la edad, el intervalo libre de enfermedad (ILE) (estableciendo el punto de corte en 24 meses siguiendo así la tendencia de las últimas publicaciones9,10), el estadio del cáncer de mama, el estado hormonal del cáncer de mama y de las MHCM (considerándolo positivo si expresaba receptores de estrógeno y/o progesterona, y negativo si la expresión de ambos receptores era negativa), el número y el tamaño de las metástasis y el tipo de hepatectomía (considerando hepatectomías mayores las que incluían la resección de 3 o más segmentos hepáticos). Los valores de p≤0,05 se consideraron estadísticamente significativos.
ResultadosCaracterísticas de las pacientesDe las 21 pacientes intervenidas, hallamos lesiones irresecables en 9 casos por afectación hepática múltiple o por presencia de enfermedad extrahepática irresecable; en estas pacientes, la cirugía consistió únicamente en una laparotomía exploratoria. En las 12 pacientes restantes, se realizó una resección hepática R0 y son los casos incluidos en la serie del estudio.
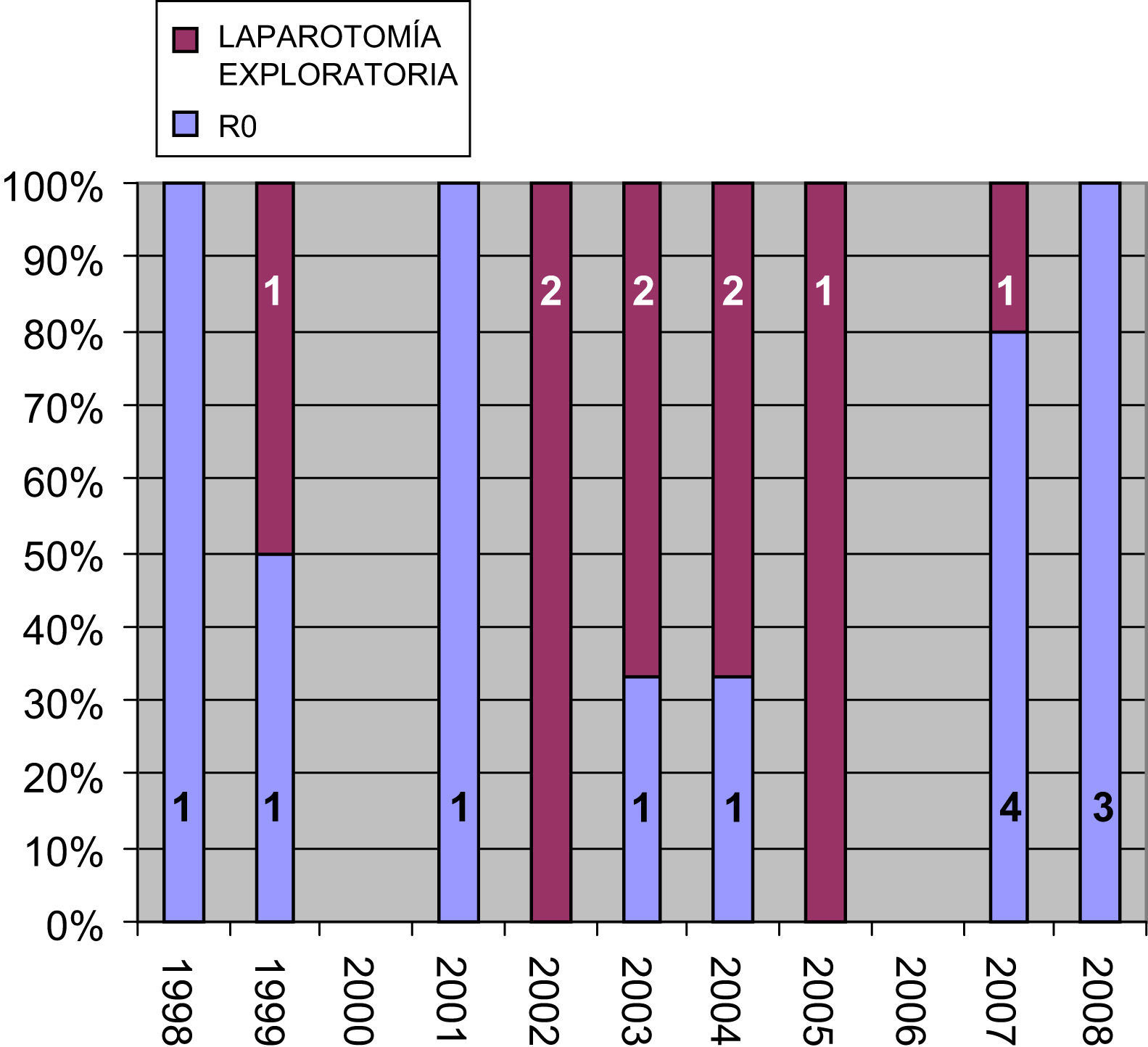
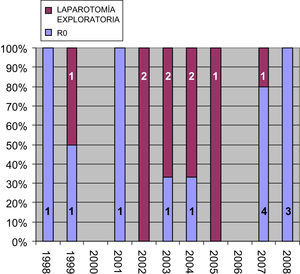
El índice de resecabilidad fue, por tanto, del 57,1%. Si analizamos el número de laparotomías exploratorias en función del año (fig. 1), comprobamos que su número desciende progresivamente desde 2002 hasta la actualidad. La edad media de estas pacientes era de 47,6 años (35–67).
Características del tumor primarioEl carcinoma de mama fue diagnosticado en estadio i en el 36, 4% de los casos (n=4), en estadio ii en el 16,7% (n=2), en estadio iiia en el 9,1% (n=1), en estadio iiib en el 9,1% (n=1) y en estadio iv en el 27,3% (n=3); el estadio iv correspondió a dos pacientes con enfermedad hepática y a una con enfermedad extrahepática; en una de las pacientes este dato no se conocía. Recibieron QT neoadyuvante 3 pacientes, en estadios ii y iiia, siendo los esquemas de QT distintos en los tres casos y recibiendo entre 2–4 ciclos. Se realizó resección R0 del tumor primario en todas las pacientes. Recibió QT adyuvante el 66,7% (n=8), con una media de 5 ciclos (rango de 4–6). Fueron administrados diferentes esquemas de QT, siendo el más frecuente el esquema ciclofosfamida, metotrexato y 5FU en el 25% de los casos (n=3). Recibió radioterapia el 50% de las pacientes (n=6), que correspondió en su mayoría a los casos en que se realizó cirugía conservadora de la mama (tumorectomía/cuadrantectomía). El 25% (n=3) de las pacientes fue tratado con hormonoterapia.
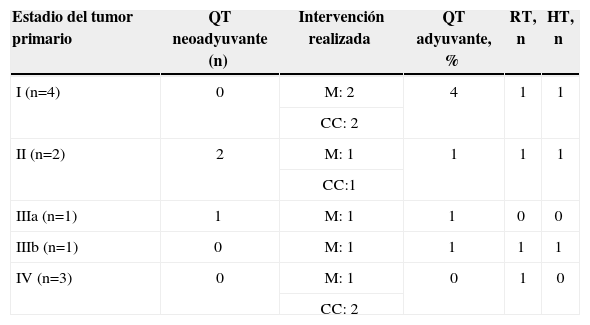
El tratamiento seguido por las pacientes según el estadio del tumor primario se muestra en la tabla 2.
Tratamiento del tumor primario según el estadio
| Estadio del tumor primario | QT neoadyuvante (n) | Intervención realizada | QT adyuvante, % | RT, n | HT, n |
| I (n=4) | 0 | M: 2 | 4 | 1 | 1 |
| CC: 2 | |||||
| II (n=2) | 2 | M: 1 | 1 | 1 | 1 |
| CC:1 | |||||
| IIIa (n=1) | 1 | M: 1 | 1 | 0 | 0 |
| IIIb (n=1) | 0 | M: 1 | 1 | 1 | 1 |
| IV (n=3) | 0 | M: 1 | 0 | 1 | 0 |
| CC: 2 |
CC: cirugía conservadora; HT: hormonoterapia; M: mastectomía; QT: quimioterapia; RT: radioterapia.
La media del periodo entre la mastectomía y el diagnóstico de las MH, intervalo libre de enfermedad (ILE) fue de 34 meses (rango de 0–73), siendo sincrónicas en 2 casos (16,7%) y metacrónicas en el resto (83,3%).
Recibieron QT neoadyuvante 8 pacientes (66,7%) con diferentes esquemas. El agente más frecuentemente administrado fue el Taxol® (16,7%) y la media del número de ciclos administrados fue de 6 (rango de 2–9). Presentaron respuesta completa el 12,5% (n=1), parcial el 75% (n=6) y estabilización de la enfermedad el 12,5% (n=1). La paciente que presentó respuesta completa recidivó a los dos años.
La cirugía de las MHCM consistió en una resección hepática mayor en el 58,3% de los casos (n=7) y en una resección menor en el resto (n=5). El tamaño medio de las metástasis fue de 4,8cm (rango de 1,5–8), resecándose una media de 2 (rango de 1–6). Se realizó resección R0 en todos los casos. Ninguna paciente presentó complicaciones posquirúrgicas y la media de estancia hospitalaria fue de 5,4 días (rango de 3–8).
Recibieron QT adyuvante 8 pacientes (66,7%), con una media de 6 ciclos (rango de 3–9), siendo el esquema de QT diferente en cada una de ellas, y se administró hormonoterapia en el 50% de los casos.
La media del periodo de seguimiento fue de 31 meses (rango de 1–111). Se registró recidiva de la enfermedad en el 33,3% de los casos (n=4); en dos pacientes la recidiva fue hepática, en una, ósea y en otra, cerebral; la media del ILE tras la resección hepática fue de 25,5 meses (rango de 1–84). El estado actual de las pacientes es vivas libres de enfermedad el 58,3% (n=7), vivas con enfermedad el 25% (n=3) y muertas por enfermedad el 8,3% (n=1). Una de las pacientes con recidiva hepática presentó respuesta completa con tratamiento quimioterapéutico. La mortalidad operatoria fue nula y a largo plazo del 8,3% (1 caso).
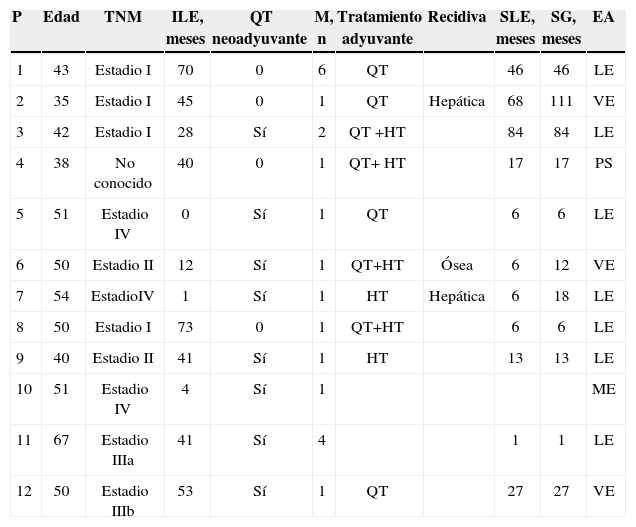
Las características de las pacientes y el seguimiento de su enfermedad se recogen en la tabla 3. Una paciente se perdió en el seguimiento.
Características y seguimiento de las pacientes
| P | Edad | TNM | ILE, meses | QT neoadyuvante | M, n | Tratamiento adyuvante | Recidiva | SLE, meses | SG, meses | EA |
| 1 | 43 | Estadio I | 70 | 0 | 6 | QT | 46 | 46 | LE | |
| 2 | 35 | Estadio I | 45 | 0 | 1 | QT | Hepática | 68 | 111 | VE |
| 3 | 42 | Estadio I | 28 | Sí | 2 | QT +HT | 84 | 84 | LE | |
| 4 | 38 | No conocido | 40 | 0 | 1 | QT+ HT | 17 | 17 | PS | |
| 5 | 51 | Estadio IV | 0 | Sí | 1 | QT | 6 | 6 | LE | |
| 6 | 50 | Estadio II | 12 | Sí | 1 | QT+HT | Ósea | 6 | 12 | VE |
| 7 | 54 | EstadioIV | 1 | Sí | 1 | HT | Hepática | 6 | 18 | LE |
| 8 | 50 | Estadio I | 73 | 0 | 1 | QT+HT | 6 | 6 | LE | |
| 9 | 40 | Estadio II | 41 | Sí | 1 | HT | 13 | 13 | LE | |
| 10 | 51 | Estadio IV | 4 | Sí | 1 | ME | ||||
| 11 | 67 | Estadio IIIa | 41 | Sí | 4 | 1 | 1 | LE | ||
| 12 | 50 | Estadio IIIb | 53 | Sí | 1 | QT | 27 | 27 | VE |
EA: estado actual; HT: hormonoterapia; ILE: intervalo libre de enfermedad; LE: libre de enfermedad; M: metástasis; ME: muerta por enfermedad; P: paciente; PS: perdida en el seguimiento; QT: quimioterapia; SG: supervivencia global; SLE: supervivencia libre de enfermedad; TNM: tumor, adenopatía, metástasis; VE: viva con enfermedad.
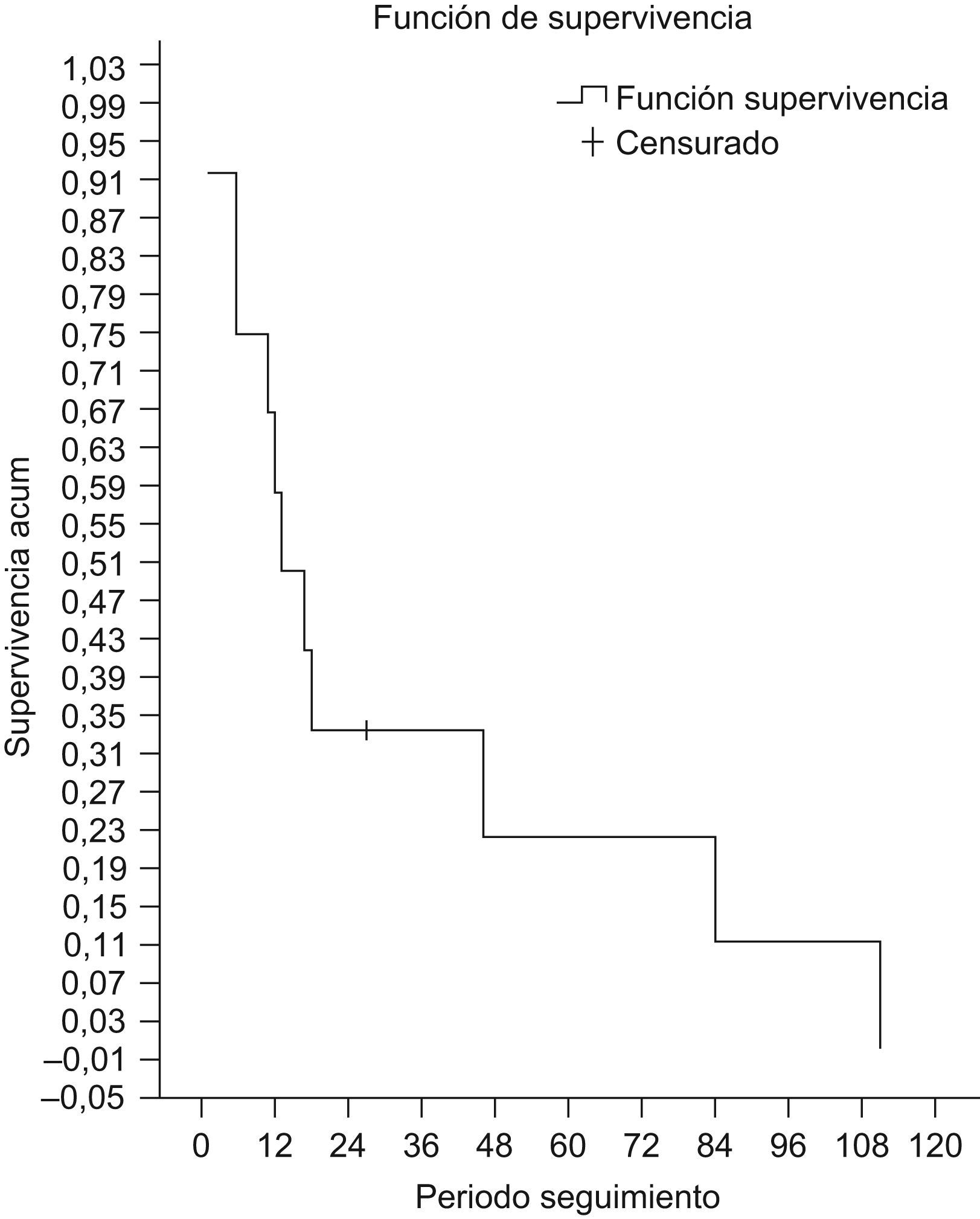
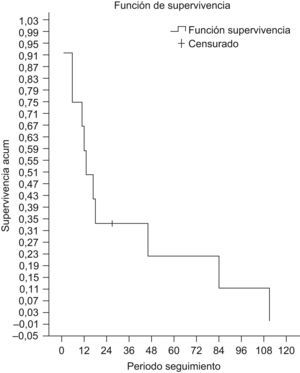
Se siguió a las pacientes una media de 31 meses y una mediana de 12,5 meses, perdiéndose una paciente en el seguimiento y constatándose un fallecimiento. La supervivencia actuarial fue del 67% al año y del 23% a los 5 años (fig. 2), siendo la media de 33,8 meses y la mediana de 17 meses. De las pacientes vivas controladas (n=10), el 70% está libre de enfermedad.
Análisis de los factores de riesgoLos resultados del análisis univariado de las variables recogidas se muestran en la tabla 4. El único factor que ofrece diferencias estadísticamente significativas en cuanto a la supervivencia es el ILE, de manera que, si dividimos la muestra en pacientes con un ILE menor de 24 meses y con un ILE mayor o igual a 24 meses, se observa una diferencia estadísticamente significativa a favor de las pacientes que tienen un ILE mayor.
Análisis univariado de las variables recogidas
| Variables | Mediana de supervivencia, meses | p |
| Edad | ||
| ≥50 | 46 | 0,109 |
| <50 | 12 | |
| Estadio del tumor primario | ||
| I-IIb | 13 | 0,45 |
| IIIa-IV | 18 | |
| Estado hormonal del carcinoma de mama | ||
| Negativo (ambos RE y RP) | 84 | 0,66 |
| Positivo (RE y/o RP) | 17 | |
| Estado hormonal de las metástasis hepáticas | ||
| Negativo (ambos RE y RP) | 13 | 0,12 |
| Positivo (RE y/o RP) | 46 | |
| Periodo libre de enfermedad | ||
| <24 meses | 12 | 0,003 |
| ≥24 meses | 84 | |
| Número de metástasis hepáticas | ||
| 1 | 13 | 0,7 |
| >1 | 46 | |
| Tamaño de las metástasis hepáticas | ||
| ≤5cm | 18 | 0,4 |
| >5cm | 13 | |
| Tipo de hepatectomía | ||
| Menor | 46 | 0,16 |
| Mayor | 12 | |
RE: receptores de estrógeno; RP: receptores de progesterona.
Generalmente se considera que el cáncer de mama metastásico es una enfermedad diseminada, y muchos oncólogos permanecen reticentes a la hora de incluir la cirugía dentro de la estrategia de tratamiento multimodal en estas pacientes. Aunque en la recidiva metastásica del cáncer de mama los tratamientos sistémicos pueden lograr aproximadamente un 60% de respuestas, la supervivencia a largo plazo es excepcional solo con tratamiento médico. Sin resección hepática, la supervivencia media comunicada tras la primera aparición de MH se distribuye en un intervalo que va desde 1–15 meses3. Sin embargo, la mayoría de estas pacientes son tratadas de forma paliativa.
En los últimos años, la cirugía de las MHCM, alentada por los resultados esperanzadores de algunos grupos pioneros, se está integrando como un recurso más dentro de una estrategia de tratamiento multimodal. En la actualidad, la resección hepática es la única posibilidad de curación en estas pacientes, ofreciendo un aumento de la supervivencia10. Para mejorar la selección de candidatas a cirugía es necesario analizar los factores de riesgo asociados a peor supervivencia e identificar a las pacientes que no se beneficiarán de la resección hepática.
En el análisis de nuestros resultados obtuvimos una media de supervivencia estimada de 33,8 meses, superior a la que se consigue con tratamiento quimioterápico único3. Nuestros resultados apoyan la tendencia actual que integra la cirugía en el tratamiento de estas pacientes y que defiende que debe plantearse en pacientes seleccionadas siempre en combinación con un tratamiento adyuvante. El aspecto más importante a la hora de plantearnos la resección hepática de las MHCM es la selección de las pacientes y, siguiendo los criterios actuales de resección hepática en las MHCCR, nosotros hemos considerado candidatas a todas las pacientes con buena situación clínica y con lesiones que permitían ser resecadas completamente con un margen de resección seguro. Aún así, el índice de resecabilidad conseguido (57,1%) fue probablemente bajo y menor al obtenido con las MHCCR en el mismo medio2; pero, como se ha comentado en el apartado de resultados, el número de laparotomías exploratorias ha descendido progresivamente desde 2002, pudiendo explicarse este hecho por la mejoría en cuanto a los métodos de diagnóstico por imagen (tomografía computarizada, resonancia magnética, tomografía por emisión de positrones) preoperatorios que han permitido la mejor selección de las pacientes12,13.
Otro aspecto para discutir es que la mayoría de los oncólogos consideran que la afectación metástasica extrahepática contraindica la resección hepática, aunque en algunos estudios6,11,14 no han encontrado diferencias estadísticamente significativas en cuanto a supervivencia a largo plazo tras la resección hepática entre las pacientes que presentaban otras metástasis y las que no en el momento del diagnóstico. Si analizamos a las pacientes incluidas en estos estudios, observamos que en la mayoría de las pacientes con metástasis extrahepáticas, las lesiones se localizaban en el hueso y eran tratadas previamente a la cirugía hepática con QT y/o radioterapia local, no considerando la presencia de estas una contraindicación para la resección hepática. En nuestro estudio, la presencia de metástasis extrahepáticas no constituyó un criterio de exclusión, conocíamos la presencia de enfermedad extrahepática en el momento de la indicación de la cirugía en tres pacientes (2 pacientes con metástasis ósea, una de ellas también con metástasis pulmonares y una paciente con metástasis axilar); sin embargo, en ninguna de ellas la enfermedad hepática fue resecable, consistiendo la cirugía en una laparotomía exploratoria sin resección hepática, por lo que no se han contemplado en el análisis estadístico de los resultados. Dada la sensibilidad de este tipo de tumor al tratamiento quimioterápico y las largas supervivencias que se consiguen manteniendo la enfermedad estable, la resección hepática se puede convertir en el tratamiento adyuvante con el que se consiga aumentar las supervivencias aun en presencia de enfermedad extrahepática irresecable.
En cuanto al análisis de supervivencias, la supervivencia actuarial fue del 67% al año y del 23% a los 5 años. La recidiva de la enfermedad después de la cirugía se registró en el 33,3% de las pacientes (n=4); estos resultados son similares a los presentados en otros estudios9–11.
En el análisis univariado de los factores de riesgo, el único parámetro que mostró diferencias estadísticamente significativas fue el ILE entre el tumor primario y la aparición de las metástasis, presentando peor supervivencia aquellas pacientes con un ILE menor de 24 meses. Corroboramos así que el ILE es uno de los factores más importantes a considerar frente a la paciente con un cáncer de mama metastásico15.
Entre los factores de riesgo analizados se encuentra el estado hormonal del tumor primario. Observamos grandes diferencias en las medianas de supervivencia entre las pacientes con un estado hormonal positivo y en las que era negativo (17 vs. 84 meses), con una supervivencia mayor en las pacientes con un estado hormonal negativo; sin embargo, estas diferencias no presentaron significación estadística. Nuestros resultados concuerdan con los de otros autores9,11 que también observaron diferencias en las medianas de supervivencia a favor de un estado hormonal negativo del tumor primario; en el estudio de Lubrano9 las diferencias sí alcanzaron significación estadística mientras que en el estudio de Adam11 las diferencias no fueron estadísticamente significativas. Actualmente, el papel que juega el estado hormonal tanto del tumor primario como el de las MH no está esclarecido en la literatura médica7,10,16.
Para el resto de variables analizadas (tabla 4) no hallamos diferencias estadísticamente significativas en cuanto a supervivencia, coincidiendo así con los resultados de otros estudios10,11 a pesar de tener una muestra de pacientes mayor que la nuestra; sin embargo, en el estudio de Lubrano9, con una muestra levemente superior (16 pacientes), sí se observan supervivencias mayores con significación estadística en pacientes mayores de 50 años, con un número de MH no superior a 1 y en las que se realizó una hepatectomía menor. Estos resultados pueden explicarse por incluir una muestra de pacientes con mejor pronóstico (edad media más alta, mayor ILE) que las pacientes incluidas en nuestra serie.
Los resultados de nuestro estudio concuerdan con los obtenidos por otras series9–11, que defienden la cirugía de las MHCM como un tratamiento seguro en pacientes seleccionadas, siempre asociado a un tratamiento sistémico. Para optimizar los beneficios de la cirugía, el punto clave es la selección de las pacientes, y el análisis de los factores de riesgo puede ayudarnos. En nuestro estudio, el ILE menor de 24 meses fue el único factor pronóstico negativo que mostró diferencias estadísticamente significativas. Las pacientes con receptores hormonales negativos en el tumor primario presentaron mayores medianas de supervivencias que las pacientes con receptores positivos, aunque estas diferencias no fueron estadísticamente significativas.
Así pues, pensamos que actualmente la resección quirúrgica de las MHCM debe ofertarse siempre a todas las pacientes con buena situación clínica que permita realizar una resección hepática, que presenten lesiones que puedan resecarse completamente (R0) y en las que el ILE sea largo. Los cirujanos debemos trabajar junto con los oncólogos en el tratamiento de estas pacientes en aras de ofrecer a las pacientes una supervivencia más larga y, por qué no, la posibilidad de una curación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Información presentada en la XVII Reunión de Cirugía celebrada el 21–24 de octubre de 2009 en Las Palmas de Gran Canaria.