Introducción
La neoplasia papilar intraductal mucinosa del páncreas (NPIMP) es una entidad clinicopatológica de reciente definición y en progresivo aumento, pese a que supone sólo un 2% de los tumores pancreáticos1,2 . Fue descrita por primera vez en 1982 por Ohhashi et al3 y ha sido sido denominada de múltiples formas, dependiendo fundamentalmente de si la descripción se realizaba a partir de su aspecto macroscópico (ectasia ductal mucinosa, tumores intraductales productores de mucina, etc.) o sus características anatomopatológicas (cistadenoma intraductal, adenoma velloso ductal pancreático, etc.)3-5 .El término NPIMP fue aceptado por la Organización Mundial de la Salud en 1996. El aumento en la frecuencia de su diagnóstico puede deberse a lo apropiado de su nomenclatura y definición, así como al mejor desarrollo de las técnicas de imagen del páncreas; sin embargo, no puede explicarse exclusivamente por estos motivos, ya que otros tumores, como los carcinomas ductales, han mantenido constante su frecuencia, por lo que diferentes autores proponen un aumento real de su incidencia debido, quizá, a la influencia de factores por ahora desconocidos6 . Clasificada dentro del grupo de los tumores pancreáticos exocrinos, la NPIMP deriva del epitelio ductal pancreático, que causa la proliferación de células mucinosas en forma de papilas que producen la secreción de una abundante cantidad de mucina, lo cual provoca la dilatación del conducto de Wirsung o de las ramas colaterales pancreáticas.
Pacientes y método
Se revisaron los casos diagnosticados de NPIMP en nuestro centro entre los años 1996 y 2001. Se recogieron las características epidemiológicas, la forma de presentación, la localización pancreática, los métodos diagnósticos empleados, los tratamientos realizados y la supervivencia obtenida.
Resultados
Se estudió a 8 pacientes, 4 varones y 4 mujeres. La edad media de presentación fue 65 años (rango, 20-82). Las formas de presentación fueron: dolor abdominal (n = 4), ictericia (n = 2), hipoproteinemia con esteatorrea (n = 2), pancreatitis aguda (n = 1), pancreatitis crónica (n = 1) y un último caso que fue diagnosticado de forma casual al realizar una técnica de imagen. La localización más frecuente fue la cabeza del páncreas (n = 6); además, en 1 caso se situaba en el cuerpo y en 1 en la cola del páncreas (tabla 1). Para el diagnóstico se realizaron la siguientes pruebas: tomografía computarizada (TC) (n = 8), colangiopancreatografía retrógrada endoscópica (CPRE) (n = 5), la determinación de las concentraciones de CA-19.9 (n = 5), la punción-aspiración con aguja fina (PAFF) guiada por ecografía (n = 4) y la resonancia magnética (RM) (n = 2). Entre los 5 pacientes en los que se realizó la CPRE se observó: en 2 de ellos (40%) una wirsungografía negativa, en 1 caso (20%) la salida de abundante cantidad de mucina por la papila, en 1 caso una zona estenótica en el conducto de Wirsung y en 1 caso no se pudo realizar la pancreatografía por la presencia de un pólipo oclusivo en la papila. La determinación de las concentraciones de CA-19.9 resultó negativa en todos los casos en los que fue empleada. De los 4 pacientes en los que se empleó la PAAF guiada por ecografía, solamente en 1 (25%) resultó positiva. El tratamiento empleado en 7 casos (87,5%) fue la resección pancreática, procediéndose a realizar una duodenopancreatectomía cefálica en 6 casos y una pancreatectomía distal en el restante. Sólo en 1 paciente no se realizó la intervención debido al alto riesgo quirúrgico derivado de una cardiopatía severa. La mortalidad operatoria fue nula. La anatomía patológica puso de manifiesto una neoplasia papilar intraductal mucinosa tipo borderline en 4 casos, una neoplasia papilar intraductal mucinosa tipo adenoma en 2 y una neoplasia intraductal mucinosa con focos de carcinoma in situ en 1 paciente. Sólo en los casos con NPIMP con focos de carcinoma in situ se observó la invasión de los márgenes invadidos y la afección del colédoco y la mucosa duodenal. Las neoplasias tipo adenoma suelen afectar de manera predominante a los conductos secundarios. En ninguno de los casos se encontraron ganglios invadidos por el proceso. El tiempo medio de seguimiento tras la intervención ha sido de 38 meses (rango, 9-76). La supervivencia ha sido del 75% (n = 6). Se produjo una muerte a los 72 meses de seguimiento en 1 paciente que presentó una recidiva pero que murió a consecuencia de un carcinoma pulmonar, y otra muerte a los 3 meses de la intervención como consecuencia de la descompensación de una enfermedad previa tras el postoperatorio. La paciente que no recibió tratamiento continúa con vida en la actualidad. La tasa de recidiva observada fue del 25% (n = 2), produciéndose una a los 24 meses de la intervención (paciente que posteriormente falleció) y otra a los 32 meses que en la actualidad sobrevive (tabla 1).
Discusión
La NPIMP presenta unas características clínicas propias que la hace diferente de los carcinomas pancreáticos, entre las que cabe destacar la secreción masiva de mucina y su retención en el sistema ductal, una evolución natural más favorable que el carcinoma ductal pancreático y la extensión longitudinal del proceso dentro del sistema ductal1,4,5 . La NPIMP aparece fundamentalmente en varones a partir de la sexta década de vida. No se conoce con exactitud la etiología de este proceso, pero sí parece demostrado que el hábito tabáquico supone un factor de riesgo para su desarrollo7 .
El síntoma más frecuente es el dolor en el hemiabdomen superior, tal como ocurrió en la serie presentada, y en general cursa con una ligera elevación de las enzimas pancreáticas (sobre todo la amilasa)5 . El desarrollo de un cuadro de pancreatitis aguda o crónica relacionado con la obstrucción ductal producida por la mucina también se ha descrito como una de las formas de presentación de este proceso, sin que se haya consensuado entre los diferentes autores la frecuencia con la que se producen (según las series, varía del 29 al 80%)7,8 . En nuestra serie, el 25% de los pacientes presentó un cuadro sugestivo de pancreatitis como manifestación inicial. En la pancreatografía de 1 paciente que presentó un cuadro de pancreatitis aguda se observó una zona estenótica en el conducto de Wirsung que provocaba la acumulación de mucina y su dilatación retrógrada. También se han descrito con menor frecuencia otros síntomas, como ictericia, pérdida de peso, esteatorrea, dolor lumbar y diabetes 1,4 . Dado que la clínica más frecuente es el dolor abdominal y que éste puede pasar inadvertido o no dársele importancia, el retraso en el diagnóstico de estos procesos es habitual 5 . También se ha descrito la circunstancia, cada vez más frecuente (10-20% de los casos), de que el diagnósico se realice de forma casual al afectuar una prueba de imagen por otro motivo y se observe una lesión pancreática que sea diagnosticada de NPIMP, como ocurrió con 1 de nuestros pacientes 9 .
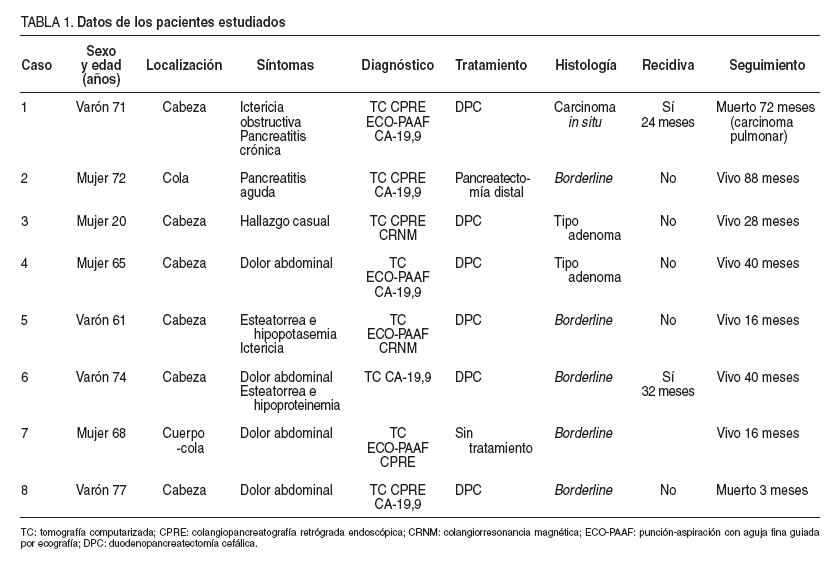
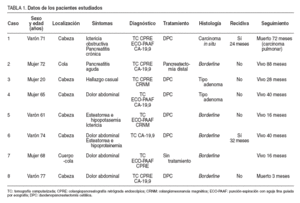
TABLA 1. Datos de los pacientes estudiados
La NPIMP deriva del epitelio de los conductos pancreáticos y se extiende a lo largo del sistema ductal. En función del grado de diferenciación de las células epiteliales tumorales, las NPIMP se clasifican en varios tipos: adenoma, tipo borderline , con focos de carcinoma in situ (estos 3 tipos se clasifican en conjunto como formas no invasivas) y asociada a carcinoma infiltrante1,5 . Según la zona donde se origine la neoplasia se pueden distinguir 2 tipos fundamentales: las desarrolladas a partir del epitelio del conducto pancreático principal, caracterizadas por su mayor frecuencia (aproximadamente el 75%), su mayor riesgo de malignidad (estimado en cercano al 67100%), su menor tamaño en el momento del diagnóstico y su asociación con el dolor en el hemiabdomen superior y los antecedentes de diabetes. Las neoplasias desarrolladas a partir del epitelio de las ramas colaterales del conducto de Wirsung son menos frecuentes, se localizan generalmente en la cabeza pancreática y suelen ser de mayor tamaño en el momento de su diagnóstico, causan una menor dilatación del sistema ductal y presentan un comportamiento menos agresivo10 .
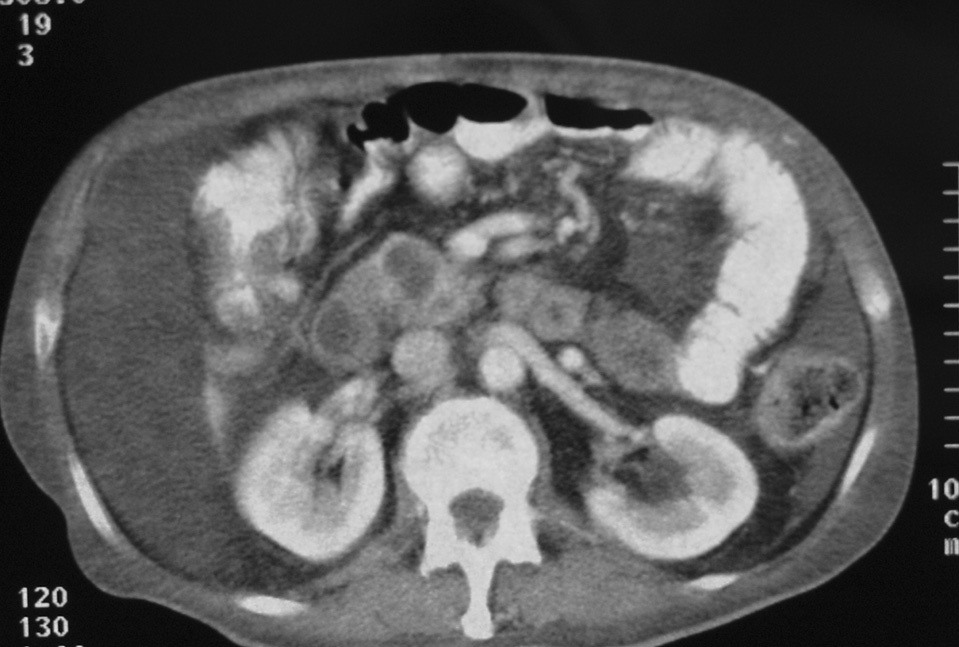
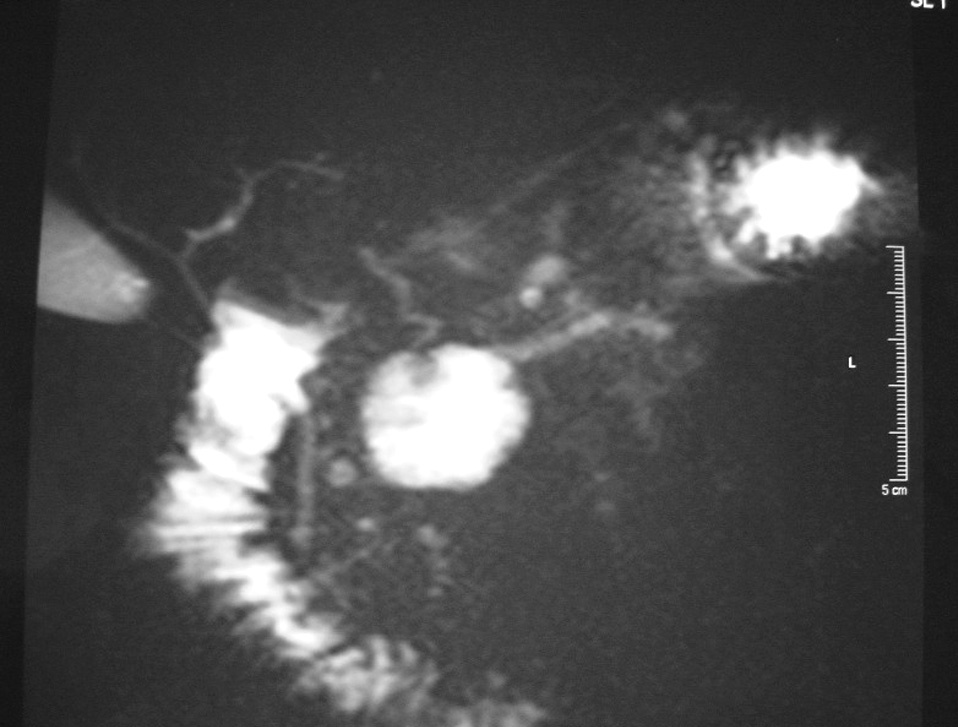
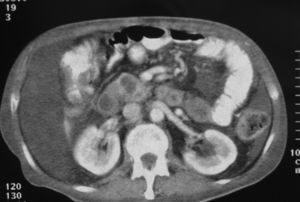
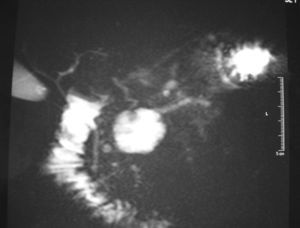
El diagnóstico de la NPIMP se lleva a cabo fundamentalmente con técnicas de imagen; la principal complicación que se plantea es la distinción entre neoplasias benignas o malignas. La TC, la RM y la ecografía abdominal suelen mostrar una imagen quística, bien definida, uniloculada o multiloculada, generalmente en comunicación con el conducto pancreático principal, que puede aparecer dilatado en su totalidad o de forma segmentaria (fig. 1). Un diámetro > 15 mm del conducto pancreático principal, un tumor > 30 mm o un nódulo en la pared del conducto pancreático > 5 mm suelen ser indicativos de ma-lignidad1,11 . El parénquima pancreático restante suele aparecer atrófico. La CPRE es una prueba de gran importancia para mejorar el diagnóstico. En general muestra una gran dilatación de todo el conducto pancreático principal, con zonas ectásicas en las ramas ductales secundarias. Las zonas de dilatación del conducto de Wirsung aparecen rellenas de gran cantidad de mucina, que en un porcentaje muy elevado de los casos también puede observarse saliendo hacia el duodeno a través de la papila12 . Las tomas de biopsia o la citología por medio de la endoscopia tienen una alta tasa de falsos negativos, pero su positividad ayuda a la realización del diagnóstico. La colangiorresonancia magnética (CRMN) puede solaparse con la CPRE en cuanto a efectividad diagnóstica, aunque es más adecuada para la determinación del grado de dilatación de las ramas pancreáticas colaterales (fig. 2). Además, dado que algunos de estos tumores no requieren cirugía, la CRMN supone una técnica no invasiva para el control evolutivo alternativa a la CPRE 13,14 .La ecografía endoscópica ha demostrado una buena eficacia en la detección de la invasión tumoral 15,16 . Las concentraciones séricas de CA-19.9 sólo se han demostrado útiles para determinar la irresecabilidad del tumor cuando superan las 2.000 U/ml, ya que no se elevan en la mayoría de los pacientes con NPIMP no invasivas 1 . Asimismo, las concentraciones de CEA > 110 ng/ml en el jugo pancreático obtenido mediante canulación por CPRE y estimulación con secretina se correlacionan con la malignidad de la tumoración 17 . Otros métodos de diagnóstico se basan en el estudio de la composición de la mucina, ya que ésta varía en función del grado de atipia del epitelio ductal 15,18 .
Fig 1. Tomografía computarizada abdominal que muestra imágenes quísticas de la cabeza pancreática.
El tratamiento indicado para la NPIMP es su resección quirúrgica1,19 . La extensión no está claramente definida. Algunos autores proponen la realización de pancreatectomías totales, de forma que se evite el posible desarrollo de recidivas tumorales. En la actualidad, gracias a los avances alcanzados en las técnicas de imagen, el papel de la pancreatectomía total es discutido, por lo que se propone la realización de cirugías menos agresivas y con menor morbilidad mediante resecciones parciales, sobre todo la duodenopancreatectomía cefálica en los tumores localizados en la cabeza pancreática, y la pancreatectomía distal para los localizados en el cuerpo y la cola2,20 . Éste ha sido el criterio que hemos seguido, salvo en los casos que el paciente presente un elevado riesgo quirúrgico que desaconseje una cirugía mayor. La realización de biopsias peroperatorias permitirá determinar con mayor exactitud la extensión de la resección, procediendo a la pancreatectomía total cuando no se consigue una escisión con márgenes libres5 . La realización intraoperatoria de una wirsungografía o una pancreatoscopia permite
Fig 2. Colangiorresonancia magnética que muestra la dilatación quística de la vía pancreática.
detectar zonas anormales más allá del margen de resección y ayudar a conseguir un margen de resección libre. La ampliación de un margen afectado por displasia o carcinoma no invasivo, que conlleva poco beneficio en términos de supervivencia, nos debe hacer pensar en las consecuencias en la calidad de vida y la morbilidad en el paciente, habitualmente de edades avanzadas. Algunos autores proponen la reconstrucción del tracto digestivo mediante una pancreatogastrostomía para permitir la realización de wirsungografía y la ecografía endoscópica como seguimiento postoperatorio17 . El papel de tratamientos coadyuvantes, como la quimioterapia y la radioterapia, aunque empleados, no está claramente estable-cido1,2 .
La supervivencia de los pacientes con NPIMP es mayor que la presentada por los pacientes con carcinomas pancreáticos, debido sobre todo a que la tasa de invasión vascular y ganglionar es menor. Aun así, en el caso de que se produzca afección de márgenes o ganglios, el pronóstico se iguala al del adenocarcinoma ductal de páncreas. Por este motivo es importante realizar una intervención quirúrgica lo más precoz posible. Las tasas de supervivencia observadas a los 5 años de seguimiento varían en función a las series presentadas, aunque en general se sitúan en torno al 60-70%2,5 .
Correspondencia: Dr. A. Moral . Servicio de Cirugía General y Digestiva. Hospital de la Santa Creu i Sant Pau. Sant Antoni M. Claret, 167. 08025 Barcelona. España. Correo electrónico: amoral@hsp.santpau.es
Manuscrito recibido el 3-5-2004 y aceptado el 12-1-2005.