Introducción
La microcirugía endoscópica transanal (TEM) es una técnica quirúrgica introducida en los años ochenta por Buess et al1 como respuesta a la dificultad técnica de la exéresis de tumores en la ampolla rectal.
Clásicamente, el procedimiento más utilizado en el tercio inferior del recto ha sido la exéresis endoanal, que está limitada por la distancia de las lesiones hasta 7-8 cm del margen anal. Esta técnica está dificultada por las tumoraciones grandes y altas para el control visual de los límites de disección y la hemostasia.
En el tercio medio del recto la técnica de exéresis local más utilizada ha sido la transesfinteriana de Mason2. Cada vez más en desuso por su elevada morbilidad y la incontinencia fecal resultante. La exéresis rectal transacra de Kraske3, que permitía el acceso hasta el tercio superior, también ha sido abandonada por sus malos resultados de elevada morbimortalidad.
La alternativa a estas técnicas en situaciones de grandes tumoraciones adenomatosas es la resección anterior del recto o la amputación abdominoperineal de Miles. En el cáncer de recto la técnica de elección es la escisión total del mesorrecto (ETM)4. Con estas técnicas, a pesar de desarrollarse en centros especializados, la mortalidad es del 1-7% y la morbilidad, como disfunciones genitourinarias y cierto grado de incontinencia fecal4-8, del 18-34%, sin olvidar los trastornos que comporta la necesidad de practicar ostomías temporales o definitivas.
Para dar respuesta a estos problemas, se concibió la TEM, procedimiento endoscópico que permite preservar el aparato esfinteriano. Mediante su excelente sistema de visión por un rectoscopio y la creación de un neumorrecto, se posibilita el acceso a tumoraciones de recto situadas hasta 20 cm del margen anal. Esta técnica facilita las maniobras de disección, corte, coagulación y sutura.
La falta de difusión de la técnica ha estado determinada por la necesidad de una curva de aprendizaje prolongada y muy específica. La introducción del bisturí ultrasónico en la TEM facilita la disección de los tumores y un mayor control de la hemostasia, con lo que se acorta el tiempo quirúrgico.
El objetivo de esta revisión no sólo pretende presentar la TEM como una técnica quirúrgica realizada por cirujanos expertos, sino exponer que el tratamiento quirúrgico de los tumores rectales mediante TEM requiere la actuación de un equipo multidisciplinario que se centre en la selección adecuada de los pacientes (endoscopia y radiodiagnóstico), realice una adecuada técnica quirúrgica (cirugía colorrectal y anestesiología), que la anatomía patológica confirmará, y un estricto seguimiento de los pacientes, con la colaboración del servicio de oncología, para que sus resultados sean adecuados.
Instrumental de la TEM
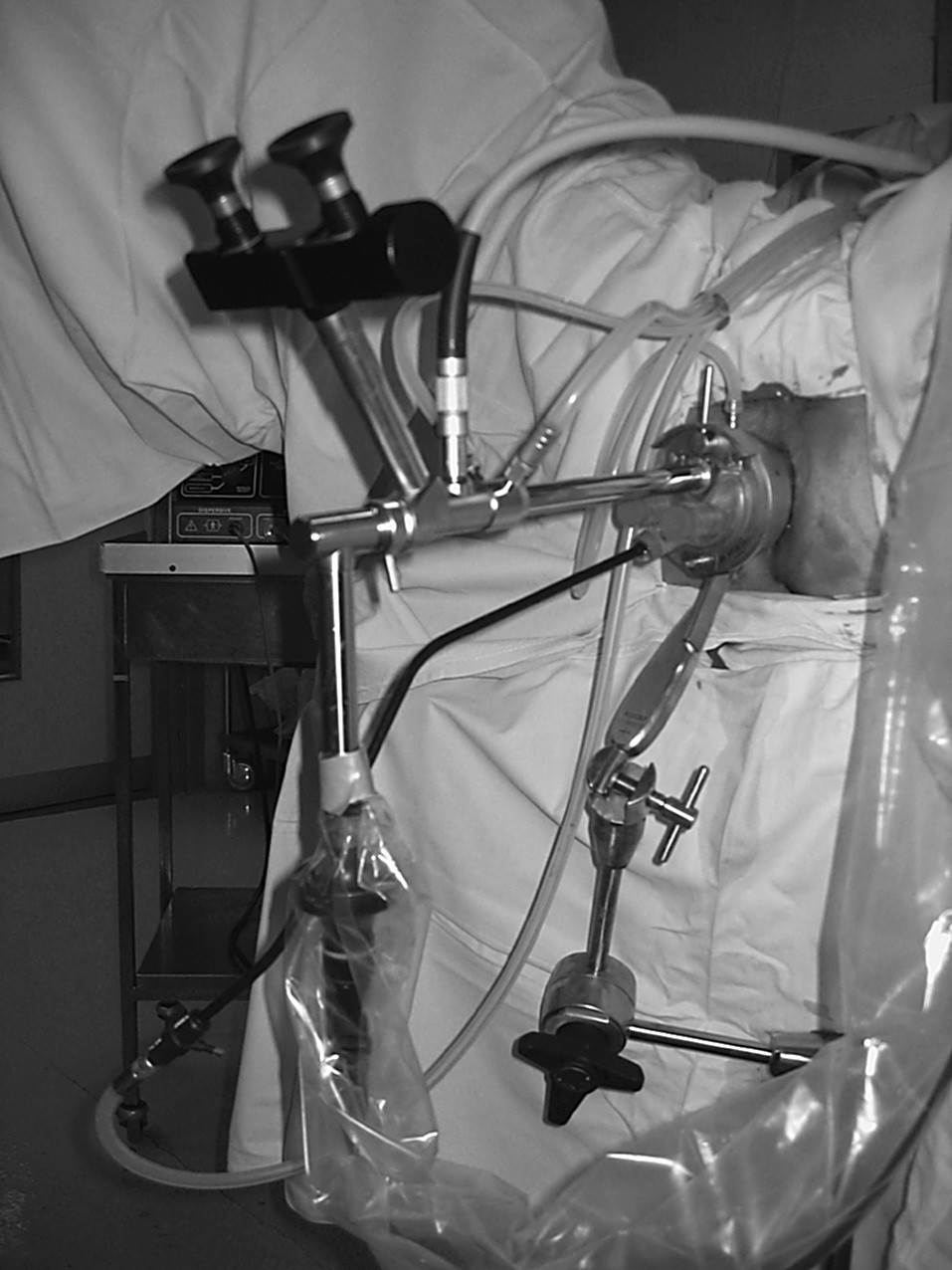
El instrumental específico de la TEM es un rectoscopio de 4 cm de diámetro. Existe la posibilidad de utilizar 2 longitudes diferentes (12 y 20 cm) (fig. 1), según sea la distancia a la que está la tumoración.
Fig. 1. Rectoscopio de 4 cm para TEM, con 2 longitudes: 12 y 20 cm.
El rectoscopio se fija a la mesa de quirófano mediante un brazo metálico multiarticulado con un mando para su manipulación.
La parte proximal del rectoscopio incorpora una tapa estanca con 4 canales de trabajo. Por uno de estos canales se coloca el sistema de visión, que incorpora una óptica tridimensional estereoscópica para el cirujano, y una salida de videocámara para el monitor, que permite la visión al resto del equipo quirúrgico.
Por los 3 canales de trabajo restantes, se introducen los diferentes instrumentos especialmente diseñados para la técnica de la TEM. Estos canales llevan incorporados manguitos de goma con válvulas para evitar las pérdidas aéreas.
Es de crucial importancia el sistema de insuflación de CO2 para mantener un neumorrecto estable no superior a 10 mmHg. El aparato, actualmente digital, permite mantener esta insuflación sin riesgo de excesiva distensión rectal. Su mecanismo se basa en una insuflación-aspiración continua en el recto a través de unas tubuladuras de goma específicas. El sistema facilita la irrigación de la lente para posibilitar una visión óptima a través de la TEM.
Los instrumentos primordiales de la TEM son de 5 mm de diámetro. Los utensilios son: pinzas de agarre, aspirador ergonómico, bisturí monopolar, portaagujas específico, portaclips y tijeras. El bisturí ultrasónico ha sido incorporado recientemente a la TEM, lo que facilita un mejor control en la exéresis y la hemostasia9.
Técnica quirúrgica de la TEM
Preparación preoperatoria
A los pacientes pendientes de intervención de TEM se les realiza el día anterior la preparación mecánica del colon. El día de la intervención se administra la profilaxis antibiótica y tromboembólica habitual de la cirugía colorrectal.
Colocación y anestesia
La colocación del paciente en la mesa de quirófano es de vital importancia. La TEM está diseñada para trabajar siempre con la tumoración en la parte inferior del rectoscopio, por lo que la posición depende de la localización de la tumoración rectal por cuadrantes. Cuando el tumor sea posterior, el paciente se colocará en litotomía. Si la neoplasia es anterior, en decúbito prono y si es lateral, en el decúbito lateral correspondiente.
La técnica anestésica empleada es la anestesia general, aunque es posible la técnica locorregional en pacientes seleccionados, en función de la localización del tumor y la duración del procedimiento. Debe mantenerse el paciente con completa relajación para facilitar el neumorrecto, pues cualquier pequeña resistencia abdominal causa el colapso del recto e impide la correcta visualización de la lesión y sus límites. Estos pacientes requieren escasa administración de analgesia durante la intervención.
Se introduce el rectoscopio sin maniobras bruscas y se lo fija al arco multiarticulado. Se aplica la tapa estanca con los 4 canales y se la fija al rectoscopio. Por el canal superior se coloca el sistema de visión. Después se conecta el cable de luz fría y se instala el sistema de tubuladura (4) (fig. 2).
Fig. 2. Instrumental completo de la TEM colocado en el paciente.
Estrategia quirúrgica
Se trabaja con neumorrecto a presión constante gracias a la regulación automática entre el insuflador de CO2 y el aspirador. La distensión rectal así creada permite exponer el tumor y la pared rectal de forma adecuada. Es importante la colaboración del anestesiólogo para obtener un correcto neumorrecto.
Como hemos comentado previamente, la lesión estará situada en la parte inferior del rectoscopio. La primera y principal maniobra antes del inicio de la exéresis es ubicar el rectoscopio sobre la lesión, de forma que podamos tener acceso a todo el perímetro de la tumoración y el control de nuestra situación en la luz del recto.
Antes de comenzar la disección, se comprueba que con las pinzas de agarre se llega a toda la periferia de la lesión y la movilidad de ésta. Se inicia la resección punteando una línea con el bisturí eléctrico monopolar a 5-10 mm de la tumoración. Luego se abre la mucosa sobre la línea punteada y se continúa con la exéresis de la lesión.
Disección con bisturí ultrasónico
La disección con el bisturí eléctrico se dificulta por la aparición frecuente de sangrado en la zona cruenta que dificulta la visión por manchas en la óptica, impide apreciar correctamente la zona de disección y prolonga de forma considerable la técnica de la TEM. Además, la escara que produce tras la sección impide un adecuado control de los bordes de sección.
La introducción de nuevas tecnologías en el control de la disección y la hemostasia ha sido de gran utilidad en la cirugía laparoscópica, pues facilitan las técnicas quirúrgicas complejas. El bisturí ultrasónico (Ultracision, Ethicon, Endo-Surgery, Cincinnati, Ohio, Estados Unidos), con un mecanismo de sección y coagulación de los tejidos mediante ultrasonidos, es una buena respuesta al problema.
Su aplicación a la TEM nos ha permitido un buen control de la hemostasia. Las pinzas de 5 mm son fácilmente adaptables a las ventanas de trabajo del rectoscopio. La forma en pinza curva del bisturí ultrasónico favorece la disección lateral, en un procedimiento cuyo máximo inconveniente es tener que trabajar en paralelo9.
Su manejo, en forma de mínima velocidad, asegura una disección sin sangrado, facilita la visión de la zona de sección, realiza un avance pausado y reduce el tiempo quirúrgico. Ayodeji et al10 publican un artículo que compara la eficacia del bisturí monopolar original, el bisturí bipolar multifuncional TEM400 (descrito por Kanehira et al11) y el bisturí Ultracision, y sus resultados aprecian las ventajas de este último. Nuestro grupo actualmente utiliza sólo el bisturí monopolar para delimitar la zona de sección y abrir la mucosa para poder traccionarla con las pinzas de agarre. El resto del procedimiento se realiza con el bisturí ultrasónico.
La exéresis será de grosor completo de la pared rectal en todos los casos, excepto en los que el tumor esté localizado próximo a la reflexión peritoneal y, por tanto, exista el riesgo de perforación del peritoneo. Así pues, el límite de seguridad para realizar la exéresis de grosor completo de la pared rectal es de 18-20 cm en la cara posterior, 10-12 cm en la cara anterior y 15 cm en las caras laterales.
Tras finalizar la exéresis y retirar la pieza, se procede a irrigar toda la zona cruenta con solución de povidona yodada diluida con suero fisiológico al 1%, con intención citolítica.
Sutura del defecto en la pared rectal
El defecto de la lesión puede dejarse abierto, como han demostrado Ramírez et al12. No afecta a la evolución postoperatoria siempre que la lesión tenga una situación extraperitoneal. Sin embargo, nosotros preferimos realizar la sutura del defecto para evitar problemas de estenosis de la luz rectal (en grandes defectos) y sangrados postoperatorios por erosiones producidas por las heces. En lesiones por encima de 10 cm del margen anal, creemos que es obligada su sutura, ya que la reflexión peritoneal no es anatómicamente igual en todos los pacientes y, al dejar una lesión abierta, puede pasar inadvertida una posible perforación que comportará una peritonitis fecal en el postoperatorio.
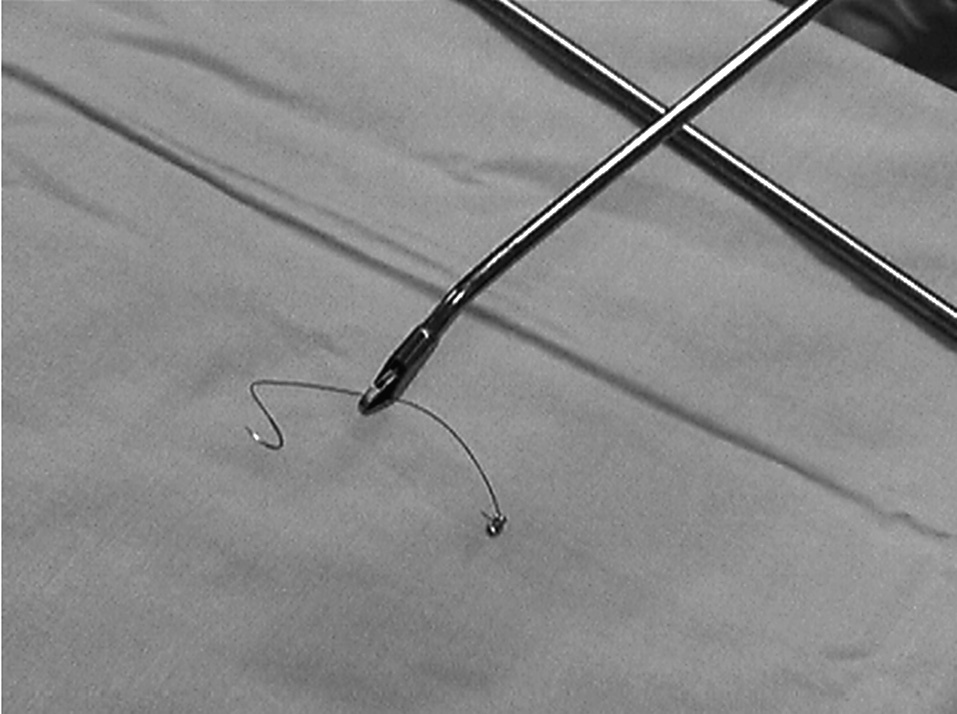
Se utiliza como sutura un monofilamento reabsorbible de larga duración. Se coloca en su extremo un clip metálico para hacer de tope y evitar un nudo (fig. 3). La sutura debe realizarse siempre en sentido transversal para no comprometer la luz rectal y evitar estenosis. Tras finalizar la sutura, se procede nuevamente a irrigar con solución de povidona yodada diluida con suero fisiológico al 1%. Tras aspirar la solución de irrigación, se procede con delicadeza a retirar del ano el rectoscopio. No se requiere la aplicación de ningún apósito ni taponamiento sobre la zona perianal.
Fig. 3. Sutura utilizada para el cierre del defecto donde se aprecia el clip metálico que hace la función de tope o nudo.
Cuidados postoperatorios
Al inicio del desarrollo de esta técnica, no se tenía experiencia sobre la repercusión que podrían tener los defectos en la pared rectal, que en ocasiones quedaban medio abiertos. Por ello, al principio, el protocolo descrito1 recomendaba 5 días de dieta absoluta con tratamiento antibiótico, en el sentido de realizar una colostomía funcional de protección. Posteriormente se ha observado que esas medidas eran innecesarias. Actualmente, si no ha habido ninguna incidencia quirúrgica, se inicia la dieta oral al día siguiente y de forma progresiva si el paciente la tolera.
Respecto a los antibióticos, sólo se administra la dosis profiláctica. Los requerimientos de analgesia en el postoperatorio son escasos, y únicamente son necesarios antiinflamatorios no esteroideos. El alta hospitalaria suele indicarse el tercer día postoperatorio, aunque hay series que describen el alta al día siguiente o el mismo día de la intervención13.
Protocolo de selección de los pacientes
Estadificación preoperatoria
La selección de los pacientes candidatos a TEM irá encaminada a una correcta estadificación preoperatoria de la tumoración rectal. Se debe practicar a todos ellos una colonoscopia total con biopsia multifocal de la lesión. Esta exploración deberá indicarnos: tamaño de la tumoración, distancia de sus bordes inferior y superior al margen anal, localización por cuadrantes y presencia de otras posibles lesiones sincrónicas en el recto o el colon.
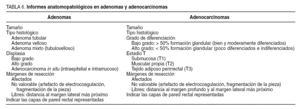
Las biopsias deberán informarnos de si se trata de adenomas y su tipo (tubular, velloso o tubulovelloso) y grado de displasia. Si son adenocarcinomas infiltrantes o intramucosos (in situ) y grado de diferenciación.
La ecografía endorrectal (ER) permitirá estadificar la lesión según los criterios de Hildebrandt14 (tabla 1). Nos confirmará los datos de: tamaño de la tumoración, distancia de sus bordes inferior y superior al margen anal y localización por cuadrantes (anterior, posterior, lateral derecho o izquierdo). Es importante ratificar la situación de la lesión, pues marca la posición del paciente en la mesa quirúrgica.
La resonancia magnética (RM) pelviana es una importante exploración complementaria a la ER. Aunque la precisión de la estadificación del tumor no es mayor que la de la ER, en situaciones de adenocarcinomas de recto es necesaria para confirmar el estadio tumoral y, fundamentalmente, la ausencia de posibles adenopatías metastásicas. Es obligada también en el caso de adenomas vellosos > 3 cm de diámetro, por su elevado porcentaje de malignización, que puede alcanzar hasta el 32%15. En concreto, la RM deberá indicarnos la estadificación del tumor (siguiendo los criterios de Hildebrandt), la presencia de adenopatías y la topografía de la lesión16.
Ante tumores diagnosticados de adenocarcinoma o elevada sospecha de ello, se realizará una tomografía computarizada abdominal para descartar metástasis a distancia y la determinación de marcadores tumorales CEA y CA 19.9.
Grupos de indicación de TEM
Actualmente los grupos de indicación de exéresis local mediante TEM están definidos como los grupos I y II de la tabla 2. Más adelante se discute la situación actual en estadios más avanzados de adenocarcinoma de recto.
Limitaciones técnicas de indicación de la TEM
1. Localización respecto al margen anal. A diferencia de la exéresis endoanal, en que la distancia al margen anal de la lesiones está limitada hasta 7-8 cm, con la TEM los límites están determinados por el riesgo de la localización de la lesión en territorio intraperitoneal. Por ello es importante conocer a qué altura se sitúa la lesión. Es posible realizar la exéresis con escaso riesgo de perforación hasta 18-20 cm cuando la situación de la tumoración está en el cuadrante posterior y hasta 15 cm cuando se sitúa anterior o lateralmente. Debemos considerar que, principalmente en las mujeres, el fondo del saco de Douglas puede estar situado más bajo, por lo que en las lesiones inferiores puede haber riesgo de perforación.
2. Tamaño de la lesión. Las limitaciones clásicas de la exéresis endoanal, con un tamaño inferior a 3-4 cm y que no ocupe más de un cuadrante de la circunferencia17, han cambiado con la TEM. En nuestra casuística (tabla 3) se ha conseguido exéresis de lesiones de hasta 12 cm de diámetro y que ocupan tres cuartos de la circunferencia.
Morbilidad y mortalidad postoperatorias
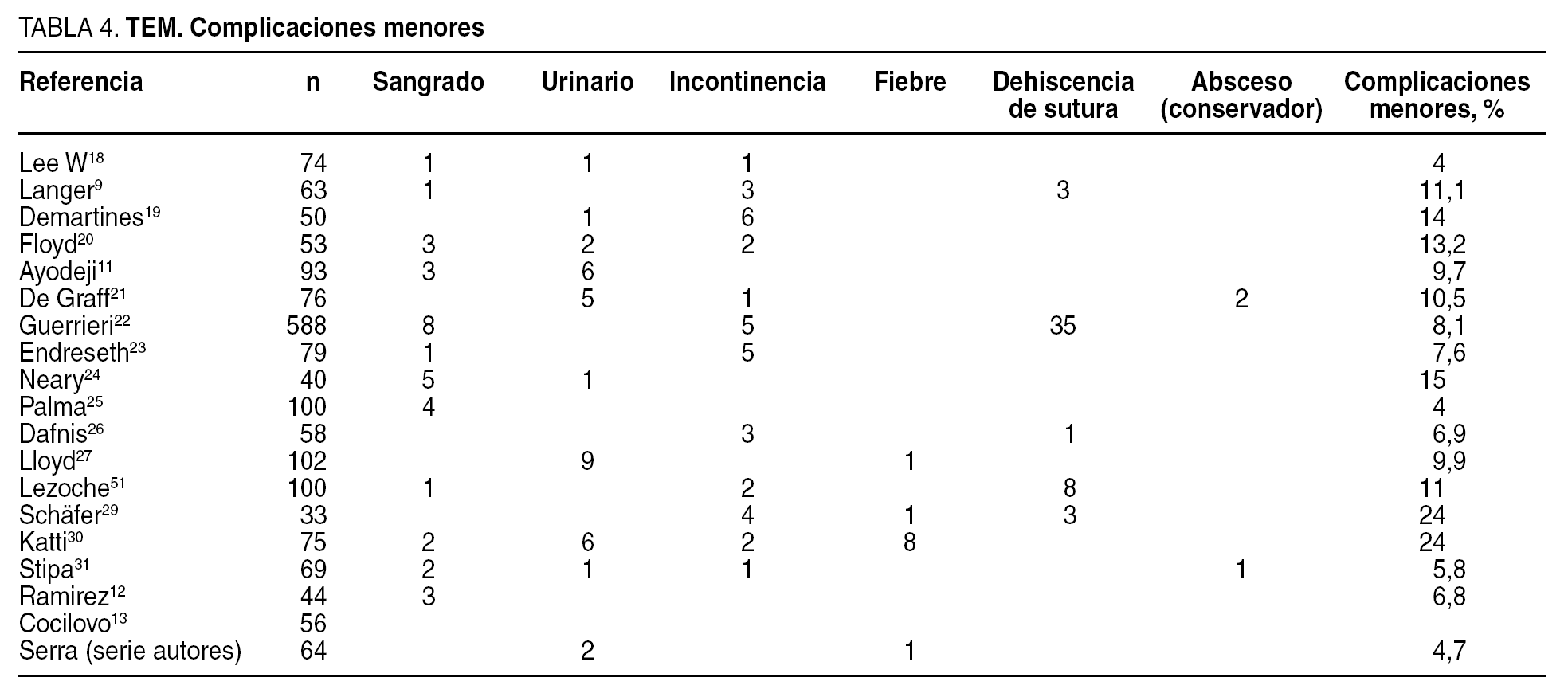
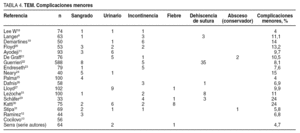
La morbilidad postoperatoria publicada en las distintas series oscila en un 4-24%. La inmensa mayoría se describe como complicaciones menores porque requieren tratamiento conservador (tabla 4). En las series publicadas durante los últimos 5 años9,11-13,18-31, la complicación menor más frecuente es el sangrado postoperatorio, de carácter autolimitado.
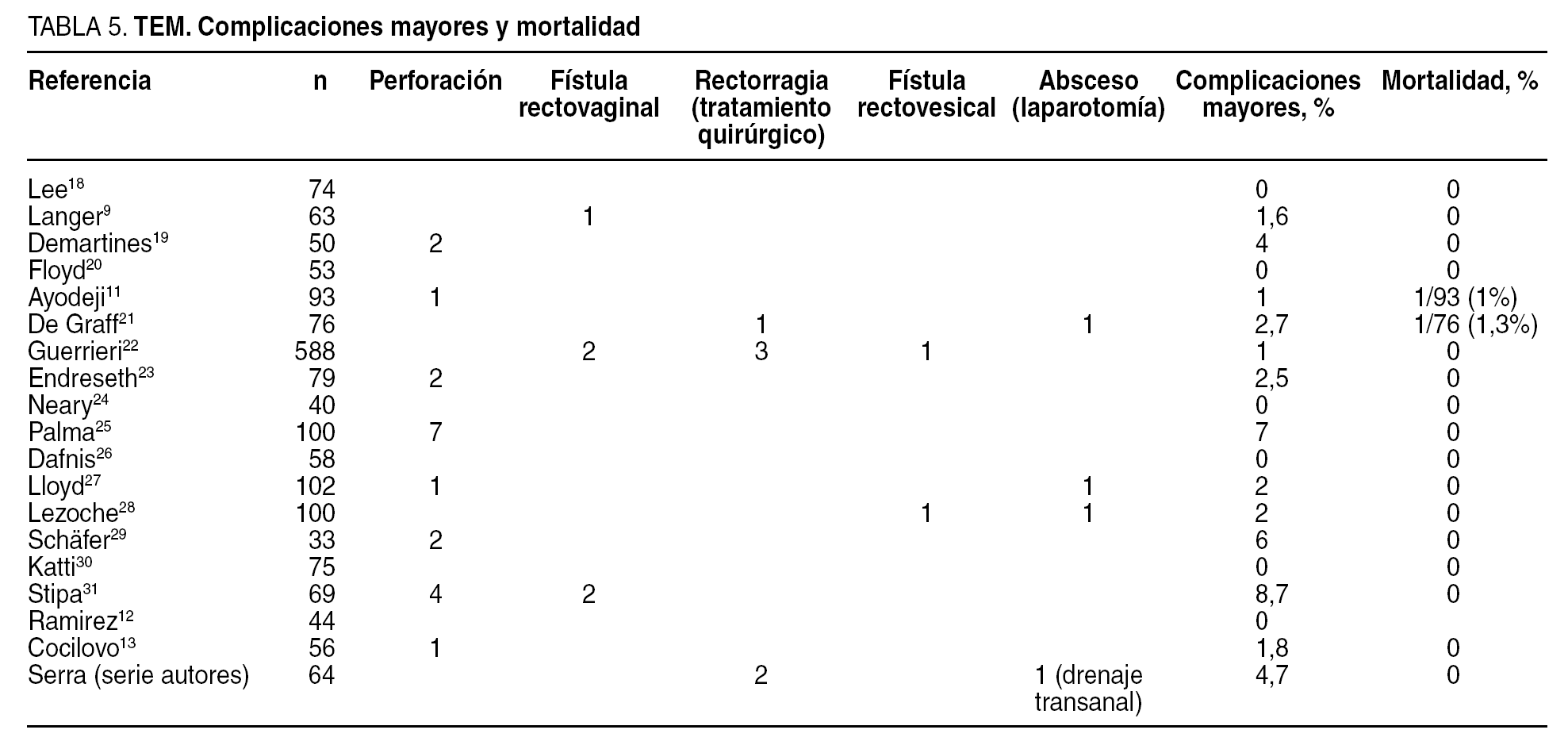
Las complicaciones mayores son aquellas que requieren tratamiento quirúrgico. En la tabla 5 apreciamos las descritas en las series revisadas9,11-13,18-31, la inmensa mayoría son menores al 5%. La más frecuente es la perforación que obliga a la reintervención quirúrgica. En nuestra serie hubo 3 complicaciones mayores: 2 casos de rectorragias en pacientes con tratamiento anticoagulante que aparecieron a los 9 y 20 días de la intervención y obligaron a controlarlas mediante una nueva revisión quirúrgica y hemostasia con TEM; el tercer caso fue un absceso submucoso, como consecuencia de la dehiscencia de la sutura, que requirió drenaje transanal.
La mortalidad es nula en casi todas las series publicadas. Las descritas no son a consecuencia del procedimiento, sino por enfermedad concomitante11,21.
Anatomía patológica
¿Cómo han de llegar las piezas de la TEM?
Tras la exéresis, el cirujano, con ayuda de la enfermera quirúrgica, deberá colocar la pieza en una base de corcho o similar y fijar los márgenes de resección con agujas para evitar su retracción. Además, es conveniente que la pieza esté orientada de forma anatómica. Se deberá remitir las ampliaciones de los márgenes, en caso de realizarlas, indicando la posición adecuada respecto a la pieza y también fijadas con agujas.
Preparación de la pieza
En el servicio de anatomía patológica se realizará la descripción de la pieza, se fotografiará, se marcará los márgenes de resección con tinta china, y después se fijará con Bouin y se incluirá toda la pieza en cápsulas identificadas.
La tabla 6 describe las características mínimas que debe tener todo informe de una pieza de exéresis tras TEM. Además, en los casos de adenocarcinoma, es importante señalar los posibles factores de riesgo de adenopatías metastásicas que aparezcan en el análisis de la tumoración: grado de diferenciación, invasión linfática, inflamación alrededor del tumor y morfología del margen invasor tumoral32.
Alteraciones funcionales esfinterianas tras la TEM
La introducción de un rectoscopio de 4 cm de diámetro por el aparato esfinteriano siempre ha tenido la consideración de que origina lesiones y alteraciones esfinterianas. Inicialmente, Kreis et al33 publicaron un estudio sobre resultados funcionales tras la TEM realizando controles manométricos y encuesta de incontinencia fecal antes y después de la intervención. Las alteraciones manométricas que persistían a los 3 meses mejoraban al año. Destacaba que un 22% de los pacientes ya tenían en el preoperatorio algún tipo de incontinencia fecal y que, desde el punto de vista clínico, la TEM no empeoraba la función esfinteriana.
En un estudio más completo, Herman et al34 practicaron manometría anorrectal, ecografía endoanal y encuesta de la función esfinteriana antes de la cirugía, a las 3 semanas y a los 6 meses de la TEM. Observaron que el 24% de los pacientes ya tenían algún grado de incontinencia, por lo que sólo el 76% antes de la TEM eran completamente continentes. La continencia se apreció alterada en el 48% de los pacientes a las 3 semanas. A los 6 meses sólo el 24% de los pacientes tenían una parcial o moderada incontinencia. Describieron una serie de factores de riesgo de disfunción anorrectal tras la TEM: anormalidades esfinterianas en la ecografía endoanal antes y después de la cirugía, baja presión anal basal antes de la intervención que no se recuperó en el postoperatorio, alteraciones preoperatorias en los reflejos rectoanales, exéresis extensa de la lesión que abarcó más del 50% de la circunferencia y exéresis de pared completa. Indicaron que aparecían alteraciones esfinterianas cuando se presentaban más de 2 de los factores descritos.
En nuestra serie, al realizar estudios manométricos y de función esfinteriana (escala de Wexner35) antes y después de la TEM, hemos apreciado un descenso de la presión anal basal y de contracción máxima a las 3 semanas, que recuperan sus valores a partir de los 3 meses. Desde el punto de vista clínico, no se apreciaron diferencias estadísticamente significativas a las 3 semanas ni a partir de los 3 meses.
En un estudio sobre calidad de vida en incontinencia fecal36 y TEM, no se aprecia diferencias antes y después de la cirugía37.
Creemos que es importante realizar estudios de función esfinteriana antes de realizar la TEM para detectar a los pacientes en riesgo pues, como hemos apreciado, más de un 20% tiene algún tipo de alteraciones. Sin embargo, a pesar de la dilatación a la que se ve sometido el aparato esfinteriano, las alteraciones de incontinencia fecal son escasas a corto o medio plazo.
Control y seguimiento tras la TEM
Presentaremos nuestro protocolo de actuación consensuado por el comité multidisciplinario (unidad de coloproctología, endoscopia digestiva, radiodiagnóstico, anatomía patológica, anestesiología, radioterapia y oncología).
La posibilidad de recidiva tras la TEM tanto en adenomas como en adenocarcinomas es principalmente en los primeros 2 años. Por ello, en nuestro centro se ha convenido en realizar un protocolo de seguimiento conjunto para ambos tipos de lesiones. Se realizará ER y rectosigmoidoscopia con biopsia multifocal de la cicatriz cada 4 meses durante los primeros 2 años. Del tercer año hasta el quinto, dichos controles se realizarán cada 6 meses y posteriormente, los controles habituales.
En el caso de recidiva de adenoma, se intentará que el tratamiento inicial sea endoscópico. Si no es posible, se indicará una nueva TEM. Cuando exista una recidiva con biopsia de adenocarcinoma, se completará el estudio con una RM combinada con la ER ya realizada. Si su estadificación es de tumor con adenocarcinoma in situ (Tis) o T1 con N0, se indicará una nueva TEM. En caso de estadificaciones superiores, cirugía radical (ETM).
Nuestro protocolo indica un control de función esfinteriana a las 3 semanas y a partir de los 3 meses.
TEM y adenomas rectales
Los adenomas de recto son una de las neoplasias colorrectales más frecuentes. Su potencial de malignización está en función del componente velloso y su tamaño29,38. Por tal motivo es obligada su exéresis.
Clásicamente los pólipos pediculados con un diámetro < 3 cm son de indicación endoscópica. Los pólipos sésiles y de mayor tamaño requieren exéresis quirúrgica, que inicialmente se realizaba mediante el abordaje endoanal descrito por Parks39. Aunque en manos expertas se consigue resultados de recurrencia inferiores al 10% y una morbilidad aceptable, se encuentra limitada porque no se puede alcanzar las lesiones más allá de 8 cm15.
La TEM permite el abordaje de esas lesiones con una perfecta exposición y la exéresis de pared completa con control de los márgenes de resección. Las series más amplias recientemente publicadas describen una incidencia de recidivas inferior al 10%13,15,22. El control de las recidivas se puede lograr en la mayoría de las situaciones mediante endoscopia o nuevo TEM.
En el caso de los adenomas gigantes con tamaño superior a 5 cm, Schäfer et al29 describen unos resultados de recidiva del 12%. Son estos tumores los de mayor probabilidad de malignidad, que puede llegar hasta el 32%15. En nuestra serie, con 31 adenomas rectales intervenidos mediante TEM, hemos observado 3 (9,7%) recidivas, todas de tamaño superior a 5 cm; 2 de ellas necesitaron una nueva TEM y la otra, control endoscópico.
La exéresis de un adenoma no obligaría a realizar una resección con pared completa. Sin embargo, debido a su riesgo de malignidad y que es más sencilla la disección a través de la grasa perirrectal, que presenta menor sangrado, defendemos que la exéresis de la pared debe ser completa, salvo en las zonas con riesgo de perforación.
Estas circunstancias han hecho que la TEM sea actualmente la técnica de elección en los adenomas de recto candidatos a exéresis quirúrgica.
TEM y cáncer de recto
TEM y adenocarcinoma Tis-T1
El tratamiento convencional del adenocarcinoma de recto es la escisión total del mesorrecto (ETM)4, técnica que comporta la práctica de una resección anterior de recto baja, lo que se relaciona muy frecuentemente con una ostomía de protección o una amputación abdominoperineal (operación de Miles) con una colostomía definitiva. Este tipo de cirugías no está exento de complicaciones, como hemos comentado previamente, con morbimortalidad postoperatoria y alteraciones de disfunción urinaria, sexual y fecal nada desdeñables4-8.
La capacidad de curar el cáncer de recto mediante cirugía local está en función de la posible invasión ganglionar. Se ha descrito que puede acontecer en un 0-12% de los T1, un 12-28% de los T2 y un 36-79% de los T340.
La cirugía local del cáncer de recto mediante exéresis endoanal ha tenido diversidad de opiniones. Con esta técnica, en los tumores T1 y aparente N0 los resultados a largo plazo se sitúan con índices de recidiva entre el 18 y el 29%41,42. Sin embargo, son series retrospectivas sin uniformidad en la selección de los pacientes, y se hace difícil compararlas con la ausencia de un protocolo estricto de seguimiento que permita el rescate del paciente. La exéresis endoanal adolece de la dificultad de controlar perfectamente los límites de resección y realizar una exéresis de pared completa y está limitada por la altura de la lesión respecto al margen anal.
La TEM permite corregir estos problemas mediante una fácil exposición de la lesión, con un buen control de los márgenes, que deben ser > 5-10 mm, con escisión de toda la pared del recto. Esta situación motiva que se haya publicado series con esta técnica en cánceres T1, con índices de recidiva de un 4-12,5% y supervivencia relacionada con la enfermedad a 5 años del 100%9,18-20,43. Los últimos estudios publicados sobre los adenocarcinomas de recto T1 consideran la exéresis local mediante TEM como la técnica de elección20.
De la misma forma que es crucial la selección de los pacientes para el tratamiento local del cáncer de recto, también lo son su seguimiento y un protocolo de actuación inmediata, con reconversión hacia cirugía radical cuando el estudio definitivo de la pieza demuestra una estadificación exagerada. Se ha descrito que esta situación no altera los resultados de supervivencia44.
TEM y adenocarcinoma T2-T3
De absoluta controversia es el tratamiento de los cánceres de recto T2, por la elevada probabilidad de relacionarse con metástasis ganglionares, hasta el 28%39; por ello el tratamiento que se ha indicado es el radical18,45.
En un polémico estudio publicado por Habr-Gama et al46 se describe un efecto de la quimiorradioterapia en el cáncer de recto distal en estadios avanzados, que alcanza hasta el 30% de respuesta clínica o anatomopatológica completa.
La quimioterapia y la radioterapia concomitantes han permitido una disminución de las recidivas locales y un aumento de la supervivencia en los pacientes afectados de cáncer de recto con estadios pT3-4 pN0 o cualquier pT pN1-247,48.
Dos estudios de fase II realizados por grupos cooperativos describieron resultados interesantes de la combinación de escisión local seguida de radioquimioterapia concomitante de los tumores incipientes del recto bajo49,50. Aunque estos estudios utilizaron técnicas de escisión local muy dispares, se concluyó que la preservación del esfínter podía conseguirse con un control excelente de la enfermedad cancerosa sin un sacrificio inicial de la función anal en la mayoría de los pacientes. Tras las recidivas locales, la cirugía de rescate podía conseguirse en la mayoría de los casos49. Indicaban que estos tratamientos conservadores podrían ser una alternativa a la cirugía radical clásica en pacientes seleccionados con cáncer rectal limitado que afectara al recto medio e inferior.
Recientemente Lezoche et al51 han publicado un estudio prospectivo y aleatorizado en una serie de 40 pacientes afectados de adenocarcinoma con estadio T2N0. Sometieron a un grupo a quimiorradioterapia preoperatoria y TEM, y al otro grupo a quimiorradioterapia preoperatoria y ETM por laparoscopia. Los resultados son similares respecto a recidiva local y supervivencia con 3 años de seguimiento.
Este mismo autor ha publicado un prometedor estudio sobre los resultados a largo plazo de la asociación de quimiorradioterapia preoperatoria asociada a TEM en estadios T2-3N0, en tumores < 3 cm. A pesar de no ser un estudio controlado y aleatorizado, observa que en un selecto grupo de pacientes con respuesta al tratamiento neoadyuvante obtiene con la TEM resultados similares a los de la ETM a largo plazo28.
Es necesaria la publicación de resultados procedentes de estudios con nivel de evidencia I para poder tener en consideración una alternativa clara a la ETM. El objetivo principal de cualquier trabajo deberá ser demostrar qué tratamiento pueda establecer, con seguridad y garantías de curación, menor morbimortalidad y mejor calidad de vida para los pacientes. Tan criticable es tratar a los pacientes por exceso como, con el afán de evitar graves riesgos quirúrgicos, no controlar la enfermedad de base que pueda acabar con la vida de los pacientes.
Comentario final
La TEM es una técnica que se desarrolla con un instrumental especializado y permite el control de la exéresis, la hemostasia y la sutura. Difiere completamente del resto de las técnicas de cirugía local de tumores de recto previamente descritas.
Se debe desarrollar, como ya hemos indicado, en el contexto de un comité multidisciplinario que controle la selección de los pacientes para una correcta indicación, con expertos cirujanos en TEM y patólogos implicados en dar un correcto informe de la pieza y una estricta vigilancia del seguimiento de los pacientes.
Es falso el mensaje de que la TEM es un procedimiento difícil, reservado a cirujanos virtuosos. Actualmente, la técnica se halla completamente estandarizada, y con la introducción del bisturí ultrasónico se ha simplificado enormemente. Sin embargo, es cierto que, como en la laparoscopia avanzada, para que la curva de aprendizaje se acelere lo máximo posible, debe estar tutelada por cirujanos expertos que reduzcan todos los pasos y los problemas técnicos que ya están resueltos. También hay que considerar que para el progreso en el aprendizaje se requiere que haya un mínimo de procedimientos, que debe ser igual o superior a uno por mes.
Hoy en día, según la experiencia y la evidencia referida, la TEM es la técnica de elección de los adenomas y adenocarcinomas de recto en estadio T1, dentro de las limitaciones de tamaño y altura descritos. Para obtener las máximas garantías será necesario que se desarrollen nuevas técnicas de imagen o características biológicas del tumor que nos permitan conocer un comportamiento benigno sin recidiva local ni a distancia.
Para estadios más avanzados de cáncer rectal, es necesario observar en un futuro los resultados que pueden dar la nueva generación de fármacos quimioterápicos en combinación con la radioterapia y la cirugía local TEM en estudios prospectivos, controlados y aleatorizados que nos garanticen esta alternativa.
Correspondencia: Dr. X. Serra Aracil.
Bailén, 194-196, 2.o-1.a. 08037 Barcelona. España.
Correo electrónico: 22341jsa@comb.es
Manuscrito recibido el 24-5-2006 y aceptado el 25-5-2006.