La irradiación parcial acelerada de la mama (IPAM) con multicatéteres tras cirugía conservadora del cáncer de mama (CM) puede ser una alternativa a la radioterapia externa adyuvante convencional para un grupo seleccionado de pacientes. El objetivo es describir nuestra experiencia en los últimos 5 años.
MétodosEntre junio de 2007 y junio de 2012 fueron evaluados 87 pacientes con CM para IPAM. Los criterios de inclusión fueron: edad mayor de 40 años, tumor unifocal, histología de carcinoma ductal infiltrante o intraductal, tamaño menor de 3 cm y ausencia de afectación ganglionar. Se valoraron las complicaciones, el resultado cosmético y la recidiva local y a distancia.
ResultadosLa IPAM se completó en 48 pacientes y se contraindicó en 39. La edad media de las pacientes tratadas fue de 59 años. La mediana del tiempo quirúrgico fue de 123 min (rango 72-234), con una media de 9 catéteres implantados por paciente. No se registraron complicaciones durante la intervención ni en la radioterapia. La mediana de la estancia hospitalaria fue de 4 días (rango 2-14). El tamaño tumoral medio fue de 11 mm. En 35 casos se trataba de carcinomas ductales infiltrantes y en 13 de carcinomas intraductales. Cuarenta y cuatro pacientes recibieron tratamiento adyuvante. Con una mediana de seguimiento de 22 meses (rango 5-64), no se ha observado recidiva local ni a distancia. El resultado estético fue bueno o excelente en el 66% de casos.
ConclusionesLa IPAM con multicatéteres colocados en el mismo acto operatorio de la cirugía conservadora del CM es una técnica segura y fiable pero exige una meticulosa selección de pacientes.
Accelerated partial breast irradiation (APBI) with multicatheters after lumpectomy for breast cancer (BC) may be an alternative to whole breast irradiation in selected patients. The aim is to show our 5 year experience.
MethodBetween June 2007 and June 2012, 87 BC patients have been evaluated for APBI. Inclusion criteria were: age over 40 years, unifocal tumour, infiltrating ductal or intraductal carcinoma, tumour size smaller than 3 cm and no lymph node involvement. Complications, cosmetic results and local and distant recurrences were evaluated.
ResultsTreatment was completed in 48 patients and contraindicated in 39. The average age of treated patients was 59 years. Operating time was 123min with 9 implanted catheters in each patient. No complications were observed during surgery or radiotherapy. Patients were discharged from hospital after 4 days. Tumour size was 11mm. Of these, 35 were infiltrating ductal and 13 intraductal carcinomas. A total of 44 patients received adjuvant treatment. Mean follow-up was 22 months with no evidence of local or distant recurrence. The cosmetic outcome was good or excellent in 66% of cases.
ConclusionsAPBI with multicatheter placed after lumpectomy for BC is feasible and safe but requires a strict selection of patients.
La cirugía conservadora asociada a radioterapia adyuvante para el tratamiento del cáncer de mama (CM) se realiza desde hace 40 años con las mismas tasas de supervivencia que la simple mastectomía1,2. El tratamiento estándar de la radioterapia externa adyuvante incluye la radiación completa de la mama y un boost en el lecho de la tumorectomía durante 30 sesiones diarias administradas en 6 semanas. Es conocido que la mayoría de las recidivas locales tras una tumorectomía se localizan en el lecho quirúrgico o en su inmediata vecindad3. Este hecho justificaría el uso terapéutico de la irradiación parcial acelerada de la mama (IPAM) incluso como técnica de radiación exclusiva en pacientes seleccionadas. La limitación del volumen de tejido mamario a irradiar hace posible acortar el tratamiento a 5 días, disminuir la toxicidad de la radioterapia4 y conseguir un excelente resultado cosmético5, sin afectar al control local de la recidiva ni a la supervivencia6.
Existen diferentes técnicas para administrar la IPAM7 que se pueden resumir en 3 grandes grupos: la braquiterapia8, la radioterapia intraoperatoria9 y las técnicas que aplican un haz externo de radiación10.
El objetivo de este estudio es describir nuestra experiencia durante los últimos 5 años con la aplicación de la braquiterapia con multicatéteres colocados en el mismo acto quirúrgico en el que se realiza la extirpación del cáncer de mama.
MétodosEntre junio de 2007 y junio de 2012 fueron evaluadas 87 pacientes consecutivas y de manera prospectiva con CM precoz para la IPAM. En nuestra serie colocamos los catéteres en el mismo acto quirúrgico en el que se extirpó el tumor y no en una segunda intervención días o semanas después de la primera, como es otra opción.
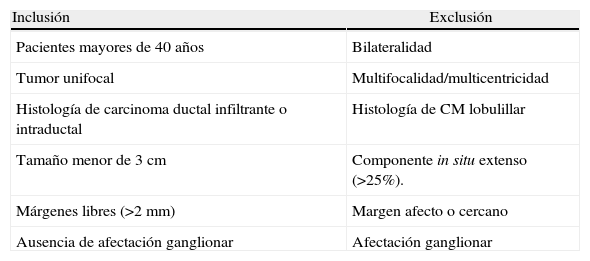
Los criterios de inclusión11 y exclusión se detallan en la tabla 1. El estudio preoperatorio incluía mamografía y ecografía y en todas las pacientes existía un diagnóstico previo de malignidad mediante biopsia con aguja gruesa. En 75 casos (86%) se realizó también una resonancia magnética.
Criterios de inclusión y exclusión
| Inclusión | Exclusión |
| Pacientes mayores de 40 años | Bilateralidad |
| Tumor unifocal | Multifocalidad/multicentricidad |
| Histología de carcinoma ductal infiltrante o intraductal | Histología de CM lobulillar |
| Tamaño menor de 3 cm | Componente in situ extenso (>25%). |
| Márgenes libres (>2 mm) | Margen afecto o cercano |
| Ausencia de afectación ganglionar | Afectación ganglionar |
El esquema del tratamiento fue el siguiente:
- 1.
Anestesia general y cirugía conservadora: tumorectomía y biopsia selectiva del ganglio centinela.
- 2.
Biopsia intraoperatoria por congelación de los bordes de la lesión y del ganglio centinela. Cuando existían microcalcificaciones, se realizaba mamografía intraoperatoria del espécimen quirúrgico.
- 3.
Marcaje con clips de titanio del lecho quirúrgico y colocación de drenaje.
- 4.
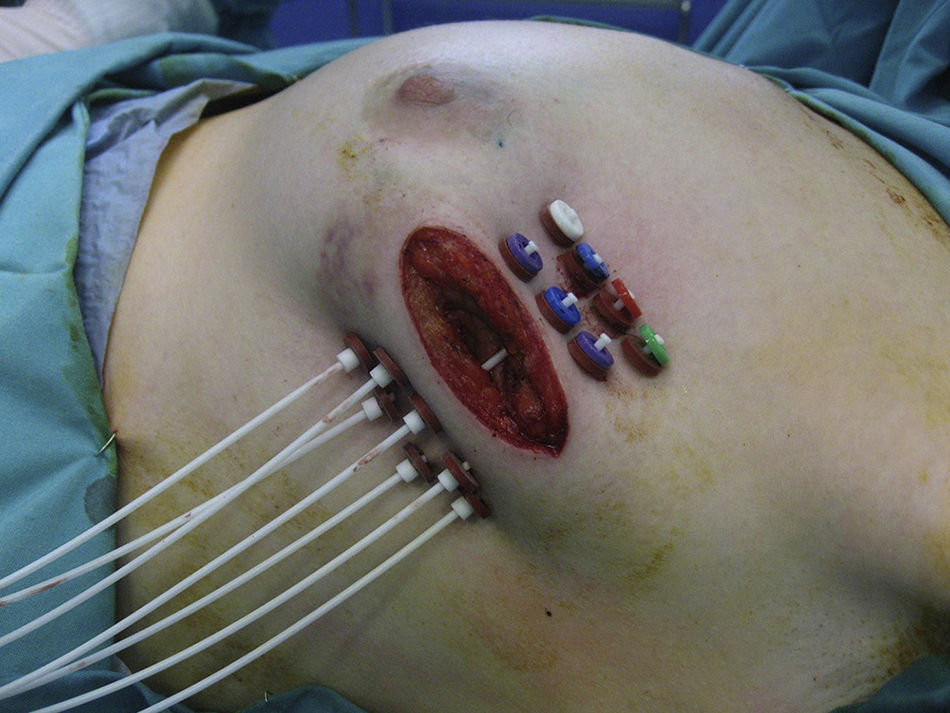
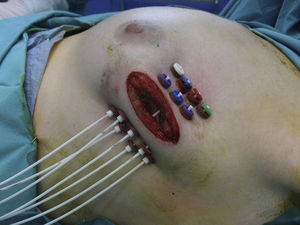
Si los resultados de la biopsia intraoperatoria eran favorables, el oncólogo radioterápico colocaba los catéteres en el lecho tumoral en 2 planos, con una separación entre catéteres de 1,5 cm y, por lo menos, a 7mm de la piel con la técnica free-hand (fig. 1).
- 5.
Alta hospitalaria a partir del segundo o tercer día del postoperatorio tras retirar el drenaje quirúrgico y con los catéteres de braquiterapia.
- 6.
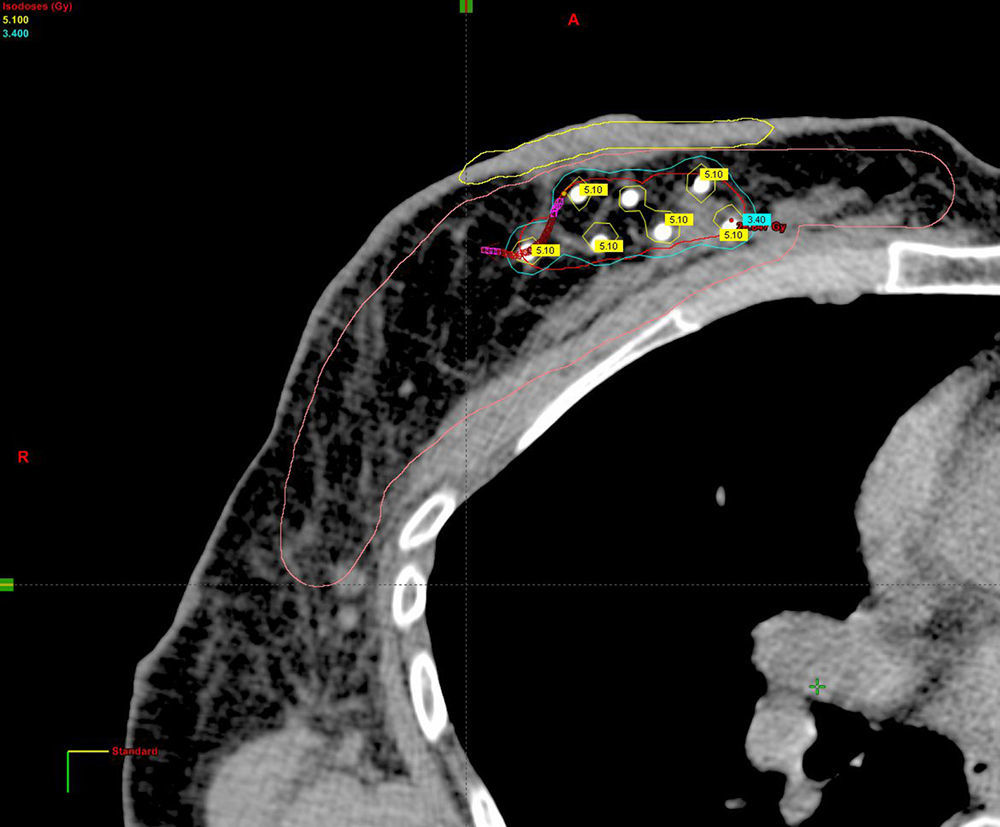
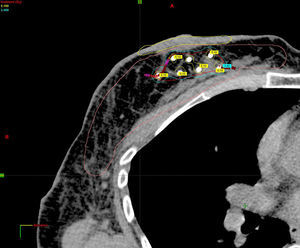
Planificación de la dosimetría en 3D mediante tomografía computarizada de simulación una vez conocido el resultado histológico definitivo (fig. 2).
- 7.
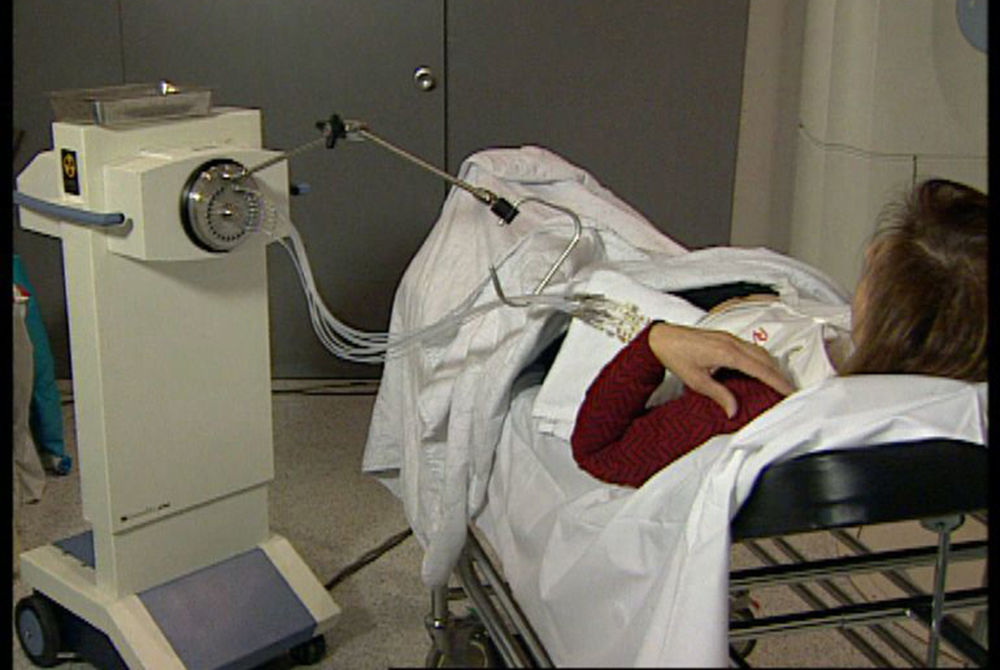
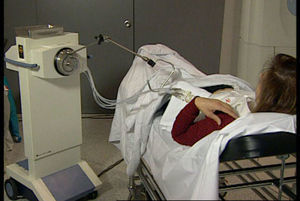
Administración de la IPAM en 2 sesiones diarias de 3,4Gy durante 5 días hasta completar 34Gy en 10 sesiones (fig. 3) mediante una fuente de Ir192.
- 8.
Retirada de los catéteres después de la última sesión de braquiterapia y revisión postoperatoria al cabo de un mes.
- 9.
Profilaxis antibiótica con amoxicilina-clavulánico: una dosis intravenosa de 2 g durante la operación y tratamiento oral con 500 mg cada 8 h hasta la retirada de los catéteres. Analgesia con paracetamol cada 8 h y metamizol según las necesidades de la paciente.
- 10.
El seguimiento incluye exploración física, radiografía de tórax y analítica: trimestral durante el primer año, cuatrimestral durante el segundo, semestral entre el segundo y el quinto año, anual a partir del quinto año. Seis meses después del procedimiento se solicita mamografía y ecografía que, después, pasan a realizarse anualmente. Una vez al año también se suele hacer ecografía hepática en las pacientes que tuvieron tumores infiltrantes. En función del tratamiento hormonal, hay pacientes a quienes se les realiza una revisión ginecológica y una densitometría anuales.
Hemos hecho un estudio descriptivo de las complicaciones, el resultado cosmético y las recidivas. Para evaluar el resultado estético les hemos preguntado a nuestras enfermas su opinión y hemos seguido los criterios de Harvard12 que valoran este resultado como excelente, bueno, regular o malo.
Análisis estadísticoLos resultados se expresan como media con desviación estándar (DE) y como medianas con rangos.
ResultadosEl protocolo de cirugía conservadora asociada a IPAM con multicatéteres se completó en 48 pacientes y se contraindicó en 39. A 12 pacientes no se les colocaron los catéteres porque se desestimó su indicación antes de la intervención quirúrgica, bien fuera por el resultado de algunas exploraciones preoperatorias, bien por los hallazgos en las biopsias intraoperatorias o por problemas técnicos. En 6 pacientes, los catéteres que fueron colocados en el acto operatorio se retiraron en el periodo postoperatorio inmediato cuando se conoció el diagnóstico histopatológico definitivo. En 21 de las pacientes que no cumplían criterios estrictos para la IPAM exclusiva, se aprovecharon los catéteres ya colocados para administrar el boost durante 2 días en 2 sesiones diarias, lo que supone una dosis nominal de 13,6Gy. Tres semanas después, se administró el resto de la radiación como radioterapia externa hipofraccionada en otras 3 semanas más, acortando en 3 semanas la duración total del tratamiento respecto a la radioterapia externa convencional.
Los motivos para contraindicar la IPAM exclusiva se resumen en la tabla 2.
Motivos para contraindicar IPAM exclusiva
| Ganglio centinela afecto (11) |
| Componente in situ extenso (10) |
| Margen afectado o muy próximo (5) |
| Problemas técnicos: herida a tensión, tumores demasiado superficiales (5) |
| Multifocalidad/multicentricidad (3) |
| Histología benigna (2) |
| Carcinoma lobulillar (1) |
| Tumor bilateral (1) |
| Criterios anatomopatológicos de mal pronóstico (1) |
La edad media de nuestras pacientes fue de 59 años (DE). La mediana del tiempo quirúrgico fue de 123 min (rango 72-234). Se implantaron una media de 9 catéteres por paciente (DE: 1,4).
La técnica quirúrgica fue una resección segmentaria con biopsia de ganglio centinela en 41 casos. En 6 pacientes se realizaron técnicas oncoplásticas: 5 round-block y un patrón de crescent. A 6 pacientes no se les hizo cirugía axilar por presentar carcinomas intraductales menores de 2 centímetros y en una se completó un vaciamiento axilar reglado porque no se identificó el ganglio centinela.
La mediana de la estancia hospitalaria fue de 4 días (rango 2-14). A pesar de no existir contraindicación para el alta, 7 pacientes eligieron permanecer ingresadas durante parte o todo el tratamiento de IPAM, tratándose todas ellas de mujeres residentes en otras regiones. Dos pacientes fueron reintervenidas porque el borde estaba afectado pero se volvieron a colocar los catéteres, completándose satisfactoriamente el plan del tratamiento. Otra paciente sufrió una necrosis completa del complejo aréola-pezón en el curso postoperatorio inmediato, antes de iniciar la IPAM, pero también la pudo completar con éxito y el resultado cosmético posterior fue muy bueno. Una paciente presentó un seroma en el curso postoperatorio que fue drenado mediante punción aspiración con aguja fina (PAAF) ecoguiada. No hemos observado hemorragias ni infecciones durante la operación ni en el periodo postoperatorio. Tampoco se registraron complicaciones durante la radioterapia.
El tamaño tumoral medio fue de 11 mm (DE: 4). El tipo histológico de los CM fue ductal infiltrante en 35 casos y en 13, intraductal. El ganglio centinela fue negativo excepto en un caso con células tumorales aisladas.
Once pacientes recibieron quimioterapia a partir de la tercera semana después de la retirada de los catéteres. En 44 se recomendó tratamiento hormonal.
En cuanto al resultado cosmético, el 66% de nuestras pacientes consideraba la apariencia de su mama buena o excelente. En ningún caso hubo secuelas estéticas importantes ni complicaciones tardías secundarias a la radioterapia como dermatitis, fibrosis pulmonar o cardiopatía.
Con una mediana de seguimiento de 22 meses (rango 5-64) no se ha observado recidiva ni local ni a distancia.
DiscusiónEl paso de la irradiación total a la parcial en la mama podría ser comparable a la evolución que hubo en la cirugía hace 40 años cuando se pasó de realizar mastectomías a cirugías conservadoras13; o la que se produjo hace 20 años cuando se implantó la técnica del ganglio centinela para sustituir en muchos casos el vaciamiento axilar. Esto se traduce en terapias menos agresivas para pacientes seleccionadas con tumores de mama precoces y de buen pronóstico. Se trata de personalizar el tratamiento al máximo según las características de la paciente y del tumor.
La experiencia hasta ahora publicada de pacientes tratadas mediante IPAM se va incrementando de año en año con el objetivo de mantener el control local de la enfermedad, reduciendo simultáneamente el tiempo de la radioterapia6. La IPAM se consolida así como una alternativa al tratamiento estándar de 6 semanas de duración.
Las 2 modalidades más utilizadas de braquiterapia en el cáncer de mama son los catéteres y el balón; cualquiera de ellos se puede colocar durante la operación o en el periodo postoperatorio.
El balón MammoSite8 es un dispositivo intracavitario que se introduce en el lecho de la tumorectomía. Su uso se ha popularizado, sobre todo en EE. UU., desde que fue aprobado por la FDA en 2002. Más de 60.000 pacientes han sido tratadas14, con seguimientos de 10 años que muestran resultados similares a los de la radioterapia externa convencional de toda la mama en lo que se refiere a control local de la recidiva y supervivencia15. Más recientemente se han introducido en el mercado otros tipos de dispositivos intracavitarios como el SAVI, ClearPath o Xoft Axxent, todos ellos híbridos entre el balón y los catéteres.
Para administrar la radioterapia intraoperatoria se dispone de varios aceleradores desarrollados para este propósito como el TARGIT y el HAM13, entre otros. El grupo que más experiencia acumula es el del Instituto Europeo de Oncología de Milán, que ha tratado a más de 2.000 pacientes desde 1999 con el acelerador ELIOT9. Este grupo administra 21Gy directamente sobre el lecho quirúrgico antes de cerrar la cavidad y de tener noticia de los resultados definitivos del examen patológico.
Últimamente, y gracias al desarrollo de aceleradores lineales más precisos, se vienen utilizando técnicas de IPAM con haz de radioterapia externa, como la radioterapia conformacional tridimensional (3D-CRT)10 y la de intensidad modulada.
Dentro de las diferentes técnicas de IPAM, la braquiterapia intersticial con catéteres es con la que se viene acumulando más experiencia7. Se ha utilizado durante los últimos 15 años16 con buenos resultados en cuanto a control local de la recidiva y ya hay series con seguimientos de hasta 10 años14. En un principio se desarrolló para administrar el boost sobre la cicatriz de tumorectomía tras un tratamiento de radioterapia externa convencional7 y más tarde se indicó como única forma de irradiación (IPAM exclusiva) en pacientes seleccionadas con tumores precoces. Los catéteres se colocan con un template, en forma de rejilla, o con la técnica free hand, que requiere más habilidad manual.
La mayor parte de los trabajos de IPAM con multicatéteres han sido publicados por centros norteamericanos. Destaca el estudio multicéntrico prospectivo en fase ii del Grupo Americano de Radioterapia RTOG 95-174,6 por su largo período de seguimiento (7 años). Este estudio ha tratado a 100 pacientes en 3 años en las que analiza toxicidad, recidiva local y a distancia. Los criterios de inclusión de este estudio difieren de los nuestros, ya que no existe límite de edad, solo incluye carcinomas ductales infiltrantes y trata pacientes con afectación axilar de hasta 3 ganglios. Tampoco realizan la técnica del ganglio centinela sino un muestreo axilar que debe extirpar al menos 6 ganglios linfáticos. Presentan cifras de recidiva local del 4% y una supervivencia global del 93%.
Ott et al.5 publicaron en 2007 la serie más larga, con 274 pacientes del estudio multicéntrico germano-austríaco. Este estudio incluye a pacientes mayores de 35 años, se acepta la enfermedad ganglionar únicamente en forma de micrometástasis pero solo admite a pacientes con tumores hormonodependientes. La colocación de los catéteres no se lleva a cabo en el mismo acto operatorio sino tras un tiempo medio de 57 días después de la exéresis tumoral. Con una seguimiento medio de 32 meses, las tasas de control local son excelentes (99,2%) así como la supervivencia global (98,5%). En el 94% de estas pacientes el resultado cosmético fue también bueno o excelente.
Nuestro grupo publicó sus resultados de braquiterapia con multicatéteres y radioterapia de alta tasa en 26 pacientes tratadas a lo largo de 7 años pero con catéteres colocados 4 semanas después de la cirugía17. Las tasas de control local de la recidiva y de la supervivencia a 6 años se sitúan en un 96%.
En la actualidad, se incrementan las series publicadas con períodos de seguimiento que se acercan a los 10 años en las que comparan la IPAM con multicatéteres con la radioterapia externa convencional, sin hallar diferencias entre ambas en cuanto al control local de la recidiva y la supervivencia18.
La IPAM con multicatéteres puede presentar ventajas sobre otras técnicas de IPAM. Si la comparamos con el balón MammoSite, los catéteres de braquiterapia son más baratos, la dosis de radiación recibida es más homogénea19 y parece interferir menos con la cicatrización de la herida al no necesitar un espacio tan grande para su inserción como el que requiere el balón, con el consiguiente riesgo de seroma, dehiscencia de la herida e infección. Respecto a la radioterapia intraoperatoria9 la desventaja clara que presenta esta forma de irradiación parcial es que se hace sin conocer el resultado final del estudio histopatológico. Esto puede resultar en un tratamiento insuficiente si los márgenes de resección estuvieran afectados o en la necesidad de completar la radioterapia sobre zonas de drenaje linfático si hubiera afectación ganglionar. En cuanto a las técnicas más finas de radiación externa como la 3D-CRT10 y la radioterapia de intensidad modulada resultan a priori muy atractivas ya que no son invasivas y teóricamente administran una dosis de radiación homogénea y selectiva con poca toxicidad para las estructuras adyacentes. La realidad es que se requiere de aceleradores lineales muy sofisticados para conformar la dosis de radiación desde múltiples ángulos. Esto se traduce en que, al día de hoy, pocas pacientes con tumores muy pequeños y en determinadas localizaciones se benefician de estas técnicas, de las que las series publicadas son cortas.
Por lo tanto, podemos concluir que la IPAM es una técnica factible y segura pero requiere una selección cuidadosa de las pacientes a tratar. La colocación intraoperatoria de los catéteres tiene la ventaja de que la identificación del lecho quirúrgico es mucho más precisa y directa. Se realiza en un único tiempo quirúrgico que apenas alarga unos 30 min la cirugía convencional. Su gran ventaja sobre la radioterapia externa convencional es el acortamiento del tiempo de radioterapia de 6 a una semana. Nuestra impresión, a pesar del corto período de seguimiento y del número limitado de pacientes, es que el resultado cosmético puede ser algo mejor tras la cirugía conservadora y que parece tener menos toxicidad que la radioterapia estándar. La IPAM con multicatéteres puede presentar además ventajas sobre otras técnicas de irradiación parcial acelerada por coste económico, simplicidad y dosimetría.
Sin embargo, es preciso un mayor número de pacientes y de tiempo de seguimiento así como disponer de los resultados de los estudios multicéntricos en fase iii que hay en marcha, tales como el NSABP B-39/ROTG0413 o el GEC-ESTRO APBI19 para afirmar que sus resultados, en cuanto a control local de la recidiva y supervivencia, son equivalentes a la radioterapia estándar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Parte de la información del manuscrito ha sido presentada como póster en la XVI Reunión de la Sección de Patología Mamaria de la Asociación Española de Cirujanos. Pamplona, mayo de 2010 y en el 32 Congress of the European Society of Surgical Oncology. Valencia, septiembre 2011.