Introducción. La proliferación celular constituye un parámetro biológico de gran interés en la clínica diaria. Nosotros hemos querido estudiar su influencia sobre ciertas propiedades clínico-biológicas utilizadas habitualmente para caracterizar los tumores mamarios.
Pacientes y métodos. Hemos determinado en 200 carcinomas ductales infiltrantes de mama las concentraciones citosólicas de receptores de estrógenos (RE), de progesterona (RP), pS2, catepsina D y activador del plasminógeno tipo tisular (t-AP), así como las del receptor del factor de crecimiento epidérmico (EGFR), proteína erbB2, CD44 v5 y CD44v6 en las membranas celulares. Asimismo, se tuvo presente el tamaño, afectación ganglionar axilar, estado menopáusico, ploidía, grado histológico, multifocalidad y multicentricidad.
Resultados. Los valores de la fase S en los 200 carcinomas ductales infiltrantes estudiados oscilaron entre el 0,2 y el 28%, siendo la mediana del 7%, cifra esta última que fue considerada como límite de positividad. En los tumores proliferativos (FS > 7%) se apreciaron menores concentraciones de RP (p = 0,054), pS2 (p = 0,031) y t-AP (p = 0,018), así como mayores de EGFR (p = 0,047). Asimismo, cursaron con mayor tamaño (p = 0,041), grado histológico 3 (p = 0,002) y fueron más frecuentemente aneuploides (p = 0,000). Estos resultados se acentuaron cuando consideramos dos grupos más extremos: fase S < 4% y fase S > 11,7%, cifras que corresponden a los percentiles 25 y 75 de todos los carcinomas ductales infiltrantes estudiados.
Conclusiones. Los resultados anteriores nos inducen a considerar que la proliferación celular se acompaña de cambios relacionados con una mayor hormonoindependencia y desdiferenciación celular, fenómenos que pueden contribuir a explicar el peor comportamiento de los carcinomas con mayor capacidad replicativa.
Introduction. Cell proliferation is among the most important biological parameters in the clinical study of malignant tumors. We examined its influence on certain clinical-biological properties routinely employed in the characterization of breast carcinomas.
Patients and methods. Flow cytometry was used to determine the S-phase fraction in fresh cell samples from a series of 200 patients with infiltrating ductal carcinomas (IDC) of the breast. We measured the cytosolic concentrations of estrogen receptors (ER), progesterone receptors (PR), pS2, cathepsin D and tissue-type plasminogen activator (t-PA), as well as cell surface levels of epidermal growth factor receptor (EGFR), the erbB2 protein, CD44 v5 and CD44 v6. Tumor size, axillary lymph node involvement, menopausal status, ploidy, histological grade and multicentricity were also recorded.
Results. The S-phase fraction ranged between 0.2% and 28%; the median was 7%, the value used as the positive cut-off point. Proliferating tumors had lower concentrations of PR (p = 0.054), pS2 (p = 0.031) and t-PA (p = 0.018), as well as higher EGFR levels (p = 0.047). These tumors were also larger (p = 0.41), corresponded more frequently to histological grade 3 (p = 0.002) and were associated with a higher rate of aneuploidy (p = 0.000). These differences were more marked in tumors corresponding to S-phase fractions in the lower (< 4%) and upper (> 11.7%) ranges, values that correspond to the 25th and 75th percentiles of all the IDC studied.
Conclusions. The results suggest that cell proliferation is preferentially associated with changes related to a greater hormone independence and cellular dedifferentiation, findings that help to explain the more aggressive behavior of carcinomas presenting a greater replication capacity.
Introducción
El cáncer de mama constituye el tumor más frecuente en el sexo femenino1. Como consecuencia de las campañas de detección y de una mayor concienciación social, su forma de presentación ha cambiado notablemente en los últimos años, de modo que en la actualidad casi el 70% de los casos diagnosticados son menores de 1 cm y sin afectación axilar. Asimismo, el número de carcinomas in situ se ha incrementado de un modo muy importante y representa ya el 20-25% de todos los tumores observados en determinados centros2,3. Son numerosos los factores pronósticos utilizados en este tipo de tumores malignos, entre los que merecen ser destacados los receptores esteroides, el tamaño y la afectación ganglionar axilar. Sin embargo, dado que muchos tumores no cursan inicialmente con afectación regional, necesitamos buscar nuevos parámetros que puedan ser de utilidad para establecer subgrupos de riesgo, pues sabemos que casi un 30% de ellos recidivan antes de lo que les correspondería, hecho que los hace tributarios de una terapia inicial más agresiva. De los numerosos factores descritos, requiere especial atención la proliferación celular, pues ha resultado ser de gran interés fisiopatológico en relación con los receptores esteroides4-8 y de utilidad para definir subtipos tumorales con un diferente comportamiento y evolución9.
La proliferación puede ser estudiada de diversas formas, ya sea mediante citometría de flujo (fase de síntesis o S) o bien con técnicas inmunohistoquímicas merced al empleo de anticuerpos que definen la fase de síntesis, todas las del ciclo celular e incluso la actividad nucleolar10,11. En el momento actual se cree que es mejor valorar todas las fases del ciclo celular, al comportarse éstas como un parámetro pronóstico, incluso en los casos sin afectación axilar, en estadios T1N0M0 y en aquellos casos con afectación axilar sometidos a cirugía radical o conservadora con radioterapia y tamoxifeno durante un año12-16. La proliferación se correlaciona con la regulación negativa de la integrina beta 1c17 y los receptores esteroides10, así como positivamente con la ploidía18, tamaño, grado de diferenciación y la proteína del retinoblastoma, la cual, a su vez, lo hace con el tamaño, grado histológico y grado nuclear19. También la proliferación celular disminuye tras la quimioterapia y la administración de tamoxifeno en los casos positivos para receptores de estrógenos, pero no en los negativos20,21. Es interesante resaltar que los carcinomas de mama de intervalo son más proliferativos que los detectados mediante campañas de detección22,23, y hoy día sabemos que la sobreexpresión del erbB2 determina en las células epiteliales humanas una independencia para factores de crecimiento24 y que la procatepsina D interacciona con un receptor celular y estimula la proliferación y motilidad de las células tumorales25.
Aunque el interés de la proliferación celular es bien conocido y su estudio ampliamente utilizado en la práctica diaria, son numerosas las facetas desconocidas acerca de su impacto fisiopatológico, por lo cual nos pareció interesante analizar las modificaciones que ejerce sobre ciertos parámetros ampliamente utilizados en la caracterización de los carcinomas mamarios.
Pacientes y métodos
El grupo de estudio incluyó 200 carcinomas ductales infiltrantes de mama a los que se determinó en fresco la fase S mediante citometría de flujo (Becton Dickinson, Fascam). Asimismo, para la determinación de otros factores las muestras tisulares fueron limpiadas de sus componentes grasos, congeladas y almacenadas en nitrógeno líquido hasta su homogeneización. Ésta se realizó en un tampón (Tris 0,1 M, EDTA Na2 0,015 M, glicerol al 10%, monotioglicerol 0,01%, pH 7,5) y en frío mediante un microhomogeneizador (OMNI 1000, Waterbury, CT, EE.UU.), siendo después centrifugadas las muestras a 1.500 rpm durante 10 min. Posteriormente, el sobrenadante se sometió a una ultracentrifugación a 100.000 g durante 1 h a 4 °C. El nuevo sobrenadante (citosol) fue utilizado para la determinación de los receptores de estrógenos (RE) (EIA, Abbott, EE.UU.), de progesterona (RP) (EIA, Abbott, EE.UU.), pS2 (IRMA, CIS Biointernacional, Francia), catepsina D (CAT-D) (IRMA, CIS Biointernacional, Francia) y activador del plasminógeno tipo tisular (t-AP) (EIA, Boehringer Mannheim, Alemania). El precipitado (pellet) fue empleado para determinar el receptor del factor de crecimiento epidérmico (EGFR) (RLG, Viennalab, Austria), proteína oncogénica erbB2/neu (EIA, Oncogene, EE.UU.), ácido hialurónico (AH) (RIA, Pharmacia, Suecia), CD44v5 (EIA) (Bender Med-System, Austria) y CD44v6 (EIA) (Bender Med-System, Austria). Asimismo, se tuvieron presentes el tamaño, la afectación ganglionar axilar, el grado histológico y el estado menopáusico. Los resultados fueron expresados por mg de proteína, determinada mediante el método de Bradford. Los umbrales de positividad para los diferentes parámetros fueron, según nuestra experiencia, los siguientes: 10 fmol/mg de proteína para los RE y RP; 5 ng/mg de proteína para la pS2; 50 pmol/mg de proteína para la catepsina D; 4,5 fmol/mg de proteína para el EGFR; 6.000 NHI/mg de proteína para la proteína oncogénica erbB2/neu de membrana; 3 ng/mg de proteína para el CD44v5 y 5 ng/mg de proteína para el CD44v6. El estudio estadístico fue realizado mediante el programa BMDP3; como los diferentes parámetros biológicos no siguieron una distribución normal, hemos empleado pruebas no paramétricas, así como la de la *2. Por ello, los resultados se han expresado mediante el intervalo y los percentiles 25, 50 y 75. Se consideró estadística una diferencia cuando el valor de p fue < 0,05
Resultados
En los 200 carcinomas ductales infiltrantes los valores de la fase S oscilaron entre el 0,2 y el 28%, siendo la mediana del 7,1%, y los percentiles 25 y 75 del 4,0 y 11,7%, respectivamente. Utilizando la cifra del 7% como umbral de positividad, pudimos observar, como se expone en las tablas 1 y 2, que los tumores proliferativos cursaron con menores concentraciones de RP (p = 0,054), pS2 (p = 0,031) y t-AP (p = 0,018), así como con mayores de EGFR (p = 0,047) y superior tamaño global (p = 0,041). Asimismo, los carcinomas proliferativos fueron más frecuentemente aneuploides (p = 0,000) y cursaron con grado histológico 3 (p = 0,002).
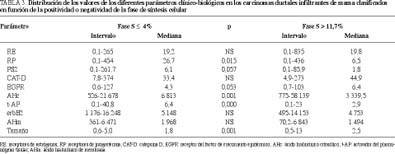
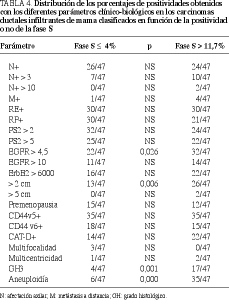
Una vez observadas estas diferencias en determinados parámetros clínico-biológicos, analizamos dos subgrupos extremos de tumores: uno con fase S < 4 (percentil 25 del grupo total) y otro con una fase de síntesis > 11,7% (percentil 75). Como se observa en las tablas 3 y 4, los tumores más proliferativos presentaron menores concentraciones de RP (p = 0,015), pS2 (p = 0,057), AHc (p = 0,001) y t-AP (p = 0,000), así como mayores de EGFR (p = 0,053) y superior tamaño (p = 0,001). También cursaron con mayores porcentajes de positividades para el EGFR (p = 0,026), tamaño > 2 cm (p = 0,006), aneuploidía (p = 0.000) y grado histológico 3 (p = 0,001)
Discusión
El estudio de la proliferación celular constituye una práctica habitual en la clínica oncológica, ya que ayuda a establecer subgrupos de riesgo tributarios de una terapia adicional. Existen discrepancias acerca de cuál es el método más efectivo para evidenciar dicho acontecimiento celular12 y resaltándose en los últimos tiempos la necesidad de analizar no sólo la fase de síntesis celular (fase S), sino todas las del ciclo (S + G2M), ya que parecen reflejar mejor la dinámica tumoral. El estudio de estas últimas mediante el anticuerpo (Ki-S2) demostró su utilidad como factor pronóstico independiente en las mujeres con cáncer de mama sin afectación ganglionar axilar y como indicador de la administración de una terapia adyuvante13. El marcador de proliferación más conocido y utilizado es el Ki67, antígeno definido por un anticuerpo monoclonal que está presente en todas las fases activas del ciclo celular menos en la G0, de modo que se considera que es un requerimiento absoluto para la progresión a lo largo del ciclo celular11, si bien otros grupos utilizan la fase S por citometría de flujo. Con respecto a su interés clínico, se acepta que es un factor pronóstico, especialmente de intervalo libre de enfermedad, en los casos N, en las mujeres mayores de 70 años N+ sometidas a cirugía y radioterapia y hormonoterapia e incluso en tumores pT1 sin adenopatías axilares14-16-26,29.
Al analizar la fase S en los 200 carcinomas ductales infiltrantes estudiados, pudimos comprobar que aquélla osciló entre el 0,2 y el 28%, siendo la mediana del 7,1%, y los percentiles 25 y 75 del 4,0 y 11,7%, respectivamente.
Similares resultados obtienen Pinto et al18, quienes citan un rango comprendido entre el 1 y el 27,8% con una mediana del 6,1%. Cuando establecimos el umbral de positividad para la fase S en el 7% (mediana del grupo global), pudimos comprobar que los carcinomas proliferativos presentaron estadísticamente menores concentraciones del RP, pS2 y t-AP, mayores de EGFR y superior tamaño, siendo con más frecuencia aneuploides y de grado histológico 3. Lo primero que llama la atención es el descenso significativo de la hormonodependencia en los casos con fase S elevada, reflejada por las menores concentraciones de los receptores de progesterona, pS2 y t-AP, moléculas todas ligadas al mecanismo de transducción de la señal estrogénica. Sabemos que la falta de RE y la expresión de PAI-1 caracteriza la invasión de las líneas celulares tumorales, asociándose la presencia de RE, RP y pS2 al fenotipo no invasi-vo30; asimismo, la combinación de los RE y RP aumenta el poder pronóstico de los receptores estrogénicos31 y la presencia de ambos receptores esteroides es indicadora de la respuesta a la quimioterapia tras la cirugía32. También se ha observado que
la expresión del RP es factor pronóstico de estos tumores malignos33,34. La pS2 es una proteína asociada a los tumores hormonodependientes y se correlaciona positivamente con los receptores de estrógenos y de progesterona, así como con otros factores de buen comportamientro, siendo, además, útil para definir subgrupos de tumores que pueden beneficiarse de la terapia endocrina35-38. El activador del plasminógeno tipo tisular (t-AP) presenta un comportamiento opuesto al del otro miembro de la familia: el tipo urocinasa (u-AP), pues se correlaciona con la positividad para los receptores de estrógenos, de progesterona y pS2, proporciona información adicional sobre el estado funcional de los receptores esteroides y se asocia a parámetros de buen comportamiento y evolución39-42. Todo lo anterior nos indica que la proliferación celular se asocia a una hormonoindependencia y, en consecuencia, a una mayor desdiferenciación celular, fenómeno que se ve apoyado y potenciado por el aumento concomitante de las concentraciones del factor de crecimiento epidérmico (EGFR), parámetro que se correlaciona con la negatividad del receptor de estrógenos y, con menos frecuencia, con la del receptor de progesterona y el grado histológico, mientras que sus relaciones con otros factores no se han demostrado de forma mayoritaria43,44. Paralelamente a esta hormonoindependencia, los tumores más proliferativos presentaron con mayor frecuencia aneuploidía, grado histológico 3 y superior tamaño global, fenómenos que se asocian, solos o junto con la edad, invasión linfática-vascular e infiltración de los márgenes, con un peor pronóstico incluso en estadio 145-53, siendo alguno de ellos factor pronóstico independiente en tumores menores de 2 cm51.Una vez establecidas las diferencias clínico-biológicas de los carcinomas ductales infiltrantes de mama clasificados en función de la positividad para la fase S, quisimos comprobar qué ocurría cuando considerábamos dos grupos extremos: con baja (< 4%, que representa el percentil 25 del grupo total) y alta proliferación (> 11,7%, que refleja el percentil 75), comprobando que las diferencias se hacían más importantes. Además, se evidenció un mayor número de casos con un tamaño > 2 cm y EGFR+, y menores concentraciones de ácido hialurónico citosólico, proteoglicano que en la experiencia de nuestro grupo se asocia positivamente con tumores hormonodependientes, diploides y poco proliferativos54.
Los resultados anteriores nos inducen a considerar que la proliferación celular se acompaña de cambios relacionados con una mayor hormonoindependencia y desdiferenciación celular, fenómenos que pueden contribuir a explicar el peor comportamiento de los carcinomas con mayor capacidad replicativa.