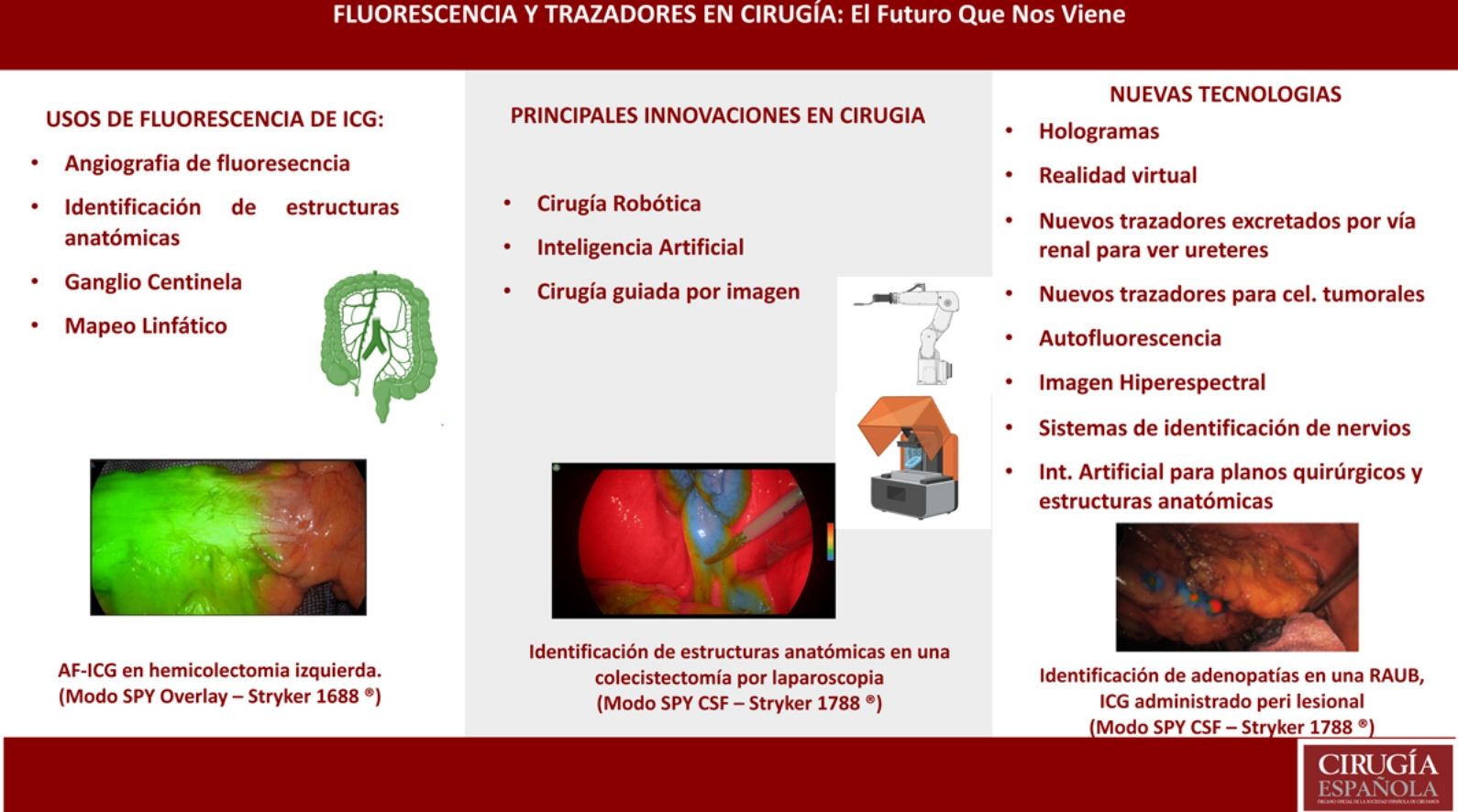
Las revoluciones de las que estamos siendo testigos en el mundo de la cirugía van a determinar la forma de entender el abordaje quirúrgico en los próximos años. Desde la implantación de la cirugía mínimamente invasiva, constantemente se han desarrollado innovaciones que facilitan que el abordaje laparoscópico llegue más lejos y se aplique cada vez a más procedimientos. En los últimos años estamos inmersos en otra época de revoluciones tales como la cirugía robótica, la aplicación de inteligencia artificial y la cirugía guiada por imagen. Esta última incluye las reconstrucciones 3D para la planificación quirúrgica, la realidad virtual, los hologramas o la cirugía guiada por trazadores, donde la florescencia guiada por verde de indocianina (ICG) ha supuesto una forma distinta de enfocar la cirugía.
El ICG se ha utilizado para identificar estructuras anatómicas, para valorar la perfusión de tejidos, para identificar tumores o el drenaje linfático de los mismos. Pero lo más importante, es que esta tecnología ha venido de la mano de un potencial desarrollo de otro tipo de trazadores, que facilitarán la identificación de células tumorales, uréteres, de diferentes haces de luz para identificar estructuras anatómicas, derivando a otro tipo de sistemas para valorar la oxigenación de los tejidos sin uso de trazadores, como las imágenes hiperespectrales. Todo esto aunado a la llegada de la cuantificación del ICG representa una revolución real en el mundo quirúrgico. Con la inminente implementación de este desarrollo tecnológico, es oportuna una revisión de su aplicación clínica en la cirugía general y esta revisión tiene ese objetivo.
The revolution that we are seeing in the world of surgery will determine the way we understand surgical approaches in coming years. Since the implementation of minimally invasive surgery, innovations have constantly been developed to allow the laparoscopic approach to go further and be applied to more and more procedures. In recent years, we have been in the middle of another revolutionary era, with robotic surgery, the application of artificial intelligence and image-guided surgery. The latter includes 3D reconstructions for surgical planning, virtual reality, holograms or tracer-guided surgery, where ICG-guided fluorescence has provided a different perspective on surgery.
ICG has been used to identify anatomical structures, assess tissue perfusion, and identify tumors or tumor lymphatic drainage. But the most important thing is that this technology has come hand in hand with the potential to develop other types of tracers that will facilitate the identification of tumor cells and ureters, as well as different light beams to identify anatomical structures. These will lead to other types of systems to assess tissue perfusion without the use of tracers, such as hyperspectral imaging. Combined with the upcoming introduction of ICG quantification, these developments represent a real revolution in the surgical world. With the imminent implementation of these technological advances, a review of their clinical application in general surgery is timely, and this review serves that aim.
Actualmente, estamos asistiendo a una época muy especial en el mundo de la cirugía. Las revoluciones de las que estamos siendo testigos van a determinar la forma de entender el abordaje quirúrgico en los próximos años. Si consideramos el concepto de revolución como un cambio determinante en la forma de concebir algo, podemos decir que, desde el inicio de la cirugía, han existido tres grandes revoluciones, la anestesia, ya que permitió realizar los procedimientos que hacemos hoy en día; los trasplantes, como acción mágica de trasladar un órgano a otra persona permitiéndole vivir; y la llegada de la cirugía mínimamente invasiva. Desde la implantación de esta última han surgido constante innovaciones que han facilitado que el abordaje laparoscópico llegue más lejos y se aplique a cada vez más procedimientos.
En los últimos años, estamos inmersos de nuevo en otra época de revoluciones, lideradas fundamentalmente por tres grandes conceptos: el impacto de la robótica, facilitando llegar con ángulos imposibles, de forma ergonómica, a cualquier lugar del cuerpo humano y abriendo el futuro a la automatización de diferentes fases de un procedimiento; la aplicación de la inteligencia artificial, recogiendo datos para la ayuda de la toma de decisiones y facilitar el aprendizaje; y, por último, la cirugía guiada por la imagen, con el objetivo de ver más allá y lo invisible, para obtener mejores resultados.
Esta última incluye diferentes conceptos, entre ellos las reconstrucciones 3D para la planificación quirúrgica, la realidad virtual, los hologramas, o la cirugía guiada por trazadores, donde la florescencia guiada por verde de indocianina (ICG) ha supuesto una forma distinta de entender la cirugía, dado el aumento creciente de aplicaciones, los resultados que ofrece y la ventana de oportunidades que brinda para una creciente implementación en diferentes campos.
El ICG ha sido utilizado para identificar diferentes estructuras anatómicas, para valorar la perfusión de los tejidos, para identificar el drenaje linfático de diferentes tumores o incluso para identificar los mismos. Pero lo más importante es que esta tecnología ha venido de la mano de un potencial desarrollo de otro tipo de trazadores, que facilitarán la identificación de células tumorales, uréteres, de diferentes haces de luz para identificar estructuras anatómicas, derivando a otro tipo de sistemas para valorar la oxigenación de los tejidos sin el uso de trazadores, como las imágenes hiperespectrales. Sin duda, el campo de posibilidades que abre con la expansión del concepto, y las mejoras inminentes en su uso, como la cuantificación, van a suponer un antes y un después en la forma de concebir un quirófano y la cirugía, lo que implica una revolución real en el mundo de la cirugía.
Bases de la fluorescenciaEl ICG es un agente de tinción fluorescente que bajo una visión cercana al infrarrojo (NIR) se utiliza habitualmente como medio de contraste para el diagnóstico médico1. Se desarrolló en la Segunda Guerra Mundial como colorante para su uso en fotografía. En 1956 se aprobó por primera vez su uso clínico en humanos y en 1957 se probó su empleo en medicina humana2. En 1959 se convierte en el primer colorante NIR aprobado por la Administración de Alimentos y Medicamentos de EE. UU. (FDA) para aplicaciones clínicas como la angiografía, imagen linfática, biliar y para la cirugía oncológica guiada por imagen2.
El ICG es un colorante aniónico de tricarbocianina hidrosoluble que contiene una cadena p-conjugada de siete carbonos. Su estructura química consiste en elementos policíclicos conectados por una larga cadena de carbono. Mientras que los elementos policíclicos son responsables de las propiedades lipofílicas del ICG, los grupos sulfato le confieren hidrofilia3. Tras la administración intravenosa, el ICG se une rápidamente a las proteínas plasmáticas, eliminándose de forma inalterada por la bilis, sin recirculación enterohepática, con una vida media plasmática de tres a cinco minutos y metabolismo hepático4. Cuando se inyecta directamente sobre un tejido, el ICG se une a las proteínas y alcanza el ganglio linfático más cercano en pocos minutos, para posteriormente unirse a los ganglios linfáticos regionales después de una a dos horas de su inyección5.
En los últimos años, se ha extendido el uso de la fluorescencia de ICG en los ámbitos quirúrgicos, especialmente en cirugía general, sobre todo en los abordajes mínimamente invasivos gracias a la tecnología utilizada en los abordajes laparoscópicos y robóticos.
Usos actuales de la fluorescencia de verde de indocianinaPerfusión de tejidos mediante angiografía de fluorescencia con verde de indocianinaLa valoración de la vascularización de los tejidos para ver su viabilidad, en especial previamente a la realización de una anastomosis, ha sido demostrada en distintas áreas de la cirugía general, tales como en cirugía colorrectal, esofágica, gástrica, bariátrica, de la hernia y reconstrucción de pared abdominal6.
La ventaja más evidente de la técnica de angiografía de fluorescencia con ICG (AF-ICG) es la visualización en tiempo real de la perfusión sanguínea a los tejidos y del flujo sanguíneo relacionado con la vascularización arterial. Sin embargo, no permite evaluar la velocidad del retorno venoso o el lavado de los tejidos. Una vez que los vasos y los tejidos están teñidos, el marcado realce dura unos cinco minutos, hasta que el hígado segrega la ICG en la bilis intacta4.
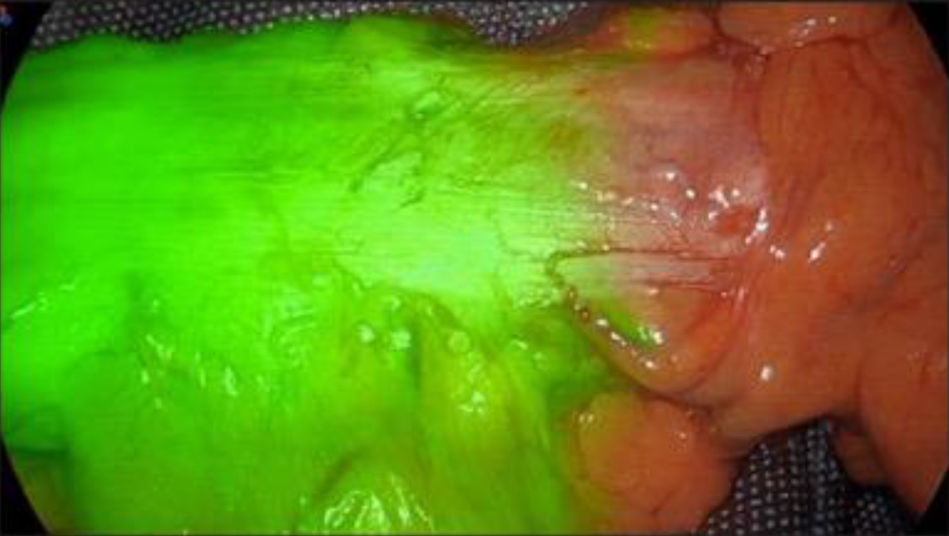
Cirugía colorrectalComo ya se ha demostrado en diferentes estudios, el adecuado aporte sanguíneo es uno de los factores más importantes para prevenir la fuga anastomótica (FA)5–11. En esa línea se han publicado una serie de artículos en los que se evidencia que la AF-ICG es una herramienta muy útil para ayudarnos a disminuir la tasa de fugas en cirugía colorrectal5–11.
En un estudio prospectivo se evaluó la utilidad de la AF-ICG durante la cirugía «sphincter-saving» asistida por robot en pacientes con cáncer de recto. En el estudio se incluyeron 436 pacientes distribuidos en dos grupos9. A un grupo de 123 pacientes se les administró vía intravenosa 10mg antes y después de la anastomosis, y al otro grupo de 313 pacientes no se les realizó AF-ICG. Los resultados mostraron que la tasa de dehiscencia fue significativamente menor en el grupo de ICG comparado con el grupo sin ICG (0,8 vs. 5,4%, respectivamente9). Otro estudio analizó el valor del uso de AF-ICG por tipos de cirugía colorrectal, en relación con el sitio de la línea de sección del colon o recto, concluyendo que el uso del ICG conlleva cambios de la línea de sección inicialmente planteada significativamente mayores en la línea de sección en la hemicolectomía izquierda seguida de resección anterior12. Con lo cual, si bien su uso es muy útil, puede que tenga aún más valor en ese tipo de intervenciones, probablemente por la variabilidad de la anatomía vascular y la dependencia de la vascularización de la preservación y el estado de las arcadas vasculares.
Con base en estos resultados, se puede concluir que la AF-ICG es un método eficaz para ayudar a reducir fugas anastomóticas después de una cirugía colorrectal5–14 (fig. 1).
Cirugía de esófagoEl uso del estómago como plastia para la reconstrucción tras una esofagectomía es una práctica ampliamente utilizada. Las tasas de FA, que oscilan entre 6,2 al 27%, es uno de los principales problemas relacionados con la morbimortalidad posoperatoria y con el pronóstico de estos pacientes15–18.
Una de las áreas deficitarias de vascularización durante estas anastomosis se localiza en la parte superior de la plastia. Con el fin de asegurar una adecuada vascularización a la anastomosis de la plastia gástrica al esófago se ha sugerido realizar AF-ICG, pudiéndose administrar el ICG por vía intravenosa en tres momentos, previo a realizar la plastia gástrica, posterior a efectuarla y previo a colocarla en el tórax y, por último, hay grupos que realizan la AF-ICG una vez ya colocada la plastia en el tórax y previo a la anastomosis18–20.
La fluorescencia con ICG es un método prometedor por la reducción del riesgo de FA después de esofagectomía. Ladak et al. publicaron un metaanálisis en el que se describe una reducción hasta del 69% de las FA, cuando al utilizar el ICG se realizó algún tipo de intervención o cambio a la cirugía inicialmente planificada19.
Cirugía de estómagoEn el caso de una gastrectomía, la vascularización es un factor importante en el desarrollo de la FA21–22. Un estudio prospectivo incluyó a 20 pacientes intervenidos de cáncer gástrico en estadios precoces a los que se le practicó una gastrectomía robótica (14 pacientes) y laparoscópica (seis pacientes) con preservación del píloro21. Se administró el ICG al inicio de la cirugía con la intención de identificar la anatomía vascular para realizar la cirugía planeada. La conclusión de este estudio fue que la valoración de la vascularización en tiempo real con fluorescencia de ICG durante una gastrectomía mínimamente invasiva resultó ser factible con mínima complejidad añadida21. Los resultados preliminares indican que la imagen vascular intraoperatoria usando la AF-ICG es útil incluso para identificar la anatomía y el origen de pequeños vasos20–21.
Cirugía bariátricaEn la cirugía bariátrica, al realizar una gastrectomía vertical, una de las complicaciones más temidas es la de una fuga gástrica en la línea de sección, que parece estar muy relacionada con problemas isquémicos en el estómago, asimismo en el caso de otro tipo de técnica, el riesgo de un aporte vascular inadecuado a una anastomosis que pudiera derivar en FA22–24. Recientemente, se publicó una revisión sistemática intentando valorar la importancia del uso de AF-ICG comparándola con las pruebas de FA y de valoración de perfusión tisular tradicionales, concluyendo que la proporción de pacientes en los que se produjo un cambio de conducta intraoperatoriamente debido a la ICG fue del 3,8%, lo que disminuye el riesgo de complicaciones posoperatorias. La imagen fluorescente ICG en cirugía bariátrica es una herramienta prometedora24.
Reconstrucción de pared abdominalLa fluorescencia con ICG parece ser de utilidad también para disminuir las tasas de complicaciones en casos de hernia y de reconstrucción de la pared abdominal25–29. Varios estudios reportan la utilidad de AF-ICG para valorar la vascularización y el aporte sanguíneo bilateral a los colgajos de piel y tejido subcutáneo, con el objeto de valorar si les ayudaba a tomar decisiones durante la intervención, concluyendo la utilidad del colorante tanto para la toma de decisiones, como para reducir las complicaciones derivadas de la herida al evitar tejidos hipoperfundidos o necrosis25–29.
Dosis de verde de indocianina para angiografía de fluorescencia con verde de indocianinaExiste una variabilidad de los autores en cuanto a la dosis y vía de administración, Morales-Conde et al. publicaron una guía en la que sus conclusiones y recomendaciones son el utilizar una dosis estándar para AF-ICG de 15 mg, y para la cirugía bariátrica aumentar esa dosis a 25 mg por vía endovenosa29.
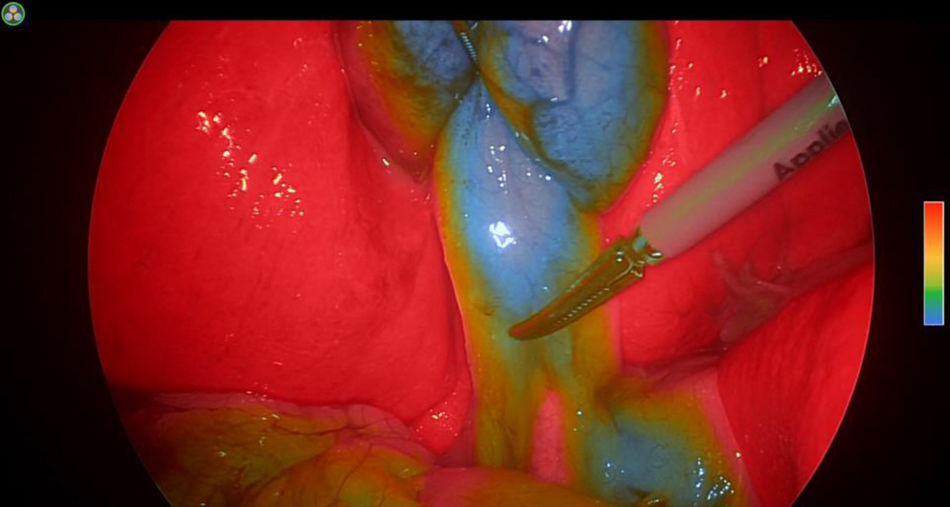
Uso del verde de indocianina para la identificación de estructuras anatómicasVía biliarLa fluorescencia con ICG permite realizar una colangiografía virtual y en tiempo real durante la disección en la colecistectomía laparoscópica, e identificar así, variaciones anatómicas y evitar situaciones de potencial riesgo de lesión de la vía biliar.
El ICG al concentrarse a nivel hepático y excretarse por la bilis, hace posible que se dibuje la anatomía del árbol biliar y la unión entre el cístico y el hepático común30.
Uno de los problemas asociados es que la alta fluorescencia del hígado puede impedir o dificultar la identificación del árbol biliar y, especialmente si la inyección ha sido muy reciente, impide la correcta visualización de la vía biliar31. Para evitar estos hechos algunos autores han propuesto la inyección preoperatoria más alejada en el tiempo o la inyección directa intravesicular30,32,33, aunque resulta una técnica algo engorrosa y no siempre posible. Por los motivos previamente comentados, para una perfecta definición de la vía biliar con menor contraste hepático, el ICG debería administrarse entre tres a ocho horas antes de la cirugía29–34, aunque los nuevos sistemas de visión permiten su inyección incluso en la inducción de la anestesia (fig. 2).
ParatiroidesLas lesiones iatrogénicas de las glándulas paratiroides son la complicación más frecuente tras una tiroidectomía total. La fluorescencia con ICG puede ser de utilidad para la identificación de las glándulas paratiroides durante la cirugía de tiroides, así como para asegurar la vascularización de las mismas tras la tiroidectomía35–38. Recientemente, se ha podido observar una alternativa muy interesante, que consiste en la autofluorescencia (AF) de las paratiroides, sin necesidad de administrar ICG. Se ha descrito que la AF puede llegar a tener un 96-98% de eficacia para la identificación de las paratiroides39–40. En caso de utilizar ICG, la mayoría de los autores recomiendan una dosis de 5mg por vía endovenosa, la mayoría posteriormente a movilizar la tiroides. Sin embargo, parece ser que la combinación de la AF con la administración del ICG ha demostrado hasta ahora ser bastante fiable por su sensibilidad que ronda entre el 84-100%39–40.
Identificación de uréteresLa lesión iatrogénica del uréter durante la cirugía colorrectal o una cirugía pélvica es una complicación que asocia un incremento de la estancia en el hospital, costes asociados al proceso y de la morbimortalidad a corto y largo plazo41. La incidencia de lesión ureteral durante una cirugía pélvica se cifra en torno a un 2%, con un rango entre 1 y 10%, siendo detectada en un 80% de los casos tras el procedimiento41–43. Se recomienda la identificación y visualización del uréter durante una cirugía pélvica con el fin de evitar dicha lesión. Si embargo, las adherencias, la obesidad o un plano de disección erróneo pueden contribuir a una incorrecta o no identificación del uréter44–45. Por este motivo, se utiliza la tutorización mediante catéteres de los uréteres en procedimientos seleccionados donde se prevé un elevado riesgo de lesión ureteral. Sin embargo, la utilidad que puede tener la colocación de un stent ureteral en la cirugía abierta donde se puede reconocer el trayecto del mismo por palpación, no parece igualmente aplicable para la identificación del uréter durante un procedimiento mínimamente invasivo, dada la ausencia de sensación táctil adecuada con los instrumentos laparoscópicos y robóticos46–47. Por ese motivo, se han introducido los catéteres ureterales iluminados que, si bien, ayudan a localizar visualmente el trayecto del uréter, tienen los mismos efectos adversos que los tutores comunes. Los resultados publicados acerca de la colocación de catéteres ureterales no muestran una reducción de las lesiones ureterales iatrogénicas durante la intervención, además de prolongar el tiempo quirúrgico por la dificultad que supone en algunos casos42–43. Además, cabe resaltar que la colocación de un tutor ureteral no es una acción inocua, ya que puede desarrollar complicaciones como infección del tracto urinario por la manipulación, hematuria, lesiones renales, obstrucción ureteral transitoria y, ocasionalmente, lesiones uretrales. La mayoría de estas complicaciones son transitorias y reversibles, pero aumentan la morbilidad y el costo sanitario del proceso45,47.
En este sentido, una de las posibles aplicaciones del ICG descrita es la identificación del uréter mediante este fluoróforo. Para ello, previo a la cirugía, se realiza una cistoscopia identificando el meato ureteral que deseamos, se cateteriza el mismo y se procede a la inyección retrógrada de una dilución de ICG. La unión de esta sustancia a las proteínas del epitelio ureteral permite que posteriormente se identifique el trayecto del uréter mediante el uso de un sistema de fluorescencia de imagen. La dilución utilizada varía según los distintos autores43,45,47,48. Varios estudios demuestran que la instilación de ICG ureteral es segura y ayuda a la identificación de este durante las intervenciones a nivel pélvico con una tasa muy elevada de localización del mismo42,43,45–48. En la serie de 16 casos de White et al., la tasa de éxito de localización ureteral es del 94% (15/16)47, Rodríguez-Zentner et al. logran la identificación del uréter en los 30 casos laparoscópicos realizados, sin lesiones ureterales43, mientras que Soriano et al. muestran una tasa de identificación del uréter derecho en el 97% y del izquierdo en el 100% de los 83 procedimientos robóticos recogidos48.
Existen diferentes métodos descritos para la inyección de la sustancia fluorescente, desde la simple inyección una vez tutorizado 1cm el uréter hasta grupos que canalizan 20cm o dejan puesto el catéter. El tiempo medio de instilación por cistoscopia es corto: 11,5min (rango 4-21) para White et al. 47 y 22,4min para Rodríguez-Zentner et al.43. La serie de Soriano et al, que compara la simple instilación del ICG con la colocación de un stent, evidencia un menor tiempo en los pacientes en los que no se coloca tutor, 4min (rango 3-8) vs. 13,5min, (rango 10-21,5min), p<0,00148. La simple instilación del ICG en el uréter sin cateterizarlo por completo es suficiente para la identificación del mismo y evita algunas de las complicaciones que conlleva este procedimiento, como demuestran Soriano et al., con una menor tasa de lesiones renales agudas y de hematuria48.
Con vistas a futuro, si se pudiera emplear una molécula con características físicas similares al ICG para ser detectada en imagen en tiempo real y cuya eliminación fuese vía renal, sería más fácilmente utilizable e implantable esta innovación puesto que sería un procedimiento más rápido y evitaría la manipulación de la vía urinaria. En este sentido, nuevos colorantes fluorescentes intravenosos con aclaramiento renal, como la fluoresceína sódica49 y el IRDye® 800-BK (LI-COR Biosciences)50, se han utilizado en modelos experimentales para probar la penetración de la fluorescencia en los uréteres, con resultados prometedores para la práctica quirúrgica. Por otro lado, la formulación liposomal del ICG permite su excreción en la orina en modelos animales y puede suponer un desarrollo en este sentido, con el fluoróforo más popular actualmente51.
Por tanto, la inmunofluorescencia aplicada para la identificación ureteral intraoperatoria es segura y eficaz, mostrando buenos resultados con menores efectos secundarios que la tutorización con catéteres habituales. Las nuevas tecnologías en desarrollo con fluorescentes intravenosos permitirían resultados similares evitando la manipulación urológica para su utilización.
Identificación de tumoresTumores hepáticosLa eliminación hepática de la ICG permite la identificación de las lesiones hepáticas mediante fluorescencia52. El tejido hepático sano elimina el ICG en un plazo de dos horas, mientras el tejido tumoral lo podría retener por la compresión que se produce en los conductos biliares53,54. Además, los hepatocitos localizados en la zona de transición entre el tumor y el tejido sano no son capaces de excretar el colorante a los conductos biliares, por lo que, en el caso de las metástasis hepáticas, la fluorescencia se configura como un anillo alrededor de la lesión, mientras que el área de fluorescencia de un carcinoma hepatocelular es identificada dentro de la lesión55. El ICG puede ayudar a delimitar de una mejor forma los márgenes de resección, ya que en los estudios en los que se ha utilizado la ICG para planificar la resección hepática se consiguió visualizar claramente los márgenes de resección entre 89-100% de las cirugías54,55.
Existen dos vías de administración descritas, por vía endovenosa y por vía intraportal, siendo la primera la más utilizada.
Tumores pancreáticosLa aplicación de la fluorescencia con ICG ha sido utilizada en la identificación de tumores pancreáticos y, aunque en la actualidad no es empleada de manera rutinaria, parece que su uso en un futuro no muy lejano, es prometedor. En este sentido, se ha utilizado para comprobar la extirpación completa del mesopáncreas en el caso de las pancreaticoduodenectomías laparoscópicas, y dado que la extirpación total del margen retroperitoneal en este tipo de tumores es un importante factor pronóstico, podría tener un valor de suma importancia56. El tejido pancreático del proceso uncinado es difícil de diferenciar del tejido graso circundante, el cual rodea la arteria mesentérica superior (AMS) y de su plexo nervioso57–59. Al inyectar intraoperatoriamente el ICG por vía intravenosa, la fluorescencia inicial de la AMS desaparece mientras que se acumula gradualmente en el páncreas, lo que resulta un claro efecto de contraste entre el proceso uncinado y la AMS demarcando así dicho margen retroperitoneal58,59.
Tumores adrenalesLa identificación de las glándulas suprarrenales (GS), así como de sus límites anatómicos puede resultar difícil, por el hecho que están rodeadas de grasa retroperitoneal60–64. Con base en la diferencia en la perfusión entre las GS y los tejidos circundantes, dichas glándulas, y los diferentes tipos de tumores localizados en las mismas, pueden ser identificados60–64. Los tumores adrenocorticales son reconocidos fácilmente por la mayor fluorescencia, sin embargo, los tumores medulares (feocromocitomas) son hipofluorescentes.
Metástasis peritonealesLa detección preoperatoria de metástasis peritoneales con frecuencia es difícil con las técnicas de imagen de las que disponemos64–66. Un adecuado diagnóstico y estadificación son importantes para la elección de la mejor opción terapéutica65–66. La aplicación clínica de la fluorescencia con ICG en la carcinomatosis peritoneal debe reservarse a aquellos pacientes con índice de carcinomatosis menor a 8, ya que en pacientes en los que se ha diagnosticado de manera preoperatoria una amplia diseminación metastásica peritoneal, el valor de la fluorescencia es limitado66. El uso del ICG podría tener un futuro prometedor con un papel importante en este tipo de intervenciones, ya que podría ayudar a la toma de decisiones intraoperatoriamente.
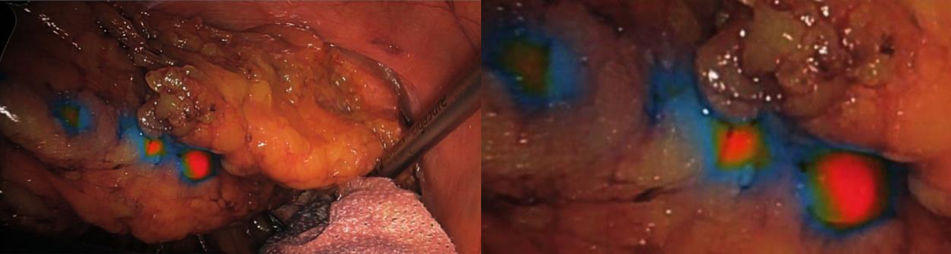
Uso de verde de indocianina para la identificación del ganglio centinela y mapeo linfáticoCirugía colorrectal - mapeo linfáticoEl uso de ICG en la detección intraoperatoria de ganglios linfáticos en cáncer colorrectal puede utilizarse tanto para detectar el ganglio centinela (GC) como para realizar un mapeo linfático durante la linfadenectomía67–74. Varios estudios han concluido que la fluorescencia con ICG proporciona información valiosa para detectar los ganglios linfáticos de drenaje en la cirugía colorrectal, siendo este aspecto especialmente importante, si estos ganglios no están presentes en la zona de disección habitual, lo que cambiaría la estrategia quirúrgica con esta información68,69. Por otro lado, el mapeo linfático intraoperatorio también puede ayudar a definir las vías de diseminación linfática en pacientes en los que haya que realizar una segunda intervención y en los que ya se ha resecado tejido linfático previamente68.
Por su parte, se ha observado que el ICG podría ser menos fiable en los pacientes con cáncer de recto intervenidos tras terapia neoadyuvante68, aunque podría tener un valor interesante en el mapeo de la pared lateral pélvica en el cáncer rectal bajo y medio, pudiendo guiar la linfadenectomía extendida en pacientes en los que esté indicado, y podría ayudar a disminuir la morbilidad de una disección lateral de la pelvis70.
La inyección peritumoral de ICG puede realizarse de varias formas, se ha descrito por diferentes grupos la administración por colonoscopia previo al inicio de la intervención, la técnica más habitual es inyectar en los cuatro puntos cardinales alrededor del tumor67–72. En este sentido, también se ha administrado de la misma forma en neoplasias de recto medio-bajo por rectoscopia antes de la intervención para la identificación de adenopatías laterales pélvicas, lo que se puede realizar más cómodamente con una rectoscopia al inicio de la intervención70–72. En una línea diferente, el ICG puede administrarse con una inyección subserosa peritumoral al inicio de la intervención por vía laparoscópica, con una adecuada identificación del drenaje linfático al GC y permitiendo, asimismo, ver el mapeo linfático correspondiente a la zona de drenaje del tumor73,74. Parece ser que no existen diferencias en cuanto a la forma de administración67–74. En cuanto a la dosis, algunos grupos expertos recomiendan una dosis estándar de dos habones a una concentración de 3cm3 con 15mg de ICG con la diferencia de que, si es en el colon, sería en la submucosa al inicio de la intervención y si es en el recto medio-alto, 12 -24 horas antes en la submucosa. En el caso del recto bajo deberá ser al principio de la cirugía con anuscopio29 (fig. 3).
Cirugía de esófago - mapeo linfáticoEl cáncer de esófago se disemina de una forma multidireccional a través de linfáticos de la submucosa a las estaciones linfáticas regionales, siendo las metástasis linfáticas uno de los factores pronósticos más importantes, por lo que es necesaria la realización de una linfadenectomía extensa para mejorar el pronóstico75–78. La fluorescencia con ICG en la linfadenectomía del cáncer de esófago es descrita en varios estudios clínicos. Se realiza la administración del ICG en la submucosa esofágica en los cuatro cuadrantes del tumor, por vía endoscópica o transmural, siendo visibles las adenopatías entre 15-30 minutos tras la inyección75–78. Se ha señalado como hipótesis que la albúmina podría ser preferible al agua destilada para efectuar la dilución del ICG, ya que incrementa el tiempo de retención del colorante en los ganglios de drenaje, tiempo necesario para la esofagectomía y linfadenectomía, evitando así que las adenopatías afectas no fueran identificadas en su totalidad76. Hachey et al. señalaron la superioridad de este procedimiento de dilución con albúmina en el caso del cáncer de esófago debido a la escasa retención del ICG en los ganglios con el agua destilada76. Yuasa et al. demostraron la detección con este sistema del 95% de los ganglios afectos, lo que es muy útil para evitar las linfadenectomías extensas que conllevan una elevada morbilidad77. En cuanto a la dosis, 1,25mg/mL en la submucosa en los cuatro cuadrantes y 0,5cm3 peritumoral mediante endoscopia entre 12-24 horas antes de la intervención29.
Cirugía de estómago - ganglio centinela y mapeo linfáticoEntre los estudios publicados en relación con la identificación del GC mediante fluorescencia con ICG en estos tumores, se reportan tasas de identificación de los mismos de entre 90 y 100%, sin embargo, esta tasa se reduce al 0 en caso de tumores T479. Bok et al. demostraron la utilidad del ICG para detectar el GC por vía laparoscópica en tumores T1N0M0, donde el tratamiento estándar había sido la resección submucosa endoscópica, lo que crea nuevas y amplias oportunidades para el uso clínico de la fluorescencia en la identificación del GC en estos estados iniciales y garantizar que no se «escape» algún paciente con adenopatías positivas79. Este trabajo describe el cambio de actitud con base en los resultados del estudio intraoperatorio de GC como tal, ya que, en dependencia del resultado de los cortes obtenidos intraoperatoriamente, se cambió de una resección submucosa a una gastrectomía con linfadenectomía D2, lo que sucedió en uno de los 13 pacientes incluidos en este estudio, en el que se detectó la presencia de células tumorales en uno de los GC resecados79.
En cuanto al mapeo linfático, La mayoría de los trabajos hablan únicamente del mapeo linfático guiado por fluorescencia con ICG de forma descriptiva, ya que en realidad no se modifica la estrategia quirúrgica planificada inicialmente80–90. En relación con la vía de administración y el momento de realizarla se han descrito varias formas, algunos grupos administran por endoscopia en cuatro puntos cardinales peritumorales a nivel submucoso un día antes de la intervención, mientras otros grupos optan por hacerlo por endoscopia, también con inyección submucosa al inicio de la intervención80–90. También se ha descrito la administración por laparoscopia, peritumoral en la capa subserosa al inicio de la intervención80–88.
En uno de los pocos estudios realizados en nuestro medio, Senent et al. describen una serie de 142 pacientes con adenocarcinoma gástrico que fueron sometidos a gastrectomía laparoscópica en un hospital español entre enero de 2017 y diciembre de 2022. De ellos, 42 pacientes recibieron inyección preoperatoria de ICG para guiar la linfadenectomía. Sus resultados se compararon con una cohorte retrospectiva de 42 pacientes90, demostrando las ventajas del uso de esta tecnología. La viabilidad del mapeo linfático con ICG fue del 95,5%. No se observaron complicaciones asociadas a la inyección de ICG. El grupo con ICG tuvo un número significativamente mayor de ganglios linfáticos recuperados que el grupo sin ICG (32,67 vs. 25,14; p=0,013). En el 47,6% de las pacientes del grupo de ICG, la linfadenectomía se amplió fuera del área de disección D2 estándar en función de la captación de ICG90.
Todos los estudios concluyen que las imágenes de fluorescencia de ICG permiten fácilmente tener una alta sensibilidad e imágenes guiadas en tiempo real para la identificación de GC y determinar el mapeo linfático en el cáncer gástrico81–90. En cuanto a la dosis, similar al esófago, 1,25mg/mL en la submucosa en los cuatro cuadrantes, 0,5cm3 peritumoral mediante endoscopia entre 12-24 horas antes de la intervención29.
Cirugía de mama - ganglio centinelaLa fluorescencia con ICG ha demostrado una elevada sensibilidad en la detección del GC en el cáncer de mama cuando se utiliza el ICG, lo que evitaría el uso de radioisótopos91–94. Por otra parte, existe un estudio en el que se valoró la detección del GC administrando 1,6mL de ICG unido a albúmina (ICG:albúmina sérica humana [HSA]). Esta combinación favorece que el ICG se una rápidamente al drenaje linfático y al GC cuando se inyecta por vía intravenosa, y que la mezcla previa de ICG:HSA mejore la cinética y aumente el brillo tres veces92.
Otro estudio realizado en 202 pacientes en estadios IIA que fueron intervenidos de cirugía conservadora de mama, realizó una comparación entre un grupo al que se identificó el GC con ICG y otro grupo utilizando una combinación de ICG más colorante azul de índigo carmín94. La combinación entre el colorante e ICG resultó con una tasa de detección del GC significativamente más alta (96,4 vs. 83,7%). Por lo tanto, concluyen ambos estudios que la terapia combinada incluyendo ICG podría ser un método factible y seguro para la identificación del GC93–94.
Cirugía de melanoma - mapeo linfáticoLa fluorescencia con ICG puede ser útil también para el mapeo linfático en caso de melanoma95. La dosis de ICG habitualmente utilizada en el melanoma es de 2mL, a una concentración de 0,25mg/mL. Con la administración antes de la cirugía de 2mL de ICG (2,5mg/mL), se ha conseguido una tasa de detección de ganglios del 80% con ICG 95.
Avances y necesidades del uso de fluorescencia con verde de indocianinaLa valoración de la AF-ICG en el NIR ha demostrado su utilidad en la prevención de fugas anastomóticas. Sin embargo, la interpretación visual subjetiva de la señal de perfusión por parte del cirujano puede limitar la validez y estandarización de la técnica.
Cuantificación del verde de indocianinaLas intervenciones quirúrgicas en las que se reseca parte del mesenterio pueden beneficiarse de las imágenes de AF-ICG con NIR. Sin embargo, la cuantificación de las imágenes de fluorescencia NIR es fundamental para la estandarización de la evaluación de la vascularización de los tejidos96–99.
En la práctica clínica habitual, el ICG se evalúa mediante una escala visual analógica, en función del aspecto del tejido y de la intensidad que proyecta el verde. Esta evaluación es muy útil, pero es subjetiva, no permitiendo realizar una medición objetiva o independiente del grado de vascularización, lo que podría llevar a una variabilidad de la técnica y dificultar que pueda estandarizarse.
En este sentido, la mayoría de los estudios se enfocan en observar y analizar los diferentes sitios de interés (ROI), para valorar la intensidad del ICG en relación al tiempo de administración del mismo96–100.
Faber et al., publicaron un estudio en el que grabaron vídeos con imágenes de fluorescencia estándar. Posteriormente, se cuantificaron los vídeos de fluorescencia dibujando ROI contiguos en el intestino. Para cada ROI, se trazó una curva tiempo-intensidad a partir de la cual se analizaron los parámetros de perfusión. Además, se evaluó la concordancia interobservador de la percepción subjetiva de fluorescencia del cirujano. Se incluyeron en el estudio 20 pacientes sometidos a cirugía colorrectal. A partir de las curvas tiempo-intensidad, se identificaron tres patrones de perfusión de AF-ICG diferentes. La concordancia interobservadores fue escasa-moderada96. Este estudio demostró que la cuantificación de la AF-ICG es un método factible para diferenciar entre distintos patrones de perfusión. Además, la escasa-moderada concordancia de la lectura subjetiva de AF-ICG interobservadores hace aún más evidente la necesidad de una cuantificación objetiva mediante sistemas integrados96.
Recientemente Nijssen et al., han publicado un estudio en el que buscaban medir la concordancia en la valoración de AF-ICG entre dos softwares de cuantificación desarrollados de forma independiente. Este análisis retrospectivo incluyó grabaciones de ICG-FA estándar de pacientes sometidos a esofagectomía con reconstrucción del conducto gástrico entre agosto de 2020 y febrero de 2022. Las grabaciones se analizaron mediante dos programas informáticos de cuantificación: AMS y CPH (Python Software Foundation). Se incluyeron en el estudio 70 registros de ICG-FA previos a la anastomosis97. El análisis de Bland-Altman indicó una media de diferencia relativa de+58,2% en la medición al comparar el software AMS con el CPH. Ninguna de las dos mediciones tuvo relación significativa con la tasa de FA97. Este es el primer estudio que ha demostrado diferencias técnicas en las aplicaciones informáticas que pueden dar lugar a discrepancias en la cuantificación de ICG-FA en casos clínicos. La posible variación entre los métodos de cuantificación realizados por softwares debe tenerse en cuenta al interpretar estudios que informan de parámetros cuantitativos de AF-ICG y los parámetros obtenidos, ya que puede existir una validez externa limitada97.
En una revisión- sistemática, Pollman et al., después de una búsqueda que incluía la cuantificación de ICG entre otros criterios, se incluyeron 61 estudios. Las principales categorías de cuantificación de ICG fueron cirugía esofágica (24,6%), cirugía reconstructiva (24,6%) y cirugía colorrectal (21,3%). La principal variable de interés fue la FA (41%), seguida de la evaluación de la perfusión del colgajo (23%) y la identificación de estructuras y órganos (14,8%). El análisis se realizó principalmente mediante software «de fabricante» (44,3%) y de «uso libre» (15,6%). El parámetro analizado con más frecuencia fue la intensidad de la AF-ICG a lo largo del tiempo, seguido de la intensidad por sí sola o la relación intensidad/fondo para la identificación de estructuras y órganos. La cuantificación intraoperatoria de ICG podría adquirir mayor importancia con el creciente impacto de la cirugía robótica y los algoritmos de aprendizaje automatizado para el análisis de imágenes y vídeos100.
Por lo tanto, es imprescindible el desarrollo y mejora en el área de cuantificación de AF-CG de los sistemas integrados que se empiezan a utilizar en los sistemas de NIR que se incluyen en los equipos de ópticas y vídeo que se usan para la cirugía mínimamente invasiva con la intención de estandarizar los criterios para la medición y facilitar su uso rutinario y que sean más reproducibles.
Criterios clínicos del uso del verde de indocianinaExisten varios criterios que se deberían de tener en cuenta al utilizar la fluorescencia de ICG de forma sistemática tales como, en qué momento de la llegada del colorante a los tejidos dar más valor clínico, qué factores podrían alterar o retrasar la llegada del ICG o a qué distancia de los tejidos se debería colocar el sistema de la óptica durante una intervención quirúrgica.
En un estudio experimental Diana et al., concluyen que con el sistema fluorescence-based enhanced reality (FLER) el momento en el que tiene más importancia es la primera llegada del ICG, al delimitar una línea de isquemia o una posible línea de sección de cara a una anastomosis101. Por otro lado, Serra-Aracil et al., publican un estudio observacional prospectivo en pacientes sometidos a cirugía colorrectal laparoscópica electiva. Se comprobó el tiempo óptimo para el análisis con ICG en una muestra de 20 pacientes y la distancia óptima en 10 pacientes. Se administró ICG por vía intravenosa y se cuantificó la vascularización del colon mediante SERGREEN. Observaron que la intensidad de la fluorescencia tiene un pico alrededor de 1,5 min y que la saturación del ICG es inversamente proporcional a la distancia entre la cámara y el tejido. Concluyen que el tiempo óptimo para determinar ICG en el colon es entre 1,5 y 3,5min, tanto en el colon derecho como en el izquierdo. La distancia óptima es de 5cm. Esta información facilitará el poder establecer parámetros de comparación en situaciones normales y patológicas102.
Es importante tener en cuenta que existen varios factores, tales como procesos inflamatorios y la obesidad, que pueden hacer que no se visualice adecuadamente el ICG al momento de intentar identificar estructuras anatómicas o al realizar un mapeo linfático; teniendo como ejemplo una colecistitis en un paciente obeso, en la que puede ser más difícil identificar las estructuras biliares5,31,103. También se debe de ser cautos cuando se repite la dosis de ICG en poco tiempo, ya que podría acumularse y se ha observado un comportamiento fotodinámico distinto en estas situaciones100,103.
Autofluorescencia y futuras utilizaciones de la fluorescencia sin trazadoresIdentificación de estructuras basado en ondas de luz sin trazadoresLa AF es un caso particular del fenómeno de fluorescencia. Cuando se habla de dicho fenómeno se hace referencia a la capacidad intrínseca que tienen algunos compuestos naturales de los tejidos biológicos y que consiste en la emisión de una luz en el espectro de longitudes de onda comprendidas entre los 500 y 700nm bajo la influencia de luces con longitudes de onda más cortas. Numerosos estudios, explican cómo en los tejidos biológicos encontramos moléculas que, cuando un tejido se encuentra sano, tienen unos patrones de concentración estándar104. Por tanto, sabiendo cuáles son esas concentraciones y sabiendo cómo responden dichas sustancias bajo la presencia de una luz que las excite, podemos detectar cambios en la concentración de estas. Algunos de los ejemplos según el tejido en el que se encuentran son los siguientes.
- •
La piel: la disminución de la fluorescencia en los melanomas resulta el producto del aumento del colágeno y la hiperpigmentación del tejido bajo una luz de excitación de 335nm. Esto puede ser muy útil y eficaz en la detección temprana de alteraciones melanocíticas105.
- •
Los bronquios: gracias a la combinación de la auto fluorescencia emitida en el rango rojo y verde del espectro electromagnético, proporciona alta sensibilidad en la detección de las lesiones neoplásicas intraepiteliales106.
- •
Cirugía del tracto digestivo: la utilidad de la auto fluorescencia en la cirugía de colon bajo combinación de imágenes tomadas con luces de excitación de 330, 370 y 430nm. Se permite la diferenciación sensible de pólipos adenomatosos e hiperplásicos del tejido normal de colon107.
- •
De igual forma, podemos encontrar utilidad en el tejido neoplásico mamario108, el cerebro109, en la boca y la laringe se ha observado que tanto las caries como la mucosa bucal responde ante iluminación azul110.
- •
El uso de la AF del fondo de ojo en el diagnóstico de desprendimientos y glaucomas retinianos se ha incrementado de forma considerable en los últimos años111.
- •
Otra de las utilidades más novedosas, es la localización precisa de los nervios en el acto operatorio.
La identificación de los nervios es de gran importancia tanto en la cirugía como en la anestesia regional. Las técnicas de base óptica pueden identificar el tejido a través de diferencias en las propiedades ópticas, como la absorción y la dispersión de la onda espectral.
En el trabajo de Langhout et al., evaluaron el potencial de la espectroscopia óptica (espectroscopia de reflectancia difusa [DRS]) para la identificación clínica de los nervios in vivo. Se incluyeron 18 pacientes sometidos a una resección de los ganglios linfáticos inguinales o a un tumor de tejido blando en la ingle, para medir el nervio femoral o ciático y los tejidos circundantes. Se realizaron mediciones ópticas in vivo utilizando espectroscopia de reflexión difusa (400-1.600nm) en el nervio, el tejido adiposo cercano al nervio, el músculo y la grasa subcutánea. Los parámetros de contenido de agua y grasa mostraron diferencias significativas (p <0,005) entre el nervio y todos los tejidos circundantes112.
Las lesiones nerviosas iatrogénicas contribuyen significativamente a la morbilidad posoperatoria y ocurren más frecuentemente de lo que desearíamos. Actualmente, no hay medios clínicamente adoptados para visualizar los nervios intraoperatoriamente más allá de la evaluación visual del cirujano. Por lo tanto, los esfuerzos recientes se han centrado en visualizar los nervios dentro del campo quirúrgico para ayudar a prevenir por completo el daño de los mismos. En el año 2023, Throckmorton et al. proponen el uso de la DRS para la detección y visualización intraoperatoria de los nervios113. Inicialmente se identificaron las longitudes de onda óptima para la discriminación nerviosa mediante la preparación del nervio ciático de rata in vivo, posteriormente se validó la DRS basada en imágenes para la visualización de los nervios a través de imágenes hiperespectrales, posteriormente se determinaron las fuentes de contraste en longitudes de onda identificadas y se verificó la selección de longitud de onda en sujetos humanos mediante DRS basada en sonda. Finalmente, se validaron las imágenes espectrales ratiométricas para mejorar la visualización intraoperatoria de los nervios113.
En general, se trata de un campo pendiente expansión. Un ejemplo de ello es la aplicación en la cirugía endocrina para la localización del nervio laríngeo recurrente después de la tiroidectomía. Se ha podido observar que la aplicación en este procedimiento es 100% sensible y específica, según un trabajo muy reciente de Dip et al. un estudio prospectivo en el que se incluyeron 65 pacientes sometidos a tiroidectomía114. Se seleccionaron 30 pares al azar de imágenes de luz blanca y fluorescente y fueron revisados de forma independiente por dos examinadores para comparar la tasa de detección de NLR, el número de ramas y la longitud y el ancho mínimo de los nervios visualizados. Y concluyen que, en 65 pacientes y 81 nervios, la detección del NLR se mejoró de manera marcada y consistente con neuroimagen de AF durante la tiroidectomía, con una sensibilidad y especificidad del 100%114.
Nuevos trazadoresNuevos trazadores para la identificación de células tumoralesAlgunos estudios han demostrado que los trazadores fluorescentes similares al ICG se pueden etiquetar con anticuerpos creados artificialmente de marcadores tumorales de superficie celular115–117. Los agentes fluorescentes más avanzados para la localización de tumores se dividen en dos categorías: anticuerpos o ligandos para proteínas y receptores en superficies de las células cancerosas y sustratos para vías metabólicas específicas del cáncer116. Casi todos están etiquetados con ICG o uno de los tintes rojo cianina116. Los compuestos basados en ICG son muy atractivos porque pueden detectarse en muchos de los equipos de detección fluorescente disponibles actualmente en los quirófanos116. Con modificaciones menores, este equipo también puede detectar cianinas y otros colorantes con fluorescencia cercana al infrarrojo (NIRF)116.
Se han desarrollado anticuerpos prometedores contra el antígeno carcinoembrionario (CEA) para el cáncer colorrectal, de mama, de pulmón y gástrico, el antígeno prostático específico para el cáncer de próstata y el antígeno 125 para el cáncer de ovario115,116. Por ejemplo, XenoLight CF750, un anticuerpo anti-CEA conjugado con ICG y sonda NIR, pudo detectar depósitos de tumores peritoneales en las cuatro líneas celulares de cáncer gástrico, incluidas micrometástasis <2mm en modelos de ratón117.
La fluorescencia es más sensible que la visualización e identificación con luz normal en un entorno intraoperatorio117. Los estudios de fluorescencia informan la relación de contraste de la señal del tumor y la señal del tejido normal para cuantificar los resultados118. El marcado fluorescente de los tumores puede ayudar la visibilidad del margen tumoral y lograr la resección R0 e identificar lesiones metastásicas, con el objetivo final de conseguir menor tasa de recurrencia119,120. Además, la posibilidad de detectar enfermedad metastásica es fundamental para planificar el tratamiento quirúrgico más apropiado121. En este sentido, se han publicado artículos sobre el uso de trazadores con ICG o nanopartículas de carbón (NC) para detectar la invasión metastásica de ganglios linfáticos en el caso de tumores colorrectales o gástricos122–125. También se puede aplicar para el mapeo linfático en varios tipos de cáncer que presentan vías de drenaje aberrantes, que podrían derivar en recurrencia local cuando no se resecan122–125. La laparoscopia diagnóstica se utiliza a menudo para detectar enfermedad metastásica, que puede no detectarse inicialmente y provocar una resección innecesaria del tumor primario, por lo que el diagnóstico y el tratamiento del cáncer podrían mejorar enormemente si se detecta adecuadamente la extensión de la enfermedad con ayuda de esta tecnología117.
Estos trazadores aún no están muy extendidos en la práctica clínica, sin embargo, es necesario continuar en esa línea de investigación para que futuros estudios permitan mejorar la tasa de resección R0 y reducir la tasa de recurrencia y metástasis.
Alternativas a la fluorescencia – la imagen hiperespectralRecientemente la imagen hiperespectral (IH) ha sido desarrollada por su uso en cirugía como alternativa a la fluorescencia126. Esta modalidad de imágenes ópticas permite medir información de todo el espectro electromagnético126. Para aplicaciones médicas, el rango espectral más interesante e investigado abarca las longitudes de onda entre el visible y rango de infrarrojo cercano (p. ej., de 450 a 1.000nm)126.
La IH posee un gran potencial tanto en áreas diagnósticas como terapéuticas126. Por lo tanto, esta innovadora tecnología de imágenes espectrales puede encontrar aplicaciones potenciales en patología, histología y diagnóstico clínico126. Además, es una herramienta óptica prometedora para la cirugía guiada por imágenes127. Recientemente, diferentes líneas de investigación han utilizado tecnología microscópica hiperespectral para identificar diferencias de color y textura, clasificar tejido patológico sin etiquetas e implementar el diagnóstico de carcinoma con técnicas de «deep learning» o aprendizaje profundo128,129.
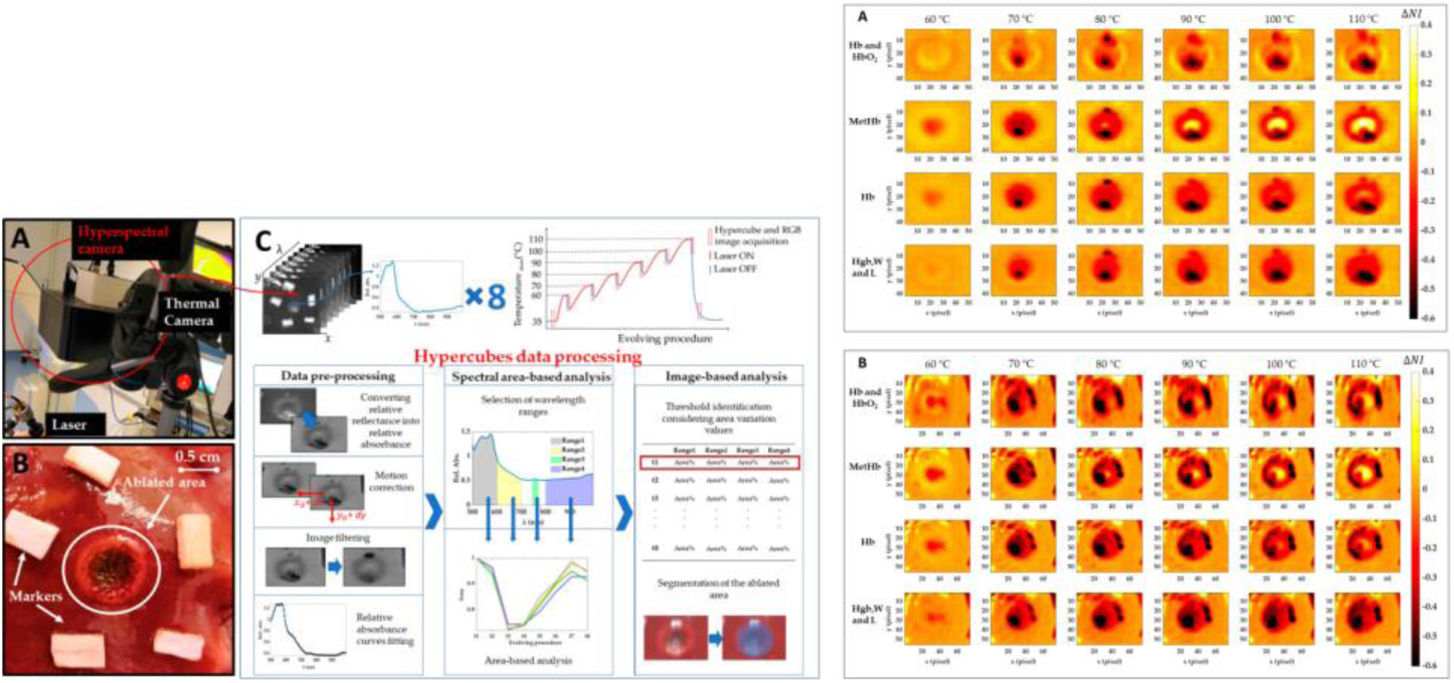
De hecho, se sabe que la forma en que una estructura biológica o un tejido interactúa con la luz puede revelar el estado en tiempo real de estructuras anatómicas, como la progresión de la enfermedad o el efecto de una terapia sistémica localizada126. La IH se basa en la AF de los cromóforos tisulares para cuantificar y realizar la absorción relativa de compuestos orgánicos endógenos, como la hemoglobina oxigenada y desoxigenada y los anticuerpos, en un amplio rango de longitudes de onda, proporcionando una evaluación intraoperatoria con un gran campo de visión130. Al interactuar con la luz, una estructura biológica sufre varios fenómenos, como la absorción y la dispersión126. La absorción se debe a la presencia natural de cromóforos en el tejido, como la hemoglobina y el agua, mientras que la dispersión es causada por una estructura no homogénea131. Por lo tanto, la luz reflejada y transmitida desde el medio lleva información de diagnóstico cuantitativa sobre el estado y el contenido del medio126. La IH es una herramienta no invasiva y sin contraste aplicada recientemente en varios centros médicos y campos de investigación básica131,132, al igual que otras nuevas tecnologías emergentes133,134. Se están investigando varios enfoques innovadores que exploran la capacidad de la IH para fuera del rango visible, como el reconocimiento de tejido intraoperatorio135, la guía terapéutica y la monitorización126,136,137 (fig. 4).
Montaje experimental de sistema láser, una cámara térmica que registra los valores de temperatura durante todo el procedimiento y una cámara hiperespectral. Detalle de una zona objetivo después del tratamiento136.
Variación normalizada de imagen hepática para los cuatro rangos espectrales peculiares. Las imágenes se obtienen con respecto a la condición inicial para dos pruebas y para los seis umbrales de temperatura136.
Un campo importante de aplicación de IH es la detección de cáncer y la biopsia in situ138,139, junto con la identificación de los límites del tumor para orientación quirúrgica140. Hoy en día, la afectación tumoral microscópica (R1) o macroscópica (R2) en los márgenes de resección quirúrgica representa el principal predictor de recurrencia local y acorta la tasa de supervivencia en diversos cánceres141–143. Además, la falta actual de sistemas de imágenes comerciales que puedan proporcionar una cuantificación intraoperatoria de anticuerpos marcados para lesiones cancerosas de poca profundidad hace que las imágenes hiperespectrales sean una de las herramientas más interesantes y clínicamente transferibles para probar126. Además, la IH puede ser utilizada para la obtención de imágenes cuantitativas de parámetros fisiológicos del tejido y la visualización de estructuras anatómicas. Otras aplicaciones en cirugía pueden ser para diferenciar el colon y su tejido mesentérico del tejido retroperitoneal, para obtener un correcto plano de disección y para cuantificación de isquemia intestinal identificando la oxigenación fisiológica del tejido, convirtiéndolo en una herramienta interesante para evaluar la perfusión de anastomosis en cirugía134,144.
Contribuciones de los autoresSalvador Morales-Conde: diseño del estudio, adquisición de datos, análisis e interpretación de resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Laura Navarro-Morales: diseño del estudio, adquisición de datos, análisis e interpretación de resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Francisco Moreno-Suero: diseño del estudio, adquisición de datos, análisis e interpretación de resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Andrea Balla: diseño del estudio, adquisición de datos, análisis e interpretación de resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
Eugenio Licardie: diseño del estudio, adquisición de datos, análisis e interpretación de resultados, preparación del manuscrito, revisión crítica y aprobación de la versión final del manuscrito.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.