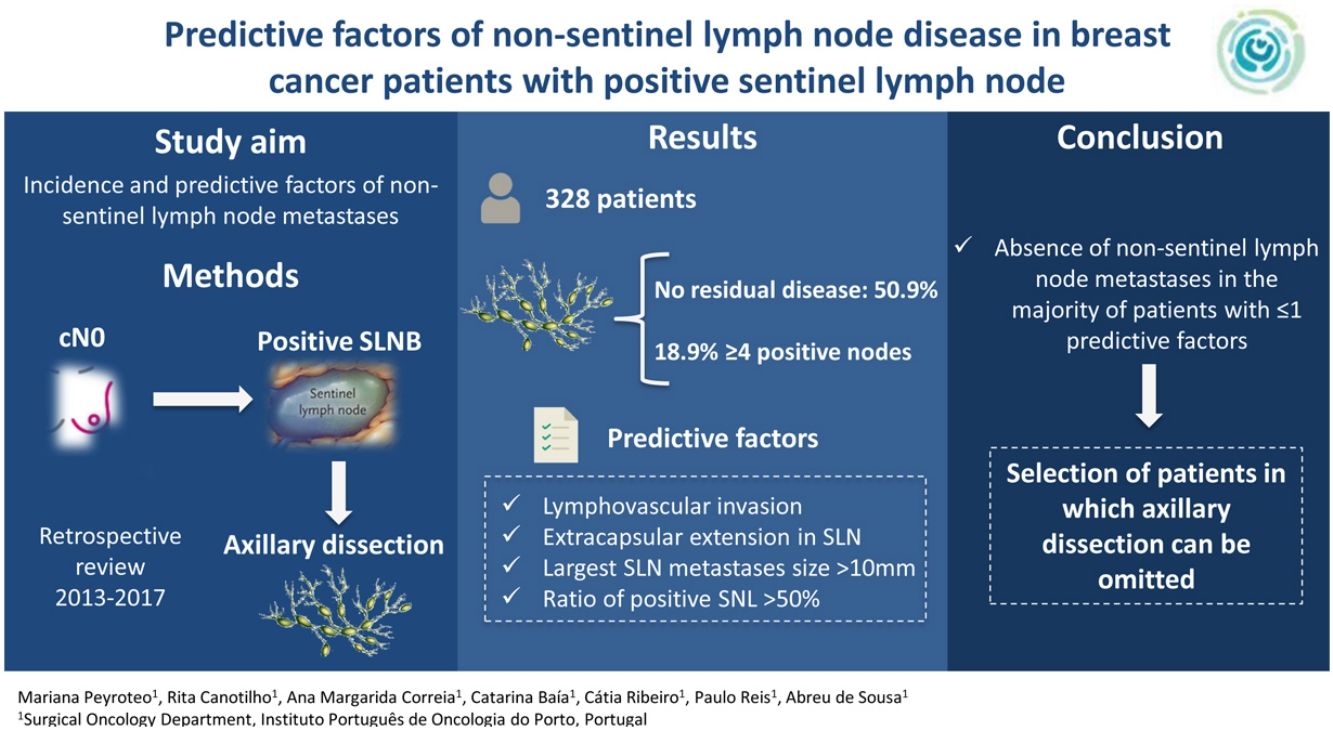
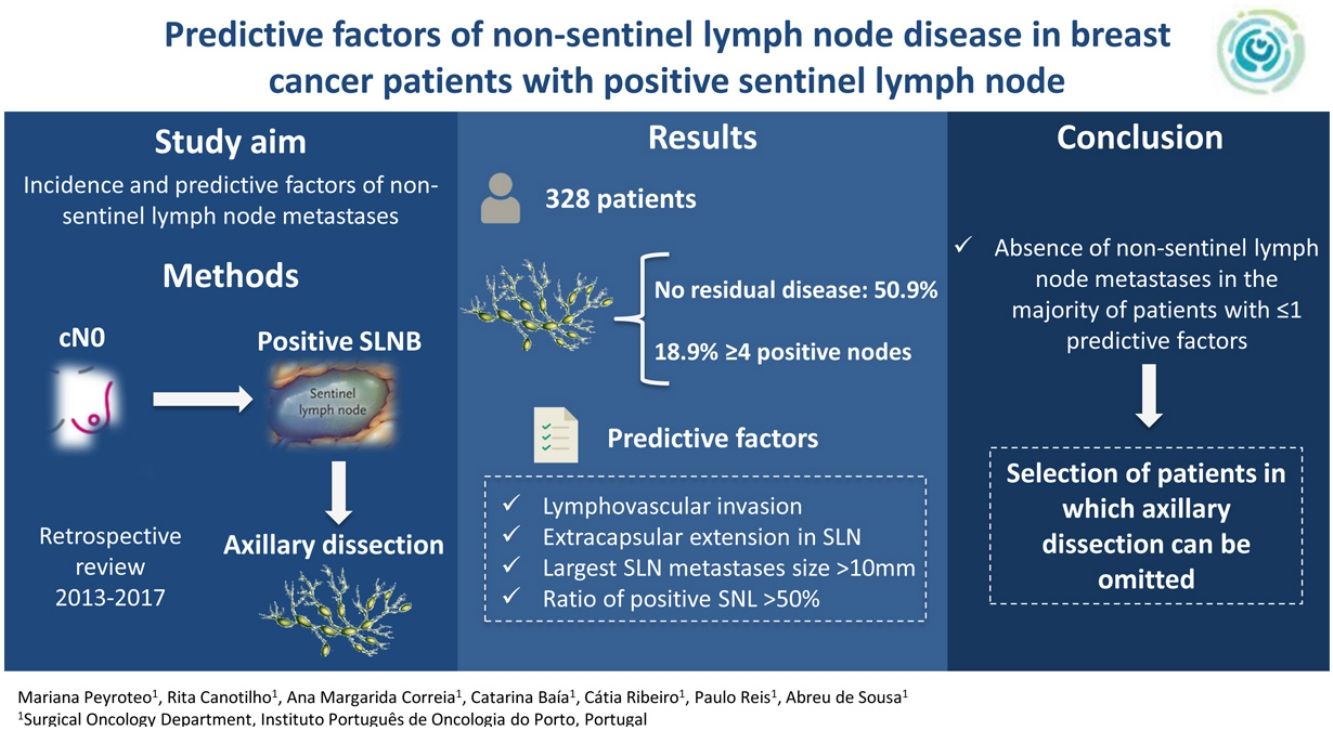
El manejo del ganglio centinela positivo en cáncer de mama sigue siendo un tema de debate. El objetivo es evaluar la incidencia e identificar los factores predictivos de metástasis en ganglios no centinela.
MétodosRevisión retrospectiva de los pacientes con cáncer de mama con axila clínicamente negativa (cN0) tratados entre enero del 2013 y diciembre del 2017, con biopsia de ganglio centinela (BGC) positiva a quienes se les realizó linfadenectomía axilar (LA).
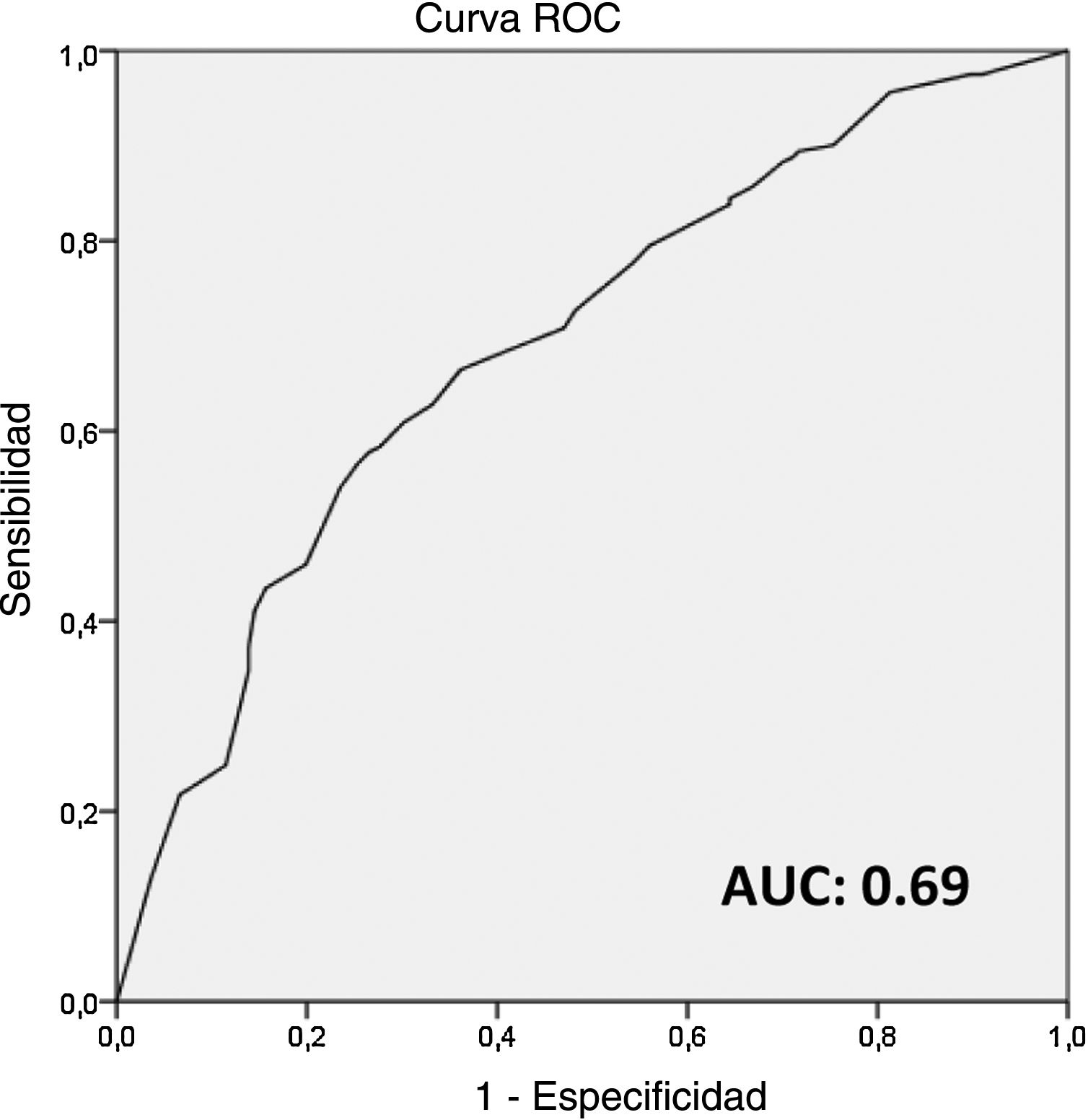
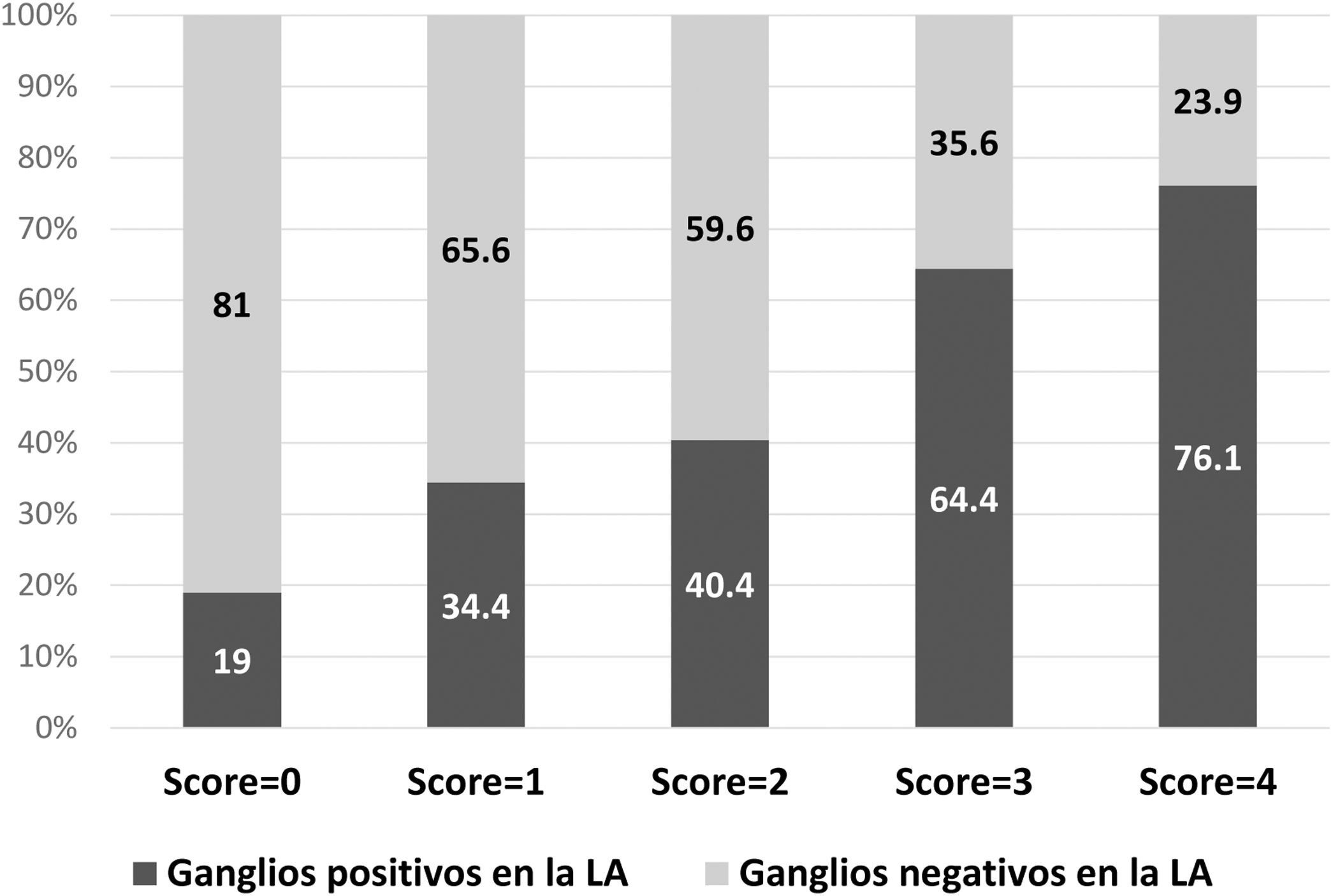
ResultadosDe los 328 pacientes incluidos, la mayoría tenía tumores cT1 o cT2, con invasión linfovascular en el 58,4% de casos. La media de ganglios detectados en BGC fue 2,7, con una media de 1,6 ganglios positivos, el 60,7% con extensión extracapsular. En LA, una media de 13,9 ganglios fueron detectados, con media de 2,1 ganglios positivos. No se observó metástasis en LA en el 50,9% de los pacientes y el 18,9% tenía ≥ cuatro ganglios positivos. En análisis multivariado, la invasión linfovascular, la extensión extracapsular, la dimensión de mayor metástasis (>10 mm) y la ratio de ganglios centinela positivos (> 50%) fueron factores predictivos independientes de metástasis en ganglios no centinela. Estos factores fueron usados para construir un score para predecir la posibilidad de LA positiva después de BGC positiva. El área bajo la curva ROC (AUC) del modelo fue 0,69 y el 81% de los pacientes con score = 0, y el 65,6% con score = 1 no tenían metástasis en la LA.
ConclusiónLa ausencia de metástasis en ganglios no centinela en la mayoría de los casos con uno a dos ganglios positivos en la BGC con score de bajo riesgo cuestiona la necesidad de hacer LA en estos pacientes. Los factores predictivos identificados pueden ayudar a seleccionar pacientes para omitir la LA.
Management of positive sentinel lymph node biopsy (SLNB) in breast cancer remains a matter of debate. Our aim was to evaluate the incidence and identify predictive factors of non-sentinel lymph node metastases.
MethodsRetrospective review of all cN0 breast cancer patients treated between January 2013 and December 2017, with positive SLNB that were submitted to ALND.
ResultsOf the 328 patients included, the majority of tumors were cT1 or cT2, with lymphovascular invasion in 58.4% of cases. The mean isolated nodes in SLNB was 2.7, with a mean of 1.6 positive nodes, 60.7% with extracapsular extension. Regarding ALND, a mean of 13.9 nodes were isolated, with a mean of 2.1 positive nodes. There was no residual disease in the ALND in 50.9% of patients, with 18.9% having ≥ four positive nodes. In the multivariate analysis, lymphovascular invasion, extracapsular extension in SLN, largest SLN metastases size (>10 mm) and ratio of positive SNL (> 50%) were independent predictors of non-sentinel lymph node metastases. These four factors were used to build a non-pondered score to predict the probability of a positive ALND after a positive SLNB. The AUC of the model was 0.69 and 81% of patients with score = 0 and 65.6% with score = 1 had no additional disease in ALND.
ConclusionThe absence of non-sentinel lymph node metastases in the majority of patients with 1-2 positive SLN with low risk score questions the need of ALND in this population. The identified predictive factors may help select patients in which ALND can be omitted.
La enfermedad de los ganglios linfáticos es un importante factor de pronóstico en el cáncer de mama. La biopsia de ganglio centinela (BGC) es, desde hace mucho tiempo, la técnica patrón firmada para determinar el estadio en los pacientes con axila clínicamente negativa (cN0)1–4. Sin embargo, el manejo de la BGC positiva sigue siendo un tema de debate, ya que hasta un 40 a 70% de los pacientes con esta misma no tienen otras metástasis en la linfadenectomía axilar (LA)1,5–11. Debido a la evolución de la técnica quirúrgica y al enfoque multidisciplinar del cáncer de mama, el beneficio potencial de la LA ha sido ampliamente cuestionado y existe un interés creciente en identificar a los pacientes en los que la LA puede ser descartada12.
Los tres principales estudios acerca del tema han demostrado la ausencia de impacto significativo en la sobrevida cuando no se hacía la LA en grupos seleccionados de pacientes con BGC positiva13–15 y por consecuencia, sobre todo después de las conclusiones del ACOSOG Z0011 trial, las recomendaciones sobre la LA en el contexto de cirugía conservadora de mama han cambiado, pero en el ámbito de la mastectomía total, la LA sigue siendo la cirugía patrón después de una BGC positiva16,17. Pese a estos resultados, sigue habiendo una controversia significativa sobre estos estudios relativa a la representación de los pacientes con tumores con características de alto riesgo18. Así, en el actual contexto de seleccionar progresivamente a menos pacientes para hacer LA, es muy importante definir los factores predictivos de metástasis en ganglios no centinela, para que se pueda realizar una selección más adecuada.
El objetivo es evaluar la incidencia e identificar los factores predictivos de metástasis en ganglios no centinela en pacientes con BGC positiva, así como construir un score que contribuya para ayudar a la decisión clínica.
MétodosRevisión retrospectiva de todos los pacientes con cáncer de mama con cN0, consecutivamente tratados en nuestra institución, entre enero del 2013 y diciembre del 2017. Todos los pacientes cN0 con una BGC positiva que han hecho LA han sido incluidos. Los pacientes con cáncer de mama estadio IV o recurrente, así como los sometidos a tratamiento neoadyuvante, fueron excluidos.
La BGC se realizó con el método dual tracer con inyección de azul patente y con isótopo radioactivo (tecnecio 99m). Todos los exámenes patológicos fueron hechos por patólogos de nuestra institución y todos los ganglios centinela fueron examinados por cortes seriados de 2 mm con hematoxilina-eosina. El análisis inmunoquímico se efectuó ocasionalmente. El examen extemporáneo no se llevó a cabo por rutina, puesto que el período del estudio incluye el mismo en el que fueron adoptados los criterios de ACOSOG Z001113 en nuestro departamento de oncología quirúrgica con abandono progresivo del examen extemporáneo.
Análisis estadísticoFueron recogidos los datos del preoperatorio, del procedimiento quirúrgico y del análisis anatomopatológico, y el análisis estadístico se realizó con la versión 21 de SPSS®, con un p < 0,05 considerado como estadísticamente significativo.
El análisis bivariante se llevó a cabo, primeramente, para examinar la asociación de potenciales factores predictivos (variables independientes) con el outcome de interés (variable dependiente), que aquí fue una LA positiva. Este análisis fue hecho con la prueba X2 o el test exacto de Fisher, de acuerdo con las variables. Las variables independientes analizadas fueron multifocalidad/multicentricidad, grado tumoral, tipo de tumor, subtipo biológico del tumor, tamaño del tumor (pT ≤ 2 cm/ > 2 cm), invasión linfovascular, extensión extracapsular en el ganglio centinela, tamaño medio de la mayor metástasis en el ganglio centinela (≤ 10 mm/ > 10 mm), número total de ganglios centinela positivos (> 1) y ratio de ganglios positivos para el número total de ganglios centinela (≤ 50%/ > 50%).
Posteriormente, se realizó el análisis multivariante, utilizando las variables estadísticamente significativas en el análisis univariado, con un modelo de regresión logística, reportando odds ratio e intervalos de confianza a 95%. Después de identificar los factores predictivos independientes con el análisis multivariado, se construyó un score no ponderado, con atribución de un punto por cada factor, para prever la probabilidad de una LA positiva después de una BGC positiva. El poder discriminativo del modelo fue evaluado con el area under the receiver operating curve (AUC), que varía entre cero y uno, siendo que uno indica poder discriminativo perfecto y 0,5 no es mejor que la determinación por suerte19.
ResultadosUn total de 328 pacientes fueron incluidos en el estudio, el 99,1% (n = 325) del género femenino. La edad media fue 57,3 años (rango 28 a 90).
Las características descriptivas del grupo de estudio se muestran en la tabla 1.
Características descriptivas del grupo de estudio
| Características | Valores |
|---|---|
| Edad, media (rango) | 57,3 (28-90) |
| Estadio clínico, n (%) | |
| cT1 | 159 (48,8%) |
| cT2 | 157 (48,2%) |
| cT3/4 | 10 (3%) |
| Multifocalidad/multicentricidad, n (%) | |
| Sí | 199 (60,7%) |
| No | 129 (39,3%) |
| Tipo histológico, n (%) | |
| Ductal | 242 (74%) |
| Lobular | 27 (8,3%) |
| Otros | 58 (17,7%) |
| Invasión linfovascular, n (%) | |
| Sí | 191 (58,4%) |
| No | 136 (41,6%) |
| Grado tumoral, n (%) | |
| 1 | 13 (4%) |
| 2 | 159 (48,6%) |
| 3 | 155 (47,4%) |
| Subtipo biológico, n (%) | |
| RH + /HER2- | 227 (72,1%) |
| HER2 + | 68 (21,6%) |
| Triple negativo | 20 (6,3%) |
| Cirugía de mama definitiva, n (%) | |
| Mastectomía total | 217 (66,2%) |
| Cirugía conservadora de mama | 111 (33,8%) |
| Quimioterapia adyuvante, n (%) | |
| Sí | 284 (86,6%) |
| No | 44 (13,4%) |
| Radioterapia adyuvante, n (%) | |
| Sí | 294 (89,6%) |
| No | 34 (10,4%) |
| GC extirpados, media (rango) | 2,7 (1-9) |
| GC metastatizados, media (rango) | 1,6 (1-5) |
| Extensión extracapsular, n (%) | |
| Sí | 199 (60,7%) |
| No | 129 (39,3%) |
| Tamaño de la mayor metástasis en el GC, mm, media (rango) | 11,1 (1-42) |
| LA positiva, n (%) | |
| Sí | 161 (49,1%) |
| No | 167 (50,9%) |
| ≥ 4 ganglios positivos en la LA | |
| Sí | 62 (18,9%) |
| No | 266 (81,1%) |
| Ganglios removidos en la LA, media (rango) | 13,9 (1-38) |
| Ganglios metastatizados en la LA, media (rango) | 2,1 (0-32) |
GC: ganglio centinela; LA: linfadenectomía axilar; RH: receptores hormonales
La mayoría de los tumores fueron de estadio cT1 (el 48,8%; n = 159) o cT2 (el 48,2%; n = 157) y el 60,7% (n = 199) fueron clasificados como multicéntricos o multifocales.
La cirugía de mama definitiva fue mastectomía en el 66,2% (n = 217) de los casos; la quimioterapia adyuvante se realizó en el 86,6% (n = 284) de los pacientes y la radioterapia adyuvante en el 89,6% (n = 294).
En cuanto a las variables histopatológicas, el 74% (n = 242) de los tumores fueron clasificados como ductales, con una mayoría de grado dos (el 48,6%; n = 159) o grado tres (el 47,4%; n = 155). El 58,4% (n = 191) de los tumores tenían invasión linfovascular. El subtipo biológico más frecuente fue receptores hormonales (RH) positivos/Her2 negativo en el 72,1% (n = 227) de los pacientes, seguido de Her2 positivo en el 21,6% (n = 68) y triple negativo en el 6,3% (n = 20).
Con relación a la BGC, la media de ganglios removidos fue de 2,7, con una media de 1,6 ganglios positivos. El 60,7% (n = 199) de los ganglios centinela tenían extensión extracapsular y la media de tamaño de la mayor metástasis en el ganglio centinela fue 11,1 mm. Considerando la LA, se detectó una media de 13,9 ganglios linfáticos, con una media de 2,1 ganglios positivos. Se observaron metástasis en la LA en el 49,1% (n = 161) de los pacientes y el 18,9% tenían ≥ cuatro ganglios positivos.
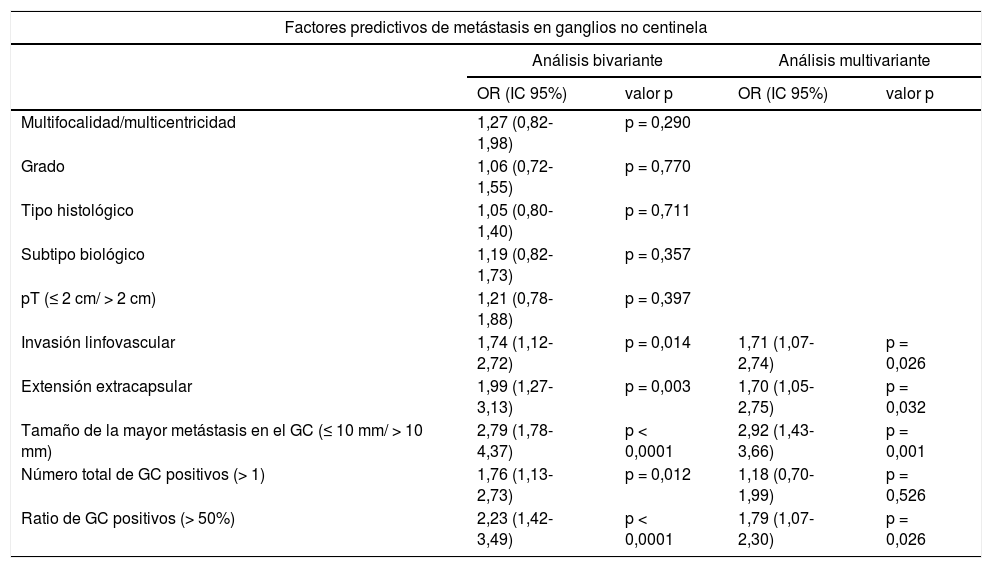
Los factores predictivos de metástasis en ganglios no centinela estadísticamente significativos en el análisis bivariante fueron la invasión linfovascular, la extensión extracapsular en el ganglio centinela, el tamaño de la mayor metástasis en el ganglio centinela (> 10 mm), el número total de ganglios centinela positivos (> 1) y la ratio de ganglios centinela positivos (> 50%) (tabla 2). En el análisis multivariante, todos los factores excepto el número total de ganglios centinela positivos fueron factores predictivos independientes de metástasis en ganglios no centinela (tabla 2).
Análisis bivariante y multivariante de factores predictivos de metástasis en ganglios no centinela
| Factores predictivos de metástasis en ganglios no centinela | ||||
|---|---|---|---|---|
| Análisis bivariante | Análisis multivariante | |||
| OR (IC 95%) | valor p | OR (IC 95%) | valor p | |
| Multifocalidad/multicentricidad | 1,27 (0,82-1,98) | p = 0,290 | ||
| Grado | 1,06 (0,72-1,55) | p = 0,770 | ||
| Tipo histológico | 1,05 (0,80-1,40) | p = 0,711 | ||
| Subtipo biológico | 1,19 (0,82-1,73) | p = 0,357 | ||
| pT (≤ 2 cm/ > 2 cm) | 1,21 (0,78-1,88) | p = 0,397 | ||
| Invasión linfovascular | 1,74 (1,12-2,72) | p = 0,014 | 1,71 (1,07-2,74) | p = 0,026 |
| Extensión extracapsular | 1,99 (1,27-3,13) | p = 0,003 | 1,70 (1,05-2,75) | p = 0,032 |
| Tamaño de la mayor metástasis en el GC (≤ 10 mm/ > 10 mm) | 2,79 (1,78-4,37) | p < 0,0001 | 2,92 (1,43-3,66) | p = 0,001 |
| Número total de GC positivos (> 1) | 1,76 (1,13-2,73) | p = 0,012 | 1,18 (0,70-1,99) | p = 0,526 |
| Ratio de GC positivos (> 50%) | 2,23 (1,42-3,49) | p < 0,0001 | 1,79 (1,07-2,30) | p = 0,026 |
IC: Intervalo de confianza; GC: ganglio centinela; OR: Odds ratio.
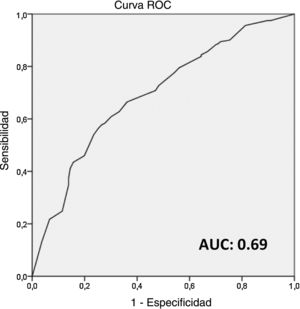
Estos cuatro factores independientes (invasión linfovascular, extensión extracapsular en el ganglio centinela, tamaño de la mayor metástasis en el ganglio centinela [> 10 mm] y la ratio de ganglios centinela positivos [> 50%]) fueron utilizados para construir un score no ponderado, con atribución de un punto por cada factor, para prever la probabilidad de una LA positiva después de una BGC positiva. La AUC del modelo fue 0,69 (fig. 1).
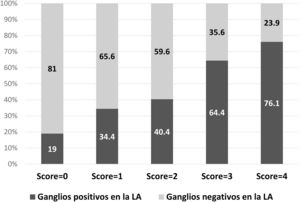
La probabilidad de una LA positiva de acuerdo con el modelo fue descrita en la figura 2. En el 81% de los pacientes con score = 0 y en el 65,6% con score = 1 no fueron detectadas metástasis adicionales en la LA.
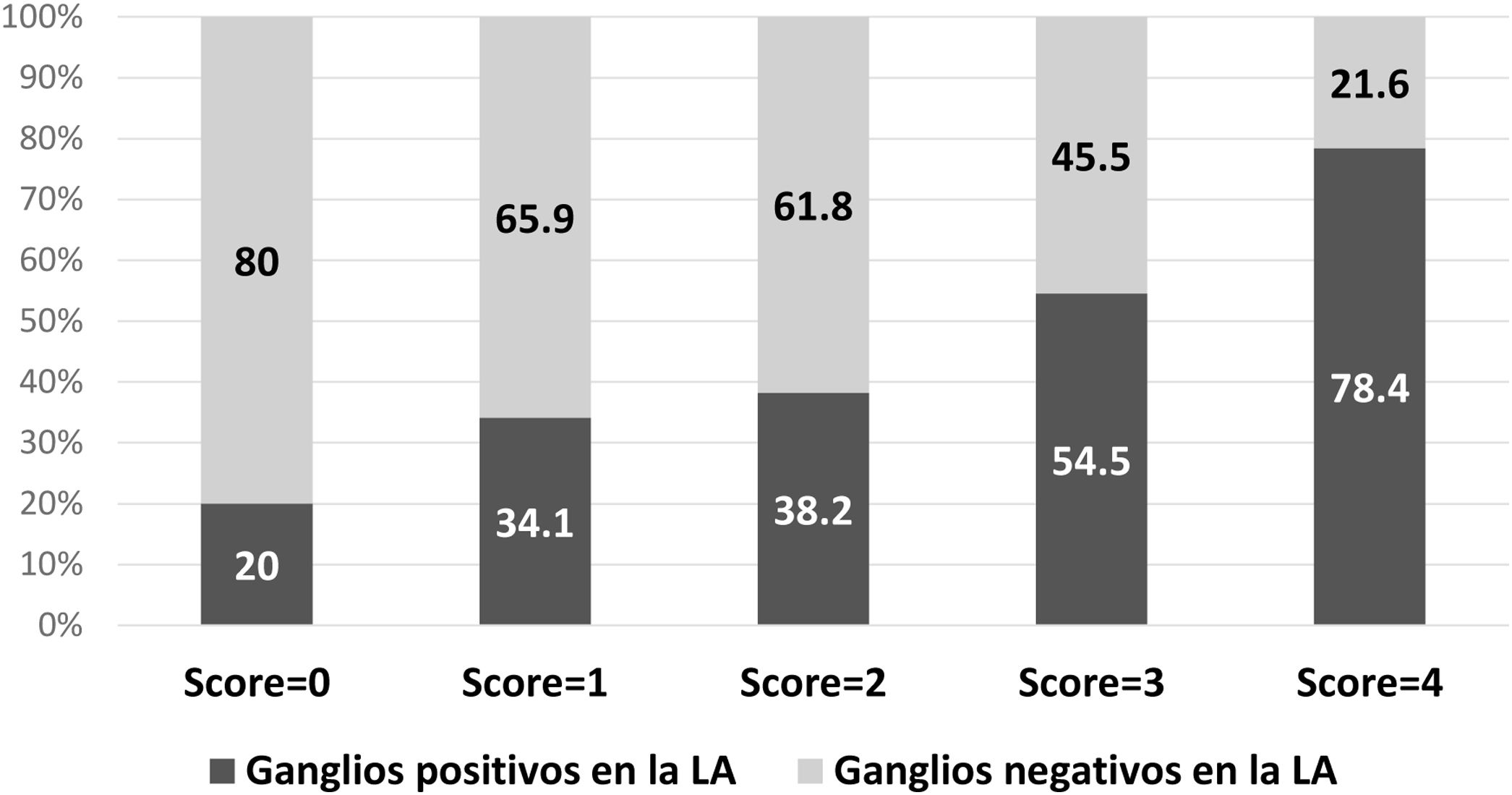
El mismo modelo se siguió aplicando solamente en los pacientes sometidos a mastectomía (n = 217), con una AUC de 0,68. La probabilidad de una LA positiva de acuerdo con el modelo se describe en la figura 3.
DiscusiónEl objetivo del estudio fue evaluar la incidencia de metástasis en los ganglios no centinela en pacientes con BGC positiva, así como identificar los factores predictivos de las referidas metástasis. No fueron detectadas metástasis en la LA en el 50,9% (n = 167) de los pacientes y solamente el 18,9% tenían ≥ cuatro ganglios positivos. Los factores predictivos independientes identificados fueron la invasión linfovascular, la extensión extracapsular en el ganglio centinela, el tamaño de la mayor metástasis en el ganglio centinela >10 mm y la ratio de ganglios centinela positivos > 50%. Con base en estos factores, se construyó un modelo predictivo en el cual el 81% de los pacientes con score = 0 y el 65,6% de los pacientes con score = 1 no tuvieron metástasis en la LA.
Múltiples estudios informaron previamente sobre la incidencia de metástasis en ganglios linfáticos no centinela, con un porcentaje variable entre el 17 y el 53%10,20. En los estudios más recientes, la incidencia fue del 27% en ACOSOG Z001113 y del 32% en AMAROS trial14. En nuestro estudio, fue detectado un porcentaje más alto de metástasis en ganglios no centinela (49,1%), que puede deberse al hecho de que existió una incidencia más grande de factores de alto riesgo, a saber, invasión linfovascular en el 58,4% de los pacientes y extensión extracapsular en el ganglio centinela en el 60,7%. Esto puede, además, depender de un posible sesgo de selección para la LA, con porcentajes más altos de estos factores de riesgo en este grupo, comparados con nuestra población global de pacientes. Por otro lado, incluso en estos casos altamente seleccionados por la LA, el 50,9% de ellos no tenían metástasis en ganglios no centinela, lo que claramente enfatiza la necesidad de tener criterios de selección más depurados.
A pesar de esta incidencia de metástasis en ganglios no centinela, el beneficio potencial en la sobrevida de la LA en grupos seleccionados no fue demostrado en estudios previos13,21–23. Por otra parte, varias investigaciones enfatizaron la morbilidad asociada con la LA cuando se comparó con la BGC, a saber, tasas más altas de linfedema, dolor en el brazo/hombro, quejas sensitivas y motoras en el miembro superior23–25. En nuestro grupo de estudio, el 89,6% de los pacientes fueron sometidos a radioterapia adyuvante (después de LA), lo cual levanta la cuestión de un doble tratamiento axilar, con beneficio oncológico dudoso y morbilidad acumulativa.
Estudios previos informaron sobre factores predictivos de metástasis en ganglios no centinela6,26,27 y se construyeron múltiples modelos predictivos 28. De los factores predictivos identificados en nuestro estudio, la ratio de ganglios positivos en la BGC, el tamaño de las metástasis en el ganglio centinela y la invasión linfovascular fueron previamente representados de alguna manera en la mayoría de los modelos predictivos8,29–32. A diferencia de los modelos mencionados, la extensión extracapsular en el ganglio centinela fue un factor predictivo independiente en nuestro grupo de estudio. La extensión extracapsular se define como el crecimiento de células tumorales a través de la cápsula del ganglio linfático y fue previamente propuesta como factor de mal pronóstico en el cáncer de mama33. La omisión de este factor en modelos predictivos previos puede relacionarse con la ausencia de inclusión consistente en los informes de anatomía patológica, así como la falta de una definición exacta de la extensión de la invasión, lo cual enfatiza la necesidad de estandarización del reporte de extensión extracapsular para facilitar más estudios así como como su inclusión en modelos futuros34.
Los nomogramas predictivos son esenciales para guiar la práctica clínica, por ejemplo, en los criterios de selección por LA, sobre todo en el contexto actual en el que progresivamente menos pacientes son sometidos a esta. A pesar de los varios modelos descritos28, su validación en poblaciones independientes no fue tan sencilla35–38, lo cual puede explicar la variedad de modelos disponibles y, al mismo tiempo, la ausencia de adopción de uno solo de forma universal. La falta de validación puede seguir relacionada con la variabilidad de la interpretación del concepto de ganglio centinela y del análisis patológico35 y los modelos se degradan cuando se aplican a poblaciones de pacientes diferentes29. Esto debería impulsar a las diferentes instituciones a construir un modelo con base en sus especificidades, que fue uno de nuestros objetivos en este estudio.
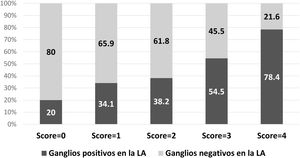
Hay que considerar especialmente a los pacientes sometidos a una mastectomía en este contexto, puesto que la LA sigue siendo la cirugía patrón después de una BGC positiva. En nuestro estudio, fue identificado un porcentaje alto de pacientes sometidos a mastectomía (66,2%). Este dato puede explicarse por diversos factores: primeramente, esta fue la cirugía definitiva y muchas de estas personas han tenido una o más tentativas de cirugía conservadora de mama previamente; además, fue detectado un alto porcentaje de tumores multifocales/multicéntricos (60,7%); por último, el período del estudio incluye el de transición de la adopción de los criterios del ACOSOG Z01113 en nuestro departamento y, por supuesto, muchos pacientes sometidos a cirugía conservadora de mama no realizaron la LA y no fueron incluidos en el estudio. A pesar de que la LA sigue siendo la cirugía patrón en estos casos, los estudios previos no informaron sobre una ventaja de sobrevida, con tasas de esta y de recidiva similares entre LA y BGC39,40. Además, aunque no hay estudios experimentales sobre este tema, principalmente debido a problemas en el reclutamiento de pacientes, la práctica clínica está cambiando y está favoreciendo la BGC en estos casos41. Cuando aplicamos nuestro score a las personas sometidas a mastectomía en nuestro grupo de estudio, el 80% de estas con score = 0 y 65,9% con score = 1 no tenían metástasis en ganglios no centinela, lo que enfatiza la necesidad del cambio de prácticas.
Por último, hay que mencionar las limitaciones de nuestro estudio, que es un análisis unicéntrico y retrospectivo. Además, existe un posible sesgo de selección ya que la adopción de los criterios de ACSOG Z001113 se hizo durante el período del estudio y tampoco se efectuó un análisis de sobrevida. Finalmente, el score construido debe ser validado prospectivamente en una población de pacientes independiente para evaluar su real poder predictivo.
En conclusión, a pesar de que nuestro grupo de estudio tenía un porcentaje alto de factores de riesgo, la mayoría de los pacientes no tenía metástasis adicionales en la LA después de una BGC positiva, sobre todo, los casos con score ≤ 1, lo cual cuestiona la necesidad y el beneficio oncológico de hacer la LA en estas personas. Los factores predictivos identificados pueden ayudar a seleccionar a los pacientes para omitir la LA después de una BGC positiva y el clínico puede incorporar esta información en la discusión de las ventajas y desventajas de la LA, para poder tomar una mejor decisión.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.