La afección ganglionar es, después de la metéstasis a distancia, el principal factor pronóstico en los pacientes con cáncer colorrectal. Además, condiciona la necesidad de tratamientos adyuvantes. Para determinar que un paciente se encuentra libre de enfermedad ganglionar, la mayoría de las asociaciones recomiendan analizar, al menos, 12 ganglios linfáticos. Se planteó en este trabajo la revisión de la literatura sobre el tema para valorar si 12 es el número mínimo y óptimo de ganglios que se debe analizar. La disparidad de resultados encontrados en la mayoría de los trabajos científicos orienta a que, probablemente, no haya un número óptimo de ganglios linfáticos que se debe analizar, sino que estará condicionado por múltiples factores. Por ello, obtener la mayor cantidad posible de ganglios parece una buena alternativa.
Metastasis to regional lymph nodes, after distant metastasis, is the most important prognostic factor of colorectal carcinomas. It is also of primary importance in decisions related to the administration of adjuvant treatments. Most scientific associations recommend the examination of at least 12 lymph nodes for the reliable determination of the absence of nodal metastases. We performed a literature review on lymph node recovery in order to determine whether 12 is the minimum and optimal number of lymph nodes to be examined after colorrectal cancer surgery. The differences between authors suggest that an optimal number of lymph nodes to be examined after colorectal cancer surgery probably does not exist and depends on many factors. Thus, recovering as many lymph nodes as possible seems to be a good option.
En nuestro medio, el cáncer colorrectal se encuentra entre los tres tumores malignos más frecuentes y, asimismo, representa una de las principales causas de muerte por cáncer1,2. De los múltiples factores que determinan el pronóstico de los pacientes con este cáncer, la afección ganglionar es, después de la metástasis a distancia, lo que se ha relacionado de una manera más directa con la supervivencia y el intervalo libre de enfermedad3–5. De hecho, la importancia de la afección ganglionar en el pronóstico es conocida desde hace décadas y este concepto ha formado parte de la mayoría de las clasificaciones a lo largo de la historia6,7.
Por otro lado, puede considerarse que, en el cáncer colorrectal, el análisis de los ganglios linfáticos regionales es el factor más importante para la toma de decisiones terapéuticas, al haberse demostrado, en repetidas ocasiones, el beneficio significativo de la quimioterapia en los pacientes con ganglios positivos4,8,9.
En este contexto, donde la afección ganglionar tiene implicaciones pronósticas y terapéuticas, la mayoría de las sociedades científicas recomiendan el análisis de, al menos, 12 ganglios linfáticos para poder asegurar que un paciente con ganglios negativos se encuentra realmente libre de enfermedad. Nos planteamos en este trabajo de revisión si esta cifra concreta de 12 ganglios linfáticos está realmente basada en la evidencia científica y si, por lo tanto, debe considerarse como un estándar mínimo en cirugía por cáncer colorrectal.
Importancia del número de ganglios analizados en la cirugía del cáncer colorrectalAl igual que sucede en otros cánceres como el de vejiga10, el de mama11 o el de pulmón12, el número de ganglios linfáticos analizados en el cáncer colorrectal, incluso siendo éstos negativos, se ha demostrado como un factor pronóstico independiente que se relaciona tanto con la supervivencia general como con el intervalo libre de enfermedad. Así, Caplin et al13, ya en 1998, demostraron que, en los pacientes con cáncer colorrectal en estadio II de la TNM, el estudio de 6 o menos ganglios linfáticos se asociaba con un peor pronóstico. Posteriormente, Burdy et al14 llegaron a una conclusión parecida, pero, en su caso, el número de ganglios que determinaban un peor pronóstico era 14. Otros estudios han sido constantes en demostrar que un mayor número de ganglios analizados se relaciona con un mejor pronóstico15–25.
Por otra parte, Johnson et al26 comprobaron también este fenómeno en los pacientes en estadio III (con, al menos, un ganglio positivo). Aunque no pudieron demostrar diferencias para los pacientes con estadio IIIA, sí que las observaron para los estadios IIIB y IIIC. El estudio de Le Voyer et al19 obtuvo similares resultados.
Por último, hay pruebas recientes de que la tasa de ganglios linfáticos (lymphatic nodes ratio, LNR), es decir, la proporción de ganglios linfáticos metastásicos entre los ganglios examinados, es también un factor pronóstico27, lo cual no es de extrañar si se tiene en cuenta que el LNR es el reflejo de dos factores con influencia en la supervivencia: el número de ganglios analizados y el número de ganglios positivos. Sin embargo, el LNR no es un buen factor pronóstico cuando se han obtenido menos de 10 ganglios linfáticos, por lo que este valor no debería compensar un número inadecuado de ganglios linfáticos. En estos casos, el factor pronóstico más importante seguiría siendo el número total de ganglios positivos19,27. Aunque Berger et al27 afirmaron que su trabajo era el primero en el que se aplicaba el LNR en pacientes con cáncer de colon, unos meses antes, Jestin et al22 utilizaron el mismo concepto, al que denominaron índice de metástasis (IM), y demostraron que cuando este índice es menor de 0,33, el pronóstico es significativamente mejor que cuando es mayor que 0,33 (p < 0,001). A pesar de estos datos favorables, la utilidad del LNR sigue siendo motivo de desacuerdo, ya que aunque parece lógico pensar que un mayor número de ganglios linfáticos analizados conllevaría mayor número de ganglios positivos, este hecho no ha sido confirmado de manera constante en la literatura médica. Diferentes estudios, llevados a cabo en instituciones únicas, demostraron que esta relación, efectivamente, existía5,15,21,28,29. Sin embargo, en estudios poblacionales los resultados obtenidos fueron opuestos a aquéllos24,30. Esto podría deberse a un sesgo en las instituciones sin un claro objetivo investigador, donde podría obtenerse un menor número de ganglios en los especímenes con adenopatías evidentemente positivas o en presencia de metástasis a distancia conocidas. En ambas circunstancias, el hallazgo de un mayor número de ganglios no modificaría el estadio de la clasificación TNM, por lo que el anatomopatólogo detendría la búsqueda y el estudio ganglionar, lo que modificaría el resultado final del estudio poblacional.
En resumen, existe consenso en la literatura científica mundial en que el número de ganglios linfáticos en pacientes con cáncer de colon en estadio II es un factor pronóstico. Aunque hay datos sobre la importancia del número de ganglios también en pacientes con algún ganglio positivo (estadio III), el reducido número de trabajos al respecto no permite extraer conclusiones en estos pacientes. Por otro lado, la tasa de ganglios linfáticos (ganglios positivos sobre el total de ganglios analizados) podría tener mayor trascendencia que el propio estadio pN en estos pacientes.
Razones por las que el número total de ganglios analizados puede modificar el pronóstico en el cáncer colorrectalSi bien es fácilmente comprensible que la afección ganglionar se relaciona con un peor pronóstico de la enfermedad tumoral, continúa siendo objeto de debate el motivo por el que la exéresis de tejido aparentemente sano (ganglios negativos) se relaciona con un mejor pronóstico. Se han postulado, básicamente, tres teorías que intentan explicar este fenómeno13,14,17,19,22,26,31,32. Aunque algunos autores "creen" más en una teoría que en otra, hasta la fecha no se ha podido demostrar la superioridad de ninguna de ellas sobre las demás.
Teoría de la migración de estadio o fenómeno de Will-RogersSegún esta teoría, el empeoramiento del pronóstico al analizar pocos ganglios linfáticos se relacionaría con errores en el proceso de estadificación. Así, cuando el número de ganglios linfáticos analizado es bajo, hay mayor probabilidad de estadificar equivocadamente a un paciente que cuando el número de ganglios analizados es mayor. Esta falsa estadificación supondría asignarle un mejor pronóstico del que realmente tiene, por lo que este paciente con un menor número de ganglios analizados tendrá una menor supervivencia que el resto de su grupo. Así, el mal pronóstico en relación con un bajo número de ganglios obtenido en pacientes con estadio II podría ser por la migración en la estadificación, donde la supervivencia por estadio mejora como consecuencia de una mejor clasificación, aunque no se produzcan cambios en el resultado final para un individuo concreto.
Teoría de la adecuación técnica e institucionalEsta segunda teoría estaría relacionada con la técnica quirúrgica y el estudio anatomopatológico, esto es, con las características del centro y del personal que realiza las diferentes técnicas. El interés de los médicos (cirujanos y anatomopatólogos), así como su experiencia, se asociaría tanto con una mejor técnica quirúrgica como con un estudio más exhaustivo del espécimen. Estos factores pueden relacionarse, por tanto, con una mejoría de los resultados y pueden reflejar el interés de la institución en el tratamiento de los pacientes con cáncer de colon.
Teoría de la relación huésped-tumorEsta tercera teoría se relaciona con las posibles interacciones entre el huésped (paciente) y el tumor. Según estudios anatómicos, se sabe que hay diferencias interindividuales en el número de ganglios linfáticos y que este número está también influido por el estado evolutivo de la enfermedad33. Por tanto, es plausible que ciertas interacciones entre el tumor y el huésped puedan modificar el número de ganglios obtenidos. De este modo, algunos factores tumorales podrían estimular el crecimiento ganglionar, facilitando así su detección por parte de los anatomopatólogos34.
Ninguna de las teorías expuestas justifica, por sí misma, que un paciente con más ganglios analizados presente mejor pronóstico. Más que probablemente, la fuerte y consistente relación encontrada entre el número de ganglios linfáticos y la supervivencia en los estadios II del cáncer de colon esté condicionada, simultáneamente, por el fenómeno de la migración de estadio, por la calidad del manejo cirujano-patólogo y por interacciones entre el huésped y el tumor.
Factores que modifican el número de ganglios linfáticos obtenidosA pesar de la trascendencia que, como se ha visto, tienen la afección ganglionar y el número total de ganglios analizados tras la cirugía del cáncer de colon, en la práctica clínica habitual es frecuente observar sustanciales diferencias en el número de ganglios obtenidos en cada paciente19,20,23,35–39. Por ello, conviene plantearse por qué el número de ganglios analizados puede ser tan variable de un paciente a otro. Los factores que modifican el número de ganglios analizados se pueden agrupar, a groso modo, en tres: a) los que dependen de la anatomía o de las condiciones biológicas del paciente; b) los que dependen de la técnica quirúrgica, y c) los que dependen del estudio anatomopatológico. Aunque, lógicamente, los tres grupos presentan importantes interacciones entre ellos, con el objetivo de clarificar la exposición, se expondrán por separado.
Anatomía y condiciones biológicas del pacienteHay ciertas características previas al acto quirúrgico, inherentes o no al individuo, que pueden modificar la obtención de ganglios linfáticos. En primer lugar, los tratamientos neoadyuvantes (quimioterapia o radioterapia preoperatorias) provocan, en la mayoría de los casos, una disminución del tamaño del tumor primario y el tamaño de las posibles metástasis ganglionares e incluso una reducción del tamaño de los ganglios linfáticos no afectados40. Además, los tratamientos neoadyuvantes frecuentemente causan fibrosis, lo que dificulta, asimismo, la identificación de los ganglios linfáticos41. En segundo lugar, hay suficiente evidencia científica para afirmar que el número de ganglios linfáticos varía dependiendo de la localización anatómica del tumor y, en consecuencia, de la resección anatómica correspondiente. Así, en el estudio de la Asociación de Coloproctología de Gran Bretaña e Irlanda42, en la hemicolectomía derecha y en la colectomía subtotal se obtuvo, como promedio, el mayor número de ganglios linfáticos, mientras que la colectomía transversa y la amputación abdominoperineal del recto se asociaron con una menor obtención de ganglios (el 48 y el 33%, respectivamente)42. Del mismo modo, otros autores16,20,29,43,44 han confirmado que el número de ganglios obtenidos en el colon derecho es significativamente mayor que en otras localizaciones, posiblemente porque las piezas de resección quirúrgica son más grandes y contienen más estaciones linfáticas mesentéricas en las colectomías derechas que en las izquierdas. En tercer lugar, existen estudios que han demostrado que el número de ganglios linfáticos analizados está relacionado con la categoría pT de la clasificación TNM. En el estudio de Leibl et al45, el número medio de ganglios linfáticos obtenidos se incrementó de 12, en los pacientes con estadio T1, hasta 23, en los pacientes con tumores en estadio T4. Baxter et al43 encontraron que el número de ganglios era significativamente mayor en los pacientes con estadio III (media, 11 ganglios) que en los pacientes con estadio II (media, 10 ganglios) y con estadio I (media, 6 ganglios). Otros autores30,46 también demostraron que cuanto más grande era un tumor más ganglios linfáticos se obtenían. En cuarto lugar, la edad del paciente ha demostrado que puede modificar el número de ganglios linfáticos obtenidos, con una reducción del 6,8% por cada incremento de 10 años de edad31,42,43. Prandi et al16 explicaron este fenómeno mediante la hipótesis de que el cirujano realiza resecciones menos extensas en pacientes de mayor riesgo quirúrgico (mayores de 65 años). Berberoglu20, por el contrario, no pudo demostrar diferencias en el número de ganglios según la edad de los pacientes. Por último, la obesidad se ha relacionado con una disminución significativa del número medio de ganglios linfáticos obtenidos tras cirugía colorrectal47.
Técnica quirúrgicaComo se ha visto, la localización tumoral puede condicionar el número de ganglios linfáticos obtenidos, de modo que las resecciones quirúrgicas sobre el colon derecho obtendrán, en principio, mayor número de ganglios linfáticos que las del colon izquierdo o del recto16,20,29,42,44,47. Otras circunstancias relacionadas con el acto quirúrgico pueden influir también en el número de ganglios linfáticos obtenidos. Así, las cirugías paliativas obtienen, normalmente, especímenes de resección quirúrgica más pequeños que las cirugías con intención curativa, por lo que la cantidad de tejido ganglionar es también menor47. El mismo proceso podría explicar la obtención de menos ganglios linfáticos cuando la cirugía es urgente en comparación con la cirugía programada40.
A pesar de la estandarización de las técnicas quirúrgicas en el cáncer colorrectal, se han demostrado variaciones significativas en los resultados según el cirujano que efectúe la intervención y según el centro en el que se realice28,31,48. Así, Reinbach et al49 encontraron que los cirujanos con un especial interés por la cirugía coloproctológica obtenían piezas quirúrgicas más grandes y, como consecuencia, un mayor número de ganglios que los cirujanos generales o con mayor interés por otras áreas de la cirugía. No obstante, no se ha podido demostrar, hasta la fecha, que el volumen de pacientes, per se, sea un determinante del pronóstico tras la cirugía en el cáncer de colon. Así, en el trabajo llevado a cabo por McArdle et al50, los cirujanos con mayor número de casos tuvieron mejores resultados que los cirujanos con un volumen medio; sin embargo, no hubo diferencias significativas con los que tenían un volumen escaso de intervenciones. Otros trabajos también han sido incapaces de encontrar diferencias significativas en la mortalidad postoperatoria, la recurrencia local o la supervivencia teniendo en cuenta solamente el volumen de pacientes50–52. Sin embargo, diversos estudios han demostrado que los cirujanos especialistas obtienen mejores resultados -también en el número de gangliosque los no especialistas50,53,54. No obstante, la cuestión del "cirujano especialista en coloproctología" es compleja ya que no hay criterios nacionales ni internacionales que lo definan, por lo que los resultados deben interpretarse con cautela.
Miller et al31, en un interesante trabajo poblacional sobre más de 300 pacientes, encontraron que se obtenía menor cantidad de ganglios linfáticos en los hospitales con menos volumen de pacientes intervenidos de cáncer de colon que en los hospitales con un gran volumen de casos. Sin embargo, al no estudiar específicamente el factor cirujano sino el factor hospital, es difícil saber cuál fue la variable con mayor peso sobre los resultados (pacientes, cirujanos y/o anatomopatólogos).
En conclusión, a la vista de los estudios disponibles, las diferencias en la técnica quirúrgica pueden modificar la extensión de la resección tumoral y, en consecuencia, modificar también el número de ganglios obtenidos. El cirujano, y posiblemente el hospital, debería alcanzar cierto grado de especialización para obtener el mayor número de ganglios linfáticos posible.
Estudio anatomopatológicoMuchos autores consideran que si se asume que la cirugía se realiza de forma estandarizada, el anatomopatólogo tendría la mayor responsabilidad en el número definitivo de ganglios linfáticos analizados23,25,33,55.
Actualmente, la técnica estándar para la obtención de ganglios linfáticos en el cáncer colorrectal es la conocida como técnica manual o técnica clásica35,56. Esta técnica se basa en la identificación visual o mediante palpación de los ganglios, para su posterior disección e individualización. Se trata de un proceso tedioso y difícil que requiere de tiempo y dedicación. Además, si se tiene en cuenta que hasta en el 70% de las ocasiones los ganglios linfáticos metastásicos pueden medir menos de 5 mm5,33,36,56,57, es lógico pensar que un número considerable de ganglios linfáticos puede pasar fácilmente inadvertido durante el procedimiento clásico de disección.
Por otro lado, se ha indicado que, igual que sucede con los resultados quirúrgicos, el volumen de pacientes de cada hospital, las características del laboratorio y el interés del anatomopatólogo por la patología colorrectal podrían condicionar el estudio anatomopatológico, de modo que en los hospitales con un escaso volumen de pacientes se producirían más errores en la estadificación31,40,58,59.
Con el objetivo de mejorar la identificación de los ganglios linfáticos, e incrementar así el número de ganglios analizados, se han desarrollado diferentes técnicas de análisis anatomopatológico35,40,60–62. Sirvan como ejemplo el aclaramiento químico de la grasa (chemical fat clearance), el examen de la totalidad del tejido mesentérico residual (ESMT: entire submission of residual mesenteric tissue), la cartografía linfática ex vivo o la sección múltiple del espécimen quirúrgico. No obstante, por diferentes motivos, especialmente organizativos y económicos, estas técnicas no se realizan de forma sistemática en la mayoría de los laboratorios de anatomía patológica. Posiblemente, su mayor indicación sea en los casos en que el número final de ganglios obtenidos con las técnicas clásicas haya sido excesivamente bajo.
Número mínimo de ganglios que es necesario analizar en los pacientes con cáncer colorrectalHan sido muchos los estudios que, por diferentes procedimientos, han intentado dar respuesta a la cuestión de si hay un número mínimo de ganglios que se debe analizar en la cirugía del cáncer colorrectal. Hasta la fecha, todos los trabajos, excepto uno63, son estudios retrospectivos de cohortes. De manera práctica, estos estudios pueden clasificarse en función del origen de los pacientes, es decir, si los datos provienen de una única institución o de múltiples centros. Así, se puede dividirlos en tres grupos: a) estudios unicéntricos; b) estudios multicéntricos y poblacionales, y c) documentos de consenso. Los estudios unicéntricos cuentan con la ventaja de reducir las posibles diferencias en las técnicas quirúrgicas y en el estudio anatomopatológico, y puede considerarse que éstos son constantes o, como mínimo, muy similares. Sin embargo, estos estudios cuentan frecuentemente con un número reducido de pacientes, lo que disminuye su potencia estadística. Por el contrario, los estudios multicéntricos y poblacionales incluyen normalmente grandes series de pacientes, por lo que sus resultados son, en la mayoría de las ocasiones, estadísticamente satisfactorios. No obstante, asumen ciertas diferencias, a veces muy considerables, entre los distintos centros participantes en cuanto a la técnica quirúrgica y/o al estudio anatomopatológico, lo que aumenta la probabilidad de sesgos incontrolados. Por último, hay una serie de documentos de consenso entre expertos que, según los resultados obtenidos por otros autores y la propia experiencia, recomiendan un número concreto de ganglios que es necesario analizar (tablas 1-3).
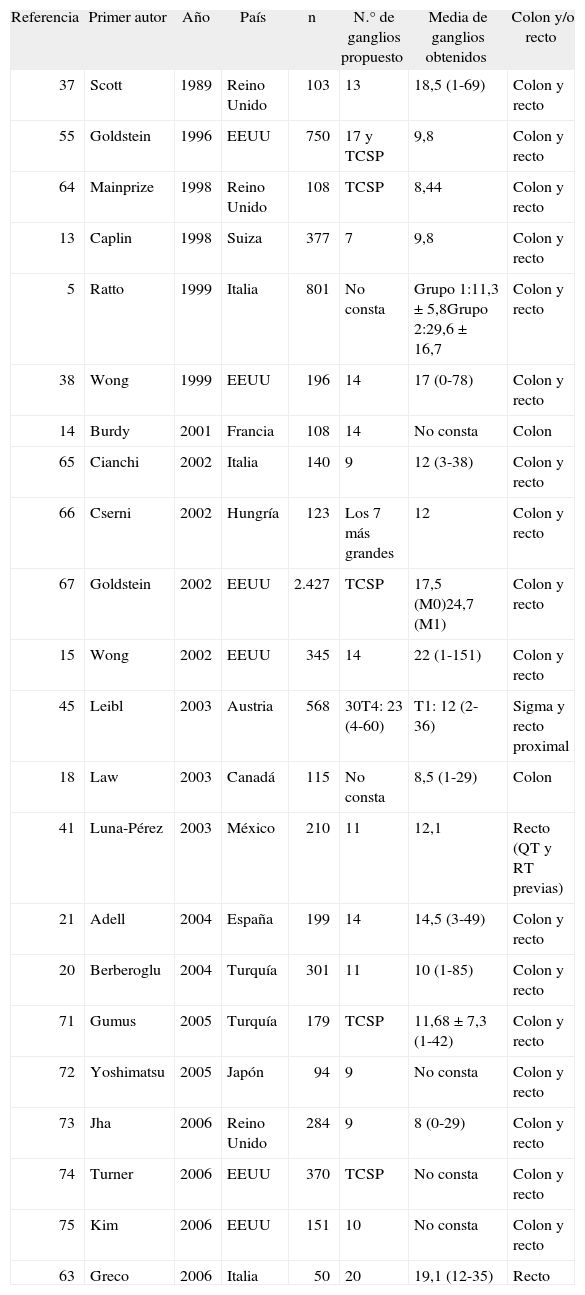
Número mínimo de ganglios recomendado en cirugía colorrectal según diferentes autores. Estudios unicéntricos
| Referencia | Primer autor | Año | País | n | N.° de ganglios propuesto | Media de ganglios obtenidos | Colon y/o recto |
| 37 | Scott | 1989 | Reino Unido | 103 | 13 | 18,5 (1-69) | Colon y recto |
| 55 | Goldstein | 1996 | EEUU | 750 | 17 y TCSP | 9,8 | Colon y recto |
| 64 | Mainprize | 1998 | Reino Unido | 108 | TCSP | 8,44 | Colon y recto |
| 13 | Caplin | 1998 | Suiza | 377 | 7 | 9,8 | Colon y recto |
| 5 | Ratto | 1999 | Italia | 801 | No consta | Grupo 1:11,3 ± 5,8Grupo 2:29,6 ± 16,7 | Colon y recto |
| 38 | Wong | 1999 | EEUU | 196 | 14 | 17 (0-78) | Colon y recto |
| 14 | Burdy | 2001 | Francia | 108 | 14 | No consta | Colon |
| 65 | Cianchi | 2002 | Italia | 140 | 9 | 12 (3-38) | Colon y recto |
| 66 | Cserni | 2002 | Hungría | 123 | Los 7 más grandes | 12 | Colon y recto |
| 67 | Goldstein | 2002 | EEUU | 2.427 | TCSP | 17,5 (M0)24,7 (M1) | Colon y recto |
| 15 | Wong | 2002 | EEUU | 345 | 14 | 22 (1-151) | Colon y recto |
| 45 | Leibl | 2003 | Austria | 568 | 30T4: 23 (4-60) | T1: 12 (2-36) | Sigma y recto proximal |
| 18 | Law | 2003 | Canadá | 115 | No consta | 8,5 (1-29) | Colon |
| 41 | Luna-Pérez | 2003 | México | 210 | 11 | 12,1 | Recto (QT y RT previas) |
| 21 | Adell | 2004 | España | 199 | 14 | 14,5 (3-49) | Colon y recto |
| 20 | Berberoglu | 2004 | Turquía | 301 | 11 | 10 (1-85) | Colon y recto |
| 71 | Gumus | 2005 | Turquía | 179 | TCSP | 11,68 ± 7,3 (1-42) | Colon y recto |
| 72 | Yoshimatsu | 2005 | Japón | 94 | 9 | No consta | Colon y recto |
| 73 | Jha | 2006 | Reino Unido | 284 | 9 | 8 (0-29) | Colon y recto |
| 74 | Turner | 2006 | EEUU | 370 | TCSP | No consta | Colon y recto |
| 75 | Kim | 2006 | EEUU | 151 | 10 | No consta | Colon y recto |
| 63 | Greco | 2006 | Italia | 50 | 20 | 19,1 (12-35) | Recto |
QT: quimioterapia; RT: radioterapia; TCSP: tantos como sea posible.
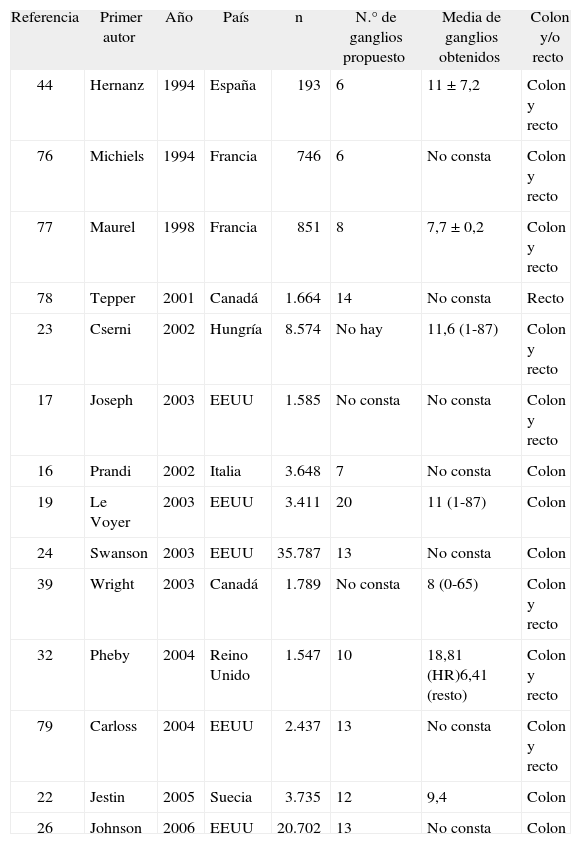
Número mínimo de ganglios recomendado en cirugía colorrectal según diferentes autores. Estudios multicéntricos
| Referencia | Primer autor | Año | País | n | N.° de ganglios propuesto | Media de ganglios obtenidos | Colon y/o recto |
| 44 | Hernanz | 1994 | España | 193 | 6 | 11 ± 7,2 | Colon y recto |
| 76 | Michiels | 1994 | Francia | 746 | 6 | No consta | Colon y recto |
| 77 | Maurel | 1998 | Francia | 851 | 8 | 7,7 ± 0,2 | Colon y recto |
| 78 | Tepper | 2001 | Canadá | 1.664 | 14 | No consta | Recto |
| 23 | Cserni | 2002 | Hungría | 8.574 | No hay | 11,6 (1-87) | Colon y recto |
| 17 | Joseph | 2003 | EEUU | 1.585 | No consta | No consta | Colon y recto |
| 16 | Prandi | 2002 | Italia | 3.648 | 7 | No consta | Colon |
| 19 | Le Voyer | 2003 | EEUU | 3.411 | 20 | 11 (1-87) | Colon |
| 24 | Swanson | 2003 | EEUU | 35.787 | 13 | No consta | Colon |
| 39 | Wright | 2003 | Canadá | 1.789 | No consta | 8 (0-65) | Colon y recto |
| 32 | Pheby | 2004 | Reino Unido | 1.547 | 10 | 18,81 (HR)6,41 (resto) | Colon y recto |
| 79 | Carloss | 2004 | EEUU | 2.437 | 13 | No consta | Colon y recto |
| 22 | Jestin | 2005 | Suecia | 3.735 | 12 | 9,4 | Colon |
| 26 | Johnson | 2006 | EEUU | 20.702 | 13 | No consta | Colon |
HR: hospital de referencia.
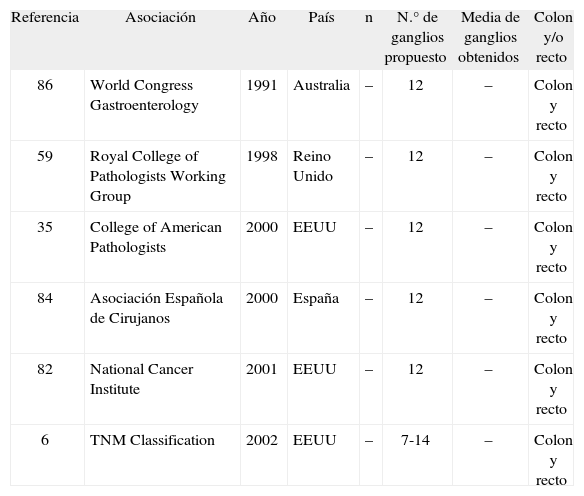
Número mínimo de ganglios recomendado en cirugía colorrectal según diferentes asociaciones. Estudios de consenso
| Referencia | Asociación | Año | País | n | N.° de ganglios propuesto | Media de ganglios obtenidos | Colon y/o recto |
| 86 | World Congress Gastroenterology | 1991 | Australia | – | 12 | – | Colon y recto |
| 59 | Royal College of Pathologists Working Group | 1998 | Reino Unido | – | 12 | – | Colon y recto |
| 35 | College of American Pathologists | 2000 | EEUU | – | 12 | – | Colon y recto |
| 84 | Asociación Española de Cirujanos | 2000 | España | – | 12 | – | Colon y recto |
| 82 | National Cancer Institute | 2001 | EEUU | – | 12 | – | Colon y recto |
| 6 | TNM Classification | 2002 | EEUU | – | 7-14 | – | Colon y recto |
En el año 1989, Scott et al37 publicaron su ya clásico trabajo sobre la utilidad del aclaramiento de la grasa en el estudio de los ganglios linfáticos en el cáncer de colon. Según estos autores, analizando 13 ganglios linfáticos se descubriría el 94% de los pacientes con ganglios positivos. Casi 10 años más tarde, Mainprize et al64 realizaron un análisis similar, pero aseguraron que no puede establecerse un número mínimo de ganglios que se debe analizar, pues se debe obtener tantos ganglios como sea posible. Ese mismo año, Caplin et al13 estudiaron el pronóstico de los pacientes operados por cáncer de colon en función del número de ganglios extraídos. Para ello, compararon la supervivencia a los 5 años de los pacientes con 6, 7 y 8 ganglios analizados. Encontraron diferencias significativas en la supervivencia de los pacientes al estudiar 7 y 8 ganglios, pero no con 6 ganglios, por lo que recomendaron obtener un mínimo de 7 ganglios linfáticos. Ratto et al5 no dieron un número exacto de ganglios para analizar, sino que, mediante la técnica de sección múltiple de la pieza quirúrgica, aseguraron que cuanto mayor es el número de ganglios analizados mejor es el pronóstico.
Wong et al38, al comparar sus resultados con las tasas de positividad del National Cancer Data Base, estimaron la proporción de pacientes con al menos un ganglio positivo según el número de ganglios extraídos. Así, a medida que aumentaba el número de ganglios analizados lo hacía también el número de ganglios positivos. No obstante, esta proporción no aumentaba cuando se analizaban más de 14 ganglios, por lo que aseguraron que 14 era el número mínimo de ganglios que se debe analizar. Estos mismos autores publicaron unos años más tarde el impacto de este número de ganglios en la supervivencia, y demostraron que los pacientes con menos de 14 ganglios linfáticos analizados tenían menor supervivencia15. En el año 2001, Burdy et al14, mediante un estudio univariable y multivariable en pacientes con estadio T3-T4N0, coincidieron con el número propuesto por Wong et al38. Cianchi et al65 estudiaron la supervivencia de los pacientes con menos de 9 ganglios analizados comparándola con la de los que tenían 9 o más ganglios analizados. La supervivencia en este segundo grupo fue significativamente mejor, por lo que concluyeron que se debe analizar, al menos, 9 ganglios linfáticos.
Cserni et al66 dieron una nueva dimensión al problema, añadiendo el tamaño ganglionar en la ecuación sobre el número de ganglios que se debe analizar. Según estos autores, analizando los 7 ganglios linfáticos más grandes la probabilidad de estadificar correctamente a pacientes con ganglios negativos es del 98%.
Goldstein, uno de los autores que más ha estudiado el impacto del número de ganglios en el cáncer de colon, aseguró en un trabajo publicado en 2002 que no hay un número mínimo de ganglios que se debe analizar y que se debe estudiar tantos ganglios como sea posible67. A esta conclusión llegó por medio de un modelo de cálculo predictivo de probabilidades, evaluando la relación entre el número de ganglios linfáticos obtenidos y el número de ganglios afectados mediante regresión logística. No obstante, este autor y sus colaboradores habían defendido años antes que el mayor número de metástasis ganglionares se producía en los pacientes cuando se analizaban entre 17 y 20 ganglios y que, en consecuencia, 17 era el número mínimo de ganglios que se debería analizar55. En aquel primer trabajo, Goldstein et al55 utilizaron el modelo propuesto por Hermanek68 en 1991, en el que examinaba el porcentaje de especímenes con metástasis ganglionares en relación con el número de ganglios obtenidos, estableciendo grupos de 1-5, 6-11, 12-20 y más de 20 ganglios linfáticos. La modificación propuesta por Goldstein et al55 fue hacer los grupos más pequeños, lo que supuso ampliar los 12 ganglios de Hermanek a 17. Sin embargo, conviene mencionar que, como apuntaron posteriormente Frankel69 y Bush70, las conclusiones de Goldstein et al55 no se correspondían con su propia discusión, ya que en ésta afirmaron que no hay un número mínimo de ganglios y que deberían obtenerse tantos como fuera posible. Posteriormente, Leibl et al45 utilizaron uno de los gráficos propuestos por Goldstein et al55 en el que se relacionaba el porcentaje acumulado de casos con metástasis detectables y el número de ganglios obtenidos de estos especímenes. El plateau de la curva (90-95%) empezaba en 30-32 ganglios, lo que dejaría el número propuesto por Goldstein (17 ganglios) en la zona ascendente. Aunque no hicieron una recomendación específica del número de ganglios necesarios, de estos resultados se deduce que sería necesario estudiar al menos 30 ganglios linfáticos. Un modelo similar al de Goldstein et al55 y al de Wong38 utilizaron Adell et al21, quienes encontraron que 14 sería el número mínimo de ganglios para analizar.
Law et al18 estudiaron la supervivencia en 115 pacientes en estadio II, comparando la de los pacientes con 6 o menos ganglios con la de los pacientes con más de 6 ganglios. Encontraron una diferencia significativa, por lo que concluyeron que se debería analizar, al menos, 7 ganglios linfáticos. Luna-Pérez et al41, en el año 2003, analizaron el número de ganglios que es recomendable obtener, pero en pacientes sometidos a quimioterapia y radioterapia preoperatorias en el cáncer de recto. Según sus resultados, la supervivencia es mayor (el 48 frente al 69%) cuando se analizan 11 o más ganglios que cuando se analizan entre 1 y 10, por lo que concluyeron que es importante obtener, al menos, 11 ganglios linfáticos en estos pacientes.
Berberoglu20 dividió a los pacientes en cuartiles en función del número de ganglios linfáticos analizados y valoró la supervivencia. Encontró que los pacientes en que se había analizado entre 11 y 18 ganglios tenían una supervivencia significativamente mejor que los grupos con 0-5, 6-10 ganglios, aunque peor (sin significación estadística) que los pacientes con 19 o más ganglios analizados. Por ello, este autor propuso estudiar un mínimo de 11 ganglios linfáticos.
El estudio llevado a cabo por Gumus et al71, en el año 2005, con un total de 179 pacientes, fue el único que no consiguió demostrar diferencias significativas en la supervivencia general de los pacientes en función del número de ganglios analizados, aunque sí las encontraron para la supervivencia a los 3 años en los pacientes con menos de 9 ganglios analizados. Estos autores, sin embargo, no recomendaron obtener 9 ganglios, sino tantos como fuera posible. También en 2005, Yoshimatsu et al72 encontraron que la supervivencia en pacientes con 9 o más ganglios analizados era mejor que con menos de 9 ganglios, por lo que recomendaron este número como el mínimo que se debería obtener.
En 2006, Jha et al73 demostraron, mediante el test de correlación ANOVA, que la relación entre el número de ganglios analizados y ganglios positivos es lineal y que, por tanto, es posible calcular el número mínimo de ganglios que es necesario analizar. Según sus datos, sería necesario analizar 8,4 ganglios para tener un ganglio afectado, por lo que su recomendación fue estudiar un mínimo de 9 ganglios. Recientemente, Turner et al74 publicaron un modelo de predicción de probabilidades en función del número de ganglios analizados. En este modelo utilizaron el total de pacientes con ganglios positivos para estimar los parámetros de la ecuación de Poisson y posteriormente estudiar las implicaciones de este modelo y del teorema de Bayes en la subestadificación de los pacientes con cáncer. Según estos autores, no habría un número mínimo de ganglios que se debe analizar, ya que cuantos más ganglios linfáticos negativos se analicen mayor será la probabilidad de una estadificación ganglionar correcta.
Kim et al75 realizaron un estudio sobre 151 pacientes con cáncer colorrectal y los dividieron en 7 grupos (0-4, 5-9, 10-14, 15-19, 20-24, 24-29 y más de 30). Valoraron la proporción de pacientes con ganglios positivos en cada grupo de pacientes. Cuando se estudió entre 10 y 14 ganglios, el porcentaje de positividad fue del 57,8% en comparación con el 33,3% de 5-9 ganglios. Por ello, llegaron a la conclusión de que estudiando 10 ganglios linfáticos se evitaría la subestadificación en pacientes con cáncer colorrectal.
Por último, en el único estudio prospectivo sobre este tema, realizado por Greco et al63, se comparó el número de ganglios obtenidos durante un primer examen sistemático sobre las piezas de resección rectal con un segundo examen de la misma pieza realizado por un anatomopatólogo con experiencia en anfermedades gastrointestinales. Aunque en los tumores pT2 se mantuvo el estado pN0, en el 18,7% de los tumores pT3 se detectó alguna nueva metástasis ganglionar con el segundo muestreo. De este 18,7%, la mayoría (5 de 6) correspondió a pacientes en los que se había encontrado menos de 20 ganglios, por lo que estos autores recomendaron un nuevo muestreo en todos los pacientes con menos de 20 ganglios linfáticos analizados.
Estudios multicéntricos y poblacionalesEn 1994, Hernanz et al44 utilizaron la distribución binomial para calcular la probabilidad de encontrar, al menos, un ganglio positivo de una muestra de "n" ganglios linfáticos. Según sus resultados, cuando se analizan 6 ganglios linfáticos, la probabilidad de encontrar una metástasis es del 95% y si se analizan 10 es del 99%. Por ello, los autores recomendaron obtener, al menos, 6 ganglios linfáticos para tener una buena probabilidad de éxito (95%). Resultados similares obtuvieron Michiels et al76 mediante el estudio de diferentes factores pronóstico en el cáncer colorrectal. Tanto en el análisis univariable como en el multivariable hubo diferencias significativas en la supervivencia de los pacientes con 0, con menos de 6 o con 6 o más ganglios analizados.
Maurel et al77, en un estudio poblacional también francés, estudiaron la correlación entre el número de ganglios linfáticos analizados y la proporción de tumores clasificados como N+ mediante la prueba de la χ2. La relación entre la clasificación del tumor (N+ frente a N–) se estudió mediante regresión logística. En los grupos con 1-3 ganglios y 4-7 ganglios la odds ratio (OR) fue claramente menor que 1. Por estos motivos, asumieron que el número mínimo de ganglios recomendable es 8.
Tepper et al78 establecieron cuartiles en función del número de ganglios obtenidos en cada paciente (0-4, 5-8, 9-13, > 13) y valoraron la supervivencia. Las diferencias que encontraron fueron significativas, de forma que cuanto mayor era el número de ganglios, mayor era la supervivencia. No obstante, aunque afirmaron que no debería establecerse un punto de corte en el número de ganglios, consideraron que, aproximadamente, 14 ganglios sería un buen número.
Cserni et al23, en un estudio sobre más de 8.000 pacientes, llevado a cabo en Hungría con la base de datos SEER (Surveillance, Epidemiology and End Results), aseguraron que no hay un número mínimo de ganglios, ya que en las curvas de Kaplan-Meier para supervivencia no había ningún punto de corte a partir del cual la supervivencia no mejorase con el aumento en el número de ganglios. El mismo año de publicación del trabajo de Cserni et al23 apareció publicado el estudio de Joseph et al17, donde se proponía un modelo matemático basado en el teorema de Bayes para el cálculo de la probabilidad de afección ganglionar en función del número de ganglios obtenidos. Los autores no propusieron un número mínimo de ganglios que se debería analizar, sino que calcularon la probabilidad de que un paciente con "n" ganglios analizados fuera clasificado correctamente como N-. Según sus datos, se debería obtener un mínimo de 30 ganglios para que la probabilidad de estadificación correcta alcanzase el 85%.
Prandi et al16, con los datos del ensayo clínico INTACC sobre terapia adyuvante en el cáncer de colon, aseguraron que se debe obtener un mínimo de 7 ganglios para que el estudio sea adecuado. Para obtener este resultado crearon cuartiles en función del número de ganglios (0-7, 8-12, 13-17 y > 18) y, junto con otras variables en un estudio univariable y multivariable, valoraron su influencia en el pronóstico. Los pacientes con menos de 7 ganglios analizados tenían un pronóstico significativamente peor. No obstante, estos autores comparten la idea de obtener tantos ganglios como sea posible y no recomendaron obtener 7 ganglios. Un análisis similar realizaron Le Voyer et al19 en 2003 utilizando los datos del estudio INT-0089. Dividieron a los pacientes en 3 grupos según el número de ganglios linfáticos obtenidos (1-10, 10-20, > 20), y también encontraron una mejora continua en la supervivencia en función del número de ganglios obtenidos. Dado el diseño de su estudio, concluyeron que el número de ganglios que se debería analizar es, al menos, 20 ganglios.
Swanson et al24, en el estudio con mayor número de pacientes hasta la fecha (n = 35.787), también crearon 3 grupos según el número de ganglios analizados (1-7, 8-12, > 12) y valoraron la supervivencia en cada uno de ellos. De este modo y de forma continua, cuantos más ganglios se analizaban mejor era la supervivencia. Asimismo, utilizando el análisis de la variancia, estudiaron el porcentaje de casos con al menos un ganglio positivo, dado el número de ganglios analizados. Cuando el número de ganglios obtenidos era mayor que 13, la proporción de ganglios positivos no se incrementaba, por lo que consideraron que 13 era el número mínimo de ganglios necesario.
En 2004, Pheby et al32 compararon los informes anatomopatológicos de un hospital, que consideraron de referencia, con los de los demás hospitales de su entorno, y clasificaron los informes anatomopatológicos según el número de ganglios obtenidos (1-9, 10-14, 15-19 y > 19). En ambos grupos (hospital de referencia y hospitales de estudio) el porcentaje de pacientes clasificados como estadio C de Dukes era mayor cuando el número de ganglios linfáticos era entre 10 y 14, por lo que consideraron que 10 es el número mínimo de ganglios que se debe obtener. Durante ese mismo año, se publicó el trabajo de Carloss et al79, en el que, mediante el Kentucky Cancer Registry, se encontró una diferencia significativa en la supervivencia de los pacientes con menos de 13 ganglios analizados en comparación con la de aquellos con 13 o más ganglios.
En el estudio sueco de Jestin et al22, se valoró la supervivencia de los pacientes con estadio II y con 12 o más ganglios analizados, y se encontró diferencias en el pronóstico y la supervivencia cuando se analizaba, al menos, 12 ganglios.
Documentos de consensoEn 1990, según los estudios de Hermanek68 y Scott et al37, durante el Congreso Mundial de Gastroenterología celebrado en Sydney (Australia), se recomendó, de manera formal, obtener un mínimo de 12 ganglios linfáticos para estadificar correctamente a los pacientes con cáncer colorrectal80. Posteriormente, este número fue aceptado por el American Joint Committee on Cancer (AJCC)81 y por la International Union Against Cancer (UICC)6, que también recomendaron obtener, al menos, 12 ganglios y si no se consigue llegar a este número, realizar pruebas más específicas para localizar ganglios linfáticos. El sistema de estadificación TNM (promovido por estas dos sociedades) ha sido aceptado por la mayoría de las asociaciones científicas, las que han recomendado también este número de ganglios35,59,82,83. España no ha sido una excepción a esta corriente y en la Guía Clínica de la Asociación Española de Cirujanos84 se afirma que la obtención de al menos 12 ganglios linfáticos es una exigencia para la estadificación adecuada del cáncer colorrectal.
Así, la mayoría de las sociedades científicas coinciden en que 12 es el número de ganglios que se debería obtener en el estudio anatomopatológico de los especímenes quirúrgicos en el cáncer colorrectal. Sin embargo, aunque en ocasiones se cita el manual TNM como origen de esta recomendación, cuando se revisa la última edición de este texto, en él no se recoge, en ningún momento, la obtención de tal número de ganglios. Es más, se propone, explícitamente, obtener entre 7 y 14.
Por todo ello, a pesar de este consenso entre sociedades científicas y de la difusión mundial de esta cifra, conviene recordar que, como se ha visto anteriormente, este número 12 no está basado en la auténtica evidencia científica, sino que deriva de la recomendación realizada, hace más de 15 años, por un comité de expertos. La mayoría de los trabajos, aparecidos con posterioridad a esta recomendación, han obtenido resultados tan diversos, en cuanto al número mínimo de ganglios que se debería analizar, que es difícil aceptar que 12 sea el número óptimo –y casi mágico– de ganglios exigibles tras cirugía por cáncer colorrectal.
ConclusionesAunque parece haber consenso en que el punto de corte en el número de ganglios linfáticos obtenidos en el cáncer de colon es 12, los trabajos que han estudiado de forma específica esta cuestión han encontrado resultados muy dispares; desde los 6 ganglios de Hernanz et al44 hasta los 30 de Leibl et al45. La falta de acuerdo entre los diferentes estudios orienta a que, probablemente, no haya un número óptimo de ganglios linfáticos que se debe analizar, sino que este número estaría condicionado por múltiples factores.
A la vista de las discrepancias en la literatura, parece justificado seguir investigando si realmente hay un número mínimo y óptimo de ganglios que es necesario analizar para poder determinar con seguridad que no hay afección ganglionar en el cáncer colorrectal.
En nuestra opinión y hasta disponer de resultados concluyentes, parece recomendable intentar obtener la mayor cantidad posible de ganglios linfáticos, tanto durante el acto quirúrgico como durante el estudio anatomopatológico, para intentar evitar así los graves perjuicios de una estadificación incorrecta en estos pacientes.