La utilidad de la estadificación N del sistema TNM, el cociente de ganglios linfáticos (CGL) y el logaritmo de probabilidades de ganglios linfáticos positivos (LODDS) para predecir la supervivencia global (SG) y la supervivencia libre de enfermedad (SLE) en los pacientes con cáncer de recto es aún controvertida.
Material y métodosSe realizó un estudio de cohortes retrospectivo con los pacientes intervenidos por cáncer de recto entre 2008 y 2017 en el Complejo Hospitalario Universitario de Vigo. Los pacientes se estratificaron en subgrupos de acuerdo al número de ganglios examinados (NGE), estadificación N del sistema TNM, punto de corte del CGL y punto de corte del LODDS. Se realizó un análisis mediante log-rank test, curvas de Kaplan-Meier, regresión de Cox y curvas ROC.
ResultadosSe incluyeron 445 pacientes. La SG y la SLE, a 5 años, fue del 73,7 y 62,5%, respectivamente. No se encontraron diferencias estadísticamente significativas en la supervivencia según el NGE. A medida que se incrementa el valor del CGL y del LODDS, disminuye significativamente la SG y la SLE, independientemente del NGE.
En el análisis multivariante la estadificación N, el CGL y el LODDS se mostraron como factores independientes de la SG y SLE; pero el sistema LODDS obtuvo la mejor área bajo la curva, con mayor capacidad predictiva para la SG (ABC: 0,679) y la SLE (ABC: 0,711).
ConclusiónEl LODDS y el CGL proporcionan información pronóstica independientemente del NGE. El LODDS proporciona un rendimiento predictivo más preciso en los pacientes con ganglios negativos que el CGL y la estadificación N.
The use of the N category of the TNM staging system, lymph node ratio (LNR) and log odds of positive lymph nodes (LODDS) in predicting overall survival (OS) and disease-free survival (DFS) in patients with rectal cancer is still controversial.
Material and methodsA retrospective study of 445 patients with rectal cancer who underwent surgery between 2008 and 2017 in the University Complex Hospital of Vigo was performed. Patients were stratified according to number of lymph nodes examined (NLNE), N staging, LNR and LODDS. The analysis was performed using the log-rank test, Kaplan-Meier functions, Cox regression and ROC curves.
ResultsFive-year OS and DFS were 73.7% and 62.5%, respectively. No statistically significant differences were observed depending on NLNE. Increased LNR and LODDS were associated with shorter OS and DFS, independently of NLNE.
Multivariate analysis showed that N stage, LNR and LODDS were independently associated with OS and DFS; however, the LODDS system obtained the best area under the curve, with greater predictive capacity for OS (AUC: 0.679) and DFS (AUC: 0.711).
ConclusionLODDS and LNR give prognostic information that is not related to NLNE. LODDS provides better prognostic accuracy in patients with negative nodes than LNR and N stage.
El número de ganglios metastatizados (NGM) es un factor pronóstico significativo asociado con la supervivencia en los pacientes con cáncer colorrectal (CCR)1.
Está establecida la necesidad de evaluar al menos 12 ganglios para realizar una estadificación segura2 y, aunque la mayoría de las sociedades científicas lo recomiendan3, este punto de corte no se obtiene en muchas series, no sobrepasando algunas el 40% de los pacientes con un número de ganglios examinados (NGE)≥124.
Para superar la dependencia del número de ganglios extirpados y analizados, se propuso un sistema de estadificación llamado cociente ganglionar linfático (CGL) definido como el cociente de dividir NGM/NGE5.
Otro sistema, el Log Odds de ganglios positivos (LODDS), definido como el logaritmo entre la probabilidad de que al analizar un ganglio sea positivo o negativo, demostró su utilidad reduciendo el riesgo de migración por etapas en el cáncer de estómago, mama, colon y páncreas. Se calcula mediante la fórmula «log (NPLN + 0,5)/(NDLN - NPLN + 0,5)», donde NPLN es el NGM y NDLN el total de ganglios resecados. El número «0,5» aparece 2 veces para evitar resultados que tiendan al infinito4. Ha mostrado un impacto predictivo significativo en el cáncer de colon etapa III6, pero pocos investigadores lo han aplicado en el cáncer de recto.
Este estudio pretende examinar la fiabilidad pronóstica de los sistemas N, CGD y LODDS en términos de supervivencia para los pacientes sometidos a resección por cáncer de recto. Nuestro objetivo era evaluar la eficacia de estos sistemas para diferenciar pronósticos dentro de la misma categoría tumoral, permitiéndonos así identificar con mayor precisión a aquellos pacientes que presentan un riesgo más elevado.
Material y métodoEstudio observacional unicéntrico de cohortes retrospectivo de pacientes diagnosticados de adenocarcinoma situado a ≤15cm del margen anal en el período 2008-2017. Pacientes con tumores sincrónicos, resección local, resección R2, estadio IV, pérdida de seguimiento o fallecidos durante el ingreso fueron excluidos.
Analizamos: sexo, edad, ASA, neoadyuvancia (QRTn), invasión vascular (IV), linfática (IL), perineural (IPN), margen de resección circunferencial (MRC), NGE, estadificaciones p/ypT, p/ypN, CGL y LODDS.
Calculamos el punto de corte del grupo CGL utilizando la media de todos los pacientes con CGL>0, clasificándolos en 3 subgrupos: CGL0: CGL=0; CGL1 (bajo): CGL>0 y ≤0,238; CGL2 (alto): CGL>0,238.
Calculamos el LODDS en cada paciente y fueron divididos por tertiles en 3 subgrupos: LODDS0: LODDS≤−1.362; LODDS1: LODDS>−1.362 y ≤0,854; LODDS2: LODDS>0,854.
Utilizamos el análisis de Kaplan-Meier, realizando las comparaciones mediante el log-rank entre subgrupos. Para el análisis multivariante empleamos la regresión de Cox para determinar el efecto de los sistemas de estatificación ganglionar en la SG y la supervivencia libre de enfermedad (SLE) a los 5 años.
Para evitar la colinealidad dentro del mismo modelo multivariante e identificar la clasificación mejor relacionada con el pronóstico, se efectuó un modelo para cado uno de los sistemas de estatificación. En el modelo A se incluyeron todos los factores significativos en el análisis univariante y la clasificación N, excluyendo CGL y LODDS. En el B, se incluyó la clasificación CGL, pero no LODDS. En el 3 se incluyeron las 3 clasificaciones.
La capacidad predictiva de la SG y de la SLE se evaluó mediante el valor del área bajo la curva (ABC).
Se hizo una estratificación dentro de los sistemas N, CGL, LODDS y su relación con el NGE (alto ≥12 o bajo <12), para intentar identificar subgrupos pronósticos.
La SG y la SLE hacen referencia al tiempo, en meses, desde la cirugía hasta la muerte o hasta la última revisión y desde la cirugía hasta el diagnostico de recurrencia, respectivamente.
Realizamos el análisis estadístico con el programa SPSS® 25.0 para Windows. Se consideraron diferencias estadísticamente significativas aquellas con un valor de p<0,05.
ResultadosCaracterísticas clínico-patológicasDe 653 pacientes diagnosticados, 445 (68,15%) fueron intervenidos quirúrgica y electivamente con intención curativa (material suplementario 1).
Incluimos 183 mujeres (41,1%). La edad media fue de 68,4 años (rango: 25-90). Identificamos un NGE inadecuado o bajo (<12) en 205 pacientes (46,1%).
Recibieron QRTn 167 pacientes (37,5%). La media del NGE fue de 13,1, superior en pacientes que no recibieron QRTn (14,5 vs. 10,6; p=0.001). El porcentaje de pacientes con NGE<12 fue superior en los pacientes que recibieron QRTn (61,7 vs. 38,3%; p<0.001).
Cuando el NGE fue ≥12, el porcentaje de pacientes con ganglios afectados fue menor si habían recibido QRTn (23,4 vs. 29,1%; p=0.304), pero significativamente mayor con cirugía sola (48,3 vs. 23,5; p<0,001) (tabla 1).
Afectación ganglionar según el número de ganglios resecados y la realización o no de tratamiento neoadyuvante
| N+ | No QRTn N+ (%) | QRTn N+ (%) | ||||
|---|---|---|---|---|---|---|
| NGE | n | N+ (%) | n | N+ (%) | n | N+ (%) |
| <12 | 205 | 54(26,3) | 102 | 24 (23,5%) | 103 | 30 (29,1%) |
| ≥12 | 240 | 100 (41,7) | 176 | 85 (48,3%) | 64 | 15 (23,4%) |
| Valor de p | <0,001 | <0,001 | 0,304 | |||
N+ (%): porcentaje de ganglios positivos; NGE: número de ganglios examinados; QRTn: quimiorradioterapia neoadyuvante.
La tasa de mortalidad global a 5 años fue del 26,1%.
Las características clínico-histopatológicas y los análisis univariante y multivariado se reflejan en las tablas 2 y 3.
Análisis univariante de la supervivencia global y supervivencia libre de enfermedad
| Variable | n | SG (%) | HR (IC 95%), valor de p | SLE (%) | HR (IC 95%), valor de p |
|---|---|---|---|---|---|
| Sexo | |||||
| Mujer | 183 | 77,6 | Referencia | 65,6 | Referencia |
| Varón | 262 | 70,9 | 1,33 (0,91-1,94), 0,147 | 60,3 | 1,14 (0,83-1,56), 0,412 |
| Edad (años) | |||||
| <70 | 235 | 82,9 | Referencia | 69,4 | Referencia |
| ≥70 | 210 | 63,3 | 2,59 (1,76-3,79), <0,001 | 54,7 | 1,62 (1,19-2,20), 0,002 |
| ASA | |||||
| I-II | 254 | 83,8 | Referencia | 73,2 | Referencia |
| III-IV | 191 | 60,2 | 3,00 (2,05-4,39), <0,001 | 48,1 | 2,37 (1,74-3,23), <0,001 |
| QRT neoadyuvante | |||||
| No | 278 | 73,9 | Referencia | 59,7 | Referencia |
| Sí | 167 | 81,4 | 1,46 (0,83-2,57), 0,194 | 67,9 | 0,87 (0,43-1,68), 0,613 |
| IV | |||||
| Sí | 83 | 59,8 | 1,97 (1,31-2,94), 0,001 | 54,4 | 1,54 (1,08-2,21), 0,018 |
| No | 362 | 76,9 | Referencia | 67,9 | Referencia |
| IL | |||||
| Sí | 99 | 61,6 | 1,96 (1,33-2,89), 0,001 | 53,5 | 1,50 (1,07-2,11), 0,019 |
| No | 346 | 77,2 | Referencia | 65,0 | Referencia |
| IPN | |||||
| Sí | 66 | 53,8 | 2,31 (1,53-3,51), <0,001 | 41,9 | 2,16 (1,50-3,10), <0,001 |
| No | 379 | 77,2 | Referencia | 66,1 | Referencia |
| MRC+ | |||||
| Sí | 42 | 46,5 | 3,06 (1,94-4,83), <0,001 | 34,9 | 2,72 (1,81-4,08), <0,001 |
| No | 403 | 76,6 | Referencia | 65,4 | Referencia |
| p/ypT | |||||
| T0-2 | 198 | 83,3 | Referencia | 72,2 | Referencia |
| T3-4 | 247 | 65,9 | 2,32 (1,71-3,61), 0,001 | 54,6 | 2,88 (1,18-7,04), 0,001 |
| NGE | |||||
| <12 | 205 | 71,7 | Referencia | 63,9 | Referencia |
| ≥12 | 240 | 75,4 | 0,93 (0,65-1,34), 0,705 | 69,1 | 0,90 (0,66-1,22), 0,496 |
| p/ypN | |||||
| 0 | 291 | 78,8 | Referencia | 76,8 | Referencia |
| 1 | 88 | 60,7 | 2,04 (1,31-3,17), 0,002 | 53,0 | 1,97 (1,36-2,84), <0,001 |
| 2 | 66 | 52,5 | 2,84 (1,82-4,44), <0,001 | 41,6 | 2,64 (1,81-3,87), <0,001 |
| CGL | |||||
| 0 | 291 | 78,9 | Referencia | 76,8 | Referencia |
| 1 | 78 | 60,7 | 1,99 (1,25-3,16), 0,004 | 57,9 | 1,99 (1,25-3,16), 0,004 |
| 2 | 76 | 53,2 | 2,85 (1,86-4,38), <0,001 | 38,1 | 2,85 (1,86-4,38), <0,001 |
| LODDS | |||||
| 0 | 154 | 84,7 | Referencia | 82,3 | Referencia |
| 1 | 140 | 71,9 | 2,06 (1,20-3,54), 0,009 | 70,9 | 2,06 (1,20-3,54), 0,009 |
| 2 | 151 | 57,0 | 3,44 (2,09-5,66), <0,001 | 47,9 | 3,44 (2,09-5,66), <0,001 |
ASA: sistema de clasificación American Society of Anestesiologist (ASA); CGL: ratio de ganglios linfáticos; HR: hazard ratio; IC 95%: intervalo de confianza del 95%; IL: invasión linfática; IPN: invasión perineural; IV: invasión vascular; LODDS: logaritmo de probabilidades de ganglios linfáticos positivos; MRC: margen de resección circunferencial; NGE: número ganglios examinados; p/ypT y p/ypN: estadios T y N de la clasificación TNM; QRT: quimiorradioterapia; SG: supervivencia global; LE: supervivencia libre de enfermedad.
Análisis multivariante de la supervivencia global y supervivencia libre de enfermedad
| Supervivencia global | Supervivencia libre de enfermedad | |
|---|---|---|
| Variable | HR (IC 95%), valor de p | HR (IC 95%), valor de p |
| Edad (años) | ||
| <70 | ||
| ≥70 | 1,574 (0,962-2,577), 0,071 | 0,936 (0,632-1,385), 0,740 |
| ASA | ||
| I-II | ||
| III-IV | 1.626 (1.034-2.557), 0,035 | 1.577 (1.083-2.293), 0,017 |
| IV | ||
| No | ||
| Sí | 1.689 (0,876-3.246), 0,117 | 1.234 (0,695-2.197), 0,473 |
| IL | ||
| No | ||
| Sí | 0,723 (0,383-1.362), 0,316 | 0,638 (0,361-1.128), 0,123 |
| IPN | ||
| No | ||
| Sí | 1.567 (0,927-2.645), 0,094 | 1.558 (1,011-2.403), 0,045 |
| MRC+ | ||
| No | ||
| Sí | 1.792 (1.002-3.205), 0,049 | 1.698 (1.046-2.762), 0,032 |
| p/ypT | ||
| T0-2 | ||
| T3-4 | 2.320 (1.202-4.332), 0,007 | 1.792 (1.149-2.798), 0,006 |
| Modelo A | ||
| p/ypN | ||
| 0 | ||
| 1 | 1,83 (1,09-3,08) 0,023 | 2,83 (1,77-4,53) <0,001 |
| 2 | 1,82 (1,04-3,19) 0,036 | 2,89 (1,71-4,87) <0,001 |
| Modelo B | ||
| CGL | ||
| 0 | ||
| 1 | 1,63 (0,95-2,78) 0,075 | 2,46 (1,49-4,06) <0,001 |
| 2 | 2,16 (1,25-3,76) 0,006 | 3,48 (2,09-5,81) <0,001 |
| Modelo C | ||
| LODDS | ||
| 0 | ||
| 1 | 1,91 (1,07-3,41) 0,029 | 2,57 (1,43-4,62) 0,002 |
| 2 | 2,62 (1,48-4,65) 0,001 | 4,51 (2,53-8,03) <0,001 |
ASA: sistema de clasificación American Society of Anestesiologist (ASA); CGL: ratio de ganglios linfáticos; HR: hazard ratio: IC 95%: intervalo de confianza del 95%; IL: invasión linfática; IPN: invasión perineural; IV: invasión vascular; LODDS: logaritmo de probabilidades de ganglios linfáticos positivos; MRC: margen de resección circunferencial; p/ypT y p/ypN: estadios T y N de la clasificación TNM.
En el modelo A, B, C, los sistemas de estadificación N, CGL y LODDS se representan separadamente para evitar la colinealidad.
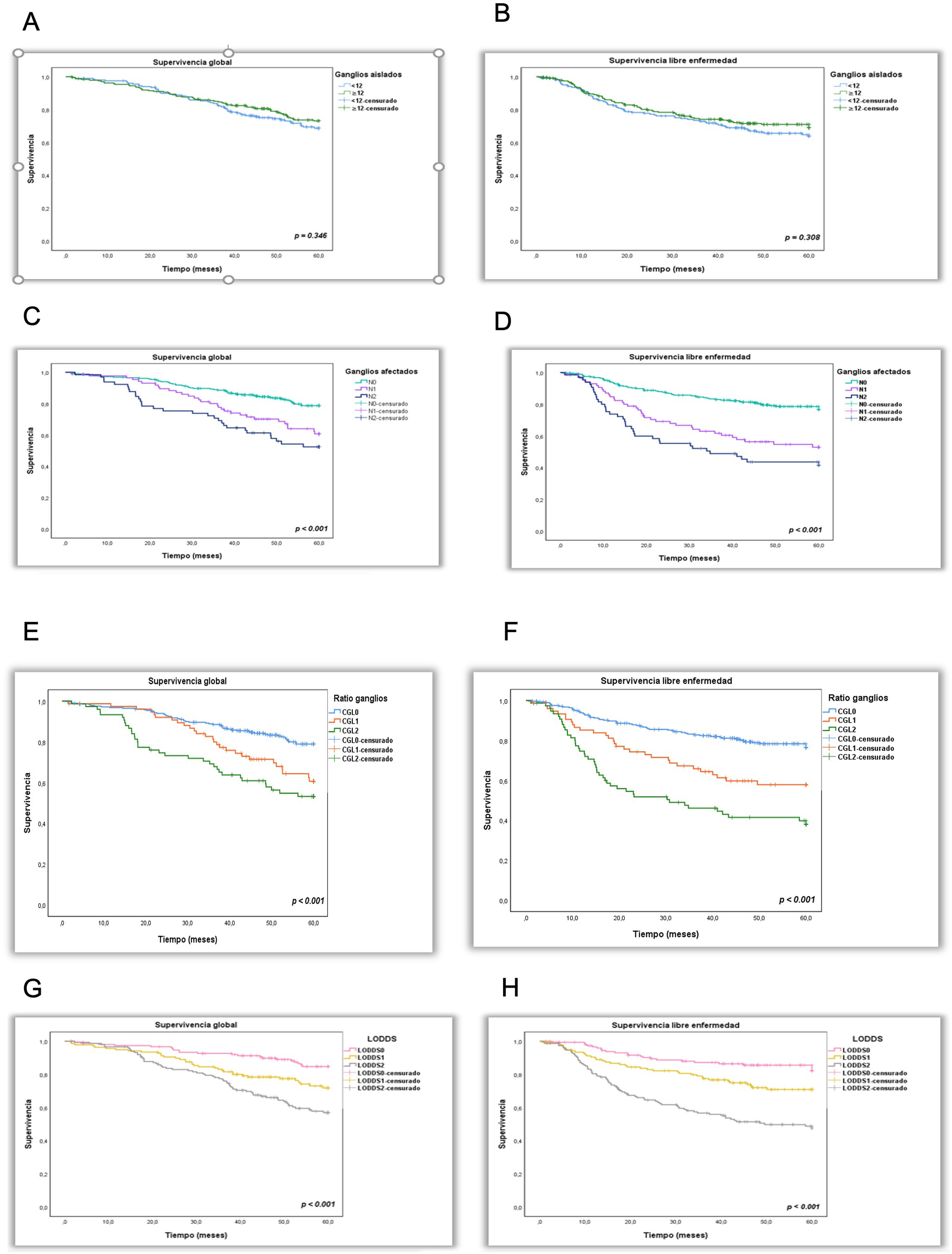
La SG y la SLE fueron del 73,7 y 62,5%, respectivamente. No hubo diferencias significativas entre los pacientes con NGE<12 o ≥12 (71,7 vs. 75,14%; p=0,346 y 63,9 vs 69,1; p=0,308).
En los subgrupos N0, N1 y N2, la SG fue del 78,8, 6,7 y 52,5%, respectivamente. La SG para los subgrupos CGL0, CGL1, CGL2 LODDS0, LODDS1 y LODDS2 fue del 78,9, 60,7, 53,2, 84,7, 71,9 y 57%, respectivamente. Fueron factores de riesgo independiente los subgrupos N1 y N2: HR: 1,83 (1,09-3,08; p=0,023) y HR: 1,82 (1,04-3,19; p=0,036); el subgrupo CGL2: HR: 2,16 (1,25-3,76; p=0,006) y los subgrupos LODDS1: HR: 1,91 (1,07-3,41; p=0,029) y LODDS2: HR: 2,62 (1,48-4,65; p=0,001).
La SLE fue del 76,8, 53 y 41,6% para los subgrupos N0, N1 y N2, respectivamente. En los subgrupos CGL0, CGL1 y CGL2 fue del 76,8, 57,9 y 38,1% y 82,3, 70,9 y 47,9% para los subgrupos LODDS0, LODDS1 y LODDS2, respectivamente. Los 3 sistemas se mostraron como factores pronósticos independientes para la SLE: N1: HR: 2,83 (1,77-4,53; p<0,001), N2: HR: 2,89 (1,71-4,87; p<0,001), CGL1: HR: 2,46 (1,49-4,06; p<0,001), CGL2: HR: 3,48 (2,09-5,81; p<0,001), LODDS1: HR: 2,57 (1,43-4,62; p=0,002) y LODDS2: HR: 4,51 (2,53-8,03; p<0,001).
La SG y la SLE disminuyen con el incremento del NGM (N0-N2; p<0,001) y a medida que los valores CGL y LODDS aumentan (CGL0-CGL2; p<0,001) (LODDS0-LODDS2; p<0,001) (fig. 1).
A y B) Curvas de supervivencia global y supervivencia libre de enfermedad según el método de Kaplan-Meier estratificado por número de ganglios extirpados (NGE); C y D) Clasificación N de la TNM; E y F) Ratio de ganglios linfáticos (CGL), G y H) Logaritmo de probabilidades de ganglios linfáticos positivos (LODDS).
Los 3 sistemas se identificaron como factores predictivos independientes de la SG y SLE.LODDS se mostró con una capacidad predictiva significativamente mayor para la SG (ABC:0.679. IC del 95% 0.612-0.728) y SLE (ABC: 0.711, IC del 95%, 0.659-0.763), con un valor de p=0.022, p=0.034 y p=0.022, p=0.007 en relación a los sistemas N y CGL, respectivamente (tabla 4; fig. 2).
Comparación del área bajo la curva de supervivencia global y supervivencia libre en enfermedad entre los 3 sistemas
| Supervivencia global | ABC (IC 95%) | Comparación ABC; Valor de p | ||
|---|---|---|---|---|
| p/ypN | CGL | LODDS | ||
| p/ypN | 0,627 (0,566-0,689) | — | ||
| CGL | 0,632 (0,571-0,694) | 0,328 | — | |
| LODDS | 0,679 (0,612-0,728) | 0,022 | 0,034 | — |
| Supervivencia libre de enfermedad | ||||
| p/ypN | 0,665 (0,602-0,717) | — | ||
| CGL | 0,668 (0,611-0,726) | 0,075 | — | |
| LODDS | 0,711 (0,659-0,763) | 0,002 | 0,007 | — |
ABC: área bajo la curva; CGL: ratio de ganglios linfáticos; IC 95%: intervalo de confianza del 95%; LODDS: logaritmo de probabilidades de ganglios linfáticos positivos; p/ypN: estadio N de la clasificación TNM.
La tabla 5 muestra la SG y la SLE de los subgrupos CGL y LODDS estratificados según el NGE y la estadificación p/ypN.
Supervivencia global y supervivencia libre de enfermedad según la estratificación en subgrupos
| NGE | p/ypN | CGL | ||||||
|---|---|---|---|---|---|---|---|---|
| SG | <12 (%) | ≥12 (%) | N0 (%) | N1 (%) | N2 (%) | CGLO (%) | CGL1 (%) | CGL2 (%) |
| CGL0CGL1CGL2 | 74,763,352,4 | 65,454,153 | 78,9 | 61,159,6 | 57,151,4 | |||
| Valor de p | 0,019 | <0,001 | 0,504 | 0,752 | ||||
| LODDS0LODDS1LODDS2 | 10075,354,9 | 83,466,756,7 | 84,77461,7 | 63,859,5 | 5052,8 | 84,774,157,9 | 61,260,5 | 53,2 |
| Valor de p | 0,003 | <0,001 | 0,023 | 0,609 | 0,555 | 0,018 | 0,994 | |
| SLE | <12 (%) | ≥12 (%) | N0 (%) | N1 (%) | N2 (%) | |||
| CGL0CGL1CGL2 | 71,449,033,7 | 82,262,940,4 | 76,4 | 57,836,0 | 57,138,5 | |||
| Valor de p | <0,001 | <0,001 | 0,047 | 0,049 | ||||
| LODDS0LODDS1LODDS2 | 83,972,347,4 | 82,264,947,7 | 82,372,165,5 | 67,948,3 | 50,041,4 | 82,372,356,3 | 64,955,2 | 38,1 |
| Valor de p | 0,001 | <0,001 | 0,039 | 0,181 | 0,955 | 0,015 | 0,570 | |
CGL: ratio de ganglios linfáticos; LODDS: logaritmo de probabilidades de ganglios linfáticos positivos; NGE: número de ganglios examinados; p/ypN: estadio N de la clasificación TNM.
La SG y SLE se valoró a los 5 años.
Con el incremento del valor de CGL la SG disminuye, independientemente de un NGE<12 (p=0,019) o ≥12 (p<0,001). Los subgrupos CGL discriminaron distintos porcentajes de SG, pero sin significación estadística entre pacientes N1 (p=0,504) y N2 (p=0,752).
La SG de pacientes N0 fue del 84,7, 74 y 61,7% en los pacientes de los subgrupos LODDS0, LODDS1 y LODDS2 (p=0,023), respectivamente. El valor del LODDS discriminó porcentajes de la SG, aunque sin significación estadística en los pacientes N1 (p=0,609) y N2 (p=0,555).
Con el incremento del valor de CGL, disminuye la SLE independientemente de un NGE<12 (p<0,001) o ≥12 (p<0,001). Con el incremento del valor del LODDS, disminuye la SLE independientemente de que un NGE<12 (p=0,001) o ≥12 (p<0,001).
Comparando los pacientes p/ypN1 y p/ypN2 de los subgrupos CGL2 (alto) y CGL1 (bajo) de acuerdo al punto de corte de 0,238, comprobamos que los primeros tenían peor SLE (0,047 y p=0,049, respectivamente). No había diferencias entre el subgrupo CGL2 p/ypN1 y el y/pN2 en la SG (p=0,793) y la SLE (p=0,828).
La SLE fue superior en los pacientes con estadificación p/ypN0 y LODDS0 (82,3%) que en los pacientes N0-LODDS1 (72,1%) (p=0,038) y N0- LODDS2 (65,5%) (p=0,039). LODDS1 y LODDS2 discriminan diferentes supervivencias en los pacientes de alto riesgo, N1 y N2, pero sin significación estadística (0,181 y p=0,955, respectivamente).
La SG fue superior en los pacientes LODDS0-CGL0 (84,7%) que en los pacientes LODDS1-CGL0 (74,1%) y LODDS2-CGL0 (57,9%) (0,025 y p=0,018, respectivamente).
El análisis de la SLE mostró que no existían diferencias significativas entre pacientes con CGL0 y CGL1 del subgrupo LODDS1 (p=0,338), ni entre pacientes con CGL0, CGL1 y CGL2 del subgrupo LODDS2 (p=0,066). En los pacientes CGL0, la SLE del subgrupo LODDS0 (82,3%) fue superior que la del subgrupo LODDS1 (72,3%) (p=0,041) y a la del subgrupo LODDS2 (56,3%) (p=0,015).
DiscusiónEn el presente estudio tanto el LODDS como el cociente ganglionar emergen como factores pronósticos independientes cruciales para la supervivencia en pacientes con cáncer de recto, superando en importancia al número de ganglios linfáticos resecado.
La recomendación de analizar al menos 12 ganglios para asegurar una estadificación correcta3 no se cumple en todos los especímenes resecados. El NGE dependerá de factores, algunos inmodificables, relacionados con el paciente, el tumor, empleo de QRTn, técnica quirúrgica y experiencia del cirujano y del patólogo7,8. La influencia de la neoadyuvancia en CGL y LODDS es desconocida9. Tras su uso, en aproximadamente la mitad de pacientes, no se consigue un NGE adecuado y el porcentaje de ganglios positivos recopilados es controvertido9–12.
Comprobamos un NGE subóptimo en el 46,1% de los pacientes y en el 61,7% tras QRTn. Con cirugía solo, el NGM fue significativamente mayor cuando se analizaron al menos 12 ganglios, sin embargo, esto no ocurrió en pacientes que recibieron QRTn, confirmando, igual que otros autores13,14, que el empleo de QRTn disminuye el NGE y la media de ganglios positivos, lo cual podría indicar una buena respuesta al tratamiento más que a una deficiente técnica quirúrgica o un examen histopatológico incorrecto15,16.
Un NGE≥ 12, no mejoró significativamente la SG o la SLE por ello sugerimos que este umbral puede ser incorrecto y debería revaluarse especialmente en pacientes que han recibido QRTn10. El sistema de estadificación N discrimina significativamente la supervivencia entre pacientes p/ypN0-N+, tiene una capacidad limitada entre pacientes p/ypN1-2 y las curvas de supervivencia de estos subgrupos se acercan.
El CGL se considera como factor pronóstico independiente de la supervivencia, pues clasifica pacientes con el mismo N en diferentes grupos pronósticos. Un CGL alto se asocia a peor SG y SLE, independientemente del NGE y se ha mostrado muy eficaz incluso después del tratamiento neoadyuvante17,18. Aunque el CGL mejora la estadificación N, presenta una serie de limitaciones. No existe un valor de corte definido y su variabilidad referida en cada estudio contribuye a la heterogeneidad19. Para unos autores5 pierde valor predictivo cuando se examinan menos de 10 ganglios, para otros es independiente del NGE19. Su capacidad discriminatoria disminuye cuando su valor es 0 o 1. Cuando su valor es 0, independientemente del NGE en pacientes N0, y cuando su valor es 1, es decir cuando el NGE fuese igual al NGM, potencialmente estaríamos introduciendo un valor pronostico falso y ambos valores del CGL conducen a un riesgo inevitable de migración de la estadificación.
Calculamos individualmente el CGL9 y, tras hallar la mediana de los pacientes con CGL>0, los dividimos en 3 subgrupos. Nuestros resultados indican que a medida que el CGL aumenta, disminuye significativamente la SG y la SLE, independientemente del grupo alto o bajo de NGE. Pacientes CGL0 y pacientes p/ypN0, por definición tienen una SG y SLE similar, por ello la clasificación del CGL no añade valor pronóstico a los pacientes con ganglios negativos. Igual que otros autores19–21, podemos confirmar que el CGL discrimina significativamente distintos porcentajes de SLE en pacientes de alto riesgo, con ganglios metastatizados, con la misma categoría p/ypN, sugiriendo que tiene un poder de estratificación superior que la estadificación N y podría ser utilizado, en pacientes con ganglios metastatizados, en la estrategia del seguimiento y o en el tratamiento adyuvante.
El LODDS ha sido identificado en varios cánceres como un factor pronóstico con más impacto en la supervivencia que el CGL y la estadificación N22,23. En este estudio, los 3 sistemas fueron identificados como factores pronósticos independientes, pero el LODDS se mostró, con un ABC más favorable. La supervivencia se redujo significativamente a medida que se incrementaban los valores del LODDS. Los pacientes LODDS2 presentaron un riesgo de 2,62 y 4,41 veces peor SG y SLE respecto al LODDS0.
El valor predictivo del LODDS era independiente del NGE y su poder pronóstico se preserva incluso cuando el NGE<12. Los pacientes LODDS2 presentaron peor SG y SLE, al margen de ser clasificados en el grupo alto o bajo de NGE y esto puede indicarnos que la asignación de esos subgrupos, por sí mismo, es insuficiente para proporcionar una buena información pronóstica y es el LODDS el que nos proporciona esa información entre los pacientes de los grupos NGE.
Algunos autores24 comunican que el LODDS podría explicar las diferencias de supervivencia encontradas en los grupos CGL. Una de sus ventajas sobre el CGL es que puede diferenciar subgrupos de riesgo dentro de la categoría N0, así como también diferenciar grupos de riesgo dentro de las categorías N1 y N225.
Nuestros resultados son concordantes con los de Persiani et al.26 y Li et al.27 en cuanto que, en pacientes N0, solo el LODDS tiene un rendimiento predictivo. El LODDS discrimina la supervivencia en pacientes N0 y permite una mejor estratificación que N y CGL en los pacientes que se habrían clasificado como de bajo riesgo. Delimita diferentes supervivencias en grupos individuales no solo del CGL1-2 y N1-2 sino entre pacientes, considerados de bajo riesgo. Por ello, igual que otros autores9, opinamos que el LODDS evita las singularidades en el caso de que ninguno o todos los ganglios examinados estén involucrados, discrimina entre pacientes con ganglios negativos, pero con un número diferente de ganglios examinados y minimiza el sesgo que podría producirse en otros sistemas.
Similarmente a los hallazgos de Arslan et al.28 en el cáncer de colon, comprobamos que las estadificaciones N y CGL no clasifican adecuadamente a pacientes con ganglios negativos. El LODDS proporciona información más valiosa que el CGL independientemente del NGE y debería incluirse en pacientes con cáncer de recto con ganglios negativos.
Aunque el cálculo de LODDS puede ser realizado por cualquier facultativo, para hacerlo más factible en nuestra práctica diaria, posiblemente un sistema informático que lo realice de manera automática sería una herramienta muy ventajosa.
Este estudio presenta limitaciones, su muestra es relativamente pequeña y es retrospectivo basado en una recogida prospectiva durante 9 años, período en el que nuestros protocolos no han variado sustancialmente, pero si lo han hecho los cuidados perioperatorios.
El sesgo por pérdida de pacientes en los que no se disponía de datos se seguimiento, al ser un porcentaje bajo hace muy poco probable que estos valores perdidos hayan modificado significativamente nuestros resultados y su exclusión del análisis es la aproximación más sencilla para manejar estos datos.
Sería preciso un estudio amplio y prospectivo para determinar el punto de corte óptimo del LODDS y su valor predictivo en la supervivencia.
ConclusionesLos resultados sugieren que el valor predictivo de los sistemas CGL y LODDS es independiente del NGE y su significado es superior al del sistema N, especialmente cuando el NGE<12.
El LODDS es superior, en grupos de pacientes de bajo o alto riesgo, como predictor de la SG y de la SLE y proporciona un rendimiento predictivo más preciso en los pacientes N0 que los sistemas N y CGL.
El LODDS identifica pacientes de alto riesgo que podrían beneficiarse de un seguimiento más estrecho o de un tratamiento adyuvante.
Responsabilidades éticasLos autores actuaron de acuerdo con los requisitos éticos de nuestra institución, del comité ético y con la declaración de Helsinki de 1964.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.