La biopsia de ganglio centinela (BGC) y los criterios ACOSOG-Z0011 han modificado el tratamiento axilar en la cirugía primaria del cáncer de mama. Por esto se realiza una revisión sistemática de los estudios que valoran el impacto del tratamiento axilar en la supervivencia. La búsqueda mostró 6.891 artículos potencialmente elegibles, de los cuales, 23 ensayos clínicos y 12 metaanálisis publicados entre 1980 y 2017 cumplieron los criterios del estudio. La revisión desveló que la linfadenectomía axilar (LA) puede ser omitida en pacientes pN0 y pN1mic, sin comprometer la supervivencia. En pacientes pN1, se propone no tratar la axila o sustituir la LA por radioterapia axilar (RA). Las principales limitaciones de este estudio es que los ensayos son antiguos, no utilizan terapias dianas ni categorizan el riesgo de recaída. En conclusión, el tratamiento axilar puede ser suprimido en pacientes sin afectación metastásica o con micrometástasis del ganglio centinela. No obstante, no hay evidencia para establecer una recomendación de tratamiento axilar en las pacientes con afectación ganglionar N1, por lo que precisan de un análisis individualizado de sus factores de riesgo.
Sentinel lymph node biopsy and ACOSOG-Z0011 criteria have modified axillary treatment in breast cancer surgery. We performed a systematic review of studies assessing the impact of axillary treatment on survival. The search showed 6891 potentially eligible items. Of them, 23 clinical trials and 12 meta-analyses published between 1980 and 2017 met the study criteria. The review revealed that axillary lymph node dissection (ALND) can be omitted in patients pN0 and pN1mic, without compromising survival. In patients pN1 it is proposed not to treat the axilla or replace ALND for axillary radiotherapy. The main limitations of this study are the inclusion of old tests that do not use therapeutic targets and lack of risk categorization of relapse. In conclusion, axillary treatment can be avoided in patients without metastatic involvement or micrometastases in the sentinel lymph node. However, there is no evidence to make a recommendation of axillary treatment in N1 patients, so individualized analysis of patient risk factors is needed.
Durante los últimos años hemos asistido a un cambio en la toma de decisiones para el tratamiento adyuvante en la mujer con cáncer de mama. Antaño, la estadificación de la enfermedad basada en el tamaño del tumor y en la afectación ganglionar constituían los elementos para la elección del tratamiento locorregional y sistémico. En la actualidad, los factores biológicos del tumor son la base para la selección del tratamiento sistémico, de tal forma que la elección de los fármacos queda casi exclusivamente limitada a las características inmunohistoquímicas o genéticas del tumor1-4. Por el contrario, la decisión del tratamiento axilar no ha experimentado esta evolución y, por ello, la estadificación axilar continúa siendo el factor clave para la indicación de una linfadenectomía axilar (LA) o una radioterapia axilar (RA). Actualmente está decisión es controvertida, por diferentes motivos. El primero, ensayos clínicos (EC)5-10 antiguos con grupos seleccionados de pacientes han indicado que el tratamiento axilar no tiene impacto en la supervivencia global (SG). El segundo, otros ensayos11-13 demuestran que la LA puede ser suprimida en un grupo seleccionado de mujeres con afectación micrometastásica del ganglio centinela (GC) sin comprometer la supervivencia libre de enfermedad (SLE) y la SG. Finalmente, algunos EC14,15 han demostrado la no inferioridad de la RA frente a la LA en mujeres con GC metastásico, con menor incidencia de linfedema. Estos hechos han condicionado unas modificaciones en la táctica del tratamiento axilar en mujeres con afectación N1 (de 1 a 3 ganglios).
El objetivo de este estudio es realizar una revisión sistemática para analizar el impacto del tratamiento axilar (LA, RA) en la cirugía primaria del cáncer de mama, con la finalidad de establecer recomendaciones clínicas.
MétodoSe realizó una búsqueda bibliográfica en PubMed, la Librería Cochrane y Google Académico introduciendo las palabras: «linfadenectomía axilar», «radioterapia axilar» y «micrometástasis», asociadas a las palabras «cáncer de mama». La búsqueda se formuló de acuerdo con el modelo «PICOS», en donde P: mujeres con cáncer de mama y cirugía primaria; I: linfadenectomía axilar; C: RA o seguimiento; O: SG y morbilidad; S: ensayos clínicos y metaanálisis. Se utilizó la metodología PRISMA16. Se realizó la búsqueda de los EC en evolución en la página www.clinicaltrials.gov.
Criterios de inclusión y exclusión: se incluyen los EC que han analizado la SG con al menos 5 años de seguimiento medio, así como los metaanálisis de calidad que comparan los tratamientos axilares publicados entre 1980 y el 2017 en español o inglés. La población a estudio son mujeres con cirugía primaria de su enfermedad (Tis-T4a, N0-N3, M0). Finalmente, se incluyen en esta revisión aquellos EC en evolución que analizan el impacto del tratamiento axilar en la supervivencia, con la finalidad de discutir las líneas de investigación futuras. Se excluyeron estudios duplicados, publicados en otros idiomas y aquellos que, por su metodología, tiempo de seguimiento o número de pacientes incluidos no se consideraron relevantes. De igual forma, se excluyeron los EC y metaanálisis que no informaron de la SG o que incluyeron a pacientes con quimioterapia neoadyuvante o carcinoma de mama metastásico (estadio IV).
Dos revisores (BA y AGN) examinaron los títulos y los resúmenes de las referencias detectadas en la búsqueda para identificar las publicaciones potencialmente elegibles. Se obtuvo el texto completo de los artículos seleccionados a través de la lectura del título/resumen y se aplicaron los criterios de selección para revisar cada ensayo. Los 2revisores evaluaron de forma independiente cada uno de los ensayos potencialmente elegibles para su inclusión en la revisión y las discrepancias se resolvieron mediante discusión y, por acuerdo mutuo, se eligieron aquellos de mayor importancia. Se seleccionaron los EC y metaanálisis que analizan el tratamiento axilar en la cirugía primaria del cáncer de mama. Finalmente, se realizó un análisis crítico para establecer recomendaciones para la práctica clínica. El nivel de evidencia y recomendación se ha establecido según los criterios de la U. S. Preventive Service Task Force17.
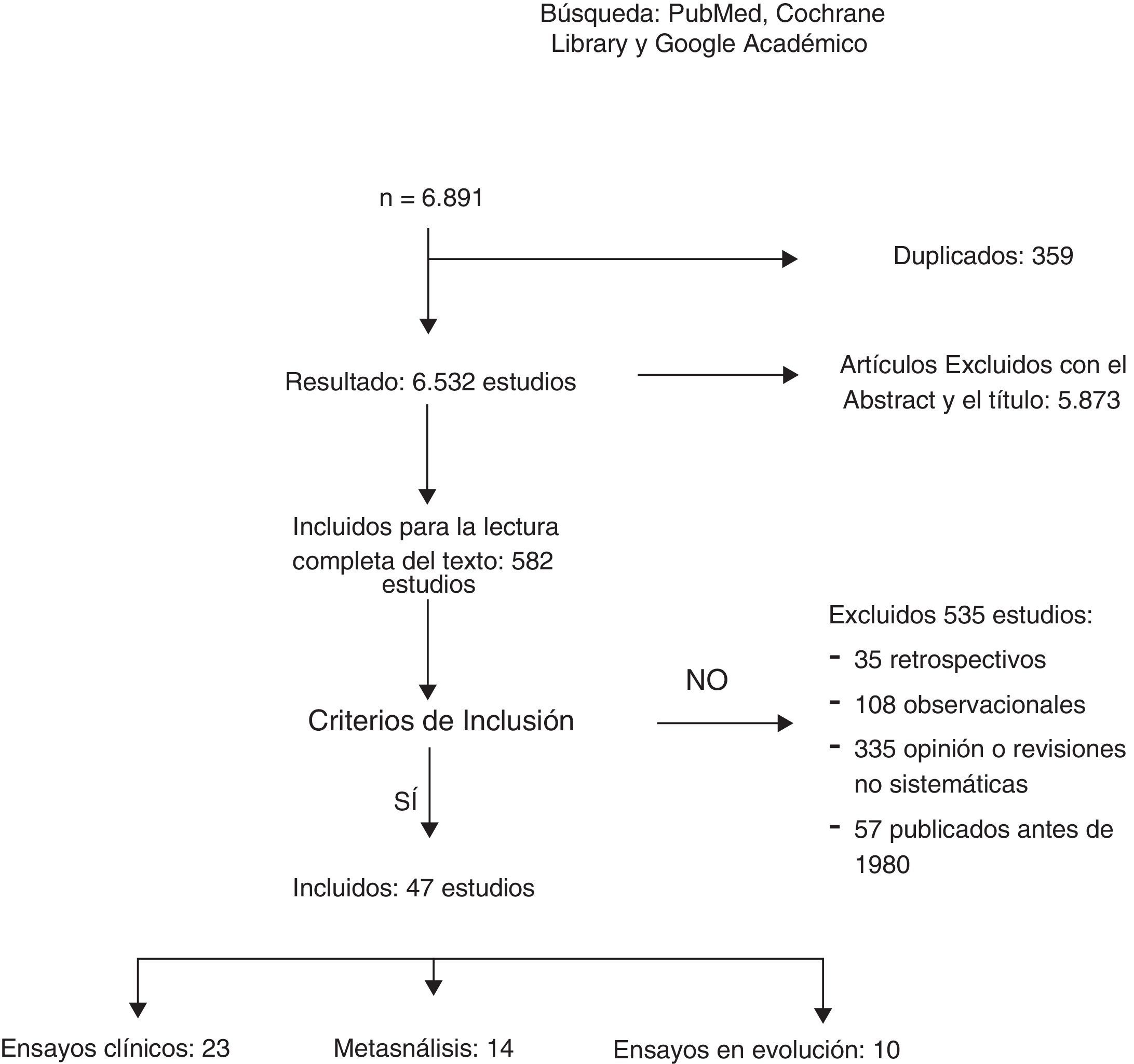
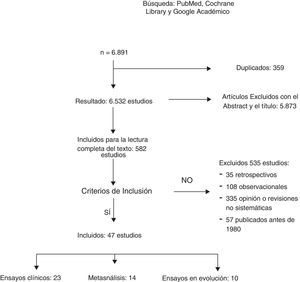
ResultadosUn total de 6.891 artículos fueron potencialmente elegibles, de los cuales 359 estaban duplicados. Después de la lectura del título o del resumen se excluyeron 5.873 estudios no relacionados con el tema y 535 fueron excluidos: 35 por ser retrospectivos, 108 por ser estudios observacionales; 335 por opinión o con metodología incorrecta y 57 por estar publicados antes de 1980. Un total de 23 EC y 12 metaanálisis fueron incluidos para la revisión sistemática (fig. 1). La búsqueda identificó 13 EC en marcha que estudian el tratamiento axilar en distintos escenarios clínicos.
Linfanedectomía axilar en pacientes sin afectación ganglionar (N0)Se identificaron 7 EC que analizaban el impacto de la LA en la SG de pacientes sin afectación clínica de la axila (cN0) previamente a la introducción de la biopsia de ganglio centinela (BGC)6,18,19. Cuatro de ellos9,10,18,19 compararon la LA con el seguimiento y no evidenciaron diferencias significativas en la SG de ambos grupos después de un seguimiento medio de al menos 5 años. No obstante, 2de estos EC9,10 solo incluyeron a pacientes ancianas. Otros 2EC compararon la LA frente a la RA6-8. Uno de ellos, de Cabanes et al.7, describe un beneficio significativo de la LA, sin embargo, en el seguimiento a largo plazo (180 meses), este beneficio desaparece. Finalmente, el estudio NSABP B-04 aleatorizó a los pacientes con mastectomía a LA, RA y seguimiento, sin evidenciar beneficios en la SLE ni SG en pacientes con axila clínicamente negativa (cN0) sin una LA (tabla 1).
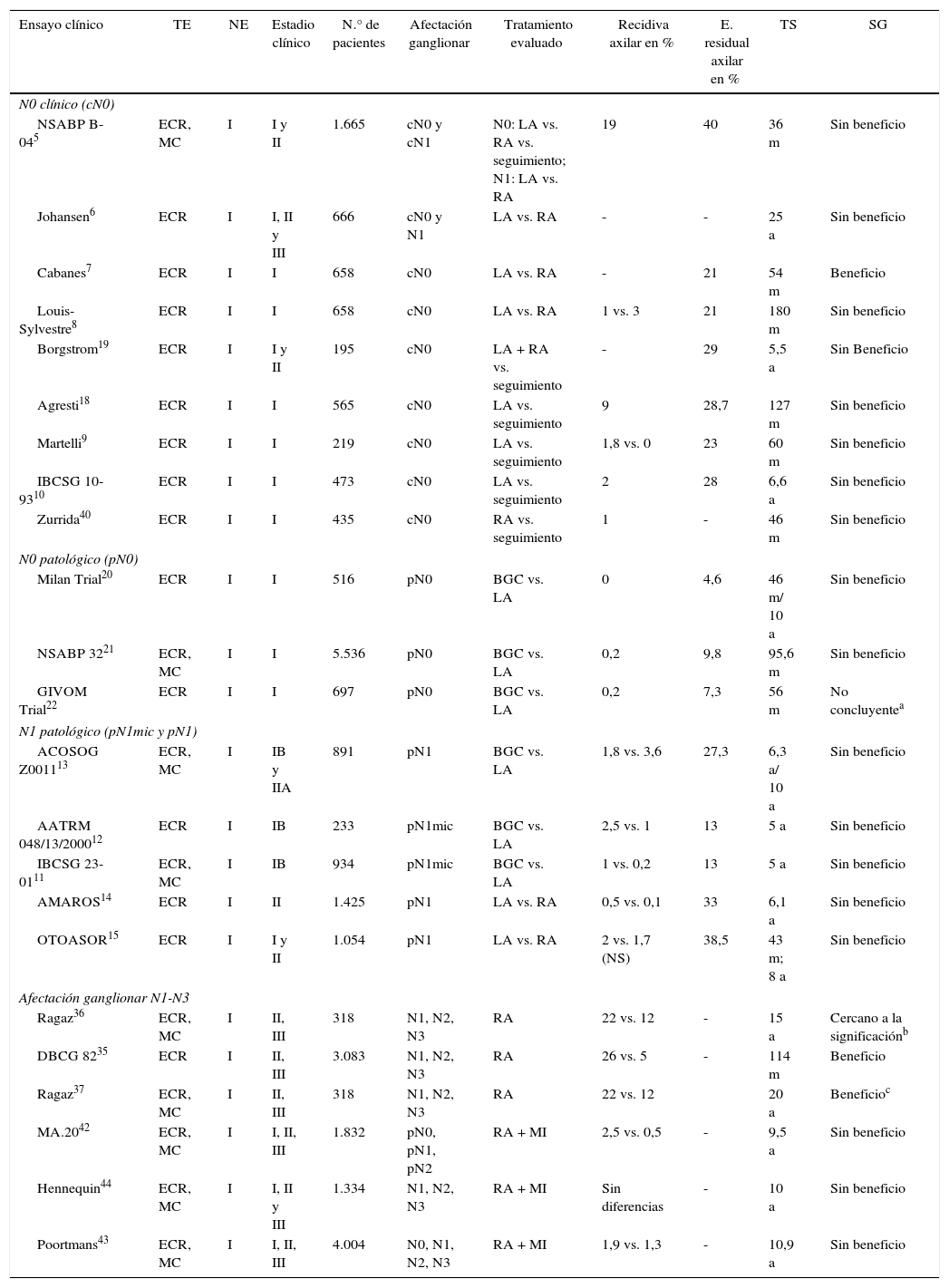
Ensayos clínicos que analizan el impacto del tratamiento axilar (LA y RA) sobre la supervivencia global
| Ensayo clínico | TE | NE | Estadio clínico | N.° de pacientes | Afectación ganglionar | Tratamiento evaluado | Recidiva axilar en % | E. residual axilar en % | TS | SG |
|---|---|---|---|---|---|---|---|---|---|---|
| N0 clínico (cN0) | ||||||||||
| NSABP B-045 | ECR, MC | I | I y II | 1.665 | cN0 y cN1 | N0: LA vs. RA vs. seguimiento; N1: LA vs. RA | 19 | 40 | 36 m | Sin beneficio |
| Johansen6 | ECR | I | I, II y III | 666 | cN0 y N1 | LA vs. RA | - | - | 25 a | Sin beneficio |
| Cabanes7 | ECR | I | I | 658 | cN0 | LA vs. RA | - | 21 | 54 m | Beneficio |
| Louis-Sylvestre8 | ECR | I | I | 658 | cN0 | LA vs. RA | 1 vs. 3 | 21 | 180 m | Sin beneficio |
| Borgstrom19 | ECR | I | I y II | 195 | cN0 | LA + RA vs. seguimiento | - | 29 | 5,5 a | Sin Beneficio |
| Agresti18 | ECR | I | I | 565 | cN0 | LA vs. seguimiento | 9 | 28,7 | 127 m | Sin beneficio |
| Martelli9 | ECR | I | I | 219 | cN0 | LA vs. seguimiento | 1,8 vs. 0 | 23 | 60 m | Sin beneficio |
| IBCSG 10-9310 | ECR | I | I | 473 | cN0 | LA vs. seguimiento | 2 | 28 | 6,6 a | Sin beneficio |
| Zurrida40 | ECR | I | I | 435 | cN0 | RA vs. seguimiento | 1 | - | 46 m | Sin beneficio |
| N0 patológico (pN0) | ||||||||||
| Milan Trial20 | ECR | I | I | 516 | pN0 | BGC vs. LA | 0 | 4,6 | 46 m/ 10 a | Sin beneficio |
| NSABP 3221 | ECR, MC | I | I | 5.536 | pN0 | BGC vs. LA | 0,2 | 9,8 | 95,6 m | Sin beneficio |
| GIVOM Trial22 | ECR | I | I | 697 | pN0 | BGC vs. LA | 0,2 | 7,3 | 56 m | No concluyentea |
| N1 patológico (pN1mic y pN1) | ||||||||||
| ACOSOG Z001113 | ECR, MC | I | IB y IIA | 891 | pN1 | BGC vs. LA | 1,8 vs. 3,6 | 27,3 | 6,3 a/ 10 a | Sin beneficio |
| AATRM 048/13/200012 | ECR | I | IB | 233 | pN1mic | BGC vs. LA | 2,5 vs. 1 | 13 | 5 a | Sin beneficio |
| IBCSG 23-0111 | ECR, MC | I | IB | 934 | pN1mic | BGC vs. LA | 1 vs. 0,2 | 13 | 5 a | Sin beneficio |
| AMAROS14 | ECR | I | II | 1.425 | pN1 | LA vs. RA | 0,5 vs. 0,1 | 33 | 6,1 a | Sin beneficio |
| OTOASOR15 | ECR | I | I y II | 1.054 | pN1 | LA vs. RA | 2 vs. 1,7 (NS) | 38,5 | 43 m; 8 a | Sin beneficio |
| Afectación ganglionar N1-N3 | ||||||||||
| Ragaz36 | ECR, MC | I | II, III | 318 | N1, N2, N3 | RA | 22 vs. 12 | - | 15 a | Cercano a la significaciónb |
| DBCG 8235 | ECR | I | II, III | 3.083 | N1, N2, N3 | RA | 26 vs. 5 | - | 114 m | Beneficio |
| Ragaz37 | ECR, MC | I | II, III | 318 | N1, N2, N3 | RA | 22 vs. 12 | 20 a | Beneficioc | |
| MA.2042 | ECR, MC | I | I, II, III | 1.832 | pN0, pN1, pN2 | RA + MI | 2,5 vs. 0,5 | - | 9,5 a | Sin beneficio |
| Hennequin44 | ECR, MC | I | I, II y III | 1.334 | N1, N2, N3 | RA + MI | Sin diferencias | - | 10 a | Sin beneficio |
| Poortmans43 | ECR, MC | I | I, II, III | 4.004 | N0, N1, N2, N3 | RA + MI | 1,9 vs. 1,3 | - | 10,9 a | Sin beneficio |
a: años; ECA: ensayo clínico aleatorizado; FN: falso negativo; m: meses; MC: multicéntrico; MI: mamaria interna; NE: nivel de evidencia; RA: radioterapia axilar; SG: supervivencia global; TE: tipo de estudio; TS: tiempo de seguimiento.
Tres EC20-22 que incluyen más de 7.000 pacientes han comparado la BGC frente a la LA en las pacientes sin afectación patológica de la axila (pN0) y evidencian una incidencia similar de recidivas axilares y SG, con menor morbilidad en las pacientes con BGC (tabla 1).
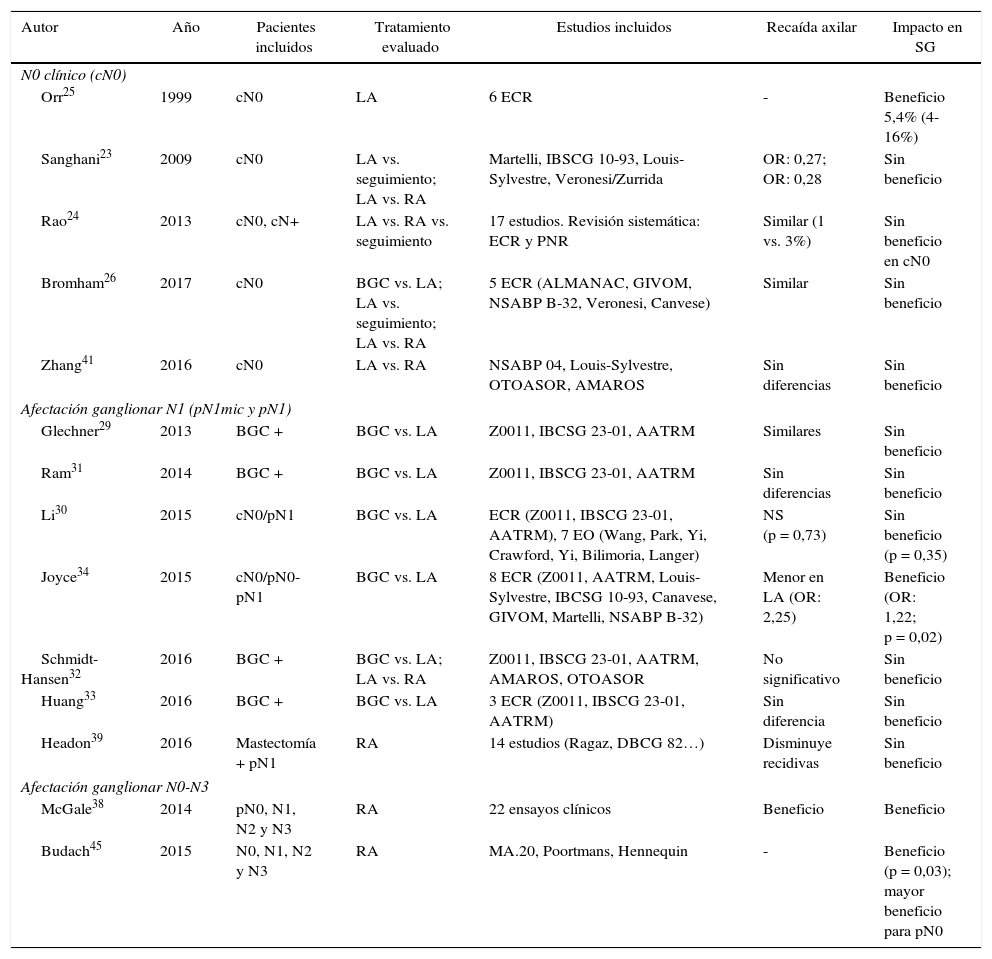
Tres metaanálisis recogen los resultados de estos estudios23-25. Los metaanálisis de Sanghani et al.23 y de Rao et al.24 no demuestran beneficio de la LA en la SG de las pacientes sin afectación clínica de la axila (cN0). Por el contrario, el metaanálisis de Orr25 describe un beneficio del 5% en la supervivencia de mujeres con una LA. Sin embargo, este estudio presenta 2limitaciones: en primer lugar, se incluyen pocos pacientes con tumores T1a y, por ello, la extrapolación de estos resultados puede ser inadecuada, ya que actualmente un gran número de pacientes presentan tumores no palpables. En segundo lugar, ninguna paciente recibió quimioterapia adyuvante, lo que podría influir en la reducción del riesgo evidenciado en el metaanálisis (tabla 2). Finalmente, la revisión de la Cochrane de 201726 evidencia similar SG en pacientes tratadas con una BGC y aquellas con una LA.
Metaanálisis que estudian el impacto del tratamiento axilar (RA o LA)
| Autor | Año | Pacientes incluidos | Tratamiento evaluado | Estudios incluidos | Recaída axilar | Impacto en SG |
|---|---|---|---|---|---|---|
| N0 clínico (cN0) | ||||||
| Orr25 | 1999 | cN0 | LA | 6 ECR | - | Beneficio 5,4% (4-16%) |
| Sanghani23 | 2009 | cN0 | LA vs. seguimiento; LA vs. RA | Martelli, IBSCG 10-93, Louis-Sylvestre, Veronesi/Zurrida | OR: 0,27; OR: 0,28 | Sin beneficio |
| Rao24 | 2013 | cN0, cN+ | LA vs. RA vs. seguimiento | 17 estudios. Revisión sistemática: ECR y PNR | Similar (1 vs. 3%) | Sin beneficio en cN0 |
| Bromham26 | 2017 | cN0 | BGC vs. LA; LA vs. seguimiento; LA vs. RA | 5 ECR (ALMANAC, GIVOM, NSABP B-32, Veronesi, Canvese) | Similar | Sin beneficio |
| Zhang41 | 2016 | cN0 | LA vs. RA | NSABP 04, Louis-Sylvestre, OTOASOR, AMAROS | Sin diferencias | Sin beneficio |
| Afectación ganglionar N1 (pN1mic y pN1) | ||||||
| Glechner29 | 2013 | BGC + | BGC vs. LA | Z0011, IBCSG 23-01, AATRM | Similares | Sin beneficio |
| Ram31 | 2014 | BGC + | BGC vs. LA | Z0011, IBSCG 23-01, AATRM | Sin diferencias | Sin beneficio |
| Li30 | 2015 | cN0/pN1 | BGC vs. LA | ECR (Z0011, IBSCG 23-01, AATRM), 7 EO (Wang, Park, Yi, Crawford, Yi, Bilimoria, Langer) | NS (p = 0,73) | Sin beneficio (p = 0,35) |
| Joyce34 | 2015 | cN0/pN0-pN1 | BGC vs. LA | 8 ECR (Z0011, AATRM, Louis-Sylvestre, IBCSG 10-93, Canavese, GIVOM, Martelli, NSABP B-32) | Menor en LA (OR: 2,25) | Beneficio (OR: 1,22; p = 0,02) |
| Schmidt-Hansen32 | 2016 | BGC + | BGC vs. LA; LA vs. RA | Z0011, IBSCG 23-01, AATRM, AMAROS, OTOASOR | No significativo | Sin beneficio |
| Huang33 | 2016 | BGC + | BGC vs. LA | 3 ECR (Z0011, IBSCG 23-01, AATRM) | Sin diferencia | Sin beneficio |
| Headon39 | 2016 | Mastectomía + pN1 | RA | 14 estudios (Ragaz, DBCG 82…) | Disminuye recidivas | Sin beneficio |
| Afectación ganglionar N0-N3 | ||||||
| McGale38 | 2014 | pN0, N1, N2 y N3 | RA | 22 ensayos clínicos | Beneficio | Beneficio |
| Budach45 | 2015 | N0, N1, N2 y N3 | RA | MA.20, Poortmans, Hennequin | - | Beneficio (p = 0,03); mayor beneficio para pN0 |
BGC: biopsia del ganglio centinela; ECA: ensayo clínico aleatorizado; EO: estudios observacionales; LA: linfadenectomía axilar; PNA: estudio prospectivo no aleatorizado; RA: radioterapia axilar; SG: supervivencia global.
Micrometástasis (pN1mic). Dos EC11,12 comparan la LA frente a la observación en pacientes con afectación micrometastásica de la axila en la cirugía conservadora y la mastectomía. En ambos EC el seguimiento medio de 5 años no mostró diferencias significativas en la SLE ni en la SG entre ambos grupos, por lo que los autores concluyen que la LA puede omitirse en mujeres con afectación micrometastásica del GC (tabla 1).
Macrometástasis (pN1). El ensayo ACOSOG-Z001113 es el único que analiza de forma específica el beneficio de la LA en mujeres con macrometástasis del GC. Este estudio incluyó mujeres con hasta 2 GC metastásicos (44,8% con micrometástasis) intervenidas mediante cirugía conservadora y radioterapia, aleatorizadas a seguimiento o LA. Los datos actualizados de este EC con un seguimiento medio de 9,25 años27 muestran una incidencia similar de recaídas axilares (BGC: 1,5% y LA: 0,5%) y SG en ambos grupos, sin diferencias en las recaídas regionales entre las pacientes con radioterapia de los 3niveles ganglionares y las que solo recibieron campos tangenciales. Los autores concluyen que, en un grupo de mujeres con carcinoma de mama en estadio precoz y afectación del GC, se puede omitir la LA (tabla 1). Algunos autores han señalado que este estudio presenta ciertas limitaciones y entre ellas destacan el cierre precoz del estudio (891 pacientes en vez de 1.900 que se pretendían), la inclusión mayoritaria de pacientes con tumores luminales (80%), la no realización de estudio inmunohistoquímico del GC y, especialmente, la omisión de la descripción de los campos de radioterapia ganglionar. Este último factor llevó a los autores del ACOSOG-Z001113 a revisar la planificación de los campos de radioterapia utilizados en las pacientes incluidas en el estudio. En 2014 los autores publicaron un artículo con el análisis de los campos de radioterapia y constataron que el 81,1% de las pacientes solo recibieron radioterapia de la mama y que no existen diferencias en la incidencia de recaídas regionales entre las pacientes con y sin RA28.
Seis metaanálisis29-34 han analizado el impacto de la LA en mujeres con metástasis del GC (tabla 2). Cinco de ellos29-33 determinan que, en las pacientes con axila clínicamente negativa y afectación micrometastásica del GC (pN1mic), la supresión de la LA permite un control local adecuado sin comprometer la SG. Por el contrario, el metaanálisis de Joyce et al.34 evidenció beneficio de la LA en términos de recaída axilar y SG.
Radioterapia axilar en pacientes con afectación ganglionar (N1-N3)Dos EC, el DBCG 8235 y el de Ragaz et al.36,37, analizan el impacto de la RA en la supervivencia de pacientes con un carcinoma mamario (tabla 1). Ambos encontraron una disminución significativa de las recaídas locorregionales y de las metástasis a distancia, que se traduce en un incremento en la SG a largo plazo en las pacientes con metástasis en 4 o más ganglios linfáticos y radioterapia regional. El EC de Ragaz36,37 determinó los mismos beneficios para las pacientes con afectación de entre 1 y 3 ganglios.
Dos metaanálisis38,39 analizan el impacto de la radioterapia ganglionar en pacientes con afectación axilar. El de McGale et al.38, que incluye 22 EC aleatorizados, evidencia beneficio en el control locorregional y la SG a los 15 años de los pacientes con afectación axilar (N1, N2 y N3) que asociaron radioterapia tras una mastectomía. El metaanálisis de Headon et al.39 valoró la irradiación ganglionar en pacientes con afectación N1 y una mastectomía y evidenció una disminución del riesgo de recaída locorregional, con mínimo impacto en la SG (tabla 2).
Radioterapia axilar en pacientes sin afectación clínico ganglionar (cN0)Dos estudios5,40 analizan el efecto de la RA sin afectación clínica de la axila (cN0). El primero de ellos, el NSABP B-045, no evidenció diferencias en la SG de mujeres con o sin tratamiento axilar. El estudio de Zurrida et al.40 incluyó a 435 mujeres con tumores T1 y axila clínicamente negativa (cN0), sin cirugía axilar (no LA ni BGC), aleatorizadas a seguimiento o RA y solo evidenció un discreto incremento de las recaídas axilares en el grupo sin tratamiento axilar (1 vs. 0,5%), sin impacto en la supervivencia (tabla 1). Igualmente, el metaanálisis de McGale et al.38 no encontró beneficio de irradiar la axila en pacientes N0.
Radioterapia axilar como alternativa a la linfadenectomía axilar en pacientes con ganglio centinela metastásicoDos EC, el AMAROS14 y el OTOASOR15, han analizado el impacto de la RA como una alternativa a la LA en las pacientes N1 (tabla 1). En ambos EC se estudió la no inferioridad de la radioterapia ganglionar frente a la LA en pacientes con axila clínicamente negativa y afectación metastásica del GC. No se evidenciaron diferencias significativas en las recidivas axilares ni en la SG a 5 años entre ambos grupos, con una menor tasa de linfedemas en las mujeres sin una LA. Los autores concluyen que la radioterapia ganglionar es una alternativa válida frente a la LA en estas pacientes.
Los resultados de estos 2EC14,15 fueron incluidos en el metaanálisis de Zhang et al.41 y el de Schmidt-Hansen et al.32 y evidenciaron similar SLE y SG en pacientes pN1 tratadas con RA sin una LA (tabla 2).
Radioterapia de la mamaria internaTres EC42-44 evalúan la eficacia de la irradiación de la mamaria interna (tabla 1). El MA.2042 incluyó pacientes con cirugía conservadora, con afectación axilar N1 o sin afectación ganglionar y factores de riesgo de recaída local, a las cuales aleatorizó a radioterapia ganglionar (incluida la cadena mamaria interna) o seguimiento. Todas las pacientes con afectación ganglionar tenían una LA. No se evidenciaron diferencias significativas en la SG a los 10 años entre ambos grupos, pero sí una disminución de la tasa de recidiva de la enfermedad. El segundo de los EC, de Poortmans et al.43, incluyó a más de 4.000 pacientes con tumores centrales o mediales de mama en estadio I, II o III, con LA en caso de afectación ganglionar, y analizó el impacto de la radioterapia de la mamaria interna. Los resultados del estudio no mostraron diferencias para la SG, aunque se evidenció una disminución de las recaídas locorregionales y metástasis a distancia en el grupo irradiado. Ambos estudios concluyen que la selección individualizada del esquema terapéutico es la clave para mejorar la supervivencia. El EC multicéntrico de Hennequin et al.44 aleatorizó a pacientes con afectación ganglionar (N1-N3) o tumores mediales a irradiación o no de la cadena mamaria interna. Después de 10 años de seguimiento no evidenció beneficio en el control local de la enfermedad ni en la SG.
El metaanálisis de Budach et al.45 (tabla 2) que incluyó estos 3EC concluye que la irradiación de la cadena mamaria interna genera cierto beneficio en la SG, aunque este beneficio a los 10 años es mínimo (1 vs. 3,3%).
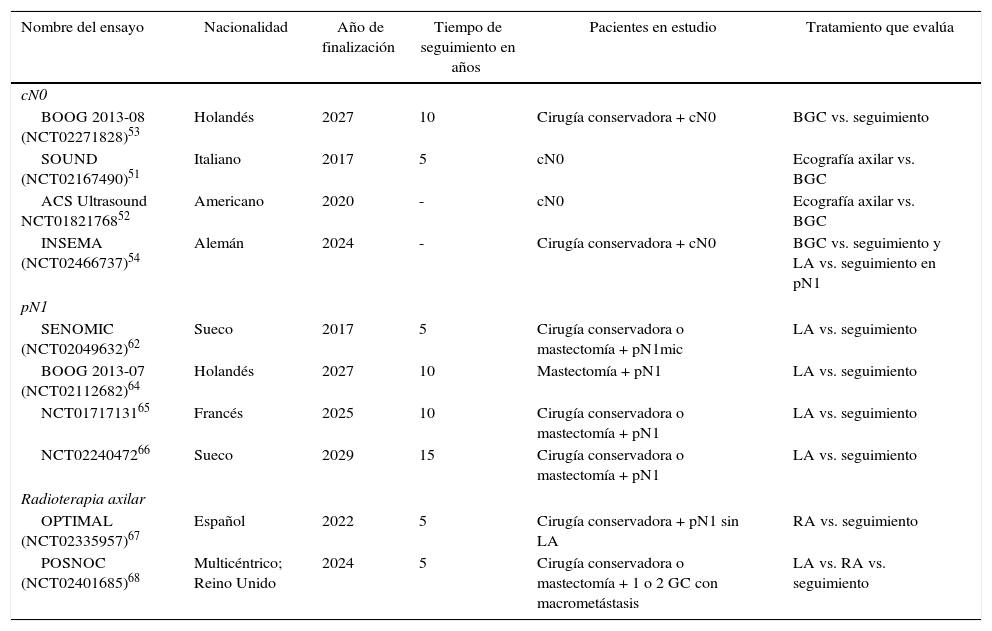
DiscusiónDiversos EC han demostrado un riesgo de recurrencia axilar entre el 19 y el 37% en axilas clínicamente negativas que no reciben tratamiento (sin LA ni radioterapia), y puede reducirse al 0-3,5% mediante una LA o RA46-49. Estos resultados muestran la importancia de la evaluación axilar, ya sea mediante ecografía o BGC, para identificar a las mujeres con afectación ganglionar sin evidencia clínica, que se beneficiarán del tratamiento axilar. Sin embargo, los ensayos realizados previamente a la introducción de la BGC5-10 no demuestran diferencias en la supervivencia de las pacientes con axila clínicamente negativa tratadas con LA, RA o seguimiento y tampoco los metaanálisis23,24 que incluyen estos estudios, a pesar de una enfermedad residual axilar que oscila entre el 21 y el 40%. Estos EC5-10 son antiguos, por lo que sus resultados no son superponibles en la actualidad. Posteriormente, la introducción de la BGC ha demostrado la seguridad en la supresión de la LA en las pacientes sin afectación metastásica del GC. Este método de estadificación no compromete la SLE ni la SG, a pesar de un 10% de falsos negativos, y se obtiene una menor morbilidad. Estos estudios constituyen la base científica para no tratar la axila (ni LA ni RA) en mujeres sin afectación metastásica del GC (pN0) y esta recomendación se recoge en las guías clínicas internacionales2,3,50 (tabla 3). En la actualidad, 4EC en marcha evalúan la necesidad de una BGC en las pacientes con axila clínicamente negativa al diagnóstico y compararán la estadificación axilar mediante ecografía frente a la BGC51-54. Sus resultados se publicarán entre el año 2017 y 2027 (tabla 4).
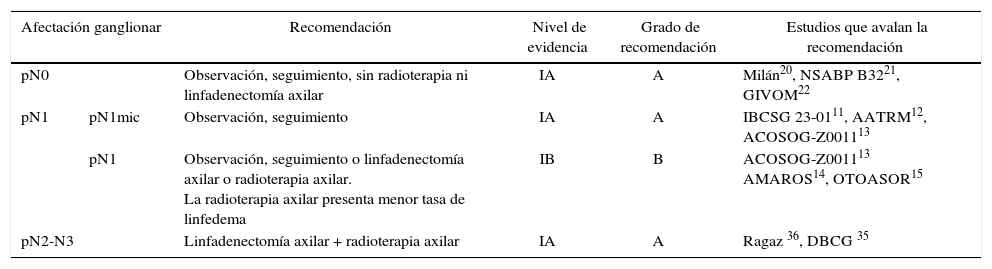
Recomendaciones de tratamiento axilar según afectación ganglionar
| Afectación ganglionar | Recomendación | Nivel de evidencia | Grado de recomendación | Estudios que avalan la recomendación | |
|---|---|---|---|---|---|
| pN0 | Observación, seguimiento, sin radioterapia ni linfadenectomía axilar | IA | A | Milán20, NSABP B3221, GIVOM22 | |
| pN1 | pN1mic | Observación, seguimiento | IA | A | IBCSG 23-0111, AATRM12, ACOSOG-Z001113 |
| pN1 | Observación, seguimiento o linfadenectomía axilar o radioterapia axilar. La radioterapia axilar presenta menor tasa de linfedema | IB | B | ACOSOG-Z001113 AMAROS14, OTOASOR15 | |
| pN2-N3 | Linfadenectomía axilar + radioterapia axilar | IA | A | Ragaz 36, DBCG 35 | |
Ensayos clínicos en evolución
| Nombre del ensayo | Nacionalidad | Año de finalización | Tiempo de seguimiento en años | Pacientes en estudio | Tratamiento que evalúa |
|---|---|---|---|---|---|
| cN0 | |||||
| BOOG 2013-08 (NCT02271828)53 | Holandés | 2027 | 10 | Cirugía conservadora + cN0 | BGC vs. seguimiento |
| SOUND (NCT02167490)51 | Italiano | 2017 | 5 | cN0 | Ecografía axilar vs. BGC |
| ACS Ultrasound NCT0182176852 | Americano | 2020 | - | cN0 | Ecografía axilar vs. BGC |
| INSEMA (NCT02466737)54 | Alemán | 2024 | - | Cirugía conservadora + cN0 | BGC vs. seguimiento y LA vs. seguimiento en pN1 |
| pN1 | |||||
| SENOMIC (NCT02049632)62 | Sueco | 2017 | 5 | Cirugía conservadora o mastectomía + pN1mic | LA vs. seguimiento |
| BOOG 2013-07 (NCT02112682)64 | Holandés | 2027 | 10 | Mastectomía + pN1 | LA vs. seguimiento |
| NCT0171713165 | Francés | 2025 | 10 | Cirugía conservadora o mastectomía + pN1 | LA vs. seguimiento |
| NCT0224047266 | Sueco | 2029 | 15 | Cirugía conservadora o mastectomía + pN1 | LA vs. seguimiento |
| Radioterapia axilar | |||||
| OPTIMAL (NCT02335957)67 | Español | 2022 | 5 | Cirugía conservadora + pN1 sin LA | RA vs. seguimiento |
| POSNOC (NCT02401685)68 | Multicéntrico; Reino Unido | 2024 | 5 | Cirugía conservadora o mastectomía + 1 o 2 GC con macrometástasis | LA vs. RA vs. seguimiento |
Diversos estudios55-60 han analizado la relevancia clínica de la afectación micrometastásica del GC y la necesidad de una LA. Mittendorf et al.60 no evidenciaron diferencias en la SG y la SLE entre las pacientes con cáncer de mama en estadio IA (pN0) y IB (pN1mi). Por el contrario, las características biológicas del tumor, como los receptores hormonales y el grado tumoral, sí se relacionaban con la supervivencia. De la misma forma, Giuliano et al.61 tampoco evidenciaron disminución de la supervivencia en aquellas mujeres con micrometástasis del GC detectadas por inmunohistoquímica. Los resultados de 3EC (IBCSG 23-0111, ATTRM12 y ACOSOG-Z001113), así como de diversos metaanálisis29-33, recomiendan la observación sin LA en las pacientes con afectación micrometastásica del GC, ya sea en cirugía conservadora, ya sea en mastectomía. Solo uno de los metaanálisis34 incluido en esta revisión evidenció beneficio de la LA en este grupo de pacientes. Sin embargo, este metaanálisis incluye EC metodológicamente dispares, que comparan la LA con la RA previa a la introducción de la BGC y los estudios de validación de la BGC. En la actualidad las guías clínicas americanas y europeas1,50 recomiendan omitir el tratamiento axilar (no LA ni RA) en pacientes con micrometástasis del GC (tabla 3). El ensayo SENOMIC62, cuyos resultados deberían publicarse este año, mostrará más evidencia sobre el impacto de la supresión de la LA en pacientes con micrometástasis del GC y cirugía conservadora o mastectomía (tabla 4).
Las pacientes con afectación macrometastásica de la axila limitada a 1-3 ganglios constituyen en la actualidad el grupo con mayor controversia para el tratamiento axilar. La principal dificultad para una recomendación en estas pacientes es su heterogeneidad, ya que podemos encontrar enfermas con 1-3ganglios afectados, con y sin afectación extrapapsular, tumores con una biología tumoral adversa y cirugía conservadora o con una mastectomía. Esta variedad de pacientes no ha sido convenientemente categorizada en los EC y, por ello, carecemos de un criterio que nos permita identificar qué pacientes N1 son de elevado riesgo para una recaída axilar. El estudio ACOSOG-Z001113 se realiza sobre una muestra de pacientes con predominancia de tumores luminales, un gran porcentaje de ellas solo con micrometástasis, y parece indicar que en este grupo de pacientes la omisión de la LA en la cirugía conservadora es segura. Otros autores14,15 proponen sustituir la LA por RA en las pacientes sin afectación clínica de la axila con metástasis del GC. No obstante, en ambos ensayos (AMAROS14 y OTOASOR15) no se incluyó un grupo control sin tratamiento en la axila, lo cual obliga a cuestionar la necesidad de irradiar los 3niveles axilares y el área supraclavicular en todas las pacientes con GC metastásico sin una LA. Un estudio observacional de nuestro centro63 propone el tratamiento con RA en las pacientes con afectación macrometastásica del GC sin una LA que presentan otros factores de riesgo de recaída regional (tumores triple negativos o HER2, invasión linfovascular, alto grado tumoral, entre otros). No obstante, este estudio presenta todas las limitaciones de no ser un EC aleatorizado y sus conclusiones no permiten establecer recomendaciones. Por lo que, en la actualidad, no existe suficiente evidencia para suprimir el tratamiento axilar en estas pacientes, pero tampoco hay evidencia que sustente la indicación sistemática de una LA o RA. El futuro de esta discusión debería orientarse a la introducción de criterios biológicos en la toma de decisión del tratamiento axilar como el realizado con las plataformas génicas para la indicación del tratamiento sistémico. En espera de esta posibilidad, Huang et al.33 recomiendan la incorporación de la preferencia de la paciente en la toma de decisiones. En la actualidad, están en marcha 3EC64-66 que estudiarán el impacto de la LA frente al seguimiento en pacientes con afectación macrometastásica del GC. Otros 2EC67,68 analizarán el impacto de la RA. El ensayo OPTIMAL67 incluye pacientes con afectación metastásica del GC sin una LA y las aleatoriza a RA o seguimiento. El ensayo POSNOC68 incluye pacientes con afectación mestastásica del GC y las aleatoriza a observación, LA o RA. Los resultados de estos ensayos estarán disponibles entre el 2022 y 2027 (tabla 4). En espera de estos estudios y basados en las premisas planteadas previamente, parece necesaria la individualización de cada caso en un comité multidisciplinar, en el que se puede incorporar la opinión de la paciente, con propuesta de la supresión del tratamiento axilar (ni La ni RA) en aquellas mujeres de bajo riesgo de recaída locorregional y con recomendación de la RA en las pacientes con factores de riesgo de recaída locorregional.
Finalmente, 2EC35-37 justifican la asociación de LA y RA en las pacientes con metástasis en 4 o más ganglios axilares. Aunque estos ensayos son antiguos y las pacientes no recibieron tratamientos sistémicos específicos (anticuerpos), las guías clínicas, basadas en estos estudios, recomiendan la LA y radioterapia ganglionar (axilar y supraclavicular) en las pacientes con afectación ganglionar N2-N3 (tabla 3). Por el contrario, aunque la irradiación de la mamaria interna disminuye el riesgo de recaída local, no ha demostrado beneficio en la SG42-44. Por tanto, no se debe incluir la mamaria interna en los campos de radioterapia (tabla 3).
Esta revisión presenta varias limitaciones. En primer lugar, los estudios más antiguos incluyen pacientes con tratamiento adyuvante menos efectivo respecto a los ensayos más recientes. Esto es especialmente importante en el riesgo de recaída locorregional de los tumores HER2 sin terapia biológica. En segundo lugar, muchos estudios no contemplan la categorización de factores de riesgo para la recaída y las características biológicas de la enfermedad, lo que impide estimar el impacto de los tratamientos. Finalmente, la falta de análisis estadístico de nuestra revisión no permite establecer el impacto de las recomendaciones propuestas.
En conclusión, esta revisión sistemática establece la supresión del tratamiento axilar en la mujer con cáncer de mama sin afectación patológica ganglionar (pN0) o con afectación micrometastásica del GC, ya que no se beneficia del tratamiento axilar (ni RA ni LA). Por el contrario, la paciente con enfermedad axilar extensa (N2 y N3) se beneficia de la LA y RA para mejorar su SG y SLE. Por su parte, las pacientes con enfermedad axilar macrometastásica (pN1) constituyen un grupo heterogéneo que precisan del análisis individualizado de sus factores de riesgo para decidir el tratamiento axilar idóneo. Las recomendaciones en este grupo de enfermas estarán condicionadas por los EC en evolución, disponibles en la próxima década.
Conflicto de interesesNo existe conflicto de intereses.