La cirugía del cáncer de esófago es un procedimiento complejo con tasas de morbimortalidad elevadas, por lo que para obtener resultados adecuados se precisa de centros experimentados, un completo soporte multidisciplinar y vías clínicas adecuadas. Se describe la experiencia inicial y la técnica de la esofaguectomía «tubeless» en la que tras realizar una resección esofágica y linfadenectomía mediastínica extendida, al final del procedimiento no son colocados drenajes ni sondas de ningún tipo, con el fin de disminuir la agresividad del mismo, mejorar el bienestar postoperatorio y acelerar la recuperación funcional del paciente.
The esophageal cancer surgery is a complex procedure with elevated rates of both morbidity and mortality, which is why, in order to achieve adequate results, it should be performed in high volume centers, where complete multidisciplinary support is available and recent clinical guidelines are applied. We describe the initial experience and the technique of “tubeless” esophagectomy where esophageal resection and mediastinal lymphadenectomy are performed and no drains nor tubes of any kind are placed, with the aim to decrease the level of surgical aggression, enhance the postoperative comfort and accelerate the patient́s recovery.
La cirugía del cáncer de esófago es un procedimiento complejo con tasas de morbilidad del 50-60% y mortalidad postoperatoria entre el 2-5%1. En la actualidad, con el desarrollo de la cirugía mínimamente invasiva, la optimización preoperatoria del estado nutricional, físico y psicológico del paciente, las mejoras en el manejo anestésico y control del dolor, y la aplicación protocolizada de otras medidas de rehabilitación multimodal se obtienen resultados satisfactorios, facilitando la recuperación y reduciendo la estancia hospitalaria y algunas complicaciones postoperatorias2.
En 2019 Low et al. publicaron la Guidelines for Perioperative Care in Esophagectomy con las medidas recomendadas por la ERAS Society3 para aplicar en los pacientes sometidos a una cirugía resectiva por cáncer de esófago. Así, en la etapa perioperatoria, en estas guías, se recomienda el uso de sonda nasogástrica, el empleo de drenajes torácicos y la alimentación enteral precoz, con el fin de cubrir los requerimientos nutricionales en los primeros 3-6 días postoperatorios, ya sea por yeyunostomía, sonda nasoyeyunal o nasoduodenal.
Sin embargo, para intentar conseguir una más pronta y total recuperación funcional posquirúrgica se está avanzando en reducir la agresión quirúrgica y el empleo de estos elementos, lo cual ha hecho cuestionar ciertas medidas cuyo uso no sustenta una evidencia sólida, como son el empleo de drenajes, sonda nasogástrica o yeyunostomía de alimentación.
A continuación, se describen la técnica, manejo perioperatorio y experiencia inicial en nuestro centro con la aplicación de la denominada esofaguectomía «tubeless» mediante un abordaje mínimamente invasivo sin empleo de ningún tipo de drenaje ni sonda nasogástrica o de alimentación enteral en pacientes con cáncer de esófago.
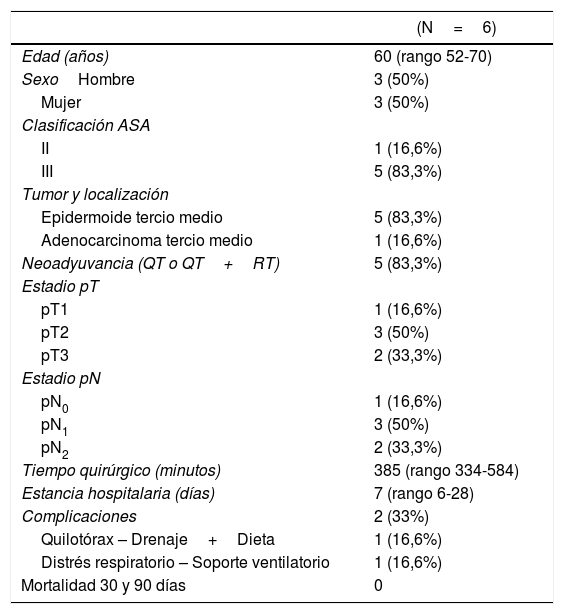
Técnica quirúrgica y manejo perioperatorio. ResultadosDesde junio a noviembre de 2020 se han intervenido en nuestro centro un total de 6 pacientes (3 hombres y 3 mujeres) mediante esta técnica y manejo perioperatorio. La edad mediana fue de 60 años (rango: 52-70) (tabla 1), padeciendo la mayoría (83,3%) un carcinoma epidermoide localizado en tercio medio de esófago y habiendo recibido 4 de ellos tratamiento neoadyuvante según el esquema CROSS4.
Estudio descriptivo de los casos
| (N=6) | |
|---|---|
| Edad (años) | 60 (rango 52-70) |
| SexoHombre | 3 (50%) |
| Mujer | 3 (50%) |
| Clasificación ASA | |
| II | 1 (16,6%) |
| III | 5 (83,3%) |
| Tumor y localización | |
| Epidermoide tercio medio | 5 (83,3%) |
| Adenocarcinoma tercio medio | 1 (16,6%) |
| Neoadyuvancia (QT o QT+RT) | 5 (83,3%) |
| Estadio pT | |
| pT1 | 1 (16,6%) |
| pT2 | 3 (50%) |
| pT3 | 2 (33,3%) |
| Estadio pN | |
| pN0 | 1 (16,6%) |
| pN1 | 3 (50%) |
| pN2 | 2 (33,3%) |
| Tiempo quirúrgico (minutos) | 385 (rango 334-584) |
| Estancia hospitalaria (días) | 7 (rango 6-28) |
| Complicaciones | 2 (33%) |
| Quilotórax – Drenaje+Dieta | 1 (16,6%) |
| Distrés respiratorio – Soporte ventilatorio | 1 (16,6%) |
| Mortalidad 30 y 90 días | 0 |
Aproximadamente entre 4 y 6 semanas antes de la intervención se procede a la optimización funcional preoperatoria y 3 semanas antes de la misma se realiza el acondicionamiento de la plastia gástrica mediante embolización de la arteria esplénica y gástrica izquierda con coils InterlockTM (Boston Scientific, Voisins-le-Bretonneux, Francia).
Todos los pacientes fueron intervenidos mediante esofaguectomía en 3 tiempos con un abordaje mínimamente invasivo (toracoscopia derecha en prono, laparoscopia y cervicotomía izquierda).
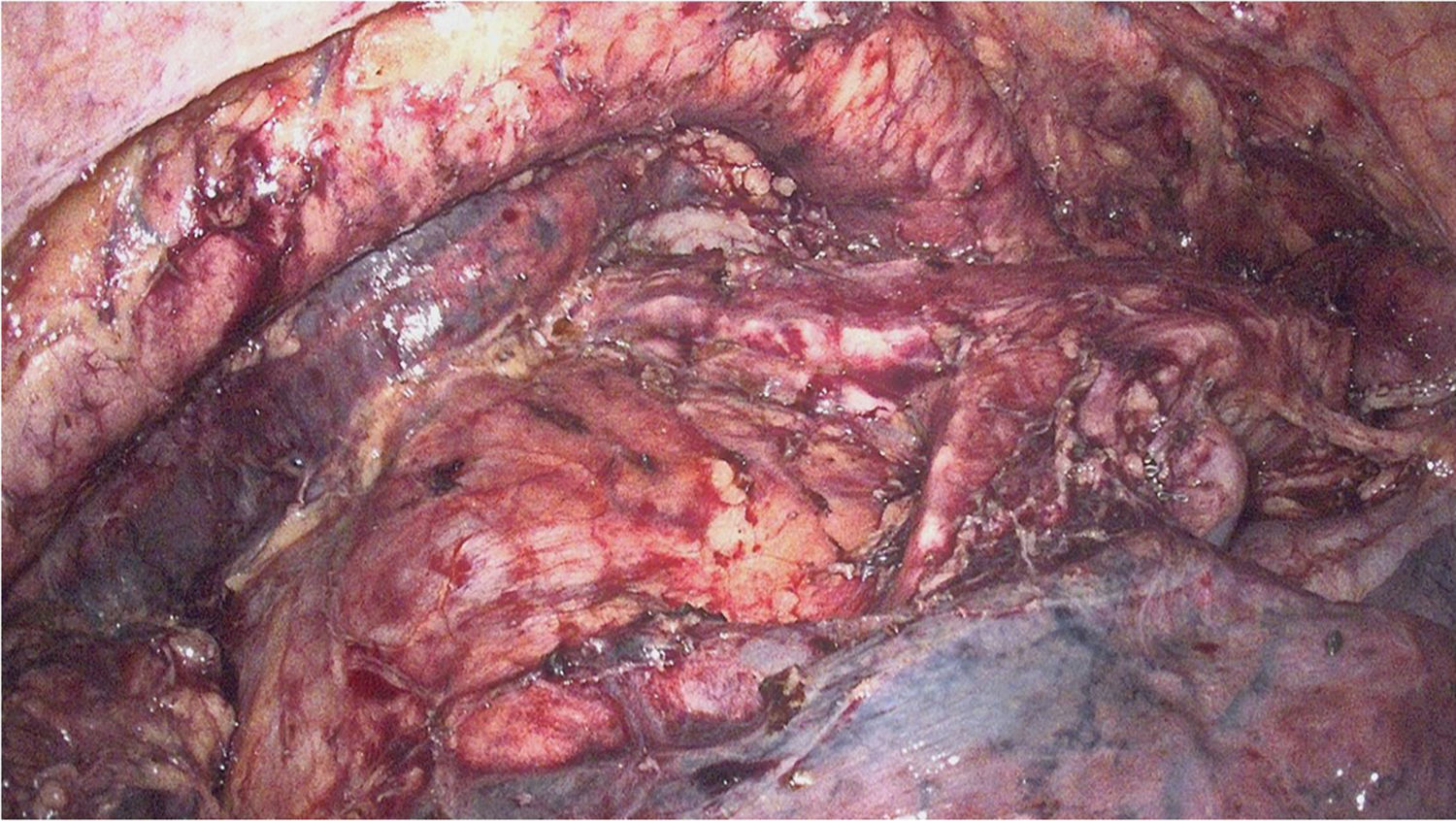
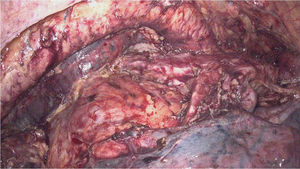
Durante la toracoscopia derecha se procede a la incisión de la pleura mediastínica, movilizando el esófago en bloque junto a su meso. Tras la disección y sección de la vena ácigos en su cayado, se realiza una linfadenectomía mediastínica total incluyendo el mesoesófago, conducto torácico, ambas pleuras mediastínicas y los grupos ganglionares 105, 106, 107, 108, 109, 110, 111 y 122 según la Japanese Classification of Esophageal Cancer. Se identifican y respetan ambos nervios recurrentes, seccionándose los nervios vagos distalmente a las ramas bronquiales (fig. 1).
El abordaje abdominal se realiza con el paciente en decúbito supino, completándose la resección oncológica (linfadenectomía de los grupos ganglionares 1, 2, 3, 7, 8, 9, 11, 19 y 20 según la Japanese Classification of Esophageal Cancer), preservando los vasos gastroepiploicos derechos y confeccionando la plastia gástrica con ayuda del sistema de grapado Echelon FlexTM (Johnson and Johnson) o SigniaTM (Medtronic).
A continuación, se realiza la disección y sección del esófago cervical mediante un abordaje por cervicotomía lateral izquierda. En el extremo craneal del esófago seccionado se confecciona una bolsa de tabaco con Prolene® de 2/0 (Johnson and Johnson) y se fija una sonda nasogástrica a su extremo caudal. Tras la realización de una laparotomía media de unos 5cm se extrae la pieza quirúrgica unida a la sonda y a continuación se procede al ascenso transmediastínico de la plastia. Una vez posicionada la plastia en su lugar definitivo se administra verde indocianina intravenoso y se comprueba la correcta perfusión de la futura zona de la anastomosis, la cual es realizada a nivel cervical de forma terminolateral mecánica con CEEA de 25mm, quedando cubierta con un «parche» omental.
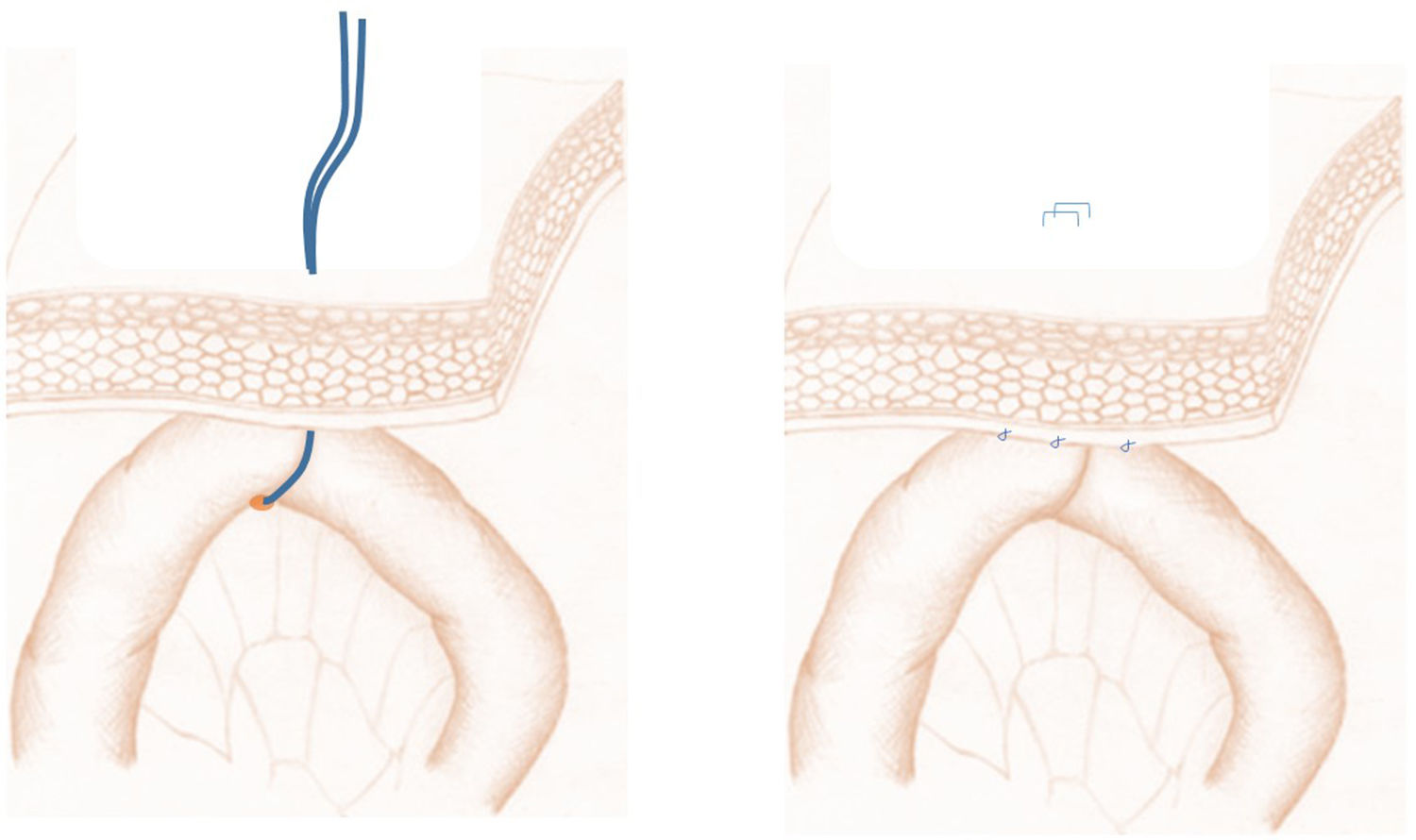
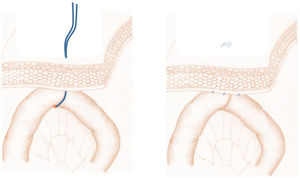
A continuación, se realiza la denominada yeyunostomía «fantasma» (fig. 2), nuevo concepto que consiste en referenciar con un vessel loop extraído transcutáneo la primera asa yeyunal o fijarla al peritoneo parietal marcando a nivel de la piel ese punto de fijación. Durante el postoperatorio, en caso necesario, podría colocarse un catéter de 12 Fr (Mac Loc® Locking multipurpose drainage catheter de Cook Medical) guiado por ecografía y por vía percutánea en el interior de dicha asa, que sería utilizado como yeyunostomía de alimentación. Si no es necesario, el vessel loop es retirado a los 10 días de la intervención.
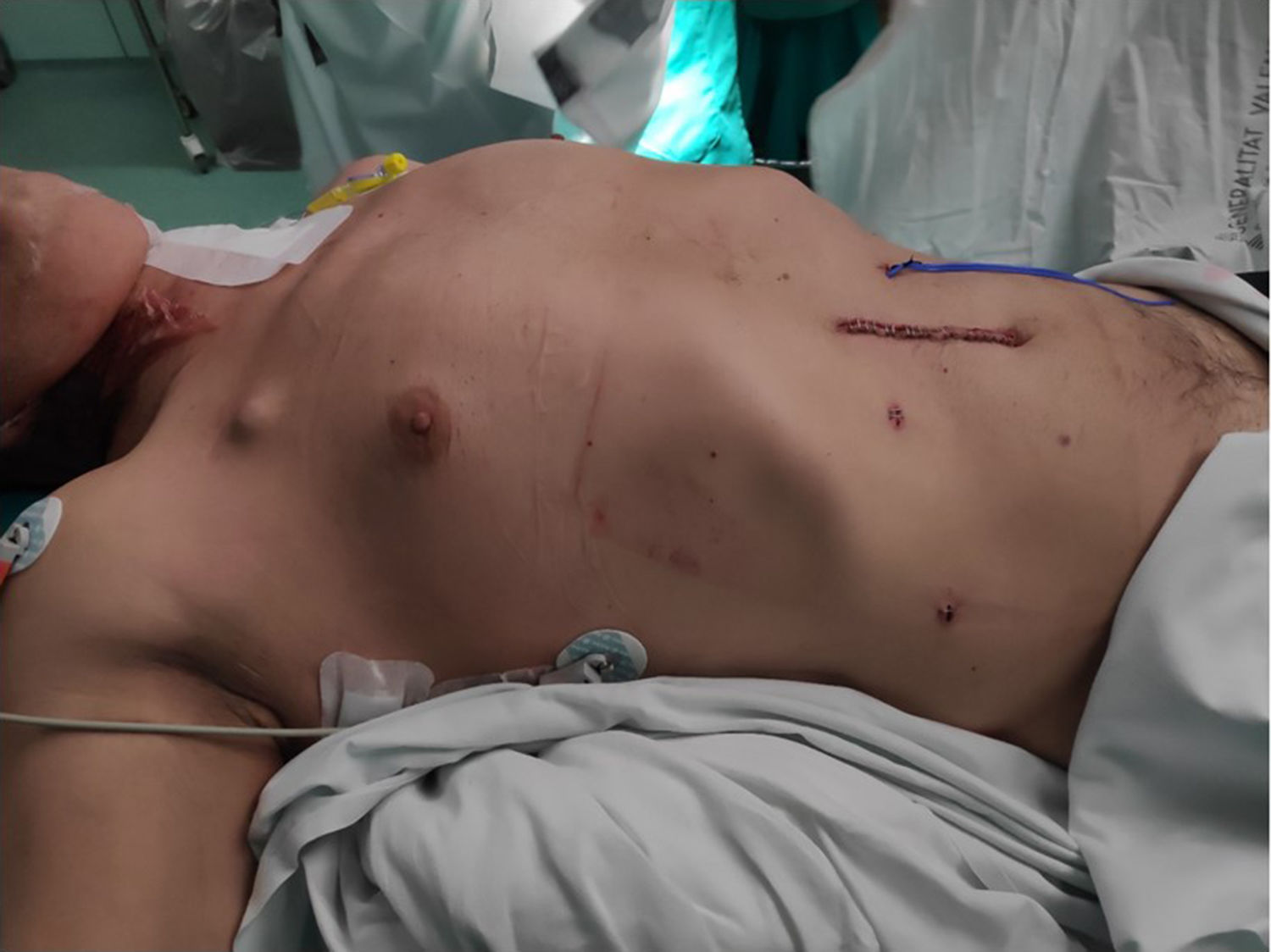
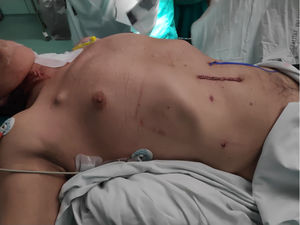
Una vez completada la fase reconstructiva, si no existen alteraciones de la hemostasia, lesión en el parénquima pulmonar ni otras complicaciones intraoperatorias, no se coloca sonda nasogástrica ni ningún tipo de drenaje (fig. 3).
Todos los pacientes fueron extubados al finalizar la cirugía, permaneciendo en la Unidad de Reanimación con soporte ventilatorio con gafas de alto flujo durante las primeras 24-48h. La sonda vesical y el catéter epidural se retiran habitualmente a las 24 y 48h de la cirugía respectivamente, iniciando la sedestación y la tolerancia oral a líquidos en las primeras 24-48h. La consistencia de la dieta y el grado de movilización se van incrementando en los días sucesivos.
Durante el postoperatorio los pacientes son controlados por un equipo multidisciplinar de especialistas (endocrinólogos, nutricionistas, fisioterapia respiratoria, anestesista, cirujanos), siendo la mediana de estancia hospitalaria de 7 días (rango: 6-28). No hubo complicaciones a nivel de la anastomosis ni fue necesario colocar una yeyunostomía, sonda nasogástrica ni reintervenir a ningún paciente. Una paciente desarrolló un quilotórax al quinto día posquirúrgico que precisó la colocación de un drenaje pleural, resolviéndose el cuadro con medidas dietéticas y retirándose el drenaje 8 días después. Otro paciente con antecedentes de enfisema pulmonar desarrolló un distrés respiratorio agudo y neumotórax al sexto día postoperatorio, precisando la colocación de un drenaje torácico izquierdo y soporte respiratorio en la Unidad de Reanimación. No hubo mortalidad a los 30 y 90 días del procedimiento (tabla 1).
Tras el estudio anatomopatológico de las piezas extirpadas se advirtieron un 50% de tumores T2, aislándose ganglios con invasión tumoral en el 83,3% (tabla 1). Los bordes proximal, distal y radial no mostraron afectación tumoral en ningún caso.
DiscusiónLa técnica y las medidas de cuidado perioperatorio descritas e incluidas bajo el concepto de esofaguectomía «tubeless» son factibles y en casos seleccionados podrían mejorar y acelerar la recuperación postoperatoria de los pacientes sometidos a este procedimiento. Este tipo de manejo no ha sido descrito previamente en la literatura, incluyendo medidas que reducen la agresión quirúrgica, el dolor y el malestar que padecen estos pacientes debidos a la colocación de sondas y drenajes.
Esta cirugía está gravada con una elevada morbimortalidad postoperatoria, por lo que es necesario un abordaje multidisciplinar en centros con experiencia, donde además se pueda garantizar una terapia eficaz y rápida ante posibles complicaciones postoperatorias. En este sentido, la centralización de estos procedimientos5 y el desarrollo y aplicación de protocolos de medicina perioperatoria cuyo propósito es optimizar el estado del paciente para que afronte la cirugía en condiciones ideales y acelerar su recuperación posterior, han demostrado ayudar a reducir las potenciales complicaciones de esta técnica6,7. A pesar de que hay ya definidos y publicados protocolos y vías clínicas de rehabilitación multimodal en esofaguectomía3,8, aún sigue existiendo controversia en muchos de los aspectos incluidos dentro de ellos.
Así, la vía de alimentación preferida durante el postoperatorio de una esofaguectomía es tema de discusión en la actualidad, mostrando recientes estudios que la alimentación oral precoz parece segura y se asocia a una más pronta recuperación del tránsito y una menor estancia hospitalaria9–11, tal y como se describe en los casos presentados con ingesta de líquidos en las primeras 24-48h y con buena tolerancia oral a dieta triturada a los 4-5 días de la intervención en la mayoría de los casos.
Yeyunostomía «fantasma»El empleo de sondas de nutrición enteral (yeyunostomía, nasoyeyunal, etc.) es efectiva y de gran utilidad en situaciones que requieran ayuno prolongado, cuando no puedan cubrirse los requerimientos nutricionales mínimos por vía oral o en pacientes en afagia y desnutrición durante la etapa perioperatoria. Sin embargo, su colocación de forma sistemática no está exenta de complicaciones12, aumentando el malestar del paciente y limitando su libre movimiento, por lo que su colocación debe realizarse de forma individualizada. En este sentido, el novedoso concepto de la yeyunostomía «fantasma» pretende evitar dicha colocación de forma rutinaria y las posibles complicaciones asociadas, facilitando a su vez el acceso rápido para la introducción de una sonda de alimentación enteral mediante un abordaje local guiado por ecografía en los casos que esté indicado.
No empleo de sonda nasogástricaTradicionalmente se ha considerado obligatorio y aún sigue recomendándose en múltiples guías3 el uso de una sonda nasogástrica tras una esofaguectomía, con el fin de descomprimir la plastia reconstructiva, evitar su dilatación, reducir la tensión anastomótica y evitar vómitos, dolor y posibles aspiraciones. Sin embargo, existen datos contradictorios en la literatura en relación con su empleo y el riesgo de complicaciones anastomóticas y respiratorias. En nuestra experiencia el empleo de la sonda nasogástrica no ha mostrado beneficios en reducción de complicaciones tras una esofaguectomía, pero sí un retraso en el inicio de la tolerancia oral, alargando la estancia hospitalaria13. En el mismo sentido, otros trabajos afirman que la retirada inmediata o precoz de la sonda nasogástrica no incrementa el número de dehiscencias anastomóticas, complicaciones pulmonares o mortalidad postoperatoria, reduciéndose de este modo la estancia hospitalaria y el malestar del paciente, acelerando a su vez el inicio de la tolerancia oral14,15.
No uso sistemático de drenajesEl empleo de un drenaje cervical tras una esofaguectomía no ha demostrado reducir el número de complicaciones locales en la herida, tales como hematoma, seroma o dehiscencia anastomótica16, y por tanto su empleo de forma sistemática no es recomendable.
La evidencia actualmente disponible para sustentar el uso de drenajes torácicos tras una esofaguectomía es muy limitada y la mayoría de las guías publicadas lo incluyen en sus recomendaciones3, ya que podría prevenir la compresión pulmonar y servir de guía para monitorizar la presencia de hemorragia y/o fugas (aéreas, quilosas o anastomóticas). Sin embargo, su empleo provoca más dolor, lo que repercute en una peor ventilación y movilidad del paciente17. Algunas series publicadas han demostrado que el empleo de un único drenaje es eficaz y reduce el dolor postoperatorio, coste y estancia hospitalaria frente a la colocación de un mayor número de ellos18–20. En este mismo sentido, su retirada precoz, con débitos inferiores a 400ml/24h sin fuga aérea, anastomótica ni quilosa, es seguro y podría mejorar el bienestar postoperatorio y disminuir la estancia hospitalaria21–23, habiéndose publicado recientemente series de casos de resecciones pulmonares mayores donde el no empleo de drenajes torácicos es factible y seguro24.
En nuestra experiencia, los pacientes colaboradores, entrenados en los programas de fisioterapia respiratoria, con estado físico y función pulmonar adecuados sometidos a una esofaguectomía sin complicaciones intraoperatorias son candidatos a la no colocación de un tubo de drenaje torácico. Evidentemente, es mandatorio tener la capacidad de poder drenar colecciones líquidas o aéreas de forma inmediata y eficazmente en caso necesario, como los casos de neumo- y quilotórax presentados en esta serie.
En cuanto al empleo de drenajes abdominales, en base a los estudios aleatorizados y revisiones de la evidencia publicadas25–27, su empleo tras una gastrectomía no ofrece beneficios y por ello no se recomienda su uso tras una esofaguectomía en las diferentes guías publicadas3,8.
Por tanto, la esofaguectomía «tubeless» es un concepto factible que puede mejorar la recuperación postoperatoria en casos seleccionados, disminuyendo el dolor asociado a los drenajes y sondas colocados habitualmente, facilitando la movilización precoz y la correcta realización de los ejercicios de fisioterapia respiratoria, mejorando la recuperación funcional y la calidad de vida durante el postoperatorio de esta cirugía. Evidentemente, estudios con un mayor número de casos y bien diseñados son necesarios para evaluar con solidez los pros y los contras de este tipo de procedimiento.
Conflicto de interesesLos autores declaran no tener conflicto de intereses en la redacción de este manuscrito.