De Paula et al1, en 1995, realizaron las primeras resecciones esofágicas con técnicas mínimamente invasivas, utilizando la vía transhiatal en pacientes con megaesófago por enfermedad de Chagas avanzada. Muy poco tiempo después, Swanstron et al2 fueron los primeros en presentar su experiencia con nueve esofagectomías transhiatales por cáncer, en Estados Unidos, mediante un abordaje abdominal laparoscópico. Lo que en principio parecía una carrera hacia la generalización de estas técnicas en afecciones neoplásicas; en la actualidad, sin embargo, su realización ha quedado limitada a unos pocos grupos de trabajo, que poco a poco han ido acumulando experiencia. Tanto la baja incidencia del cáncer de esófago, en comparación con otras localizaciones tumorales, como el aprendizaje complejo de la técnica han colaborado a su escaso desarrollo. La ausencia de datos sobre la idoneidad oncológica de este procedimiento también ha retrasado su implantación.
Las ventajas de la cirugía endoscópica se han ido perfilando en múltiples publicaciones y, aunque aún es pronto para tener estudios de control oncológico a largo plazo, no hay datos que desaconsejen su creciente aplicación.
Nosotros incorporamos inicialmente la cirugía laparoscópica para completar el estudio de extensión de los pacientes con cáncer de esófago y de la unión esofagogástrica antes de proceder a la cirugía exerética reglada. Su uso sistemático desde 1998 permitió evitar algunas laparotomías innecesarias. Posteriormente, la introducción gradual de las técnicas mínimamente invasivas en el tratamiento quirúrgico del cáncer de esófago, primero en el abdomen y después en el tórax, nos ha permitido llegar a realizar el procedimiento completo minimizando las consecuencias de su aprendizaje. El objetivo de este artículo es presentar la experiencia de nuestro grupo con las diferentes técnicas realizadas, según la localización tumoral, y mostrar los resultados obtenidos.
Pacientes y metodoPacientesEstudio prospectivo de los primeros 50 pacientes con cáncer de esófago a los que se les realizó una resección curativa (resección R0) de su enfermedad neoplásica, mediante técnicas de cirugía videoasistida (toracoscopia y/o laparoscopia). Las intervenciones se practicaron entre diciembre de 2002 y julio de 2007. Se incluyó a 8 mujeres y 42 varones con edades entre los 19 y los 77 (media ± desviación estándar de 59,9 ± 12,5) años. El síntoma más frecuente fue la disfagia (82%) y la duración media de las manifestaciones clínicas antes de establecer el diagnóstico ha sido de 3,3 ± 1,8 meses.
El diagnóstico se determinó siempre con endoscopia y toma de biopsias. El estudio de extensión inicial fue mediante un estudio analítico completo con marcadores nutricionales y tumorales (CEA y CA 19.9), tránsito baritado, tomografía computarizada (TC) toracoabdominal, ecoendoscopia esofagogástrica y tomografía por emisión de positrones (PET).
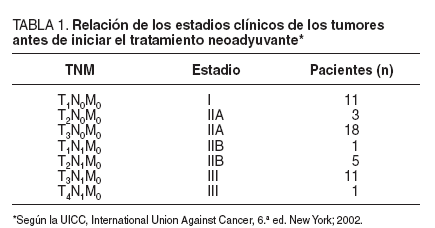
Los tumores resecados se localizaron: 18 en el esófago torácico por encima del nivel de la carina traqueal, 24 por debajo del nivel de la carina y 8 a nivel de cardias. Los de esta última localización han sido incluidos en este estudio sólo si afectaban principalmente a la vertiente esofágica. En cuanto a su clasificación histológica: 23 eran adenocarcinomas y 27, carcinomas escamosos. La estadificación clínica inicial de los tumores se muestra en la tabla 1. La afectación ganglionar se determinó a partir de la información que proporcionaron la TC toracoabdominal, la ecoendoscopia y la PET. En este sentido, el diagnóstico de sospecha se estableció por el tamaño ganglionar (TC y ecoendoscopia), las características ecográficas (ecoendoscopia) o por la detección de una alta tasa metabólica (PET). No efectuamos punción-aspiración con aguja fina (PAAF) dirigida por ecoendoscopia para confirmar la afección ganglionar.
TABLA 1.Relación de los estadios clínicos de los tumoresantes de iniciar el tratamiento neoadyuvante*
A partir de 2004 iniciamos el protocolo de tratamiento neoadyuvante con quimioterapia y radioterapia en pacientes con tumores T3-4 y/o afección ganglionar (N+). Este tratamiento se ha aplicado en 22 pacientes siguiendo las pautas marcadas por el Comité de Tumores Digestivos de nuestro hospital: 3 ciclos de cisplatino 75 mg/m2 el primer día y 5-fluorouracilo 1.000 mg/m2/día en infusión continua de los días 1 a 4. Se repitió la pauta a las semanas 3 y 6. La radioterapia se inició a partir de la tercera semana, coincidiendo con el segundo ciclo, y se administró 50,4 Gy en fracciones de 1,8 Gy/día. La intervención quirúrgica se practicó entre las semanas 6 y 8 del final del tratamiento quimiorradioterápico.
En todos los casos se ha recurrido a un plan de fisioterapia respiratoria preoperatoria y sólo se administró nutrición enteral por sonda durante el tratamiento neoadyuvante cuando la disfagia no permitía un aporte nutricional adecuado.
Técnica quirúrgicaLa cirugía videoasistida, en el protocolo terapéutico del cáncer de esófago, se efectuó en tres fases. En la primera, iniciada en diciembre de 2002, se introdujo la laparoscopia, en sustitución de la laparotomía clásica, para la disección y la movilización gástrica y la confección del tubular que ha de sustituir al esófago resecado. Una vez consolidado el procedimiento y reducido el tiempo total de ejecución, se introdujo la toracoscopia como sustitución de la toracotomía para efectuar la disección esofágica en los tumores torácicos altos (septiembre de 2005). A partir de entonces, los pacientes que han precisado un abordaje en tres campos se han beneficiado de una toracoscopia, seguida de laparoscopia y cervicotomía, por donde se ha extraído la pieza de resección y se ha confeccionado la anastomosis. La última fase (a partir de marzo de 2007) ha sido la realización de la toracoscopia en el procedimiento de Ivor Lewis con anastomosis esofagogástrica intratorácica.
Esofagectomía en tres campos (toracoscopia, laparoscopia y cervicotomía). Se prepara a los pacientes con profilaxis antibiótica y antitrombótica. También se prepara mecánicamente el colon con una pauta de polietilenglicol el día anterior a la intervención.
–Fase torácica. En la mesa de operaciones se coloca al paciente en decúbito prono con los brazos extendidos hacia delante. Se precisa intubación traqueobronquial selectiva para facilitar el colapso pulmonar derecho. Los cirujanos se sitúan en el lado derecho del paciente y se colocan tres puertos de entrada en la horizontal de la línea axilar posterior en el cuarto (5 mm), el séptimo y el noveno (ambos de 10 mm) espacios intercostales. Se puede colocar un trocar adicional de 5 mm en el séptimo espacio intercostal, línea axilar anterior. No se practica neumotórax adicional. La disección se inicia a nivel del cayado de la vena ácigos que se secciona para exponer toda la superficie del esófago. Se diseca y moviliza el esófago, desde el hiato esofágico hasta el estrecho torácico superior. Se incluye en un solo bloque el tejido graso y linfático circundante hasta dejar expuesto el pericardio, la pleura del lado opuesto y la aorta torácica en la zona inferior, y la pars membranosa de la carina y la tráquea en la zona superior. La disección esofágica en el tórax se realiza con bisturí eléctrico monopolar y LigaSure de 5 mm. Se aprovechan los mismos orificios inferiores para colocar 2 drenajes torácicos.
–Fase abdominal y cervical. Se cambia de posición al paciente y se sitúa en decúbito supino con las piernas abiertas. El cirujano se sitúa entre las piernas y un ayudante a cada lado del enfermo. Se colocan seis puertos de abordaje (2 de 11 mm y 4 de 5 mm). Un retractor mantenido por un soporte externo mantiene el lóbulo hepático izquierdo. La disección se inicia con la completa movilización duodenal. A continuación se libera la curvatura mayor gástrica respetando la arteria gastroepiploica derecha que aportará flujo vascular al futuro tubular gástrico. La sección de los vasos cortos permite llegar hasta el pilar diafragmático izquierdo. Se secciona el ligamento gastrohepático y los vasos gástricos izquierdos en su origen. A continuación se secciona la arcada vascular de la curvatura menor, unos centímetros por encima del píloro y se inicia la confección del tubular gástrico con endograpadoras lineales. No se alcanza a seccionar completamente el estómago, dejando un pequeño segmento de unión entre el tubular y la zona cardial. Se finaliza esta fase con la colocación de una yeyunostomía de alimentación en la primera asa yeyunal y la última maniobra es la disección hiatal, que comunica el espacio abdominal con el espacio pleural derecho previamente disecado en la fase toracoscópica. Simultáneamente a las últimas actuaciones abdominales, un segundo equipo quirúrgico diseca el esófago cervical por una pequeña cervicotomía lateral izquierda. La tracción suave del esófago permite ir extrayéndolo con el tejido ganglionar circundante procedente del mediastino medio, al que siguen el cardias y la curvatura menor gástrica. El tubular neoformado se va alojando en el mediastino posterior. La intervención finaliza con la confección de una anastomosis esofagogástrica cervical mixta (mecánica en la cara posterior y manual en la anterior).
Técnica de Ivor Lewis (laparoscopia y toracoscopia):
–Fase abdominal. La preparación es la misma que en la técnica anteriormente descrita. La intervención empieza por la fase laparoscópica siguiendo los mismos pasos descritos. A diferencia del procedimiento anterior, en este caso añadimos una piloroplastia para mejorar el drenaje de la gastroplastia.
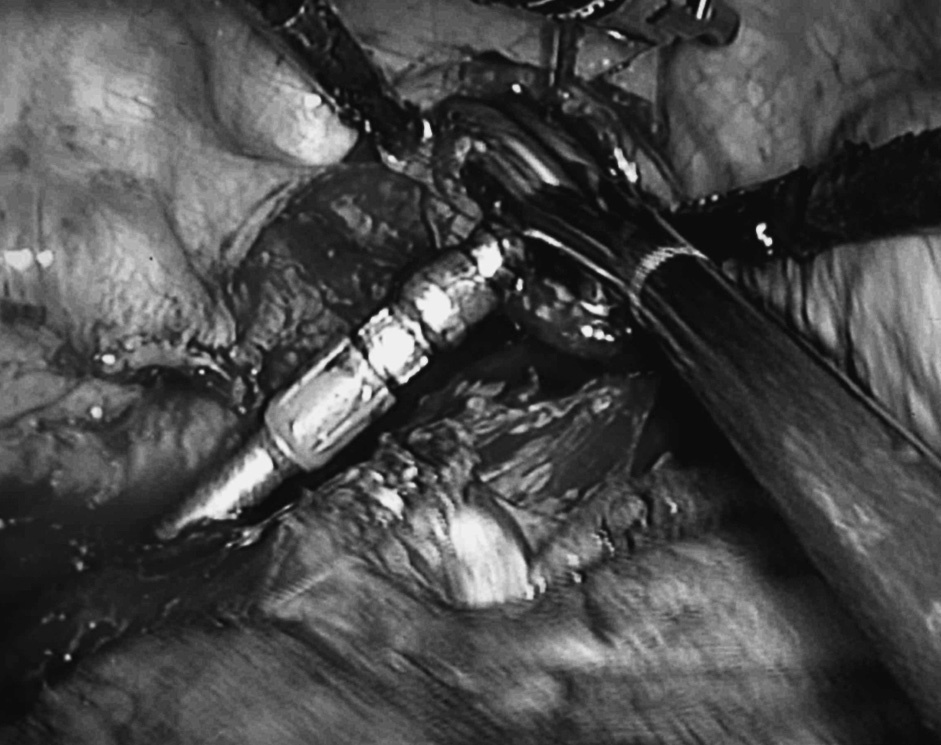
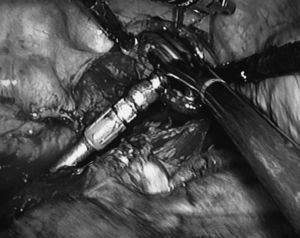
–Fase torácica. En este procedimiento el paciente se coloca en decúbito lateral izquierdo. El cirujano se coloca a la izquierda del paciente y los ayudantes a la derecha. Se utilizan 5 vías de entrada: 3 de 11 mm y 2 de 5 mm. En este caso es preciso ayudarse de un separador para mantener el pulmón colapsado fuera del campo operatorio. La colocación de un punto de tracción en la pars tendinosa del diafragma, exteriorizado a través de la pared costal, mejora la visión en la parte baja esofágica, donde se inicia la disección en bloque del esófago y del tejido graso y linfático adyacente para completar la correcta linfadenectomía. Se progresa en sentido proximal seccionando la vena ácigos en su cayado e incluyendo en la pieza el tejido linfático retrocarinal e interaortoesofágico. Por tracción de la zona esofágica baja se ha ascendido el cardias que arrastra consigo el tubular gástrico ya confeccionado por vía abdominal. Se secciona el esófago en la zona alta de la cavidad pleural y se extrae la pieza por una pequeña incisión intercostal de 4 cm ampliando uno de los orificios de un trocar y protegiendo sus bordes para evitar el contacto con la pared. Ese mismo orificio es utilizado para la introducción del cabezal de la máquina de sutura circular EEA 25 mm que entra en el esófago. Se ajusta el cabezal con una sutura en bolsa de tabaco. La introducción final de la propia máquina permite la realización de la anastomosis esofagogástrica (fig. 1).
Fig.1.Introducción del cabezal de la máquina de sutura EEA 25 mm en el tórax para llevar a cabo la anastomosis esofagogástrica por toracoscopia (procedimiento de Ivor Lewis).
Esofagectomía transhiatal asistida por laparoscopia.La parte abdominal es igual a la descrita en la primera de las técnicas anteriores. Una vez liberado completamente el estómago y movilizado el duodeno, sin llegar a confeccionar el tubular gástrico, se abre el diafragma (maniobra de Pinotti) y se accede al mediastino posterior. Es posible la progresión movilizando el esófago y el tejido graso circundante hasta la altura de las venas pulmonares inferiores. La linfadenectomía en estos casos es más limitada que en el procedimiento de Ivor Lewis. Entonces es necesario realizar una laparotomía subcostal para acabar la disección transhiatal. El acceso laparoscópico no permite llegar más arriba del nivel de la carina. Los puertos de entrada en el abdomen y el paso a través del hiato agrandado no permiten que alcancemos niveles más altos y esa laparotomía transversa facilitará la finalización de la técnica. Una cervicotomía lateral izquierda permite la sección esofágica. La pieza se extrae por el abdomen, se confecciona el tubular con la curvatura mayor gástrica a través de la laparotomía y se asciende por el mediastino posterior para realizar la anastomosis cervical.
Análisis estadísticoHemos llevamos a cabo un estudio descriptivo de los resultados obtenidos. Los resultados se expresan en número, porcentaje, media ± desviación estándar (DE) y rangos. El análisis de la supervivencia general de la serie de pacientes se obtuvo mediante la aplicación del método de Kaplan-Meier.
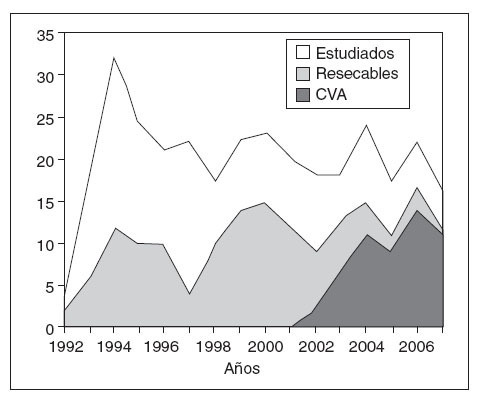
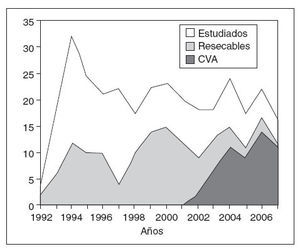
ResultadosSe ha podido constatar un incremento en el número de procedimientos videoasistidos en el tratamiento quirúrgico del cáncer de esófago desde su inicio en el año 2002 hasta el final del trabajo. De aplicarse en el 53,3% de los pacientes en 2003, se pasa al 82% de los operados en 2006 y al 91% en 2007 (fig. 2). Los pacientes que configuran este estudio son los primeros 50 a quienes se ha aplicado un procedimiento videoasistido completo, abdominal (laparoscopia), torácico (toracoscopia) o ambos, con todos los pasos descritos anteriormente.
Fig.2.Número de pacientes vistos y estudiados anualmente ennuestra unidad. Relación de pacientes resecados y pacientes en los que se han utilizado técnicas videoasistidas (CVA).
El tumor se ha localizado en el esófago torácico por encima del nivel de la carina en 18 pacientes. En todos ellos se realizó una intervención quirúrgica en tres campos (abdominal, torácico y cervical). En 17 se practicó una laparoscopia para la fase abdominal y en 8 se realizó, además, la disección esofágica por toracoscopia. En un solo paciente se efectuó únicamente la toracoscopia, puesto que tres intervenciones abdominales anteriores impidieron la laparoscopia.
En 24 pacientes el tumor se localizaba por debajo del nivel de la carina traqueal y otros 8 eran tumores de cardias. En 19 de estos 32 pacientes, se llevó a cabo un abordaje en dos campos (técnica de Ivor Lewis). En todos ellos menos en uno, por cirugía abdominal previa, se realizó toda la fase abdominal por laparoscopia. Además, en los últimos 5 pacientes ha sido posible completar la intervención con la fase torácica realizada por toracoscopia. En los 13 pacientes restantes se ha utilizado la vía transhiatal, con abordaje abdominal y cervical. Esta vía se ha utilizado en tumores de cardias, tumores iniciales (T1) y en pacientes con elevada morbilidad asociada por afección respiratoria.
En 22 pacientes se efectuó tratamiento neoadyuvante con quimioterapia y radioterapia, y se apreció una respuesta favorable (disminución o desaparición de la lesión) en 16 (72,7%) de ellos.
El tiempo operatorio medio fue de 281 ± 35 (intervalo, 240-365) min y la pérdida hemática media, de 350 ± 220 (intervalo, 100-650) ml. La estancia postoperatoria media en la unidad de cuidados intensivos fue de 1,2 días en los pacientes sin complicaciones y de 5,3 días en el total de la serie (intervalo, 1-33 días). La analgesia epidural por catéter se mantuvo una media de 2,2 (intervalo, 1-4) días.
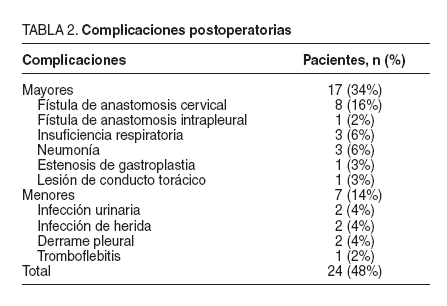
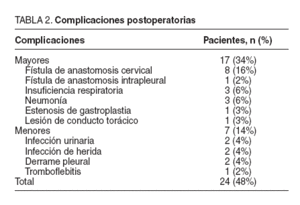
La morbilidad general registrada en esta serie ha sido del 48% y se recoge en la tabla 2. Es preciso destacar un número no despreciable de fístulas digestivas en las anastomosis cervicales (8 pacientes) y también un predominio de las complicaciones respiratorias (neumonías, insuficiencias respiratorias…) en 6 pacientes. Las complicaciones de orden menor fueron del 14% (7 pacientes). La mortalidad postoperatoria de la serie fue del 8% (4 pacientes) y fue debida a una tromboembolia pulmonar, un accidente vascular cerebral, dos insuficiencias respiratorias por broncoaspiración y neumonía bilateral. La estancia postoperatoria media fue de 13,2 días.
TABLA 2.Complicaciones postoperatorias
Fue necesario reintervenir precozmente a 3 (6%) de los 50 pacientes: uno por fístula en la anastomosis mediastínica, otro por lesión del conducto torácico y el tercero por estenosis de la gastroplastia a nivel de los pilares diafragmáticos. Se han realizado 2 (4%) reintervenciones tardías a los 12 y 19 meses por hernias mediastínicas de intestino delgado que condicionaron un cuadro obstructivo y se resolvieron por laparoscopia.
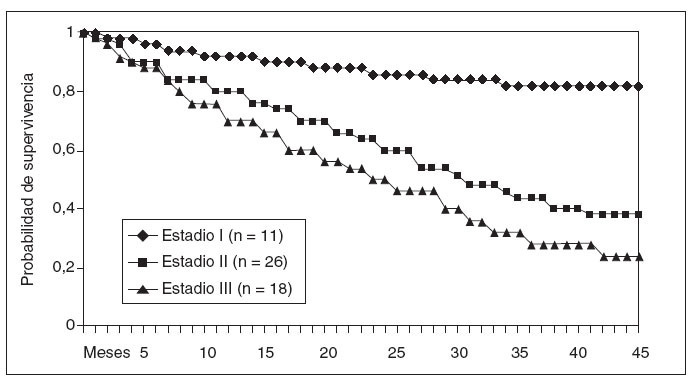
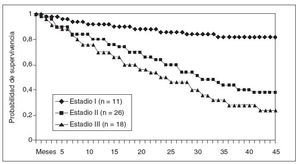
No se ha registrado ningún caso de recidiva neoplásica en las cicatrices de los trocares. En la figura 3 se representan las curvas de supervivencia de Kaplan-Meier según la estadificación anatomopatológica de los pacientes resecados. El seguimiento medio del grupo es de 19 (intervalo, 2-54) meses.
Fig.3.Probabilidad de supervivencia general por grupos de estadificació nanatomopatológica (Kaplan-Meier).
DiscusiónEn el tratamiento quirúrgico del cáncer de esófago siguen coexistiendo dos filosofías diferentes. Unos abogan por minimizar la morbilidad precoz y la mortalidad con una resección limitada, otros prefieren una disección más extensa para conseguir mejorar la estadificación tumoral, disminuir las recidivas locorregionales y poder mejorar la supervivencia3. Los seguidores de una resección limitada optan por la esofagectomía transhiatal con abordaje abdominal y cervical, sin una linfadenectomía formal4, puesto que sólo se tiene acceso a los ganglios mediastínicos más distales. A cambio, al obviar la toracotomía, consiguen disminuir la incidencia de complicaciones respiratorias y la mortalidad temprana sin influir demasiado en los resultados a largo plazo. Una resección amplia supone una técnica combinada toracoabdominal o cervicotoracoabdominal, según la localización del tumor, con amplia escisión de la lesión y de los tejidos peritumorales y con una disección extensa de los ganglios linfáticos en el mediastino posterior y en el abdomen superior (esofagectomía transtorácica con linfadenectomía en dos campos)5. Incluso otros autores añaden un tercer campo al realizar también una linfadenectomía cervical6.
En los tumores de localización torácica alta (supracarinales) el abordaje debe ser necesariamente por vía transtorácica. En nuestros pacientes la toracoscopia sustituye perfectamente a la toracotomía para conseguir una perfecta disección del esófago y de todos los grupos ganglionares periesofágicos e interesofagotraqueales. Se requiere, al igual que en la cirugía convencional, una intubación selectiva y colapso pulmonar derecho durante el procedimiento. Dos aspectos importantes han favorecido la situación local en el momento de la disección por toracoscopia: la colocación del paciente en decúbito prono y las terapias neoadyuvantes. La posición en prono es una innovación asociada a la cirugía mínimamente invasiva, que permite un acceso fácil sobre el esófago, al facilitar que la propia gravedad retire el pulmón colapsado del campo operatorio. Esto se traduce en una disminución del tiempo operatorio y menor número de complicaciones respiratorias7. Palanivelu et al8 han presentado recientemente su experiencia con esta posición en 130 pacientes, y obtuvieron muy buenos resultados.
Los tratamientos neoadyuvantes son útiles puesto que, en nuestra serie, han permitido una reducción tumoral en el 72% de los casos, facilitando una mejor disección local. Además, se ha podido ver que la supervivencia general mejora en los pacientes que tienen una respuesta clinicopatológica completa a la neoadyuvancia9. Un reciente metaanálisis de Gebski et al10, en el que revisan 10 estudios aleatorizados y 1.209 pacientes y comparan el tratamiento neoadyuvante con cirugía posterior y la cirugía aislada, constata unos mejores resultados a favor de la primera opción.
En los tumores torácicos bajos y paracardiales es posible el uso de la vía transhiatal con anastomosis cervical (linfadenectomía limitada) o la vía abdominal y torácica con linfadenectomía amplia (en dos campos) y anastomosis intratorácica (procedimiento de Ivor Lewis)11,12.Am-bos son perfectamente reproducibles mediante técnicas mínimamente invasivas (laparoscopia y toracoscopia). El procedimiento de Ivor Lewis, por su complejidad técnica al ser realizado por toracoscopia, es practicado sólo por algún grupo aislado con experiencias aún muy iniciales13.
La vía transhiatal ha sido muy criticada por tener una fase ciega en la disección del mediastino superior con el riesgo que comporta hacia otras estructuras. No obstante, ha sido rápidamente aceptada por los primeros grupos que han empezado a trabajar la exéresis esofágica con procedimientos endoscópicos por ser más fácil de realizar. Se han reavivado trabajos publicados a principios de los años noventa14,15, recogidos en dos metaanálisis posteriores16,17, que mostraban la equivalencia de ambas técnicas con supervivencias similares a la vía transtorácica. Sin embargo, estos metaanálisis pueden ser motivo de crítica al comparar procedimientos quirúrgicos en lugar de la extensión de la resección. Sólo 3 trabajos de los referidos, con sólo138 pacientes, comparaban los tipos de resección18-20. Por otra parte, recientes estudios, como el de Hulscher et al2, muestran un claro beneficio en la supervivencia a favor de los pacientes con adenocarcinoma del tercio inferior de esófago o cardias (tipo I de Siewert) cuando son intervenidos por vía transtorácica y se realiza el procedimiento de Ivor Lewis. En estos pacientes la supervivencia estimada a los 5 años se incrementa en un 17% sobre la expectativa de los operados por vía transhiatal.
La introducción progresiva de las diferentes fases, primero la laparoscopia y después la toracoscopia, nos ha permitido asentar ciertos procedimientos y acortar tiempos operatorios antes de afrontar las nuevas fases. Este proceder ha mantenido los tiempos quirúrgicos generales bastante constantes. En 2 años ha sido posible realizar todas las fases por cirugía mínimamente invasiva de las tres técnicas que practicamos y aplicamos, según la localización del tumor y las características del paciente21.
En pocas ocasiones renunciamos al procedimiento endoscópico. El único factor que puede impedir el planteamiento quirúrgico por toracoscopia o laparoscopia es el antecedente de intervenciones quirúrgicas torácicas o, sólo a veces, el antecedente de cirugía abierta del compartimento abdominal supramesocólico. Nunca la hemos efectuado en los que se prevé que deba ser el colon el sustituto del esófago. La reconstrucción por técnicas mínimamente invasivas se realiza siempre con el estómago. Nosotros realizamos la piloroplastia en los tubulares más cortos y amplios que ascienden hasta el tórax (Ivor Lewis), no creemos que sea imprescindible en los largos que suben hasta el cuello. Aunque la vagotomía acompaña a ambas técnicas, la atonía de la gastroplastia es mayor al aumentar su calibre22.
La morbilidad observada en nuestra serie ha sido del 48%. Es similar a la que teníamos al realizar la resección por vía abierta y a la presentada por otros grupos23,24.La mortalidad ha sido del 8%, similar a la que presentan los grupos con mayor volumen de casos intervenidos25.El análisis oncológico de la resección, en relación con la supervivencia a medio y largo plazo de los pacientes, aún es prematuro realizarlo. El seguimiento medio de nuestra serie es de 19 meses y aún es necesario un período mayor. No obstante, está en consonancia con otros estudios que han fijado en un 65% la supervivencia a 3 años en los estadios iniciales, un 41% en el estadio II y un 17% en el estadio III26.
Los resultados obtenidos tras nuestra experiencia inicial indican que la cirugía realizada por técnicas mínima-mente invasivas es comparable con la cirugía convencional. Ha sido posible incorporar las diferentes fases sin reflejar en los resultados generales el período de aprendizaje inherente a toda nueva técnica. También ha sido posible conservar las mismas resecciones y linfadenectomías que realizábamos en cirugía abierta, en función de la localización del tumor. Los resultados oncológicos son buenos a medio plazo, con un seguimiento aún corto. La aplicación de la cirugía endoscópica en el cáncer de esófago se irá extendiendo indudablemente con el paso del tiempo, aunque dada la magnitud de la resección y la dificultad del aprendizaje, quedará reservada a grupos especializados.
Correspondencia: Dr. J. Roig García. Oriol Martorell, 70, 4.o, 3.a. 17003 Girona. España. Correo electrónico: jroigg@ono.com
Manuscrito recibido el 6-8-2007 y aceptado el 5-12-2007.