Describir los datos enviados al Registro Nacional de Cirugía Gástrica por laparoscopia y analizar el tipo de cirugía, la reconversión, las complicaciones postoperatorias y la mortalidad.
Pacientes y métodoDesde marzo de 2005 a julio de 2008 han sido remitidos al registro 302 pacientes a través de un cuestionario ubicado en la página web de la Asociación Española de Cirujanos, donde se registraron datos clinicopatológicos, características de la cirugía realizada, reconversión y morbimortalidad.
ResultadosSe ha intervenido a 245 pacientes por adenocarcinoma gástrico, 35 por tumores estromales y 22 por otras afecciones. En los adenocarcinomas gástricos se realizó cirugía resectiva en 232 (95%) casos. La localización predominante fue el tercio distal y el tipo de tumor más frecuente, el intestinal. El 34% fueron tumores localmente avanzados. Se realizó una linfadenectomía D2 en 117 casos, D1 en 105 y D0 en 6. Se realizó reconversión en 21 (9%), y entre las causas destacan las dificultades técnicas. Se han descrito complicaciones postoperatorias en 72 (31%) casos, entre las que destacan por su gravedad las fístulas digestivas. Hubo una mortalidad postoperatoria del 6%, y las causas más frecuentes fueron la sepsis por fuga anastomótica y las complicaciones cardiorrespiratorias. La estancia media hospitalaria en los pacientes que no presentaron complicaciones fue de 9,2±3 días.
ConclusionesLa gastrectomía laparoscópica en el cáncer gástrico es un procedimiento factible que no está exento de dificultades técnicas. Una considerable tasa de complicaciones postoperatorias pueden llegar a condicionar los beneficios de la cirugía mínimamente invasiva.
To study the data from the Laparoscopic Gastric Surgery Spanish National Register of laparoscopic Gastric Surgery and to analyse the type of surgery, the conversion to laparotomy, postoperative complications and mortality.
Patients and MethodFrom March 2005 to July 2008, details of 302 laparoscopic gastric surgical interventions were sent to the Association of Spanish Surgeons web-site. Details of surgical technique, reconversion, clinical and pathological data, morbidity and mortality were collected and analysed.
ResultsA total of 245 patients had gastric adenocarcinoma, 35 of them stromal tumours and 22 other gastric pathologies. In gastric adenocarcinoma patients, resection was performed in 232 cases (95%). The most frequent histology was intestinal, mainly located in the distal third of the stomach, with 34% of the tumours being locally advanced. D2 lymphadenectomy was performed in 117 cases, D1 in 105, and D0 in 6. Reconversion was needed in 21 cases (9%), with technical difficulty being the most frequent cause . Postoperative complications were reported in 72 patients (31%), with anastomotic leak being one of the most significant. Postoperative mortality was 6%, with sepsis due to anastomotic leak and cardiac or respiratory complications the most frequent causes. The mean hospital stay of patients without complications was 9.2±3 days.
ConclusionsLaparoscopic gastrectomy for gastric cancer is a feasible but technically demanding procedure. Potential benefits of minimal invasive surgery can be reduced due to a high rate of postoperative complications.
La introducción de las técnicas mínimamente invasivas en la cirugía de los tumores digestivos ha tenido un desarrollo desigual. En el cáncer de colon, existen ensayos clínicos aleatorizados que demuestran ventajas en el postoperatorio inmediato del tratamiento laparoscópico, con resultados oncológicos similares a los del abordaje convencional a largo plazo1. Sin embargo, en otro tipo de tumores abdominales no hay suficiente evidencia de su eficacia debido a que son menos frecuentes, la complejidad técnica de la cirugía es mayor y las características biológicas son diferentes. Ante la dificultad para desarrollar estudios prospectivos controlados que aporten más solidez científica, y a la espera de éstos, se establecieron una serie de registros nacionales sobre cirugía laparoscópica hepática, pancreática, esofágica y gástrica, auspiciados por las diferentes secciones de la Asociación Española de Cirujanos (AEC)2,3. La información que aportan los registros es especialmente útil en los casos en que los procedimientos se aplican a un pequeño número de pacientes por ser técnicas no estandarizadas, en patologías de escasa prevalencia y en los que la experiencia se limita a un reducido número de cirujanos. Este tipo de registros permite acumular gran cantidad de información, cuyo análisis ayuda a identificar problemas técnicos y establecer una serie de recomendaciones para evitarlos, así como determinar la viabilidad y la eficacia de las nuevas técnicas a largo plazo especialmente en patología oncológica.
En el año 2005 se inició el Registro Nacional de Cáncer Gástrico por laparoscopia auspiciado por las secciones de cirugía laparoscópica y de cirugía esofagogástrica de la AEC. El objetivo de este trabajo es dar a conocer y analizar cómo se ha ido desarrollando este procedimiento en nuestros hospitales.
Material y métodoEn marzo de 2005 se inició la recogida de datos de cirugía gástrica por laparoscopia a través de un cuestionario ubicado en la página web de la AEC (www.aecirujanos.es/registros_cir_lap/reg_cir_lap_gastrica.php). Se incluyó a todos los pacientes intervenidos en cualquier hospital del territorio nacional, independientemente de la experiencia previa, con el único requisito de haberse iniciado la cirugía por laparoscopia. Tras finalizar la introducción de cada caso, los datos eran remitidos al coordinador del registro, para su análisis en una base de datos Microsoft Access 2003. El formulario incluía información clínica de los pacientes, aspectos de la técnica quirúrgica, características anatomopatológicas de los tumores, evolución postoperatoria, morbilidad, mortalidad y seguimiento (fig. 1).
Hasta julio de 2008 han sido remitidos 302 pacientes intervenidos por diferentes afecciones gástricas, entre los que destacan 245 adenocarcinomas gástricos que son el objetivo de este análisis (tabla 1). Para la estadificación de los tumores se utilizó la clasificación TNM de la UICC (5.a ed.)4. Los tumores que afectaban a la serosa o invadían órganos vecinos fueron considerados localmente avanzados independientemente de la afección ganglionar. El tipo de linfadenectomía realizada se estableció en función del criterio del cirujano que realizó la intervención según la definición establecida por la Japanese Classification of Gastric Carcinoma5. Esta clasificación define los ganglios regionales en tres niveles dependiendo de la localización del tumor primario, y se establecen cuatro categorías de disección (D0–D3). En los pacientes que presentaron más de una complicación, sólo se ha registrado la de mayor gravedad potencial. A pesar de que el seguimiento a largo plazo no se encontraba entre los objetivos iniciales de este registro, se hizo constar la fecha del último control y el estado del paciente.
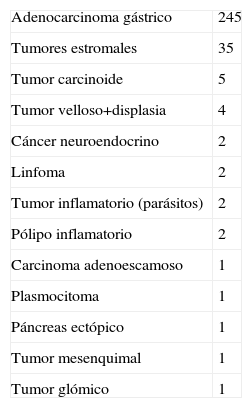
Patologías gástricas remitidas al Registro Nacional
| Adenocarcinoma gástrico | 245 |
| Tumores estromales | 35 |
| Tumor carcinoide | 5 |
| Tumor velloso+displasia | 4 |
| Cáncer neuroendocrino | 2 |
| Linfoma | 2 |
| Tumor inflamatorio (parásitos) | 2 |
| Pólipo inflamatorio | 2 |
| Carcinoma adenoescamoso | 1 |
| Plasmocitoma | 1 |
| Páncreas ectópico | 1 |
| Tumor mesenquimal | 1 |
| Tumor glómico | 1 |
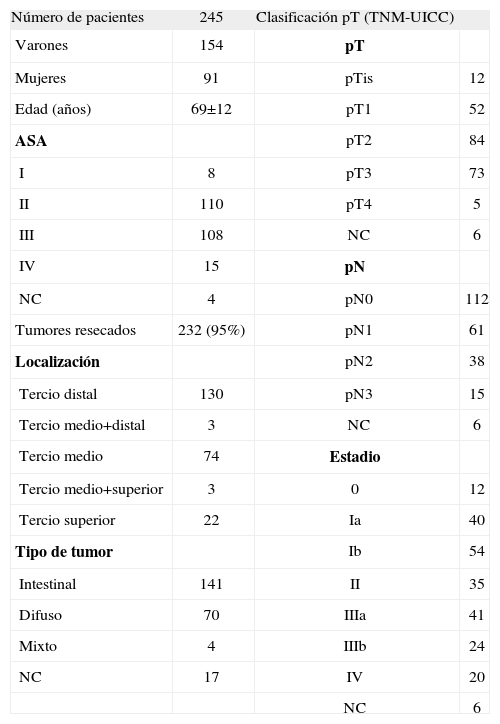
De los 245 pacientes intervenidos por adenocarcinoma gástrico, 154 eran varones y 91, mujeres. La media de edad de la serie fue 69±12 años. Los tumores resecados se encontraban localizados de forma predominante en el tercio distal del estómago y el tipo histológico más frecuente fue el intestinal. El 34% de estos tumores presentaban infiltración de la serosa, por lo que se los ha considerado localmente avanzados (tabla 2).
Características clínico-patológicas en adenocarcinomas gástricos
| Número de pacientes | 245 | Clasificación pT (TNM-UICC) | |
| Varones | 154 | pT | |
| Mujeres | 91 | pTis | 12 |
| Edad (años) | 69±12 | pT1 | 52 |
| ASA | pT2 | 84 | |
| I | 8 | pT3 | 73 |
| II | 110 | pT4 | 5 |
| III | 108 | NC | 6 |
| IV | 15 | pN | |
| NC | 4 | pN0 | 112 |
| Tumores resecados | 232 (95%) | pN1 | 61 |
| Localización | pN2 | 38 | |
| Tercio distal | 130 | pN3 | 15 |
| Tercio medio+distal | 3 | NC | 6 |
| Tercio medio | 74 | Estadio | |
| Tercio medio+superior | 3 | 0 | 12 |
| Tercio superior | 22 | Ia | 40 |
| Tipo de tumor | Ib | 54 | |
| Intestinal | 141 | II | 35 |
| Difuso | 70 | IIIa | 41 |
| Mixto | 4 | IIIb | 24 |
| NC | 17 | IV | 20 |
| NC | 6 |
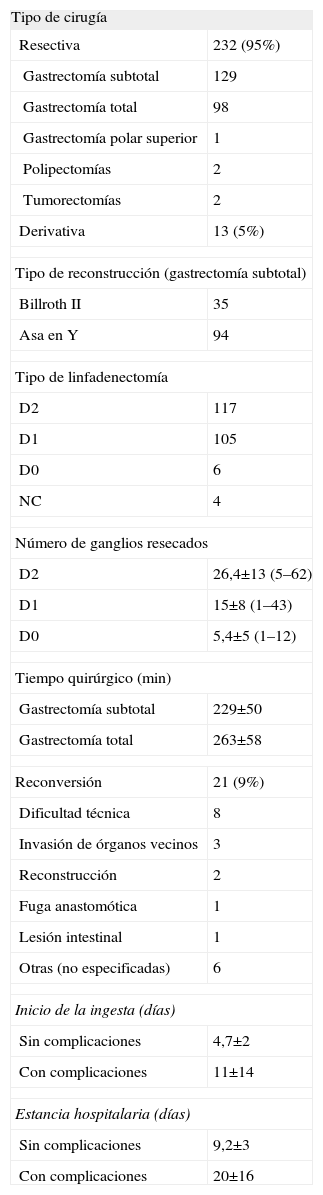
Se realizó cirugía resectiva en 232 (95%) casos y derivativa en 13 (5%) (tabla 3). El tipo de resección más frecuente fue la gastrectomía subtotal (129 casos), aunque el número de gastrectomías totales también fue elevado (98 casos). Las polipectomías laparoscópicas y la tumorectomía estaban justificadas por tratarse de tumores incipientes en pacientes de edad muy avanzada y con alto riesgo quirúrgico. Las dos polipectomías se realizaron mediante gastrotomía laparoscópica. Las tumorectomías consistieron en una gastrectomía en cuña (tabla 3). Todos los tumores del tercio superior fueron tratados mediante gastrectomía total, excepto en un tumor precoz en el que se realizó una gastrectomía polar superior. Los tumores del tercio medio fueron tratados en la mayoría de los casos mediante una gastrectomía total, aunque en 19 de ellos se realizó una gastrectomía subtotal. En 22 pacientes con tumores del tercio inferior se realizó una gastrectomía total. La reconstrucción del tránsito en las gastrectomías totales fue mediante una esofagoyeyunostomía en Y de Roux en todos los casos y en un 27% de las gastrectomías subtotales se realizó una gastroyeyunostomía tipo Billroth II (tabla 3). Las anastomosis se realizaron íntegramente por laparoscopia en 132 (57%) casos, mientras que en 71 (31%) fueron asistidas por la laparotomía realizada para la extracción de la pieza. En todos los casos de gastroenteroanastomosis asistida se reconstruyó el tránsito mediante una gastroyeyunostomía con asa en Y de Roux, excepto en 3 casos en que se realizó una reconstrucción tipo Billroth II. El número de linfadenectomías D1 y el de D2 fueron similares, con un ligero predominio de la D2. La media del número de ganglios extraídos y sus intervalos se muestran en la tabla 3. La media de ganglios resecados en relación con el grado de invasión de la pared del tumor primario fue: 19,6±13 (1–62) en T1, 20±13 (1–60) en T2 y 23,1±12 (2–52) ganglios en T3. El 9% de los pacientes resecados fueron reconvertidos a cirugía abierta, y la causa más frecuente fueron las dificultades técnicas. Ninguno de los casos en los que se realizó cirugía derivativa precisó reconversión.
Características de la cirugía en adenocarcinomas gástricos
| Tipo de cirugía | |
| Resectiva | 232 (95%) |
| Gastrectomía subtotal | 129 |
| Gastrectomía total | 98 |
| Gastrectomía polar superior | 1 |
| Polipectomías | 2 |
| Tumorectomías | 2 |
| Derivativa | 13 (5%) |
| Tipo de reconstrucción (gastrectomía subtotal) | |
| Billroth II | 35 |
| Asa en Y | 94 |
| Tipo de linfadenectomía | |
| D2 | 117 |
| D1 | 105 |
| D0 | 6 |
| NC | 4 |
| Número de ganglios resecados | |
| D2 | 26,4±13 (5–62) |
| D1 | 15±8 (1–43) |
| D0 | 5,4±5 (1–12) |
| Tiempo quirúrgico (min) | |
| Gastrectomía subtotal | 229±50 |
| Gastrectomía total | 263±58 |
| Reconversión | 21 (9%) |
| Dificultad técnica | 8 |
| Invasión de órganos vecinos | 3 |
| Reconstrucción | 2 |
| Fuga anastomótica | 1 |
| Lesión intestinal | 1 |
| Otras (no especificadas) | 6 |
| Inicio de la ingesta (días) | |
| Sin complicaciones | 4,7±2 |
| Con complicaciones | 11±14 |
| Estancia hospitalaria (días) | |
| Sin complicaciones | 9,2±3 |
| Con complicaciones | 20±16 |
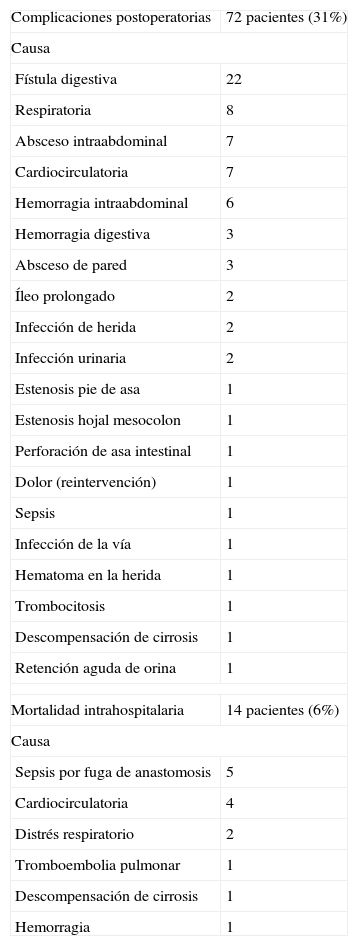
El 31% de los pacientes resecados presentaron complicaciones postoperatorias, y en el 24% de ellos se observó más de una. Las complicaciones más frecuentes fueron las fístulas digestivas, seguidas de las cardiorrespiratorias y de los abscesos intraabdominales (tabla 4). Las fístulas se observaron en un 14% de las gastrectomías totales y en un 6% de las subtotales. La realización de una anastomosis asistida por laparotomía se asoció con un mayor número de fístulas que las realizadas íntegramente por laparoscopia al realizar una gastrectomía total, mientras que en las gastrectomías subtotales no existió esta diferencia. Los tumores localmente avanzados no presentaron mayor número de fístulas que aquellos en que no había afección de la serosa. El 38% de los pacientes en quienes se realizó reconversión presentaron complicaciones postoperatorias y las causas fueron: dificultades técnicas (3), lesión intestinal (1), fuga tras comprobación de gastroyeyunostomía (1), invasión de órganos vecinos (1) y no especificadas (2). Se requirió transfusión sanguínea durante la intervención en el 23% de los pacientes, con una moda de 2 (intervalo, 2–10) concentrados de hematíes.
Complicaciones postoperatorias y mortalidad en cirugía resectiva
| Complicaciones postoperatorias | 72 pacientes (31%) |
| Causa | |
| Fístula digestiva | 22 |
| Respiratoria | 8 |
| Absceso intraabdominal | 7 |
| Cardiocirculatoria | 7 |
| Hemorragia intraabdominal | 6 |
| Hemorragia digestiva | 3 |
| Absceso de pared | 3 |
| Íleo prolongado | 2 |
| Infección de herida | 2 |
| Infección urinaria | 2 |
| Estenosis pie de asa | 1 |
| Estenosis hojal mesocolon | 1 |
| Perforación de asa intestinal | 1 |
| Dolor (reintervención) | 1 |
| Sepsis | 1 |
| Infección de la vía | 1 |
| Hematoma en la herida | 1 |
| Trombocitosis | 1 |
| Descompensación de cirrosis | 1 |
| Retención aguda de orina | 1 |
| Mortalidad intrahospitalaria | 14 pacientes (6%) |
| Causa | |
| Sepsis por fuga de anastomosis | 5 |
| Cardiocirculatoria | 4 |
| Distrés respiratorio | 2 |
| Tromboembolia pulmonar | 1 |
| Descompensación de cirrosis | 1 |
| Hemorragia | 1 |
En la serie se ha observado mortalidad intrahospitalaria de 14 (6%) pacientes; entre sus causas destacan las complicaciones infecciosas por fugas digestivas y las cardiocirculatorias (tabla 4). El riesgo anestésico en estos pacientes fue ASA III (8), ASA IV (2) y ASA II (4). La mayoría de los pacientes fallecidos (8) presentaban tumores localmente avanzados.
El tiempo transcurrido hasta el inicio de la ingesta y la estancia media se muestran en la tabla 3. A pesar de que el seguimiento estricto en el tiempo y el estado de los pacientes no formaba parte de los objetivos iniciales del registro, se ha observado un seguimiento medio de 429 (6–2.033) días. En ningún caso se informó de la aparición de implantes en los orificios de los trocares.
Los centros que han colaborado en el Registro Nacional son 18 (tabla 5).
Centros participantes
| Hospital de Zumárraga (Guipuzcoa) |
| Hospital Josep Trueta (Girona). |
| Hospital de Donostia. |
| Hospital de Igualada. |
| Povisa (Vigo). |
| Hospital Royo Villanova (Zaragoza). |
| Hospital Sant Pau (Barcelona). |
| Hospital La Paz (Madrid). |
| Hospital Mutua de Terrassa. |
| Hospital Son Llatzer (Mallorca). |
| Hospital Sant Joan (Reus). |
| Hospital del Mar (Barcelona). |
| Hospital Universitario de Canarias |
| Hospital Severo Ochoa (Leganés). |
| Hospital de Serrallana.(Torrelavega) |
| Hospital de Jerez. |
| Hospital Clínico Universitario de Valencia |
| Complejo Hospitalario Jaén |
Entre los restantes casos destacaron los tumores estromales (35). Se localizaron de forma mayoritaria en los tercios medio y distal, aunque en 10 casos se encontraban en el tercio proximal. Las resecciones realizadas fueron segmentarias mediante endograpadora, excepto 4 gastrectomías subtotales y 1 gastrectomía total por la localización o el tamaño de los tumores. La mediana del tamaño fue de 4,5 (0,6–12)cm, y en el 75% de los casos fue >3cm. Tan solo en 4 pacientes se informó de complicaciones: respiratorias (2), hemorragia (1) y hematoma por trocar (1). Ningún caso requirió reconversión.
DiscusiónA principios de la década de los noventa se comunicaron las primeras experiencias de cirugía laparoscópica en el adenocarcinoma gástrico6–8. La evolución de la cirugía minimamente invasiva en los países en que esta enfermedad tiene una alta prevalencia ha puesto de manifiesto que la gastrectomía distal videoasistida en el carcinoma gástrico precoz presenta una serie de ventajas sobre la cirugía abierta. Entre ellas destacan un menor dolor, una menor pérdida de sangre, inicio de la ingesta oral de forma precoz y una corta hospitalización9,10. Los seguimientos a largo plazo en los tumores precoces, en los que el tipo de linfadenectomía no es tan relevante, hacen que se la considere segura desde el punto de vista oncológico y sea bien aceptada entre los cirujanos orientales11. En 2003, más de 1.700 pacientes con cáncer gástrico fueron intervenidos de gastrectomía distal asistida por laparoscopia en Japón12. Sin embargo, su aceptación en los tumores localmente avanzados continúa siendo controvertida. Series cortas con tumores localmente avanzados también muestran los beneficios a corto plazo e informan de la seguridad oncológica, aunque en la actualidad no hay suficiente evidencia13–16. A pesar de la existencia de ensayos que informan de la seguridad del tratamiento laparoscópico de los tumores colorrectales avanzados en cuanto a su curabilidad, puede resultar precipitado trasladar estos resultados directamente a los tumores gástricos que afectan a la serosa, debido a sus diferentes características biológicas17–19.
En la serie destaca un elevado número de gastrectomías totales en los tumores del tercio medio (72%) y en un 18% de los localizados en el tercio distal. La falta de sensación táctil puede dificultar la identificación del tumor e influir en la decisión de establecer unos márgenes de resección más extensos. Ni el tamaño ni la infiltración macroscópica de la serosa influyeron en el número de gastrectomías totales en los tumores del tercio medio y distal, lo que indica que la decisión pudiera estar relacionada con las preferencias del cirujano para cada caso.
En la actualidad persiste la controversia sobre los beneficios de la extensión de la linfadenectomía en el tratamiento radical de la enfermedad. La experiencia japonesa muestra el beneficio de la linfadenectomías D2 en los seguimientos a largo plazo de los tumores localmente avanzados. Sin embargo, los estudios prospectivos aleatorizados realizados en Occidente no han podido confirmar estos resultados20,21. Independientemente del debate creado, las linfadenectomías extensas disminuyen las recidivas locorregionales22. Aunque en el 50% de los pacientes resecados se realizó una linfadenectomía D2, llama la atención que en el 46% de los tumores localmente avanzados se practicara una linfadenectomía D1 o menor. A pesar de que la media del número de ganglios extraídos en relación con el tipo de linfadenectomía parece razonable, sorprenden los rangos inferiores en las linfadenectomías y las diferencias entre los centros participantes. Si analizamos los tumores T3, se puede observar una media de 23,1±12 ganglios resecados pero, mientras en uno de los centros fue de 28±14, en otro con un número similar de casos fue de 9,1±5 ganglios.
La tasa de reconversión es baja (9%) al compararla con otros estudios que informan entre el 1,1 y el 33%11,23,24. Entre sus causas destacan las dificultades técnicas (53%). En la mayoría de los casos no se hizo constar el tipo de dificultades, aunque fueron más frecuentes en los tumores localmente avanzados. A pesar de que la hemorragia intraoperatoria es una causa frecuente de reconversión en la mayoría de los trabajos publicados, no ha sido posible relacionarla con las dificultades técnicas de nuestra serie.
Al analizar la tasa de complicaciones postoperatorias (32%) se ha de tener presente que se han incluido tanto las mayores como las menores y que se trata de un registro sin criterios de inclusión predefinidos, que incluye la experiencia inicial de la mayoría de los cirujanos, con un considerable número de pacientes con alto riesgo (ASA III–IV), con un porcentaje alto de estadios avanzados y en los que se ha realizado linfadenectomías extensas. La revisión de la literatura muestra tasas que pueden oscilar entre el 11,8 y el 35%17,25. No obstante, incluso la cirugía abierta con linfadenectomías D2 se ha asociado a tasas de complicaciones que han llegado al 43 y el 46%20,21. En la serie, las fístulas digestivas ocurrieron con mayor frecuencia en las gastrectomías totales. Las asistidas por laparotomía se asociaron de forma significativa con un mayor número de fístulas que las realizadas íntegramente por laparoscopia. Los pacientes que requirieron reconversión presentaron una tasa de complicaciones postoperatorias ligeramente superior a la observada en el total de la serie, lo que indica que este subgrupo de pacientes requiere estrecha vigilancia. El análisis de la aparición temporal de las complicaciones mostró que fueron disminuyendo con la experiencia acumulada por los centros. Con el objetivo de mejorar los resultados parece aconsejable estar familiarizado con los procedimientos estándar en la cirugía abierta del cáncer gástrico, así como contar en los casos iniciales con la tutela de cirujanos con experiencia previa. Entre las causas de mortalidad destacan las complicaciones cardiorrespiratorias y las sepsis secundarias a fugas anastomóticas, que hacen de la reconstrucción del tránsito uno de los aspectos técnicos más relevantes.
Hasta la actualidad existen dos metanálisis sobre la gastrectomía distal laparoscópica comparada con la abierta26,27. En uno de ellos se incluyeron 4 ensayos controlados y aleatorizados y 12 estudios retrospectivos, y se concluyó que la gastrectomía distal laparoscópica se asociaba con menor morbilidad, menor dolor, tránsito precoz y menor estancia hospitalaria, pero con menor número de ganglios resecados25. Sin embargo, otro metaanálisis posterior que incluía exclusivamente los mismos 4 ensayos controlados y aleatorizados sólo ha mostrado menores pérdidas sanguíneas a expensas de un mayor tiempo quirúrgico y menor número de ganglios extraídos. A pesar de las limitaciones existentes en la interpretación de los datos (pocos ensayos, número limitado de casos y seguimiento corto), los autores concluyeron que no se podía recomendar su aplicación sistemática26.
En conclusión, la cirugía laparoscópica en el cáncer gástrico es un procedimiento técnicamente complejo que se asocia al inicio con un número considerable de complicaciones. Su consolidación en la práctica clínica va a depender de que pueda realizarse con una baja morbilidad y de la confirmación de la seguridad oncológica a largo plazo. Los registros, en los que no se han establecido de forma previa unas condiciones para homogeneizar criterios, pueden presentar sesgos y limitaciones para su análisis preciso. No obstante, permiten conocer lo que se está realizando en el día a día de nuestros hospitales.