Introducción
Conceptos básicos
La tomografía por emisión de positrones (PET) es una técnica de medicina nuclear que permite obtener imágenes de la distribución in vivo de diferentes moléculas. Es lo que se ha denominado la imagen molecular, complemento de la información anatómica que proporcionan la tomografía computarizada (TC) o la resonancia magnética (RM). Las imágenes diagnósticas de la PET se obtienen mediante la administración por vía intravenosa de un radiofármaco, que es la unión de un isótopo radiactivo con una molécula determinada; pasado un tiempo variable de incubación dependiente, del radiofármaco empleado, se realiza la adquisición de imágenes corporales en una tomogammacámara PET. En la práctica clínica diaria, la molécula que se utiliza es la 2-fluoro-D-desoxiglu-cosa (FDG) que va unida al 18 F, isótopo radiactivo emisor de positrones de período de semidesintegración muy corto (110 min). La 18 F-FDG es un análogo de la glucosa y es captada tanto por las células normales como por las cancerosas, pero no sigue el ciclo bioquímico normal de la glucosa, por lo que queda atrapada en su interior.
De forma fisiológica, algunos tejidos como el cerebro, el miocardio o el hígado tienen una alta demanda de glucosa, lo que se traduce en una alta retención de 18 FFDG. En el caso de las células malignas, su alta tasa metabólica implica igualmente una gran avidez por la 18 FFDG, cuyo paso al interior celular está, además, muy potenciado, lo que permite a priori diferenciar los tejidos malignos de los benignos. No obstante, la imagen obtenida tiene limitaciones en cuanto a la detección de la enfermedad de muy bajo grado de malignidad, debido precisamente a una menor avidez por la glucosa; del mismo modo, también puede mostrar zonas de elevada actividad celular de causa benigna, como la inflamación o la infección, que serán causas potenciales de falsos positivos. Además, aunque las tomogammacámaras PET poseen una aceptable resolución espacial (4-5 mm), cabe señalar que la imagen obtenida no será capaz de detectar la enfermedad microscópica. También estará dificultada la identificación de lesiones malignas en órganos que acumulen o eliminen de forma fisiológica la FDG, como es el caso del cerebro o los riñones.
Dado que estamos analizando el metabolismo de las células cancerosas, su detección será más precoz que las alteraciones morfológicas, parámetro utilizado por la TC o la RM. Además, se podrán evaluar también de forma más precoz los efectos de los tratamientos tanto quimioterápicos como radioterápicos, en comparación con esas técnicas convencionales. Por el contrario, la falta de definición anatómica de la PET conlleva que la introducción de los nuevos equipos híbridos PET-TAC o PET-RM proporcionen al especialista una visión completa de la enfermedad, especialmente cuando se prevean procedimientos quirúrgicos.
La PET en el cáncer de mama
La captación de FDG en el cáncer de mama está influida por varios factores, entre ellos la microvasculatura, la expresión del transportador de glucosa del subtipo I (GLUT-1) y de la enzima de la glucólisis hexocinasa sub-tipo II, la carga tumoral (número de células por unidad de volumen) y la tasa de proliferación1-3 . Se ha comprobado que la actividad de fosforilación mediada por la hexocinasa II es más reducida en el cáncer de mama que en el de pulmón, lo cual implica una menor acumulación intracelular de glucosa3,4 . También se sabe que el metabolismo de la glucosa se incrementa de manera exponencial con el crecimiento tumoral y que sólo los tumores > 1 cm están principalmente constituidos por clones celulares menos dependientes del oxígeno que utilizan sobre todo la glucólisis anaerobia para la obtención de energía4 . Las investigaciones en animales de laboratorio han demostrado que la captación de FDG en el cáncer de mama refleja fundamentalmente la tasa de proliferación celular2 . En este sentido, estudios como el de Buck et al5 han mostrado que sólo el índice proliferativo histológico Ki-67 presenta una correlación significativa con la acumulación intracelular de FDG, entre todos los parámetros de biología molecular tumoral considerados en su trabajo, aunque otros autores, como Crippa et al6 , también han relacionado una elevada expresión del antioncogén p53 con una mayor retención de glucosa.
Este especial comportamiento bioquímico, unido a la capacidad de resolución espacial de los tomógrafos PET humanos, implica que se puedan obtener resultados falsamente negativos al valorar lesiones < 5-10 mm y, en menor grado, en tumores de bajo potencial proliferativo (carcinomas lobulillares, enfermedad de Paget y carcinomas in situ )4,7,8 . Además, la capacidad espacial de detección está influida, en parte, por el efecto del volumen parcial, por el cual pequeños tumores pueden pasar inadvertidos al ser mucho menos captantes y proporcionalmente más voluminosos, aunque la acumulación de FDG sea similar a la de tumores > 1 cm4 .
Es posible que las mamas presenten una captación fisiológicamente aumentada de FDG, sobre todo en pacientes jóvenes y/o en tratamiento hormonal, aunque suele tener un patrón difuso y de baja intensidad que pocas veces interfiere con la interpretación del estudio9 .
Los tumores benignos de la mama rara vez presentan captaciones significativas de FDG; lo habitual es que no la capten o su grado de captación medido por el SUV (Standard Uptake Value) no exceda de 2,5, valor umbral establecido para el diagnóstico de malignidad. No obstante, como ocurre en el caso de la gammagrafía con 99m Tc-MIBI, hay constancia de que fibroadenomas y displasias pueden mostrar grados de captación propios de tumores malignos4,10 . Sea como fuere, los resultados falsos positivos son motivados principalmente por la presencia de fenómenos inflamatorios o infecciosos (tuberculosis, sarcoidosis, histiocitosis) o iatrogénicos (cirugía, radioterapia o biopsia recientes)4,7,8 . Es recomendable evitar la inyección de la FDG en la extremidad ipsilateral a la lesión, ya que una extravasación de ésta implicará una migración linfática del radiotrazador hacia los ganglios axilares (fundamento básico de la técnica del ganglio centinela), que puede ser falsamente interpretado como una afección linfática maligna.
Pese a estas limitaciones, numerosos estudios han puesto de manifiesto las ventajas de la PET aplicada al cáncer de mama con respecto a las técnicas de diagnóstico convencionales. Como veremos más adelante, la PET es una técnica útil en el diagnóstico diferencial entre lesiones benignas y malignas de la mama, como método complementario de la mamografía, la ecografía y la RM cuando éstas aportan resultados dudosos. Aunque no es una técnica adecuada para el cribado, presenta una mayor exactitud en la evaluación de mamas densas, con prótesis o en presencia de lesiones multicéntricas o bilaterales. También permite una estadificación ganglionar no invasiva de la axila, así como la valoración de la cadena mamaria interna y del plexo braquial, aunque esta indicación, objetivo principal de este artículo, es aún algo controvertida. La capacidad de la PET para obtener imágenes de todo el cuerpo en una única exploración permite una estadificación global de la enfermedad, sobre todo en pacientes de alto riesgo, ya sea por tumores localmente avanzados, por elevación importante de los marcadores tumorales o por sospecha tras la estadificación convencional con otros métodos clínicos o de imagen anatómica. El propio grado de captación de FDG medido de forma semicuantitativa mediante el SUV parece correlacionarse con el grado de malignidad histológico, y se ha observado una mayor tasa de afección ganglionar regional cuanto mayor es el SUV; de esto se desprende un posible valor pronóstico de la PET que aún no ha sido demostrado11 . Dado que la captación de FDG refleja el volumen celular tumoral y su grado de proliferación, se ha utilizado con éxito en la predicción precoz de la respuesta al tratamiento, tanto a la quimioterapia neoadyuvante como a la terapia hormonal, hecho que merecerá una mención aparte.
En España, al contrario de lo que ocurre en Estados Unidos, el cáncer de mama no es contemplado como una indicación para el uso tutelado de la PET recomendado por el Ministerio de Sanidad y Consumo, si bien puede beneficiarse de indicaciones genéricas, como es el caso de la elevación de marcadores tumorales o la búsqueda de tumores primarios ocultos12 .
En el momento actual, la introducción de los nuevos equipos híbridos PET-TAC, que permiten la obtención de una imagen anatomofuncional, está generando expectación por lo que puedan aportar al manejo de los pacientes oncológicos. De forma general, esta nueva tecnología permitirá minimizar los falsos positivos de la PET, localizar de forma más exacta las lesiones neoplásicas y, en definitiva, aglutinar los beneficios de ambas técnicas en una sola exploración, lo que redundará en una mayor comodidad para el paciente y evitará exploraciones innecesarias, con el consiguiente ahorro de recursos. En el caso concreto del cáncer de mama, no hay todavía suficientes datos disponibles para un análisis en profundidad. Otros enfoques tecnológicos prometedores son el desarrollo de equipos híbridos PET-RM y de tomomamógrafos PET. En el caso de estos últimos, es previsible que lleguen a detectar tumores muy pequeños, del orden de 2-3 mm, solventando así la falta de resolución de los tomógrafos PET actuales13 .
Material y métodoSe ha realizado una revisión de la bibliografía disponible hasta el momento sobre la utilidad de la PET en el cáncer de mama. Para ello se han utilizado las bases de datos disponibles en Internet (PubMed-Med-line, Embase, CancerLit, Pascal, Cochrane Library Plus). La estrategia de búsqueda se basó en la introducción de los términos «positron emission tomography (PET)», «breast neoplasms » y «18-fluorodeoxy-glucose (FDG)» combinados mediante los operadores boleanos «AND » y «OR ». Se incluyeron artículos originales y revisiones sistemáticas, y se excluyeron los artículos de experimentación animal, las series de menos de 14 pacientes o con graves deficiencias metodológicas, técnicas o científica, según criterios de la medicina basada en la evidencia.
Se incluyen, además, los resultados obtenidos en un estudio realizado por nuestro centro sobre la utilidad de la PET-FDG en la evaluación de la afección ganglionar en pacientes diagnosticadas de cáncer de mama. En este estudio se evaluó a 35 pacientes con diagnóstico histológico de cáncer de mama remitidas para estadificación preterapéutica. En la selección se excluyó a las que tenían una manifiesta afección clínica ganglionar axilar, sugerente de enfermedad localmente avanzada. Para la exploración con PET se utilizó una cámara Siemens ECAT Exact 47 con cristales detectores basados en la tecnología BGO y una resolución espacial de 5 mm. La preparación de los pacientes incluyó ayuno de 4-6 h e hidratación previa por vía oral. Se administraron 150 µCi de FDG por kilogramo de peso por vía venosa periférica, previa determinación de glucemia basal. Tras 45-60 min se procedió a la adquisición de imágenes de cuerpo completo de emisión y transmisión con fuente de 68 Ge, 10 min por frame (37% transmisión) en modo 2D. Finalizada la exploración, se obtuvieron imágenes volumétricas y proyección 3D tras reconstrucción iterativa y corrección por atenuación.
La interpretación de las imágenes fue visual y semicuantitativa (SUV). Se consideraron como patológicas las lesiones que presentaban una captación superior a la fisiológica de la zona examinada y una semiología compatible con hipermetabolismo de origen neoplásico maligno.
Todas las pacientes fueron intervenidas quirúrgicamente tras la exploración PET, llevándose a cabo una mastectomía reglada y vaciamiento axilar ganglionar, con posterior análisis histopatológico de las piezas quirúrgicas.
Por último, se obtuvieron tablas de contingencia para la obtención de los resultados referentes a la sensibilidad, la especificidad, la exactitud y los valores predictivos positivo y negativo de la prueba.
ResultadosDiagnóstico de tumores primarios malignos de la mama
El diagnóstico precoz del cáncer de mama constituye uno de los factores pronósticos más importantes de esta enfermedad; de ahí que se haya recurrido a métodos de cribado poblacional para su detección. La técnica utilizada hasta la actualidad en el cribado del cáncer de mama es la mamografía, que presenta una sensibilidad del 8090% en la detección de lesiones malignas; sus principales factores limitantes son la densidad de la mama, los cambios fibrosos-fibroquísticos y las prótesis mamarias14 . La especifidad es muy baja debido a que muchos procesos benignos cursan con calcificaciones tisulares, uno de los parámetros utilizados para el diagnóstico de malignidad. Así, el valor predictivo positivo no supera el 30%, lo cual se traduce en un número elevado de biopsias innecesarias. La ecografía permite descartar lesiones quísticas, habitualmente benignas, pero no se utiliza como método de cribado debido que no permite detectar microcalcificaciones y a causa de la alta variabilidad interobservador. Este hecho motiva que la biopsia sea todavía indispensable en las lesiones sólidas, si bien es una técnica útil para dirigirla. La RM dinámica con contraste es una técnica con una sensibilidad muy alta en la detección del cáncer de mama, con un valor predictivo negativo cercano al 100%, y que además no se ve afectado por la alta densidad mamaria, permite explorar a pacientes con prótesis mamarias y es capaz de detectar enfermedades multicéntricas. No obstante, su especifidad es baja, muy parecida a la de la mamografía, lo cual, añadido al coste de la prueba, desaconseja su uso como método de cribado. Otras técnicas, como la gammagrafía con 99m Tc-MIBI, presentan cifras de sensibilidad y especifidad bastante parejas (70-90%). Aunque parece claro que no es un método adecuado para el cribado, tampoco se ha establecido aún su posible uso sistemático en la valoración de lesiones mamarias sospechosas debido a la escasa experiencia acumulada.
Algo parecido al caso de la gammagrafía ocurre con la PET. Su papel como método de cribado casi no ha sido abordado, puede que motivado en gran parte por su escasa disponibilidad y su alto coste. En el futuro es posible que se replantee su papel con la implantación de cámaras híbridas PET-TC, PET-RM y tomomamógrafos PET.
Ya hemos adelantado en la introducción las limitaciones de la PET en el diagnóstico del cáncer de mama, motivadas fundamentalmente por lesiones < 1 cm. Ello implica que las cifras de sensibilidad sean algo inferiores, de manera general, a las de especifidad. Así, en el estudio de Avril et al15 se comprobó una sensibilidad de sólo el 68% en tumores pT1 (< 2 cm), frente a un 92% en tumores pT2. También se comprobó una tasa de falsos negativos superior en tumores de extirpe lobulillar (65%) frente a los ductales (24%), probablemente debido al patrón de crecimiento difuso de los primeros. De este estudio también se desprende que el valor umbral óptimo del SUV para el diagnóstico de las lesiones malignas es del 2,5.
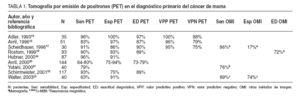
No obstante, los estudios realizados hasta el momento presentan bastante variabilidad (tabla 1)16-23 . Cabe destacar el realizado por la Technology Evaluation Center, Blue Cross and Blue Schield Association, que realizó una revisión sistemática entre junio de 1996 y marzo de 200124 , según los criterios de la medicina basada en la evidencia, para estudiar el papel de la PET en el diagnóstico diferencial de benignidad frente a malignidad en mamografías patológicas y/o masas palpables, con unos resultados de sensibilidad y especificidad del 89 y el 80%, respectivamente. El valor predictivo negativo fue del 88%, es decir, ante una PET negativa hay un 12% de posibilidades de no diagnosticar correctamente un cáncer de mama, por lo que no recomiendan usar PET-FDG para ayudar en la decisión de realizar una biopsia.
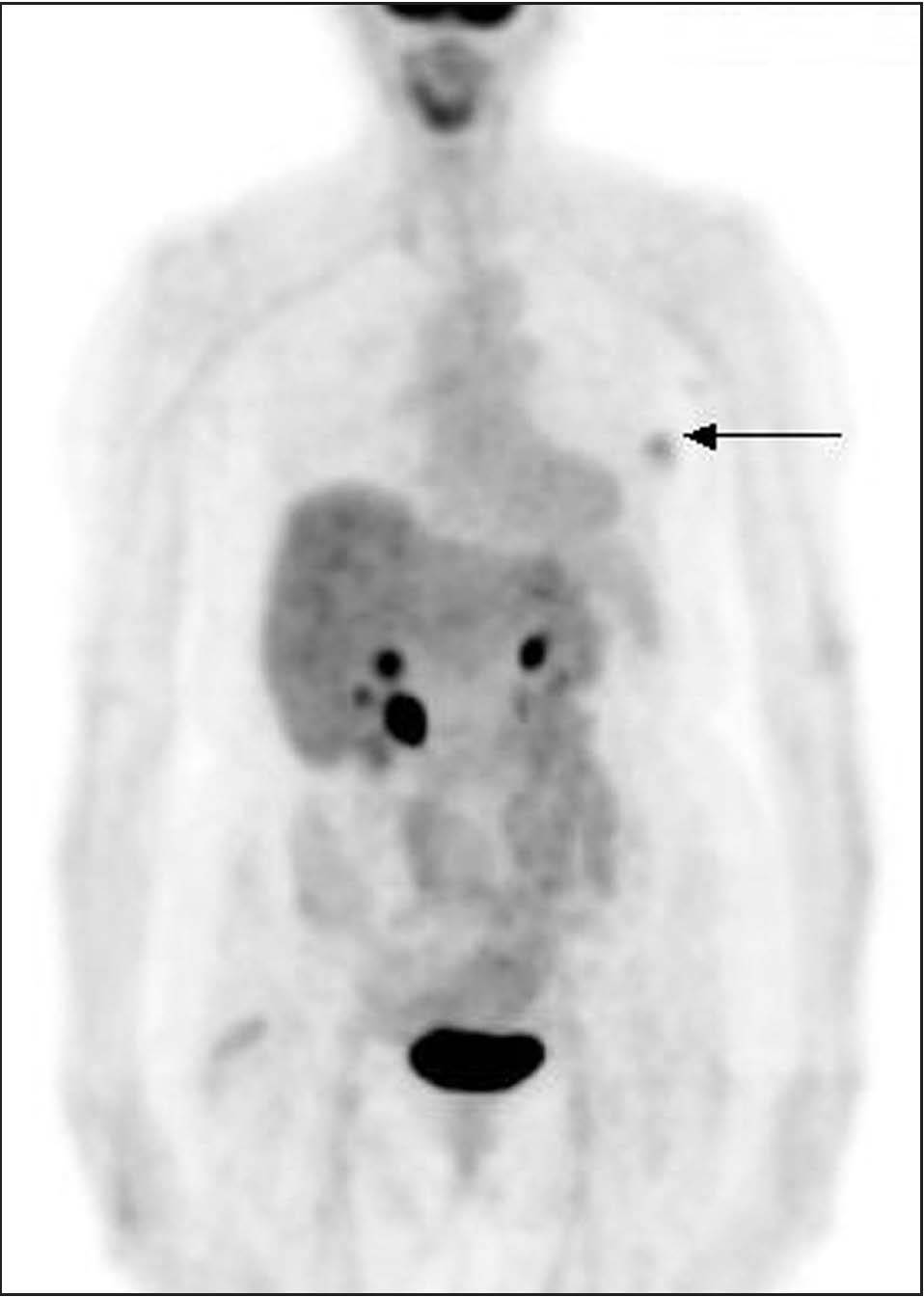
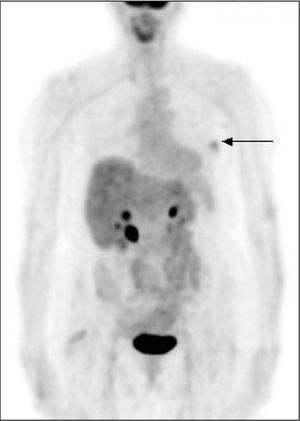
En el estudio realizado en nuestro centro, el 91% de los tumores malignos presentó captación significativa de FDG, confirmándose 3 falsos negativos en tumores pT1 (fig. 1). Los valores del SUV se situaron en 3,4 ± 2,3 y se observaron valores más altos en los tumores de mayor tamaño, alto grado histológico y Ki-67 > 15%, así como en los casos con afección ganglionar axilar.
Como ya se ha comentado, la sensibilidad de la PET no está afectada por la densidad de las mamas y puede ser útil en el estudio de mamografías dudosas. La PET también permite la detección de cáncer de mama multifocal o multicéntrico, con una sensibilidad superior a la de la mamografía y ecografía juntas, y quizá inferior a la de la RM, pero con una especificidad cercana al 100%23 .En el caso de las prótesis mamarias, la PET puede detectar las lesiones malignas con una excelente sensibilidad y valor predictivo negativo25,26 . Se echan en falta estudios comparativos entre la RM y la PET que permitan establecer la exactitud de ambas técnicas en estas dos últimas situaciones.
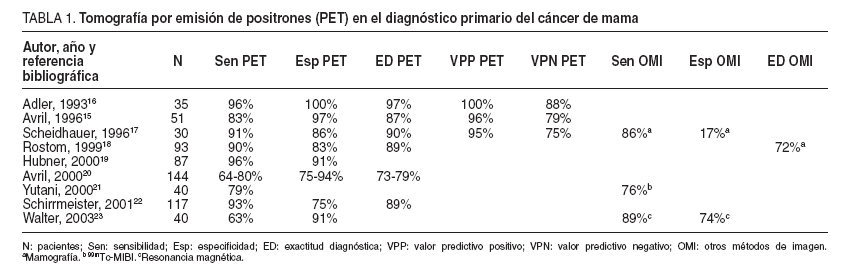
TABLA 1. Tomografía por emisión de positrones (PET) en el diagnóstico primario del cáncer de mama
Fig. 1. PET-FDG: tumor primario maligno en la mama derecha.
Diagnóstico de extensión ganglionar
La correcta estadificación de la afección ganglionar axilar proporciona una importante información pronóstica, aunque su impacto terapéutico es limitado. Los programas de diagnóstico precoz han llevado a que, en la actualidad, sólo una cuarta parte de los tumores pT1 presenten invasión ganglionar de la axila. De forma sistemática se realiza una disección axilar asociada con una mastectomía total o parcial, a pesar de la morbilidad asociada (linfedema de la extremidad, lesiones del plexo braquial, etc.). El desarrollo de técnicas de estadificación no invasivas o mínimamente invasivas, como la detección y biopsia del ganglio centinela, podrían evitar en un futuro intervenciones innecesarias. De manera general, los métodos de imagen anatómicos presentan limitaciones en cuanto a sensibilidad y, sobre todo, especificidad y no deben aplicarse de forma sistemática. La técnica del ganglio centinela proporciona información, tanto de la afección axilar como de la cadena mamaria interna, con una exactitud del 72-100% 27-30 . No obstante, su uso aún no se ha generalizado.
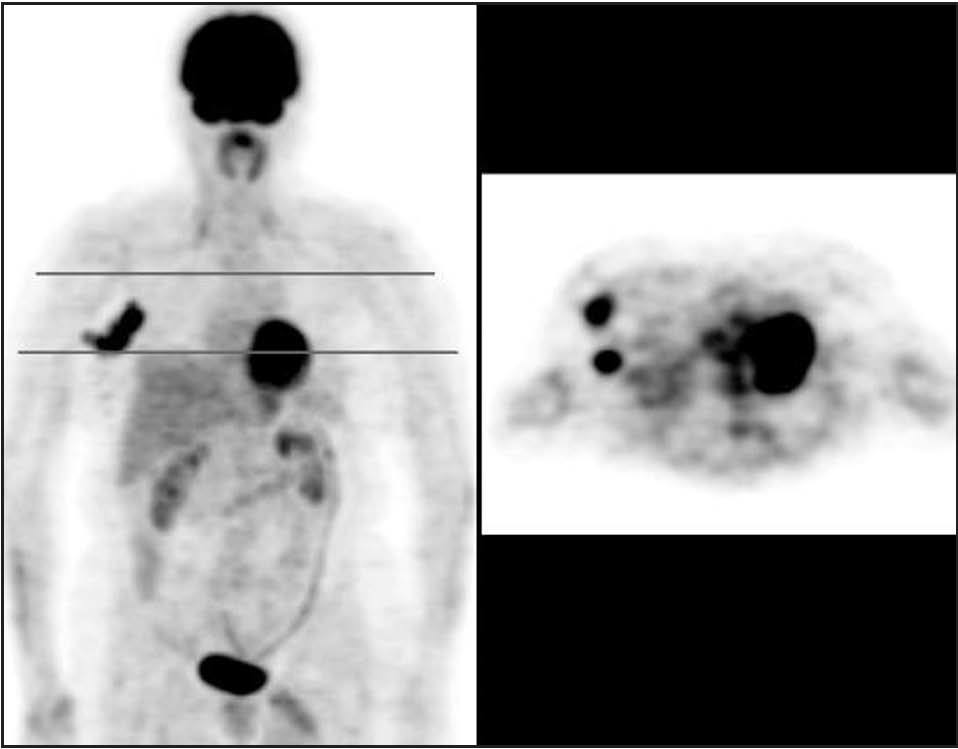
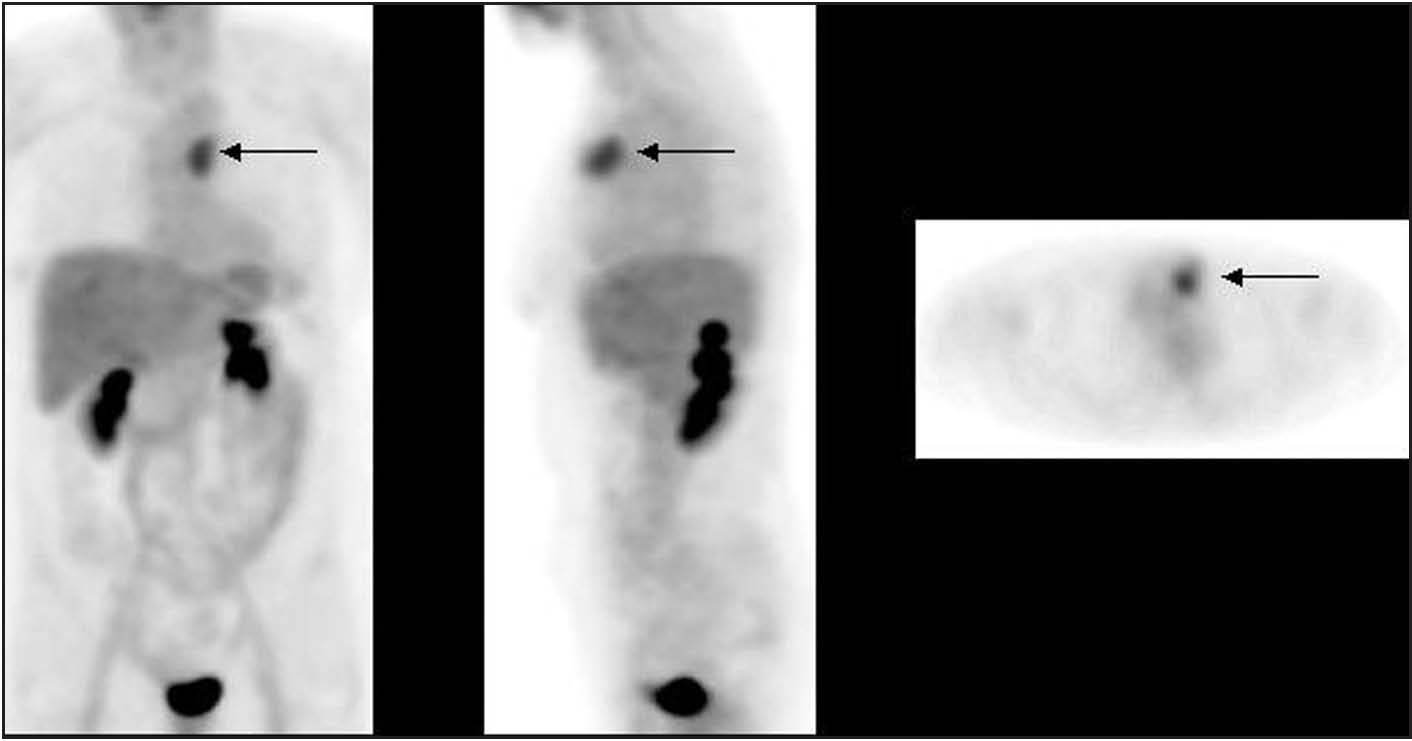
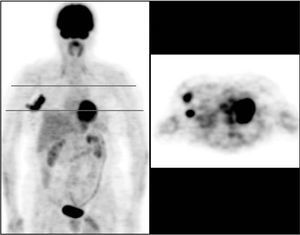
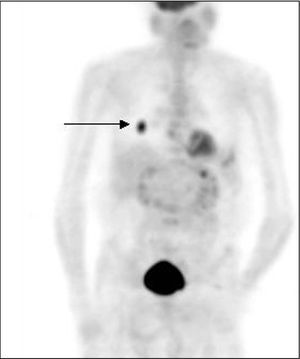
Fig. 2. PET-FDG: 2 focos de afección ganglionar axilar.
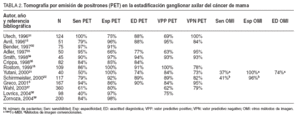
La PET presenta una sensibilidad aceptable, aunque insuficiente, para la detección de lesiones de axila (hasta un 20% de falsos negativos), debido en buena parte a su baja resolución espacial, que impide detectar lesiones < 5-10 mm, como ya hemos comentado en el caso de los tumores primarios (fig. 2). La mayoría de los estudios muestra una sensibilidad superior al 80% y una especifidad cercana al 100% (tabla 2)15,18,21,22,31-39 . Cabe destacar, entre ellos, el trabajo de Greco et al36 realizado en 167 pacientes, en el que obtuvieron una sensibilidad del 94%, una especificidad del 86% y unos valores predictivos del 84%. No obstante, otro grupo estadounidense ha realizado recientemente un estudio prospectivo multicéntrico en el que la sensibilidad fue sólo del 61%, la especificidad del 80% y los valores predictivos positivo y negativo del 62 y 79%, respectivamente 37 . De ahí que todavía haya cierta controversia acerca de la exactitud de la prueba. En otro estudio prospectivo aún más reciente, Lovrics et 38 evaluaron la exactitud de la PET con respecto a la biopsia selectiva del ganglio centinela y al vaciamiento ganglionar axilar en 98 pacientes con cáncer de mama en estadios I y II, y obtuvieron un 40% de sensibilidad, un 97% de especificidad y un valor predictivo positivo del 75%. Como consecuencia, aunque la PET determina la afección ganglionar axilar con probablemente la mayor exactitud diagnóstica de entre todos los métodos de imagen no invasivos, y aunque no haya sido del todo establecido el valor pronóstico de la enfermedad microscópica, a priori no puede reemplazar la evaluación histopatológica de los ganglios linfáticos axilares 40 . Se ha sugerido que la combinación de la PET y de la técnica del ganglio centinela permitiría una estadificación ganglionar de muy elevada exactitud, opinión que compartimos, aunque la experiencia acumulada es insuficiente para aconsejar ambas exploraciones de forma sistemática 39,41 .
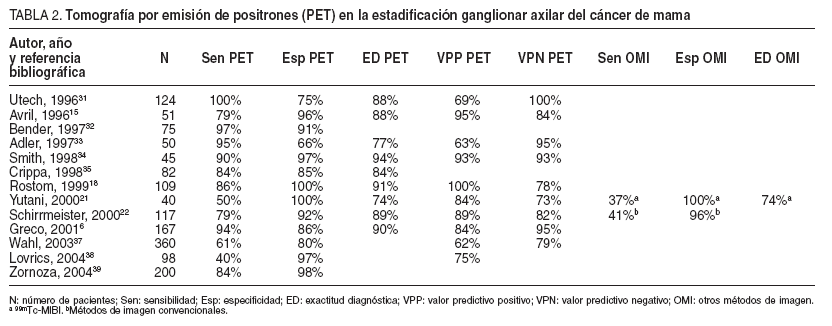
TABLA 2. Tomografía por emisión de positrones (PET) en la estadificación ganglionar axilar del cáncer de mama
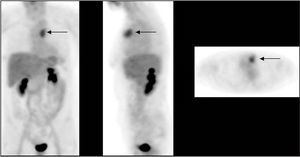
Al igual que la linfogammagrafía del ganglio centinela, la PET puede detectar la afección ganglionar de la cadena mamaria interna, hecho que ocurre en el 10-20% de las pacientes con cáncer de mama, y que en ocasiones pasa inadvertida para la TC o la RM (fig. 3). La presencia de la afección de la mamaria interna es un importante factor pronóstico, ya que estos pacientes presentan un doble riesgo de recurrencia o muerte a los 10 años del diagnóstico42 . Esta cadena suele estar afectada con más frecuencia en lesiones del cuadrante interno y en los casos con enfermedad localmente avanzada. Eubank et al43 publicaron un estudio con 73 pacientes en el que obtuvieron una sensibilidad y especificidad para la PET del 85 y 90%, respectivamente, en la estadificación mediastínica y de la mamaria interna.
En nuestro centro se realizó un estudio en 35 pacientes diagnosticadas de cáncer de mama a las cuales se les practicó una PET-FDG antes de cualquier decisión terapéutica. En la selección de las pacientes se excluyó a las que tenían una afección clínica ganglionar axilar manifiesta sugerente de enfermedad localmente avanzada. Tras la cirugía con vaciamiento axilar y el estudio anatomopatológico, fueron clasificadas en estadio I (n = 10), estadio IIA (n = 11), estadio IIB (n = 10) y estadio IIIA (n = 4). Obtuvimos unos resultados de sensibilidad y especificidad del 71 y del 100%, y un valor predictivo positivo y negativo del 100 y 84%, respectivamente. Los valores del SUV fueron de 3,8 ± 1,75. Los falsos negativos se asociaron con una afección ganglionar < 1 cm. No se detectaron afección de la cadena mamaria interna y metástasis a distancia. Nuestra opinión, al igual que la de muchos autores, es que una PET positiva podría indicar la necesidad de vaciamiento axilar, mientras que una negativa no la excluiría.
Fig. 3. PET-FDG: afección ganglionar de la cadena mamaria interna.
Debe citarse la posible utilidad de la PET en la diferenciación de la plexopatía braquial metastásica de la inducida por el tratamiento radioterápico, indicación que sólo se ha abordado en 1 estudio hasta el momento, con resultados prometedores44 .
La técnica híbrida PET-TC podría incrementar la exactitud de la estadificación ganglionar, sobre todo en términos de sensibilidad, y es posible que también ayude a la planificación del tratamiento radioterápico, como se ha sugerido en otras neoplasias malignas. Hasta el momento no se han publicado trabajos que evalúen la utilidad de esta nueva técnica en estas 2 situaciones.
Detección de metástasis a distancia
Las metástasis óseas son la manifestación a distancia más frecuente en el cáncer de mama. La necesidad de descartar o confirmar la diseminación hematógena de la enfermedad puede surgir en tumores muy avanzados localmente, en caso de elevación de los marcadores por encima de determinadas cifras o por la detección de lesiones sospechosas por otros métodos de imagen, sobre todo la TC en la afección visceral y la gammagrafía en la afección ósea. La razón es obvia, ya que la afección aislada del pulmón, del hígado o del hueso pueden ser tratadas mediante cirugía o radioterapia, mientras que la enfermedad diseminada sólo puede ser tratada con quimioterapia. En otras palabras, facilita un manejo individual de cada paciente.
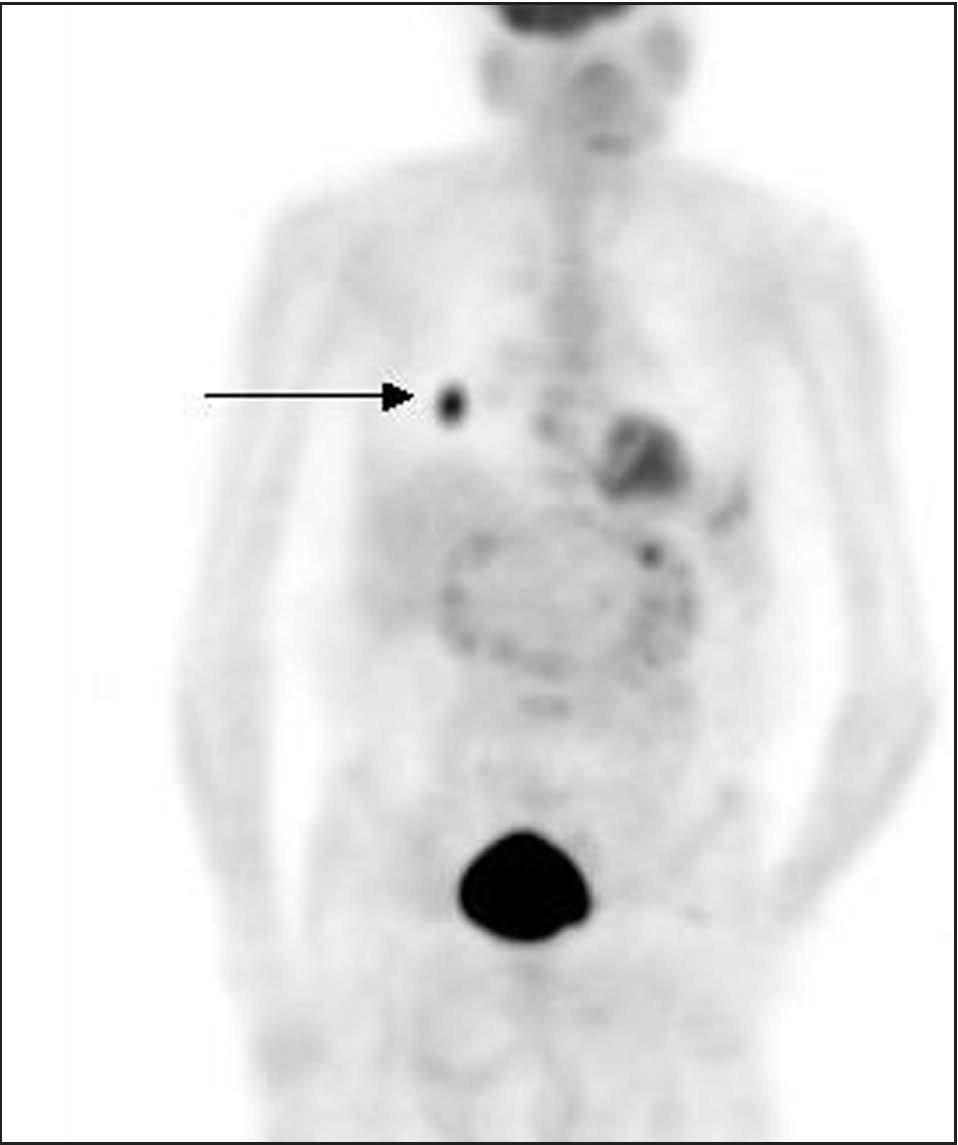
Fig. 4. PET-FDG: metástasis pulmonar única.
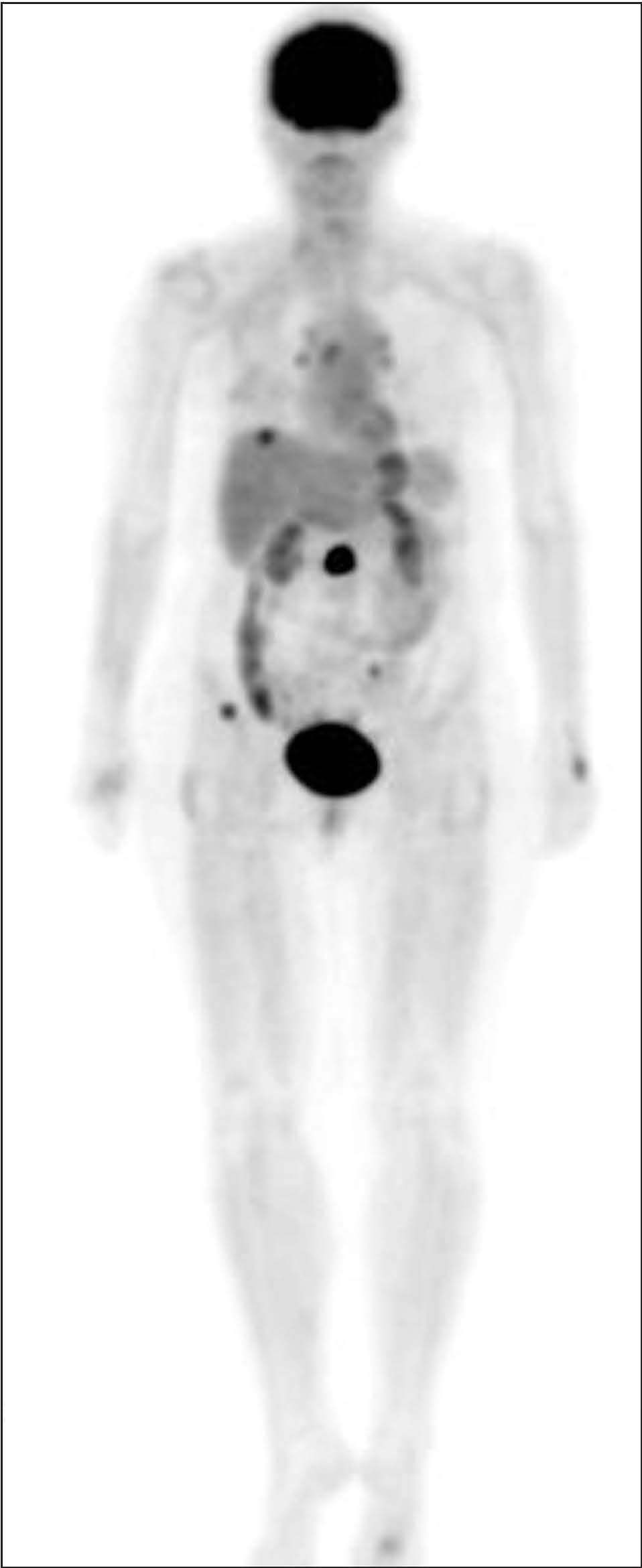
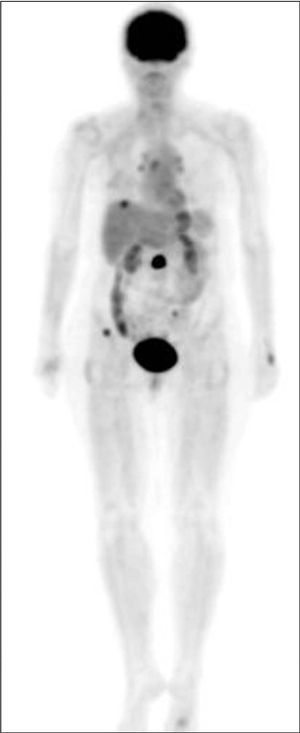
Como técnica de cuerpo entero que es, la PET proporciona información acerca de la estadificación sistémica con una alta fiabilidad, ya que todos los datos disponibles apuntan a que presenta mayor sensibilidad que las pruebas convencionales en la detección de la afección ganglionar a distancia y pulmonar, y similar sensibilidad en la detección de metástasis hepáticas y óseas18,22,45-47 (figs. 4 y 5). En el caso concreto de las metástasis óseas, la PET presenta mayor exactitud que la gammagrafía ósea con 99m Tc-ditostonatos (94,1 frente al 80,3%) y una especificidad más elevada (97,6 frente al 80,9%), tal y como se refleja en el estudio de Gallowitsch et al47,48 , aunque parece menos sensible en la detección de lesiones puras osteoblásticas48 . La PET también puede revelar metástasis no sospechadas, ya que podría detectar lesiones óseas en estadios muy tempranos, con afección únicamente de la médula ósea, que escaparían al diagnóstico gammagráfico. Es casi seguro que la introducción de los equipos híbridos PET-TC mejorará aún más la exactitud de la técnica.
De todo esto se desprende que la PET tiene un importante impacto en el manejo de los pacientes, como mostraron Yap et al49 y permite modificar la estadificación clínica en el 36% de los casos (en el 28% aumenta el estadio y en el 8% lo reduce). Estos mismos autores observaron un cambio en el manejo clínico en el 40% de los 50 pacientes estudiados. Otros autores también han puesto el énfasis en los beneficios de la PET en el seguimiento del cáncer de mama tratado50-53 .
Fig. 5. PET-FDG: metástasis óseas, hepáticas y ganglionares.
Otras indicaciones: control de la respuesta al tratamiento
El tratamiento quimioterápico neoadyuvante tiene como finalidad disminuir el tamaño del tumor primario y tratar las posibles micrometástasis. Como ya hemos mencionado, la PET evalúa fundamentalmente la carga celular tumoral y la tasa de proliferación, por lo que refleja con exactitud y precocidad la respuesta al tratamiento aplicado; en este aspecto se diferencia de los métodos convencionales, que sólo indican cambios en el tamaño, que generalmente suceden más tarde que los cambios metabólicos. La medición del grado de respuesta se basa en el estudio semicuantitativo con el SUV, considerándose como positivo un descenso de la glucólisis > 25% con respecto al estudio basal, aunque un descenso de al menos un 55% predice la remisión histopatológica con una exactitud del 80-90%54 .
Los estudios publicados en este sentido confirman una buena sensibilidad y una excelente especifidad para diferenciar a los respondedores de los no respondedores55-57 . La PET puede mostrar una correcta respuesta al tratamiento tras el primer ciclo de quimioterapia, lo que permitiría a priori un cambio precoz en la línea de tratamiento en el caso de falta de respuesta o progresión. También se han publicado estudios en los que se ha valorado la respuesta a la hormonoterapia58,59 .
Aunque un estudio PET negativo predice un intervalo libre de enfermedad significativamente superior a los estudios positivos, debe recordarse que no permite descartar una enfermedad residual microscópica o lesiones con un importante descenso metabólico como consecuencia del tratamiento quimioterápico.
ConclusionesLa bibliografía disponible y nuestra propia experiencia indican que la PET-FDG en el diagnóstico primario del cáncer de mama tiene especial interés para el estudio de mamas densas, la determinación de lesiones multicéntricas y la valoración de mamas protésicas. No obstante, no evita la realización de biopsias para establecer el diagnóstico correcto de benignidad/malignidad en las lesiones primarias.
En la estadificación ganglionar regional, la exactitud de la PET supera al resto de las técnicas de imagen convencionales y, además, permite la estadificación ganglionar de la mamaria interna, aunque tampoco puede reemplazar a la estadificación quirúrgica ni al estudio de detección y análisis del ganglio centinela. La combinación de este último con el estudio PET podría ser en un futuro el método de elección como estudio prequirúrgico para valorar la afección ganglionar regional.
Al realizar un estudio de todo el cuerpo, la PET también tiene gran utilidad para la estadificación sistémica respecto al resto de las pruebas diagnósticas, juntas y por separado; este hecho permite un manejo individual del paciente y el consiguiente ahorro de recursos.
Por último, la PET valora de forma exacta y precoz el grado de respuesta a los tratamientos de quimioterapia neoadyuvante y hormonoterapia, lo que permitiría eventuales cambios tempranos en la actitud terapéutica, además de añadir un valor pronóstico a la evolución de cada paciente.
Correspondencia: Dr. A. Maldonado . Centro PET Complutense. Bartolomé Cossío, 10. 28040 Madrid. España. Correo electrónico: mluzovi@yahoo.es, director@petmadrid.com
Manuscrito recibido el 23-6-2004 y aceptado el 20-1-2005.