El empleo de doble arteria mamaria en cirugía coronaria mejora la supervivencia y recurrencia de síntomas. Existe controversia respecto a las complicaciones derivadas de su uso y configuración de injertos. Se exponen los resultados a corto plazo de nuestra serie de cirugía coronaria con doble mamaria, así como las distintas configuraciones de los injertos.
MétodosSe analizaron los pacientes intervenidos de cirugía coronaria aislada con 2 arterias mamarias entre enero del 2011 y diciembre del 2015.
ResultadosDe 767 pacientes sometidos a cirugía coronaria, 413 (53,4%) recibieron 2 mamarias. Edad media 64 (DE: 8,7) años. El 87,7% fueron hombres. EuroSCORE II medio 2,7%. Trescientos cuarenta y nueve pacientes (85,1%) fueron intervenidos sin circulación extracorpórea. Doscientos cincuenta pacientes (60,5%) recibieron un injerto compuesto (2 mamarias en T), 142 (34,3%) 2 mamarias in situ y 21 (5,1%) un injerto de mamaria izquierda in situ y un injerto libre aortocoronario de mamaria derecha.
La mortalidad quirúrgica fue 3 pacientes (0,7%). Seis pacientes (1,4%) necesitaron BCIA, 5 presentaron infección esternal superficial (1,2%) o mediastinitis (1,2%), 3 ictus (0,7%), 2 (0,5%) precisaron hemodiálisis y 4 (1%) reintervención por sangrado.
ConclusionesLa cirugía coronaria con doble mamaria es una técnica segura y con excelentes resultados de morbimortalidad a corto plazo. Son necesarios estudios de seguimiento clínico y angiográfico a largo plazo para determinar la mejor estrategia quirúrgica a emplear.
Bilateral internal mammary grafting (BIMA) in coronary bypass surgery (CABG) improves survival and recurrence of symptoms. There is still controversy regarding complications arising from its use and graft configuration strategy. We expose the short-term outcomes of BIMA grafting in our institution, as well as the different graft configurations available.
MethodsPatients who underwent CABG with BIMA grafting between January 2011 and December 2015 were analyzed.
Results413 (53.4%) out of 767 CABG patients underwent BIMA grafting. Mean age was 64 (SD: 8.7) years, with a 87.7% male. Mean EuroSCORE II was 2.7%. Three hundred and forty-nine patients (85.1%) underwent off-pump CABG. BIMA grafting with composite T-graft configuration was performed in 250 patients (60.5%), BIMA in situ grafting in 142 (34.3%) and BIMA grafting with free right internal mammary artery (RIMA) from the aorta, 21 patients (5.1%).
30-day mortality (0.7%). Six patients (1.4%) needed BCIA for low cardiac output, five presented sternal wound infection (1.2%) or mediastinitis (1.2%), three stroke (0.7%), two patients (0.5%) had renal failure with hemodialysis and four (1%) needed re-operation for bleeding.
ConclusionsBIMA grafting is a safe technique with excellent short term outcomes. Large prospective randomized trials with long term follow-up are still needed to clarify the optimal surgical strategy for graft configuration.
La cirugía de revascularización miocárdica (CRM) representa actualmente el tratamiento de elección en una proporción importante de pacientes con cardiopatía isquémica. A pesar del auge de las técnicas de revascularización percutánea en las últimas 2 décadas, la cirugía coronaria ha demostrado un mayor beneficio clínico en términos de supervivencia, recurrencia de síntomas y necesidad de nueva revascularización en los pacientes con enfermedad multivaso, particularmente en aquellos pacientes con lesiones coronarias más complejas o diabetes1,2. El empleo de la arteria mamaria izquierda (AMI) como injerto para la arteria descendente anterior (ADA) es considerado, desde hace 3 décadas, como el patrón de oro en cirugía coronaria y su superioridad respecto al injerto de vena safena en lo que respecta a la permeabilidad a largo plazo, así como los mejores resultados clínicos derivados de su uso, han sido ampliamente demostrados en la literatura y están fuera de toda duda3,4. Las particularidades fisiológicas del endotelio de la arteria mamaria y su resistencia a la arteriosclerosis han sido 2 de los principales mecanismos propuestos para explicar dicha superioridad5.
El hecho de que los pacientes sometidos a cirugía de derivación coronaria con frecuencia necesiten varios injertos, así como el reconocimiento de los beneficios de la AMI sobre la vena safena en el territorio de la ADA, ha dado lugar a un creciente interés en el empleo de técnicas de cirugía con doble arteria mamaria (CDM) para obtener una revascularización arterial completa. Desde los años 906,7, se ha producido un incremento de la evidencia científica en favor de la CDM sobre la cirugía convencional (CC), utilizando un injerto de mamaria a la ADA e injertos venosos para el resto de vasos, en términos de permeabilidad a largo plazo, supervivencia y eventos cardiovasculares en el seguimiento, especialmente cuando ambas mamarias se emplean en el sistema de la coronaria izquierda8.
Si bien el único ensayo clínico prospectivo aleatorizado comparando ambas estrategias se encuentra en curso (ART trial9) y todavía no están disponibles sus resultados a los 10 años de seguimiento, el empleo de injertos arteriales en cirugía coronaria aislada, especialmente en pacientes con una expectativa de vida razonable, se encuentra recomendado (clase iia B) por las guías europeas de revascularización miocárdica10.
No obstante, pese a los datos publicados en favor de la CDM, el empleo de esta técnica en la práctica clínica es poco frecuente y representa tan solo entre un 5-15% de la cirugía coronaria de forma global. Las razones esgrimidas para explicar la poca adherencia a esta técnica serían la mayor complejidad técnica y duración de la intervención, el potencial incremento del riesgo de infección de la herida quirúrgica o mediastinitis, así como algunas consideraciones relacionadas con el flujo competitivo, que puede limitar la permeabilidad de los injertos en el corto plazo11.
Las diversas estrategias quirúrgicas propuestas y analizadas en la literatura existente hasta la fecha son12:
- –
Las 2 mamarias in situ, empleando la AMI a la ADA y la arteria mamaria derecha (AMD) vía retroaórtica para las ramas marginales, o bien la AMD preaórtica para la ADA y la AMI para la cara lateral.
- –
Las 2 mamarias como injerto compuesto en T o en Y, es decir, la AMI in situ a la ADA y la AMD libre anastomosada proximalmente de forma término-lateral al cuerpo de la AMI y distalmente a las ramas marginales y/o posterolaterales de la arteria circunfleja (ACX).
- –
La AMD libre como injerto aortocoronario al territorio de la ACX y la AMI in situ a la ADA.
Con esta publicación, pretendemos exponer nuestra experiencia inicial con la CDM en los primeros 5 años de actividad de nuestro servicio, en lo referente a la mortalidad y morbilidad quirúrgicas, así como describir las diferentes configuraciones empleadas.
Por otro lado, se realiza una breve revisión de las diferentes estrategias quirúrgicas existentes centrando la atención en los aspectos técnicos de cada una de ellas, así como sus ventajas e inconvenientes.
MétodosDiseño y análisis estadísticoSe trata de un estudio descriptivo retrospectivo de una serie de 413 pacientes intervenidos de cirugía coronaria aislada entre enero del 2011 y diciembre del 2015, en los que se utilizaron ambas arterias mamarias con al menos 2 anastomosis arteriales en el territorio de la coronaria izquierda. Los datos preoperatorios, las características demográficas y clínicas, las variables intraoperatorias y los resultados a 30 días fueron obtenidos y analizados retrospectivamente a partir de la base de datos Sistema Informático Cirugía Cardíaca Sorin (SICCS), Biomenco SL, Barcelona, España, la cual había sido completada de forma prospectiva. Las variables cuantitativas continuas se expresaron como media y su desviación estándar, mientras que las variables cualitativas fueron expresadas como recuentos y porcentaje.
Técnica quirúrgicaEl empleo de la CDM en nuestro centro se realiza en aquellos pacientes con edad inferior a 75 años y que no presenten comorbilidades que limiten su expectativa de vida13. Ambas arterias mamarias son disecadas de forma esqueletizada y revascularizan la ADA junto al mejor vaso del territorio izquierdo en todos los casos. En ocasiones, si la anatomía coronaria lo requiere, se realizan anastomosis secuenciales en varias ramas de la cara anterior o lateral. La coronaria derecha y sus ramas son, generalmente, revascularizadas mediante injertos de vena safena aortocoronarios. De forma rutinaria, los pacientes son revascularizados mediante cirugía sin circulación extracorpórea (CEC), salvo en aquellos casos en los que debido a inestabilidad hemodinámica, arritmias ventriculares, ciertas dificultades técnicas o combinaciones de las anteriores, se opta por la cirugía con CEC.
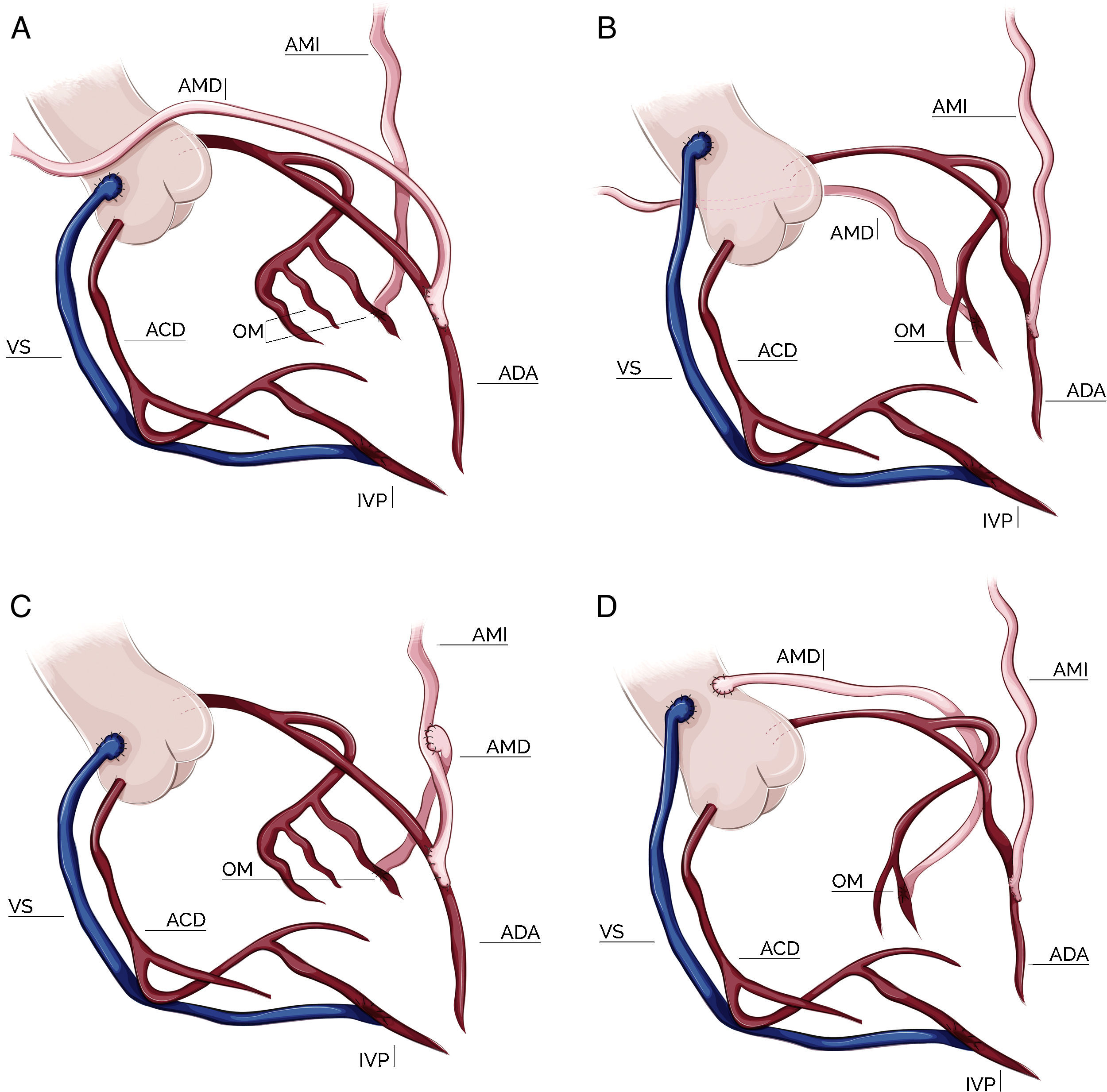
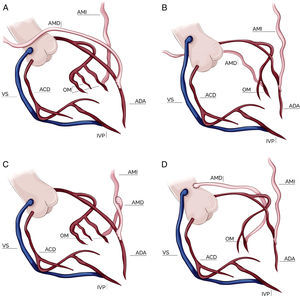
Configuración de los injertosLa elección de la configuración de los injertos fue a criterio de cada cirujano dependiendo de varios factores como el diámetro y longitud de las mamarias, localización y número de vasos coronarios a revascularizar y la presencia de ateromatosis aórtica. Durante los primeros 3 años del período analizado predominó la elección del injerto compuesto en T; posteriormente la tendencia fue un uso cada vez más frecuente de las 2 mamarias in situ. Por último, en una pequeña proporción de pacientes se empleó la AMD como injerto libre, conectada proximalmente a la aorta ascendente o al segmento proximal de un injerto venoso. El esquema de las configuraciones empleadas está representado en la figura 1.
Configuraciones de injertos en cirugía con doble mamaria. A: doble mamaria in situ con AMD preaórtica; B: doble mamaria in situ con AMD retroaórtica; C: doble mamaria con injerto compuesto en T; D: doble mamaria con AMD libre (injerto aortocoronario). AMI: arteria mamaria izquierda; AMD: arteria mamaria derecha; ADA: arteria descendente anterior; OM: obtusa marginal; ACD: arteria coronaria derecha; IVP: arteria interventricular posterior; VS: vena safena.
Se realizó a través de esternotomía media completa, tras la disección de los injertos se administró heparina sódica para un TCA>300 s, previamente a la sección del extremo distal de ambas mamarias. Las mamarias fueron tratadas mediante aplicación tópica de solución de verapamilo. Previamente a las anastomosis distales y tras decidir la configuración elegida, se construyeron las anastomosis proximales en la aorta o la anastomosis en T del injerto compuesto. Las anastomosis distales se realizaron con sutura de monofilamento de 8/0 (Surgipro®, Covidien, Dublin, Irlanda) y mediante el empleo de oclusión coronaria proximal con cinta de silicona (Sertilac®, Péters Surgical, Bobigny, Francia), así como shunt intracoronario (Clearview®, Medtronic, Dublín, Irlanda) en todos los casos. Así mismo, los vasos a revascularizar fueron expuestos mediante el uso del estabilizador coronario y posicionador apical Acrobat de Maquet® (Rastatt, Alemania). Tras completar cada anastomosis distal y después de la administración de protamina, se procedió a la medición del flujo de cada uno de los injertos mediante el uso del equipo VeriQ de Medi-Stim® (Oslo, Noruega).
Cirugía con circulación extracorpóreaSe realizó mediante esternotomía media completa y heparinización sistémica con un TCA>450 s. La CEC fue establecida en normotermia mediante canulación central en aorta ascendente y atriocava. Las anastomosis proximales en la aorta ascendente y la construcción del injerto compuesto con ambas mamarias fueron realizadas antes del pinzamiento aórtico, si esa era la configuración elegida. La protección miocárdica se llevó a cabo mediante la administración de cardioplejía hemática fría intermitente (Cardi-Braun) por vía anterógrada y retrógrada, con una dosis de inducción de 1.000 cc tras el pinzamiento aórtico y dosis de mantenimiento de 500 cc cada 20 min. Tras finalizar las anastomosis distales y previo al despinzamiento aórtico, se administraron 500 cc de sangre normotérmica por vía retrógrada. La medición del flujo Doppler en cada injerto se realizó tras completar cada anastomosis, previamente a la salida de CEC y tras la administración de protamina.
ResultadosDe un total de 767 pacientes consecutivos intervenidos de CRM aislada entre enero del 2011 y diciembre del 2015, 413 pacientes (53,5%) fueron intervenidos mediante el empleo de 2 arterias mamarias. La edad media fue 64 (DE: 8,7) años y el 87,7% fueron hombres. El EuroSCORE logístico medio fue 3,8% y EuroSCORE II logístico medio fue 2,7%. Las variables demográficas preoperatorias y características clínicas de los pacientes se encuentran resumidas en la tabla 1.
Características demográficas y clínicas
| N = 413 | |
|---|---|
| Edad (años), media (DE) | 64 (8,7) |
| Sexo masculino, n (%) | 362 (87,7) |
| Hipertensión arterial, n (%) | 287 (69,5) |
| Diabetes mellitus, n (%) | 198 (48,1) |
| Tabaquismo, n (%) | 217 (52,6) |
| EPOC, n (%) | 41 (9,9) |
| Arteriopatía periférica, n (%) | 83 (20,1) |
| Insuficiencia renal/HD, n (%) | 46 (11,3)/6 (1,45) |
| EuroSCORE logístico medio | 3,7% |
| EuroSCORE II logístico medio | 2,7% |
| Enfermedad de TCI, n (%) | 187 (45,2) |
| FE media (media [DE]) | 49,2% (15,6) |
| Urgencia, n (%) | 163 (39,5) |
| IAM previo, n (%) | 133 (32,3) |
| N.° medio vasos afectos (media [DE]) | 2,7 (0,8) |
De: desviación estándar; EPOC: Enfermedad pulmonar obstructiva crónica; FE: fracción de eyección; HD: hemodiálisis; IAM: infarto agudo de miocardio; TCI: tronco coronario izquierdo.
Respecto a las variables intraoperatorias, cabe destacar que 349 pacientes (85,1%) fueron intervenidos sin CECE. Doscientos cincuenta pacientes (60,5%) recibieron injerto compuesto (AMI-AMD en T), 142 pacientes (34,3%) 2 mamarias in situ y en 21 (5,1%) se empleó la AMD como injerto libre aortocoronario y la AMI in situ a la ADA. El número medio de injertos por paciente fue de 2,8, congruente con el número medio de vasos afectados (2,7) y con una tasa de revascularización completa del 96,3%.
La mortalidad quirúrgica fue de 3 pacientes (0,7%). Un paciente falleció por isquemia mesentérica, otro debido a una hemorragia aguda postoperatoria y el tercero debido a una fibrilación ventricular tras ventilación mecánica prolongada por fallo respiratorio. Cinco pacientes (1,21%) presentaron infarto agudo de miocardio (IAM) perioperatorio, 5 presentaron infección esternal superficial (1,2%) o mediastinitis (1,2%), 3 ictus isquémico (0,7%), 2 pacientes (0,5%) precisaron hemodiálisis y 4 pacientes (1%) reintervención por sangrado. Las principales complicaciones postoperatorias se muestran resumidas en la tabla 2. La estancia media en Unidad de Cuidados Intensivos fue de 2,6 (DE: 3,9) días y la estancia media postoperatoria total fue de 9 (DE: 9,6) días.
Complicaciones postoperatorias
| N = 413 | |
|---|---|
| Mortalidad quirúrgica, n (%) | 3 (0,73) |
| Reintervención por sangrado, n (%) | 4 (0,97) |
| IAM perioperatorio, n (%) | 5 (1,21) |
| ACV isquémico, n (%) | 3 (0,7) |
| Bajo gasto cardíaco/BCIA, n (%) | 6 (1,4) |
| Mediastinitis, n (%) | 5 (1,2) |
| Insuficiencia renal (diálisis), n (%) | 2 (0,48) |
| Fibrilación auricular, n (%) | 103 (24,94) |
ACV: accidente cerebrovascular; BCIA: balón de contrapulsación intraaórtico; IAM: infarto agudo de miocardio.
El empleo de la arteria mamaria como injerto para revascularización coronaria ha sido ampliamente estudiado y analizado desde hace décadas. Desde que Loop et al.3 publicaran en 1986 un mayor beneficio clínico a largo plazo de la AMI sobre la vena safena en el territorio de la ADA, el uso de esta se ha convertido en un estándar de la cirugía coronaria. Por otro lado, la menor permeabilidad de los injertos venosos a largo plazo dirigió a numerosos grupos a emplear injertos arteriales para obtener una revascularización coronaria completa. De entre los injertos arteriales empleados, el uso de ambas arterias mamarias, especialmente para revascularizar el territorio de la coronaria izquierda, ha cobrado un interés creciente. Todo ello ha dado lugar a una mayor evidencia en favor del empleo de 2 mamarias frente a una sola e injertos de vena safena en CRM aislada.
Desde las primeras publicaciones en los años 90, donde se objetivó una mayor supervivencia y menor necesidad de reintervención a largo plazo en el grupo de pacientes intervenidos con 2 mamarias frente a una sola, se ha producido un incremento importante de las publicaciones que reflejan estos mismos resultados11,14,15.
Así pues, Taggart et al.16 publicaron recientemente un metaanálisis actualizado de 27 estudios no aleatorizados (25 retrospectivos y 2 prospectivos) y 79.000 pacientes donde se concluye que los pacientes sometidos a CDM presentan una mayor supervivencia que los pacientes intervenidos mediante CC con una sola mamaria, con un seguimiento medio de 8 años. Hasta la fecha solo existe un ensayo clínico prospectivo aleatorizado de más de 3.000 pacientes comparando ambas estrategias (ART trial9) en términos de supervivencia a 10 años. Por ahora, han sido publicados únicamente sus resultados a un año, sin observar diferencias significativas de mortalidad entre ambos grupos (2,3% vs. 2,6%), con una mayor tasa de infección de la herida esternal en el grupo de doble mamaria (1,9% vs. 0,6%, p < 0,05).
Teniendo en cuenta los datos disponibles hasta la fecha, la CDM es un claro ejemplo donde la evidencia científica no se traslada a la práctica clínica habitual, ya que el empleo de esta técnica no ha gozado de la expansión que cabría esperar entre los cirujanos cardíacos y su uso abarca tan solo un 4-5% del total de la cirugía coronaria en EE. UU.17, mientras en Europa estaría en torno al 15%18. Es decir, que pese a los importantes beneficios clínicos demostrados, la gran mayoría de los pacientes intervenidos de CRM aislada a nivel mundial reciben una única arteria mamaria. En nuestra serie, el uso de doble mamaria fue del 53,5%, lo que supone una proporción muy superior a lo comunicado hasta la fecha en nuestro entorno.
Los principales motivos propuestos para explicar la escasa adopción de esta técnica son, por un lado, la percepción por parte de los cirujanos de que la intervención es más larga y compleja técnicamente, debido a lo cual prefieren una intervención menos beneficiosa en el largo plazo pero con menor riesgo de complicaciones perioperatorias. No obstante, los resultados publicados hasta la fecha son excelentes, con una mortalidad quirúrgica que oscila entre el 1,5 y el 3%19,20.
En nuestra serie, la mortalidad quirúrgica fue del 0,7%, la cual es significativamente inferior a la mortalidad esperada según EuroSCORE (3,8%) y EuroSCORE II (2,7%), y se encuentra en un valor similar a las series contemporáneas21. Por otro lado, las principales complicaciones postoperatorias, como el IAM perioperatorio, el ictus isquémico, la insuficiencia renal y la mediastinitis presentaron una baja incidencia, lo cual indica que pese a la mayor complejidad técnica percibida, esta técnica puede ser llevada a cabo con excelentes resultados de morbimortalidad a corto plazo superponibles a los obtenidos con la cirugía coronaria convencional20,21. No se ha realizado un análisis multivariante para identificar factores predictores de mortalidad o complicaciones debido al escaso número de eventos encontrados en nuestra serie.
Por otra parte, la reducción de la vascularización esternal producida por la disección de ambas arterias mamarias supone un potencial incremento del riesgo de infección profunda de la herida esternal o mediastinitis. En los principales estudios contemporáneos19,22, la incidencia de infección profunda de la herida esternal está entre el 1 y el 6%, y los principales factores de riesgo asociados al desarrollo de la misma son la diabetes, EPOC, edad avanzada y obesidad23. En los resultados preliminares del estudio ART, la tasa de infección profunda de la herida esternal fue ligera pero significativamente mayor en el grupo de CDM frente a la CC (1,9% vs. 0,6%). En nuestra serie, la incidencia de infección esternal profunda/mediastinitis fue del 1,2%, pese a que la prevalencia de diabetes y EPOC en los pacientes de nuestra serie es algo mayor a la publicada en otros estudios como el ART. La esqueletización de las mamarias durante su disección para preservar la vascularización esternal, la optimización de los protocolos de profilaxis antibiótica, así como el control peroperatorio de la glucemia han reducido la incidencia de mediastinitis en publicaciones recientes24,25, siendo comparable con la de pacientes intervenidos mediante CC, incluso en pacientes diabéticos.
La presencia de flujo competitivo como factor limitante de la permeabilidad de los injertos arteriales, así como la configuración ideal a emplear en la disposición de los mismos para obtener una revascularización completa, son otros aspectos que han sido objeto de controversia en la CDM. El flujo competitivo ocurre cuando la presión intracoronaria es similar a la presión de perfusión del injerto y, desde el punto de vista angiográfico, se define como aquella situación en la que la arteria coronaria nativa no se opacifica o lo hace muy ligeramente cuando el contraste se inyecta en el injerto coronario o bien, cuando el injerto se opacifica de forma retrógrada al inyectar contraste en el vaso coronario nativo. La existencia de flujo competitivo da lugar a una disminución del flujo anterógrado del injerto en diástole y a un incremento del flujo retrógrado en la fase inicial de la sístole. Este patrón oscilante de flujo arterial en el injerto da lugar a una alteración en la liberación de óxido nítrico y prostaglandinas vasodilatadoras por parte del endotelio arterial, lo cual favorece el desarrollo del «signo de la cuerda» (vasoconstricción del injerto) y la oclusión funcional del mismo26.
En varios estudios de Nakajima et al.26,27, la prevalencia de flujo competitivo en pacientes revascularizados con doble mamaria fue del 6,5% de los injertos y se ha relacionado con una disminución significativa de la permeabilidad a largo plazo. Se identificaron como factores predictores de flujo competitivo, la revascularización de la arteria coronaria derecha, la presencia de estenosis inferior al 75% en el vaso diana, el mayor número de anastomosis distales en los injertos compuestos y el uso de injerto compuesto con arteria radial.
En nuestra serie, presentamos únicamente los resultados de morbimortalidad hospitalaria y, por tanto, no disponemos de seguimiento angiográfico que nos permita identificar la incidencia de flujo competitivo en nuestros pacientes. No obstante, realizamos medición intraoperatoria de flujos que nos permite valorar ciertos parámetros que orienten a su existencia, de tal manera que la presencia de un pobre flujo anterógrado en el injerto que mejora con la oclusión coronaria proximal, así como la presencia de flujo retrógrado al final de la diástole, todo ello con índices de pulsatilidad levemente aumentados, puede indicar su presencia. En el momento de realizar este estudio, no se dispone de forma completa de los datos obtenidos a partir de la valoración intraoperatoria de los injertos, por lo que no es posible analizar la incidencia de flujo competitivo en nuestra serie, ni tampoco identificar factores asociados con él. Sin embargo, nuestra tendencia desde que iniciamos la CDM ha sido un uso cada vez más frecuente de la configuración de 2 mamarias in situ en detrimento del injerto compuesto en T, debido a la percepción de que el flujo competitivo es mayor con esta última estrategia.
Nuestra intención en el futuro es correlacionar los parámetros obtenidos con la medición intraoperatoria de flujo en las diferentes estrategias empleadas y la eventual presencia de flujo competitivo, con la evolución clínica de los pacientes en el seguimiento, con el objetivo de evaluar si existen diferencias entre las distintas configuraciones y si estas son relevantes desde el punto de vista clínico.
En lo referente a las diferentes estrategias quirúrgicas existentes, hemos realizado una breve revisión bibliográfica con el objetivo de definir diversos aspectos técnicos, así como ventajas e inconvenientes de cada configuración12.
Configuración de injertos y estrategias quirúrgicas en la cirugía con doble arteria mamariaCirugía con ambas arterias mamarias in situMamaria izquierda a descendente anterior y mamaria derecha retroaórtica a ramas marginales vía retroaórticaLa utilización de la AMD tunelizada por vía retroaórtica a través del seno transverso para revascularizar el territorio de la ACX fue descrita en 1984 por Puig et al.28. Aunque inicialmente fue descrita en su forma pediculada, es recomendable su esqueletización para obtener una mayor longitud del injerto. Una vez ligada y seccionada distalmente, se tuneliza a través del seno transverso discurriendo posterior a la aorta ascendente y el tronco de la arteria pulmonar hasta alcanzar la cara lateral del ventrículo izquierdo, donde se emplea para revascularizar ramas marginales de la circunfleja. Es importante ser cuidadoso en la tunelización para evitar el sangrado, la angulación o la rotación del injerto, así como comprobar, tras la misma, que su flujo libre es el adecuado. En esta técnica la AMI se emplea in situ para revascularizar la ADA.
Como ventajas de esta estrategia cabe destacar que permite la revascularización completa del sistema coronario izquierdo con injertos arteriales y cuyo flujo procede de orígenes distintos, siguiendo el principio de «un injerto-un vaso». Permite revascularizar la ADA con la AMI in situ, lo cual es considerado como un patrón de oro en cirugía coronaria, y por último, evita la manipulación de la aorta ascendente en la revascularización del territorio izquierdo. Los principales inconvenientes de esta técnica son los problemas técnicos derivados de la tunelización (compresión, torsión), el posible sangrado en localizaciones difícilmente accesibles y, por último, la insuficiente longitud de la AMD para alcanzar las ramas marginales distales o posterolaterales de la ACX29.
Mamaria derecha preaórtica a descendente anterior y mamaria izquierda a ramas marginalesEn este tipo de configuración, la AMD es movilizada por vía preaórtica retroesternal y cruzando la línea media hacia la ADA. Para evitar problemas técnicos en caso de futuras reintervenciones se aconseja posicionarla sobre la porción más distal de aorta ascendente para, una vez cruzada la línea media, dirigirla hacia la ADA. Así mismo, se recomienda cubrir dicho injerto con grasa tímica en su recorrido retroesternal, evitando de esta manera que pueda lesionarse en caso de necesidad de reintervención, futura canulación o manipulación de la aorta. En esta estrategia30, la AMI se emplea in situ para las ramas marginales o posterolaterales de la ACX. Como en el caso anterior, es aconsejable disecar la AMD de forma esqueletizada con el objetivo de obtener mayor longitud del injerto y realizar la anastomosis en la ADA, evitando los segmentos más distales y vasoespásticos de la AMD. Es importante destacar que deben desaconsejar esta técnica aquellas situaciones que impidan que la AMD alcance la ADA de forma adecuada, como puede ser la elongación de la aorta ascendente, la dilatación del ventrículo derecho, la presencia de una AMD de corta longitud o la necesidad de realizar la anastomosis en el segmento más distal de la ADA, así como aquellas situaciones que aumenten el riesgo de reintervención, como puede ser la existencia de valvulopatías asociadas aórtica o mitral que puedan necesitar una cirugía en el futuro.
Como ventajas de este tipo de configuración cabe mencionar la posibilidad de revascularizar el territorio izquierdo en su totalidad con injertos arteriales, sin manipulación de la aorta ascendente y siguiendo el principio de múltiples orígenes del flujo sanguíneo para los vasos revascularizados en el sistema izquierdo. Otra ventaja importante es la facilidad con la que se disponen los injertos, evitando la tunelización de la AMD, con el potencial riesgo de compresión, angulación o lesión inadvertida e inaccesible en el injerto. Por el contrario, su principal inconveniente es el riesgo de lesión de la AMD preaórtica durante la reesternotomía en caso de necesidad de reintervención.
Cirugía con injerto compuesto en TEsta estrategia quirúrgica consiste en el empleo de la AMI in situ para la ADA y la AMD libre (seccionada en su extremos proximal y distal) conectada proximalmente al cuerpo de la AMI de forma término-lateral (en forma de T o Y) y distalmente a una o varias ramas marginales y/o posterolaterales de la ACX. Tector et al.31 describieron la revascularización arterial completa de los 3 territorios mediante el uso de esta configuración, a través de la realización de una o varias anastomosis secuenciales con la AMD en la cara lateral e inferior del ventrículo izquierdo.
Como ventajas de esta configuración se debe destacar el hecho de evitar la manipulación aórtica y disminuir así el riesgo de ictus asociado a la aterosclerosis aórtica y la posibilidad de alcanzar una revascularización arterial completa sin necesidad de emplear un tercer injerto, gracias a la mayor longitud disponible de la AMD libre para alcanzar todas las ramas laterales e inferoposteriores. Por otro lado, el principal inconveniente de la misma es que el origen del flujo sanguíneo es único para todo el territorio izquierdo y depende del flujo de la AMI, de forma que la posible aparición del fenómeno de robo arterial a uno de los territorios reperfundidos, la presencia de flujo competitivo en alguna de las ramas del injerto en T o el desarrollo del síndrome de hipoperfusión secundario a espasmo arterial puede poner en peligro la revascularización de todo el sistema izquierdo, con las implicaciones que ello puede tener en términos de morbimortalidad.
Cirugía con injerto de mamaria derecha libre aortocoronarioEsta estrategia quirúrgica es menos frecuentemente empleada en la práctica clínica habitual. Consiste en el uso de la AMI in situ a la ADA y la AMD libre conectada proximalmente a la aorta ascendente (o al segmento proximal de un injerto venoso) y distalmente a las ramas de la ACX. Su principal inconveniente es la necesidad de manipular la aorta, así como la discordancia entre el espesor de la pared aórtica y de la pared de la arteria mamaria, que puede favorecer los problemas técnicos a nivel de la anastomosis proximal. Su ventaja, al igual que las estrategias previamente descritas, es que permite una revascularización completa del sistema coronario izquierdo con injertos arteriales, con el beneficio clínico demostrado que ello conlleva. Por otro lado, permite una revascularización mediante 2 orígenes individuales de flujo sanguíneo para el territorio izquierdo, manteniendo el patrón de oro en cirugía coronaria, como es la AMI a la ADA.
LimitacionesPor un lado, se trata de un estudio descriptivo sin grupo control donde nuestros resultados no han sido comparados con un grupo homogéneo de pacientes intervenidos según la estrategia convencional, ya que en nuestra serie global de pacientes coronarios, el grupo de mamaria única presenta mayor comorbilidad, más edad y mayor EuroSCORE II, lo cual implicaría un evidente sesgo de selección en caso de realizar una comparación cruda entre ambos grupos. Por otro lado, no existe seguimiento angiográfico ni clínico ya que nuestro servicio inició su actividad hace solo 5 años y una proporción significativa de pacientes han sido intervenidos poco antes de publicar esta experiencia inicial.
En nuestro estudio descriptivo, no hemos comparado los resultados entre las diferentes configuraciones empleadas, ya que no disponemos todavía de seguimiento, por lo que consideramos que es interesante analizar los resultados a largo plazo para identificar si alguna de ellas es superior a las demás y cuáles son los factores que pueden condicionar la permeabilidad a medio y largo plazo.
ConclusionesLa CDM puede ser llevada a cabo con excelentes resultados de morbimortalidad hospitalaria en pacientes menores de 75 años y con una expectativa de vida razonable. El empleo de esta técnica ha demostrado una mayor supervivencia y menor recurrencia de síntomas respecto a la CC en la literatura existente hasta la fecha. Respecto a las diferentes configuraciones empleadas, son necesarios nuevos estudios prospectivos aleatorizados con seguimiento clínico y angiográfico a largo plazo para identificar si existen diferencias entre ellas. Por último, con la información disponible hasta la fecha, debemos individualizar la estrategia quirúrgica a emplear de acuerdo con las características anatómicas y clínicas de cada paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.