La insuficiencia cardíaca (IC) es un síndrome con una prevalencia en aumento y un sombrío pronóstico en sus fases finales, en las cuales el tratamiento de elección sigue siendo a día de hoy el trasplante cardíaco. desgraciadamente, la disponibilidad de donantes es limitada y muchos pacientes no pueden acceder a él, por lo que son necesarias estrategias alternativas. La utilidad de la asistencia ventricular como terapia definitiva es uno de los objetivos buscados desde que los primeros dispositivos empezaron a desarrollarse, y las mejoras tecnológicas y de diseño en los dispositivos de asistencia ventricular en los últimos 20 años han permitido su utilización en estos pacientes, puesto que los datos de estudios y registros han demostrado una mejoría en la supervivencia y la calidad de vida de los pacientes con IC avanzada cuando son implantados como apoyo ambulatorio a largo plazo. El estudio REMATCH (Randomized Evaluation of Mechanical Assistance for the Treatment of Congestive Heart Failure) supuso la confirmación científica de ese beneficio, y otros estudios posteriores lo respaldan.
En el presente artículo se analizan diversos aspectos relacionados con la asistencia ventricular permanente como son la experiencia recogida con los distintos dispositivos a lo largo de los años, las complicaciones y morbilidad asociada a ellos o los diferentes ensayos clínicos realizados. Se hace un especial hincapié en la selección de pacientes para terapia definitiva y en las escalas de riesgo específicas para asistencia ventricular, y se consideran también brevemente otras opciones de asistencia a largo plazo menos empleadas como el corazón artificial total o las microbombas implantables.
The prevalence of heart failure is increasing and the prognosis in the terminal phase is dismal. The gold-standard therapy in end-stage heart failure remains cardiac transplantation at the present time, but there is a great excess of eligible candidates compared with the number of donor organs, so alternative strategies are needed. The usefulness of left ventricular assist device as destination therapy is one of the objectives pursued since the first devices began to be developed; the technological and design improvements in ventricular assist devices in the last 20 years has allowed its use in these patients. Data from multicenter trials and registries have demonstrated an improvement in survival and quality of life in patients with advanced heart failure when they are implanted as outpatient long-term support. The REMATCH (Randomized Evaluation of Mechanical Assistance for the Treatment of Congestive Heart Failure) trial entailed the scientific confirmation of that benefit and other later studies support it.
The present article discusses many aspects of ventricular assistance as destination therapy: lessons learned with the different devices along the years, the complications and morbidity associated with them or the specific designed clinical trials. There is a special emphasis on destination therapy patient’s selection and on specific risk scores for ventricular assistance; other options for long-term support less used as the total artificial heart or implantable micro-pumps are also briefly considered.
El número de pacientes con IC en estadio D es progresivamente creciente, y además son cada vez de mayor edad. A pesar de que el mayor beneficio en supervivencia para estos enfermos se consigue con el trasplante cardíaco, el número de donantes es limitado, y además muchos de ellos no pueden acceder al trasplante por razones de edad o de otras comorbilidades asociadas, por lo que el empleo de formas alternativas de «sustitución» cardíaca ha suscitado gran interés. La investigación en ingeniería genética y el xenotrasplante (animales genéticamente modificados como donantes) han progresado considerablemente, pero no tanto como para llegar a la fase de ensayos clínicos; la comprensión y el conocimiento de la biología de las células madre en la IC son la base para la terapia celular como opción de tratamiento, pero esto se encuentra aún en una etapa muy inicial, por lo que el uso de dispositivos de asistencia ventricular izquierda (DAVI) se va consolidando como una posibilidad terapéutica más, de primera elección en el grupo de enfermos en IC refractaria no candidatos a trasplante cardíaco o que no pueden llegar a él y en los cuales supone la opción más real y accesible en el momento actual.
El corazón artificial total también se emplea como terapia de destino, y las microbombas implantables quizá podrán servir para ello en un futuro próximo, pero la limitada experiencia acumulada en ambos casos hace que se les dedique sólo una breve consideración final, y para el presente trabajo consideremos únicamente los DAVI intracorpóreos como asistencias definitivas.
Modelos disponibles y experiencia acumuladaLa descripción detallada de las características técnicas de cada uno de los aparatos excede el propósito del presente artículo y existe abundante bibliografía disponible sobre modelos y técnicas de implantación, por lo que nos centraremos en la experiencia de uso con cada uno de ellos como terapia de destino, incluyendo los que ya están fuera del mercado pero fueron empleados con ese propósito.
Dispositivos de primera generaciónEran bombas pulsátiles o de desplazamiento, y la experiencia conjunta es de una mortalidad perioperatoria del 15–20%, con una supervivencia global tras el explante del dispositivo de un 60–70% en los enfermos trasplantados; en casi todas las series el apoyo medio estaba entre los 50–60 días1.
El HeartMate® XVE (Thoratec Corporation, Pleasanton, CA, USA), único que aún permanece en el mercado, tiene aprobación de la Food and Drug Administration (FDA) para terapia definitiva y presenta una experiencia acumulada de más de 6.000 pacientes implantados en 186 centros con un tiempo medio de apoyo de 155 días y un tiempo máximo de 7,2 años (Thoratec Corporation, comunicación personal, 2010).
El Novacor® (World Heart Corporation, Oakland, CA, USA), también eléctrico y que había sido implantado en más de 1.700 pacientes2 hasta 2007, fue el modelo de mayor durabilidad mecánica hasta que se detuvo definitivamente su comercialización en 2008.
El Arrow LionHeart™ (Arrow Internacional Inc, Reading, PA, USA) era el único dispositivo totalmente implantable. El European LionHeart Clinical Utility Baseline Study (CUBS) incluyó 23 pacientes asistidos durante una media de 347 días y una supervivencia del 39% a 1 año3. En 2005 la compañía interrumpió su distribución por razones de mercado.
Dispositivos de segunda generaciónDurante la última década ha habido una experiencia creciente con estos dispositivos de flujo continuo axial. La mayor evidencia corresponde, sin lugar a dudas, al HeartMate® II (Thoratec Corporation, Pleasanton, CA, USA), único con aprobación de la FDA como terapia definitiva, con más de 5.000 pacientes implantados en el mundo (alguno de ellos por más de 6 años) con un amplio rango de edad (11–87 años); la experiencia europea publicada incluye 571 pacientes (21% como asistencia definitiva) apoyados durante una media de 236 días (0–1.029) y con una supervivencia al final del estudio (trasplante, recuperación o apoyo continuado) del 69% y una mortalidad precoz del 17%4.
Con los otros aparatos la experiencia es más reducida y menos difundida, como la casuística europea de 46 pacientes como asistencia definitiva con el Jarvik 2000 (Jarvik Heart Inc, New York, NY, USA)5, la de Drews, et al.6 en un único centro con 198 pacientes que recibieron el Berlin Heart INCOR (Berlin Heart GMBH, Berlín, Alemania) o los 440 implantes del DeBakey® VAD (MicroMed Cardiovascular Inc, Houston, TX, USA) comunicados por la compañía.
Dispositivos de tercera generaciónSon dispositivos de flujo continuo con un impulsorrotor de levitación magnética, similares a las bombas centrífugas clásicas pero de muy pequeño tamaño e implantables. Estas «minicentrífugas» son la DuraHeart® LVAS (Terumo Corporation, Ann Arbor, MI, USA) y el HVAD™ (HeartWare International, Sydney NSW, Australia), así como un dispositivo empleado durante años y desde 2009 fuera de mercado, el VentrAssist™ LVAD (VentraCor Limited, Chatswood NSW, Australia)7.
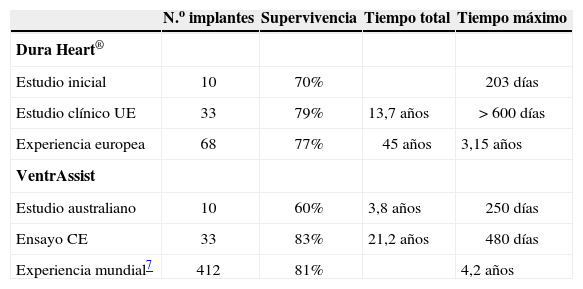
La evidencia acumulada es todavía pequeña pero prometedora (Tabla I): la experiencia con DuraHeart® es básicamente europea y como puente a trasplante8, aunque los prolongados tiempos de apoyo indican su posible uso como asistencia definitiva; el HVAD™ (HeartWare International, Sydney NSW, Australia) ha completado ya dos estudios como puente a trasplante, uno europeo con 50 pacientes y otro americano con 140 pacientes, y está en marcha uno para asistencia definitiva.
Experiencia comunicada con asistencias centrífugas de 3.A generación («minicentrífugas»)
| N.o implantes | Supervivencia | Tiempo total | Tiempo máximo | |
| Dura Heart® | ||||
| Estudio inicial | 10 | 70% | 203 días | |
| Estudio clínico UE | 33 | 79% | 13,7 años | > 600 días |
| Experiencia europea | 68 | 77% | 45 años | 3,15 años |
| VentrAssist | ||||
| Estudio australiano | 10 | 60% | 3,8 años | 250 días |
| Ensayo CE | 33 | 83% | 21,2 años | 480 días |
| Experiencia mundial7 | 412 | 81% | 4,2 años |
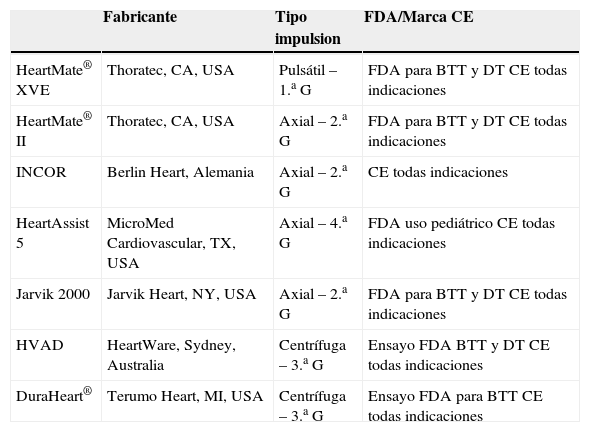
La tabla II sumariza los DAVI, que en la actualidad están disponibles para su uso como asistencia permanente.
Davi para asistencia definitiva actualmente en uso o ensayo clínico
| Fabricante | Tipo impulsion | FDA/Marca CE | |
| HeartMate® XVE | Thoratec, CA, USA | Pulsátil – 1.a G | FDA para BTT y DT CE todas indicaciones |
| HeartMate® II | Thoratec, CA, USA | Axial – 2.a G | FDA para BTT y DT CE todas indicaciones |
| INCOR | Berlin Heart, Alemania | Axial – 2.a G | CE todas indicaciones |
| HeartAssist 5 | MicroMed Cardiovascular, TX, USA | Axial – 4.a G | FDA uso pediátrico CE todas indicaciones |
| Jarvik 2000 | Jarvik Heart, NY, USA | Axial – 2.a G | FDA para BTT y DT CE todas indicaciones |
| HVAD | HeartWare, Sydney, Australia | Centrífuga – 3.a G | Ensayo FDA BTT y DT CE todas indicaciones |
| DuraHeart® | Terumo Heart, MI, USA | Centrífuga – 3.a G | Ensayo FDA para BTT CE todas indicaciones |
DAVI: dispositivo de asistencia ventricular izquierda; G: generación; BTT: puente a trasplante; DT: asistencia permanente.
La experiencia con asistencia permanente en España es prácticamente anecdótica: en el año 1996 se realizaron los dos primeros implantes de ventrículos artificiales izquierdos internos (Novacor® en el Hospital 12 de Octubre de Madrid y TCI HeartMate® en el Hospital de la Santa Creu i Sant Pau de Barcelona) con algún otro implante más de Novacor® años después en la CUN, mientras que en 2007 el Hospital Universitario de Bellvitge realizó la primera implantación de un dispositivo izquierdo de flujo continuo, un Berlin Heart INCOR inicialmente como asistencia definitiva, aunque pudo ser desconectado meses después por recuperación ventricular.
Dispositivos de cuarta-quinta generaciónSe trata del HeartAssist 5™ (MicroMed Cardiovascular Inc, Houston, TX, USA), evolución tecnológica de la bomba axial DeBakey®. Su miniaturización le permite ser implantado intrapericárdico (4.a generación), y posteriormente se ha incorporado un medidor de flujo real (5.a generación). La experiencia es escasa por ahora.
Ensayos clínicos para asistencia definitivaRematchIniciado en mayo de 1998, asignó aleatoriamente 129 pacientes con IC terminal, no candidatos a trasplante cardíaco, a dos grupos de tratamiento: a 68 se les implantó un dispositivo HeartMate® XVE y 61 recibieron sólo tratamiento médico. Los resultados fueron clarificadores: el análisis de supervivencia mostró una reducción del 48% del riesgo de muerte por cualquier causa en el grupo de enfermos asistidos comparado con el grupo de tratamiento médico, y las tasas de supervivencia fueron a 1 año del 52% en el grupo de asistencias y 25% en el de medicación (p=0,002) y a 2 años del 23 y 8% (p=0,09), respectivamente. Además, la frecuencia de eventos adversos graves fue menor en los enfermos asistidos y su calidad de vida a 1 año mejoró significativamente9.
El REMATCH supuso la confirmación científica del beneficio de la asistencia ventricular en enfermos no trasplantables y provocó un progresivo incremento del empleo de dispositivos izquierdos en estos pacientes como terapia definitiva, dando pie también al diseño de nuevos ensayos con otros aparatos.
Otros ensayos con bombas pulsátiles- –
INTREPID (Investigation of the Non-Transplant Eligible Patients who are Inotrope Dependent): con diseño similar al del REMATCH, comparaba el implante de Novacor® (37 pacientes) frente a tratamiento inotrópico (18 pacientes), con una supervivencia al año de 27% para el DAVI frente al 11% del tratamiento médico10.
- –
CUBS (Clinical Utility Baseline Study): estudio europeo no aleatorizado y observacional de 23 pacientes con el LionHeart, encontrándose una baja tasa de infección (quizá por la total implantabilidad del dispositivo) y una supervivencia a 1 y 2 años del 39 y 22%, respectivamente3.
- –
RELIANT (Randomized Evaluation of Novacor® LVAS In A Non-Transplant Population): iniciado en 2004 para alcanzar la aprobación de la FDA del Novacor® como dispositivo definitivo, aleatorizó pacientes a Novacor® o HeartMate® XVE pero no se completó al interrumpirse la distribución del dispositivo en 2008.
- –
HeartMate® II DT Trial: ensayo aleatorizado que incluyó a 200 pacientes con IC avanzada no candidatos a trasplante cardíaco y los asignó a implantación de un HeartMate® II (continuo, 134 pacientes) o HeartMate® XVE (pulsátil, 66 pacientes). El ensayo concluyó que el tratamiento con el modelo de flujo continuo mejoraba significativamente la probabilidad de supervivencia libre de ictus y fallo de los dispositivos a los 2 años (que era el objetivo principal compuesto) en comparación con los dispositivos de flujo pulsátil (46 vs 11%). Además, los pacientes con dispositivos de flujo continuo tuvieron tasas superiores de supervivencia actuarial a los 2 años (58 vs 24%) y ambos dispositivos mejoraron significativamente la calidad de vida y la capacidad funcional, objetivos secundarios todos ellos11.
- –
REVIVE-IT: aprobado en enero de 2011, enrolará 100 pacientes en 12 centros de EE.UU. comparando el dispositivo HeartWare frente a tratamiento médico en pacientes no trasplantables.
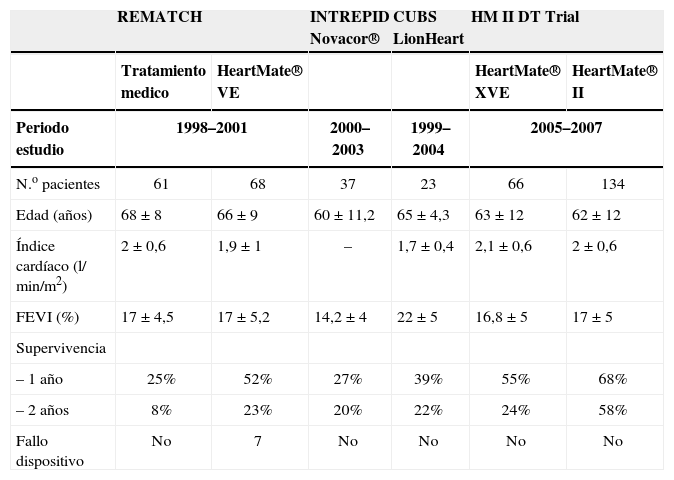
La tabla III recoge los resultados de los diferentes estudios realizados con DAVI como asistencia definitiva.
Resultados de los ensayos clínicos diseñados para asistencia definitiva
| REMATCH | INTREPID Novacor® | CUBS LionHeart | HM II DT Trial | |||
| Tratamiento medico | HeartMate® VE | HeartMate® XVE | HeartMate® II | |||
| Periodo estudio | 1998–2001 | 2000–2003 | 1999–2004 | 2005–2007 | ||
| N.o pacientes | 61 | 68 | 37 | 23 | 66 | 134 |
| Edad (años) | 68±8 | 66±9 | 60±11,2 | 65±4,3 | 63±12 | 62±12 |
| Índice cardíaco (l/min/m2) | 2±0,6 | 1,9±1 | – | 1,7±0,4 | 2,1±0,6 | 2±0,6 |
| FEVI (%) | 17±4,5 | 17±5,2 | 14,2±4 | 22±5 | 16,8±5 | 17±5 |
| Supervivencia | ||||||
| – 1 año | 25% | 52% | 27% | 39% | 55% | 68% |
| – 2 años | 8% | 23% | 20% | 22% | 24% | 58% |
| Fallo dispositivo | No | 7 | No | No | No | No |
FEVI: fracción de eyección de ventrículo izquierdo.
Los eventos adversos que con más frecuencia aparecen tras la implantación de un DAVI son: sangrado, infección y arritmias (tasas de incidencia acumulada del 36–48%), seguidos de reoperación y eventos neurológicos (24–31%), y además se presentan fundamentalmente en los primeros 60 días12, aunque la aparición no es homogénea (sangrado y arritmias se concentran en los primeros días, infección y tromboembolia decrecen progresivamente a partir del primer mes).
- –
Hemorragia: son frecuentes el sangrado perioperatorio mediastínico aumentado y las hemorragias espontáneas (frecuentemente gastrointestinales o epistaxis y raramente intracraneales), más incluso de lo que cabría esperar según el régimen de anticoagulación seguido por los pacientes. Parte de ese sangrado gastrointestinal (32–40% de incidencia acumulada) se relaciona con la génesis de malformaciones arteriovenosas, que son más frecuentes en los dispositivos de flujo continuo, y en general la mayor tendencia al sangrado puede ser atribuida a disfunciones plaquetarias por un síndrome de Von Willebrand adquirido13.
- –
Fallo ventricular derecho secundario: la disfunción ventricular derecha en pacientes que han recibido un DAVI es una causa mayor de morbilidad y mortalidad que requiere a menudo apoyo adicional, ya sea en forma de inotrópicos o de dispositivos de asistencia derecha. Cuando aparece fallo derecho la mortalidad perioperatoria de la cirugía de implante de un dispositivo izquierdo llega a duplicarse y los pacientes tienden a tener una supervivencia disminuida14. La optimización preoperatoria del paciente utilizando diuréticos, vasodilatadores pulmonares e inotrópicos para reducir la tensión parietal del ventrículo derecho y mejorar la contractilidad es crítica, especialmente en el grupo de pacientes con asistencia permanente en los cuales todavía no hay buenas opciones para apoyo mecánico ventricular derecho a largo plazo.
A pesar de todo, la determinación de qué pacientes son los de mayor riesgo para desarrollar fracaso ventricular derecho postoperatorio es todavía controvertida y relativamente desconocida, aunque algunos estudios han identificado diversos factores preoperatorios significativamente asociados con dicho fracaso como la necesidad preoperatoria de balón de contrapulsación, la elevación de resistencias vasculares pulmonares y la terapia de destino como indicación de asistencia14. Una aproximación al problema es el score de riesgo de fallo ventricular derecho (derivado de una serie con pacientes asistidos mayoritariamente como puente a trasplante) propuesto por Cowger, et al. y compuesto por datos clínicos preoperatorios sencillos de recoger que estratifican de forma efectiva tanto el riesgo de fallo derecho como la muerte tras el implante del DAVI15.
- –
Tromboembolismo: los episodios tromboembólicos que provocan un ataque isquémico transitorio o un daño cerebral establecido aparecen con una frecuencia muy variable, entre un 5–50% (0,009-5,730 eventos/paciente/año)16 dependiendo de los diferentes tipos de dispositivos y de la variación en los protocolos de anticoagulación; esa variación es también responsable de las diferentes tasas de complicaciones hemorrágicas.
Entre los dispositivos de primera generación las tasas más bajas de tromboembolismo correspondían al HeartMate® XVE (3–9%), posiblemente por el recubrimiento biológico interno que llevaba el dispositivo, y esas cifras se mantienen en el modelo de flujo continuo HeartMate® II (0,06-0,10 eventos/ paciente/año para ictus isquémicos y 0,05-0,11 para ictus hemorrágicos)9,11, mientras que para otros dispositivos de segunda y tercera generación, como el Jarvik 2000 o las minicentrífugas VentrAssist o DuraHeart®, las tasas de complicaciones neurológicas son más altas (15–18% de ictus)1.
- –
Infección: los episodios infecciosos se presentan en más de la mitad de los pacientes con un DAVI y corresponden fundamentalmente a bacteriemia/sepsis e infecciones del dispositivo. La sepsis (20%) se asocia significativamente con un incremento de la mortalidad y la mayor parte de casos ocurren antes del alta hospitalaria, mientras que la mayoría de las infecciones relacionadas con el dispositivo, asociadas a Staphylococcus resistentes y Pseudomonas17, se producen tras el alta y pueden afectar a cualquiera de sus aspectos (el cable percutáneo, el «bolsillo» de implantación o la propia bomba): los problemas relacionados con la bomba o su zona de implantación eran más frecuentes en los modelos pulsátiles (dado su tamaño y la amplia disección que requerían), y con los actuales dispositivos axiales de segunda generación el problema se suele circunscribir al cable percutáneo, aunque su frecuencia sigue siendo alta (18–28%)17,18 y sin repercusión en la mortalidad17.
- –
Fallos técnicos del dispositivo o problemas relacionados con las baterías son excepcionales hoy en día, aunque en el pasado tuvieron su importancia (35% de fallos a los 2 años en el estudio REMATCH, con una mortalidad superior al 10%); tampoco son un problema la sensibilización por elevación del número de anticuerpos citotóxicos o el ruido del dispositivo.
las guías clínicas y las recomendaciones de sociedades científicas señalan que la documentación recabada en los ensayos clínicos para los dispositivos de asistencia ventricular es escasa debido a la naturaleza de la población a la que están destinados, y no hay consenso en cuanto a las indicaciones de los dispositivos ni sobre la población objetivo, por ello sólo hacen indicaciones genéricas (pacientes no candidatos a trasplante dependientes de inotrópicos endovenosos o cuando no se haya establecido un tratamiento definitivo)19,20.
Aunque no existen unos parámetros específicos para la selección de candidatos a asistencia definitiva, todos los pacientes cumplen unos criterios parecidos a los de entrada en el estudio REMATCH: clase funcional IV e IC en fase terminal, una expectativa de vida inferior a 2 años, no candidatos a trasplante cardíaco y con algunos criterios de gravedad: tratamiento médico optimizado al máximo, fracción de eyección (FE) inferior al 25% y un consumo pico de oxígeno inferior a 12ml/kg/ min o necesidad de infusión endovenosa continua de inotrópicos. En un estudio de Lietz, et al. que recogía 280 pacientes con un DAVI como asistencia definitiva en la era post-REMATCH (entre 2003–2005), se observó que la mortalidad hospitalaria tras el implante era del 27%, cifra concordante con la observada en el propio REMATCH y en los otros ensayos clínicos para terapia de destino, y casi todas las muertes precoces se debían a complicaciones postoperatorias (sepsis, fracaso multiorgánico, sangrado, fallo ventricular derecho e ictus) con el dispositivo normofuncionante; en total, casi dos tercios de las muertes registradas en ese grupo post-REMATCH ocurrieron antes del alta21. Es crucial, por tanto, una correcta selección de los pacientes atendiendo a criterios no sólo cardiológicos, y en ese sentido las guías 2006 de la International Society for Heart and Lung Transplantation (ISHLT) proporcionan una profunda revisión19.
Todos los pacientes con IC avanzada remitidos para asistencia definitiva deben ser inicialmente evaluados en busca de factores potencialmente reversibles que contribuyan al empeoramiento de los síntomas cardiológicos, como un tratamiento médico inadecuado, fibrilación auricular, disincronía ventricular, etc.; en un paciente con enfermedad isquémica o valvular esto incluirá valoración de la viabilidad miocárdica y/o gravedad de la patología valvular para determinar si puede beneficiarse de un tratamiento quirúrgico previo. Cuando todas las causas reversibles de IC sintomática han sido tratadas, se optimizará el tratamiento médico y se iniciará terapia de resincronización, si está indicada; de forma ideal puede contemplarse un periodo de 1–2 meses de tratamiento médico a dosis máximas para valorar la respuesta terapéutica y, en caso de que se considere que se ha alcanzado el nivel óptimo, comenzará el proceso de evaluación para un DAVI definitivo, poniéndose en marcha una evaluación sistemática que debe incluir los siguientes aspectos22:
- –
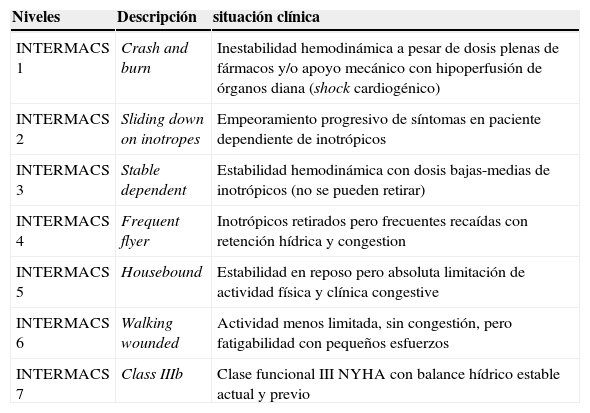
Valoración clínica de la gravedad del fracaso cardíaco: la población de pacientes con IC avanzada es heterogénea, por lo que se hace necesario clasificarlos según criterios clínicos. La clasificación de INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support), definida sobre un registro multicéntrico de dispositivos de asistencia ventricular, permite la estratificación de los pacientes en siete niveles (Tabla IV) para unificar criterios en la descripción del estado clínico de los enfermos con IC avanzada.
Tabla IV.Niveles intermacs para clasificación de pacientes con ic avanzada (estadio D)
Niveles Descripción situación clínica INTERMACS 1 Crash and burn Inestabilidad hemodinámica a pesar de dosis plenas de fármacos y/o apoyo mecánico con hipoperfusión de órganos diana (shock cardiogénico) INTERMACS 2 Sliding down on inotropes Empeoramiento progresivo de síntomas en paciente dependiente de inotrópicos INTERMACS 3 Stable dependent Estabilidad hemodinámica con dosis bajas-medias de inotrópicos (no se pueden retirar) INTERMACS 4 Frequent flyer Inotrópicos retirados pero frecuentes recaídas con retención hídrica y congestion INTERMACS 5 Housebound Estabilidad en reposo pero absoluta limitación de actividad física y clínica congestive INTERMACS 6 Walking wounded Actividad menos limitada, sin congestión, pero fatigabilidad con pequeños esfuerzos INTERMACS 7 Class IIIb Clase funcional III NYHA con balance hídrico estable actual y previo Las dos indicaciones más frecuentes para el implante de una asistencia ventricular dentro de la base de INTERMACS son el empeoramiento progresivo en pacientes dependientes de inotrópicos (nivel 2) y el shock cardiogénico (nivel 1), que suman en total un 67% de todos los implantes, si bien el shock ha disminuido dramáticamente en el último año su frecuencia como motivo de implantación23. Es recomendable que las implantaciones en los niveles 1 y 2 se destinen al rescate de candidatos potenciales al trasplante cardíaco o a la recuperación ventricular, mientras que la asistencia permanente debe ser reservada para pacientes estables como una cirugía electiva.
La dependencia de inotrópicos se asocia a una supervivencia a 6 meses inferior al 50%, por lo que estos pacientes son candidatos a cirugía semiurgente, ya sea de trasplante o de asistencia, para proporcionar el mayor beneficio posible de supervivencia en ese estadio clínico y muy especialmente en los pacientes como terapia de destino, en los cuales no se obtiene ningún beneficio de un apoyo inotrópico prolongado, excepto si es para optimización de la función derecha y recuperación del fracaso de órganos diana previos al implante del dispositivo definitivo.
El momento óptimo de implantación en los niveles 4–7 no está perfectamente definido dado que es un grupo heterogéneo de pacientes con evoluciones clínicas muy diferentes, por lo que la sola valoración de la situación clínica y cardiológica no debe ser suficiente y debe complementarse con la evaluación del riesgo según escalas específicas.
- –
Consideraciones cardíacas y anatómicas: se estudiará la posible disfunción ventricular derecha, la presencia de arritmias, la anatomía cardíaca (competencia de la válvula aórtica, necesidad de reparaciones valvulares o defectos septales) y el tamaño corporal (menos relevante con los dispositivos de flujo continuo, más pequeños y menos voluminosos)
- –
Consideraciones no cardiológicas:
- •
Edad del paciente: cronológica y «biológica».
- •
Existencia de comorbilidades que limiten la expectativa de vida o la calidad de vida: daño pulmonar irreversible, enfermedad hepática avanzada, disfunción renal significativa, enfermedad vascular periférica grave, daños neurológicos o neuromusculares irreversibles o antecedentes de malignidad y/o metástasis19.
- •
Aspectos psiquiátricos: capacidad para manejar el dispositivo (baterías, alarmas) y ausencia de enfermedades mentales, retraso o abuso de sustancias.
- •
Aspectos sociales: disponibilidad de un apoyo familiar estable e implicación de los servicios sociales.
- –
Evaluación del riesgo quirúrgico: es tratado de forma diferenciada en el apartado siguiente.
- •
La experiencia con apoyo mecánico crónico ha demostrado de forma consistente que la mayor parte de muertes ocurren antes del alta hospitalaria y se relacionan con complicaciones postoperatorias21; también se han identificado múltiples factores relacionados con un riesgo quirúrgico aumentado: marcadores de disfunción renal, hepática o pulmonar, indicadores de fallo ventricular derecho, anomalías de coagulación, desnutrición, etc.
Dado que no hay una única variable que pueda predecir con precisión la supervivencia en estos pacientes, se han utilizado escalas de riesgo compuestas para valorar la gravedad del daño previo en órganos diana y estratificar el riesgo tras el implante de un DAVI, incluyendo escalas generales de pacientes críticos (Acute Physiology and Chronic Health Evaluation [APACHE II]), scores para IC (Heart Failure Survival Score [HFSS], Seattle Heart Failure Model[SHFM]) y escalas de riesgo más específicas, derivadas de series de pacientes con asistencia ventricular como puente a trasplante o como indicación definitiva.
Acute physiology and chronic health evaluation II scoreSe trata de un clásico score de 1985 que pretendía medir la gravedad de la enfermedad en pacientes de cuidados intensivos a partir de una cohorte multicéntrica de 5.815 pacientes críticos. Mediante la puntuación de 13 variables se obtiene un rango entre 0–71 que marca el riesgo de muerte, y así para la IC congestiva un score igual o superior a 20 supone un gran incremento de la muerte hospitalaria. En una pequeña población de pacientes asistidos con HeartMate® VE se observó que con puntuaciones entre 10–20 los pacientes presentaban beneficio en supervivencia frente al tratamiento médico óptimo, indicando un punto de corte para discriminar la población de pacientes críticos que se beneficiarían de la implantación de un DAVI.
Heart failure survival scorePublicado por Aaronson en 1997, se diseñó para determinar el pronóstico de pacientes ambulatorios referidos para trasplante cardíaco24; se obtenía de siete variables clínicas y analíticas y se hizo muy popular al ser utilizado para decidir el momento óptimo de indicación de trasplante cardíaco e inclusión en lista de espera basándose en la estratificación de riesgo que proporcionaba. Ha sido validado en alguna población actual con un moderado poder predictor y se ha criticado porque los tratamientos actuales (?-bloqueadores, resincronización) modifican el valor de las variables que inicialmente se computaban, por lo que hoy en día su validez es pequeña.
Seattle heart failure modelSe desarrolló a partir de 1.125 pacientes de IC del estudio PRAISE 1, obteniéndose un modelo de riesgo multivariante para predicción de supervivencia a 1, 2, 3 o 5 años (validado posteriormente en 9.942 pacientes de otros estudios)25.
Incluye 21 variables clínicas, de laboratorio y de tipo de tratamiento, y para facilitar el cálculo los autores desarrollaron un software que permite la introducción de valores online en una pantalla (Fig. 1), obteniéndose la probabilidad de supervivencia a partir del score obtenido según la fórmula Supervivencia (t)=e^(–0,0405*t*e^ [SHFM score]). Además, permite calcular cómo varía la supervivencia de un paciente si se modifican los diversos tratamientos que recibe o si se añaden tratamientos distintos como β-bloqueadores o dispositivos mecánicos (desfibrilador, resincronizador, DAVI).
El modelo presenta gran precisión y capacidad de discriminación, por lo que se ha convertido en una herramienta muy útil, validada en otros grupos de enfermos como los pacientes enviados para trasplante cardíaco o, de forma retrospectiva, en series de implantados electivamente con un DAVI.
Los autores del modelo lo aplicaron posteriormente a 126 pacientes del REMATCH, añadiendo como variables prospectivas el uso de inotrópicos y el balón de contrapulsación ± ventilación mecánica, comprobando que:
- –
El SHFM resultó altamente predictivo para supervivencia a 1 año pues ésta fue similar a la realmente observada en el REMATCH, tanto en el grupo de tratamiento médico (30 vs 28%) como en el de DAVI (49 vs 52%).
- –
El modelo modificado con las variables añadidas mantenía su valor predictivo26, siendo por tanto útil para identificar pacientes de alto riesgo con IC terminal que se beneficiarían de un DAVI.
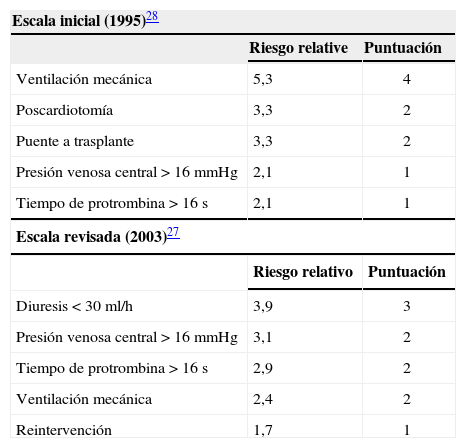
Se trata de una escala derivada por Rao, et al.27 (a partir de una versión previa28 sobre 56 pacientes), utilizando una cohorte de 130 pacientes consecutivos implantados con HeartMate® como puente a trasplante. Se asignaron puntos a cinco factores preoperatorios que predecían mortalidad perioperatoria (Tabla V), y la escala fue utilizada para estratificar la población en dos grupos según el riesgo de mortalidad perioperatoria: alto (> 5 puntos), con mortalidad del 46%, y bajo (≤ 5 puntos), con mortalidad del 12%.
Escala de riesgo de la Columbia University
| Escala inicial (1995)28 | ||
| Riesgo relative | Puntuación | |
| Ventilación mecánica | 5,3 | 4 |
| Poscardiotomía | 3,3 | 2 |
| Puente a trasplante | 3,3 | 2 |
| Presión venosa central > 16 mmHg | 2,1 | 1 |
| Tiempo de protrombina > 16 s | 2,1 | 1 |
| Escala revisada (2003)27 | ||
| Riesgo relativo | Puntuación | |
| Diuresis < 30ml/h | 3,9 | 3 |
| Presión venosa central > 16 mmHg | 3,1 | 2 |
| Tiempo de protrombina > 16 s | 2,9 | 2 |
| Ventilación mecánica | 2,4 | 2 |
| Reintervención | 1,7 | 1 |
Su limitación principal es que deriva de una serie de enfermos más graves (ventilación, shock cardiogénico) que las de otras escalas, además de ser pacientes como puente a trasplante.
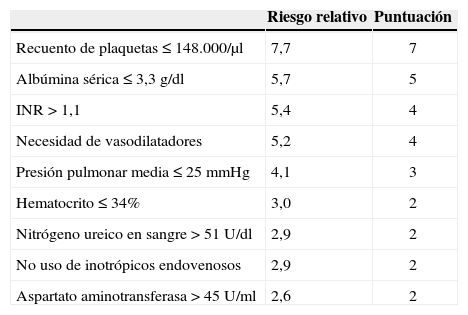
Destination therapy risk scoreFue diseñado por Lietz y Miller21 utilizando una población de 222 pacientes con HeartMate® XVE del registro americano de asistencia definitiva. Identificaron nueve factores preoperatorios que predecían mortalidad hospitalaria a 90 días (Tabla VI) y asignaron puntuaciones utilizando las odds ratio, logrando discriminar a los pacientes en grupos de bajo (≤ 16 puntos) y alto riesgo (≥ 17 puntos): los pacientes de bajo riesgo tenían mayor probabilidad de ser dados de alta y presentaban una supervivencia a 1 año entre 71–80% frente a los del grupo de alto riesgo, cuya supervivencia era inferior al 15%29, que es menor incluso que la de los pacientes del brazo de tratamiento médico del REMATCH (supervivencia a 1 año 28%)29 y habla a favor de la correcta selección del paciente y del momento de implantación.
Score de riesgo lietz-miller pa ra asistencia definitiva (DTRS)21
| Riesgo relativo | Puntuación | |
| Recuento de plaquetas ≤ 148.000/µl | 7,7 | 7 |
| Albúmina sérica ≤ 3,3 g/dl | 5,7 | 5 |
| INR > 1,1 | 5,4 | 4 |
| Necesidad de vasodilatadores | 5,2 | 4 |
| Presión pulmonar media ≤ 25 mmHg | 4,1 | 3 |
| Hematocrito ≤ 34% | 3,0 | 2 |
| Nitrógeno ureico en sangre > 51 U/dl | 2,9 | 2 |
| No uso de inotrópicos endovenosos | 2,9 | 2 |
| Aspartato aminotransferasa > 45 U/ml | 2,6 | 2 |
El estudio ponía de manifiesto también la fuerte correlación entre las variables anormales en la valoración preoperatoria y la eventual causa de muerte, por ejemplo malnutrición con muerte por infección o plaquetopenia e índice internacional normalizado (INR) elevado con muerte relacionada con sangrado y disfunción derecha. Pero el estudio también cuenta con algunas limitaciones, como son el hecho de derivarse de una población de pacientes añosos, con una baja prevalencia de ventilación mecánica y balón de contrapulsación (que no aparecen en el modelo) y el no tomar en consideración la gravedad clínica del fracaso cardíaco.
INTERMACS scoreLos siete niveles de gravedad clínica definidos a partir del registro INTERMACS se correlacionan con el pronóstico y la supervivencia, y así, por ejemplo, un nivel 1 presenta un riesgo relativo de 1,59 de mortalidad precoz según el análisis multivariante del propio registro.
Cinco de estas escalas de riesgo han sido comparadas por Schaffer, et al.30 en pacientes implantados con dispositivos de flujo continuo para comprobar su validez actual. Las puntuaciones preoperatorias fueron calculadas de forma prospectiva para APACHE II, SHFM, INTERMACS, Columbia y Destination Therapy Risk Score [DTRS] en 86 pacientes implantados con un Heart-Mate® II, y el análisis de riesgos proporcionales de Cox permitió definir el efecto en la mortalidad a 30, 90 días y 1 año, y estratificar a los pacientes en grupos de bajo y alto riesgo. En el análisis univariante el score de Seattle fue el que mejor diferenció los pacientes de bajo y alto riesgo en todos los puntos de mortalidad, mientras que INTERMACS y APACHE II fueron predictivos sólo para la de 90 días y 1 año. En el análisis multivariante el SHFM y el APACHE II predijeron la mortalidad a 1 año, por lo que, al menos en la experiencia de un centro y con dispositivos de flujo continuo, el mejor predictor de mortalidad parece ser el score del SHFM, dado que además categoriza bien a los enfermos de bajo y alto riesgo.
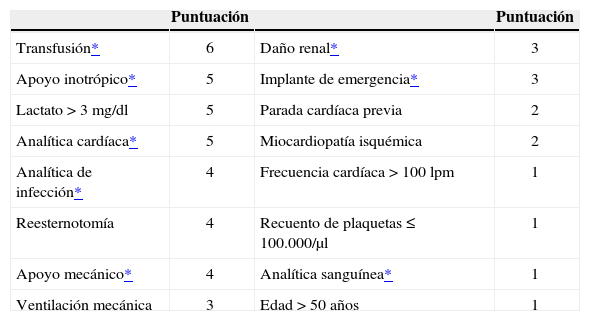
Score de MünsterDiseñado a partir de una serie de 241 pacientes para predecir la mortalidad en la unidad de vigilancia intensiva (UVI) tras el implante de un DAVI con diversas indicaciones31, lo integran 13 factores de riesgo demográficos, clínicos y de laboratorio (Tablas VII y VIII), pudiendo alcanzar un total de 50 puntos y definiendo tres estratos de riesgo: bajo (< 15 puntos) con mortalidad 15,8%, medio (16–30 puntos) 48,2%, y alto (> 30 puntos) con mortalidad del 65,2%.
Escala de mortalidad en uvi tras implante de davi (klotz, et al.31)
| Puntuación | Puntuación | ||
| Transfusión* | 6 | Daño renal* | 3 |
| Apoyo inotrópico* | 5 | Implante de emergencia* | 3 |
| Lactato > 3 mg/dl | 5 | Parada cardíaca previa | 2 |
| Analítica cardíaca* | 5 | Miocardiopatía isquémica | 2 |
| Analítica de infección* | 4 | Frecuencia cardíaca > 100 lpm | 1 |
| Reesternotomía | 4 | Recuento de plaquetas ≤ 100.000/µl | 1 |
| Apoyo mecánico* | 4 | Analítica sanguínea* | 1 |
| Ventilación mecánica | 3 | Edad > 50 años | 1 |
DAVI: dispositivo de asistencia ventricular izquierda.
| – | «Transfusión»: administración preoperatoria de > 10 unidades de glóbulos rojos y/o > 10 unidades de plasma |
| – | «Apoyo inotrópico»: uso de epinefrina y/o norepinefrina y/o dobutamina |
| – | «Analítica cardíaca»: lactato deshidrogenasa (LDH) > 500 U/l y/o creatina fosfocinasa (CPK) > 200 U/l y/o troponina I > 20 ng/ml |
| – | «Analítica infecciosa»: proteína C reactiva > 8 mg/l y/o leucocitos > 13.000/µl |
| – | «Apoyo mecánico»: ECMO previo y/o balón previo y/o cirugía cardíaca previa (< 7 días) |
| – | «Daño renal»: creatinina > 1,5 mg/dl y/o BUN > 40 mg/dl y/o apoyo renal (hemofiltro, diálisis) |
| – | «Implante de emergencia»: implante en shock cardiogénico o poscardiotomía (previo ECMO) |
| – | «Analítica sanguínea»: hemoglobina < 12 g/dl y/o hematocrito < 35% |
BUN: nitrógeno ureico en sangre; ECMO: circulación extracorpórea con membrana de oxigenación.
Dada la buena capacidad de la mayor parte de estas escalas para predecir riesgo operatorio e incluso supervivencia a corto y medio plazo, debemos considerar la inclusión de algún modelo de estratificación del riesgo entre nuestras rutinas para la selección de pacientes candidatos a asistencia definitiva. En este sentido, el Seattle Heart Failure Model parece un sistema adecuado por su sencilla aplicación y su poder predictivo, y el score desarrollado en la Universidad de Münster es simple, de diseño robusto y se centra en la mortalidad inicial (relacionada con la situación clínica y hemodinámica preoperatoria), aunque deberá ser validado en series de pacientes con asistencia definitiva.
Presente y futuro en la asistencia permanenteLa controversia entre flujo pulsátil y flujo no pulsátil se ha mantenido viva en los últimos 50 años. La mayo-ría de publicaciones que avalan la superioridad del flujo pulsátil se basan en estudios con circulación extracorpórea de corta duración realizados en diversas especies, pero no son trasladables al apoyo a largo plazo en pacientes con miocardiopatía, no sólo por la falta de modelos animales de fallo cardíaco crónico sino porque la extracorpórea con clampaje aórtico es una situación de verdadero flujo no pulsátil, mientras que durante el apoyo con DAVI el corazón nativo continúa funcionando y puede contribuir al gasto cardíaco por la eyección de sangre a través de la válvula aórtica o incrementando la precarga de la bomba, lo cual conlleva un cierto grado de pulsatilidad arterial, salvo que la velocidad de la bomba sea extremadamente alta, el volumen intravascular sea muy bajo o no haya ningún grado de contracción ventricular izquierda; de hecho los pacientes ambulatorios en situación estable a menudo no tienen un pulso palpable pero sí hay una presión arterial pulsátil que variará dependiendo de la hidratación y la actividad física. Es por ello que este tipo de dispositivos no deberían ser llamados «de flujo no pulsátil».
- –
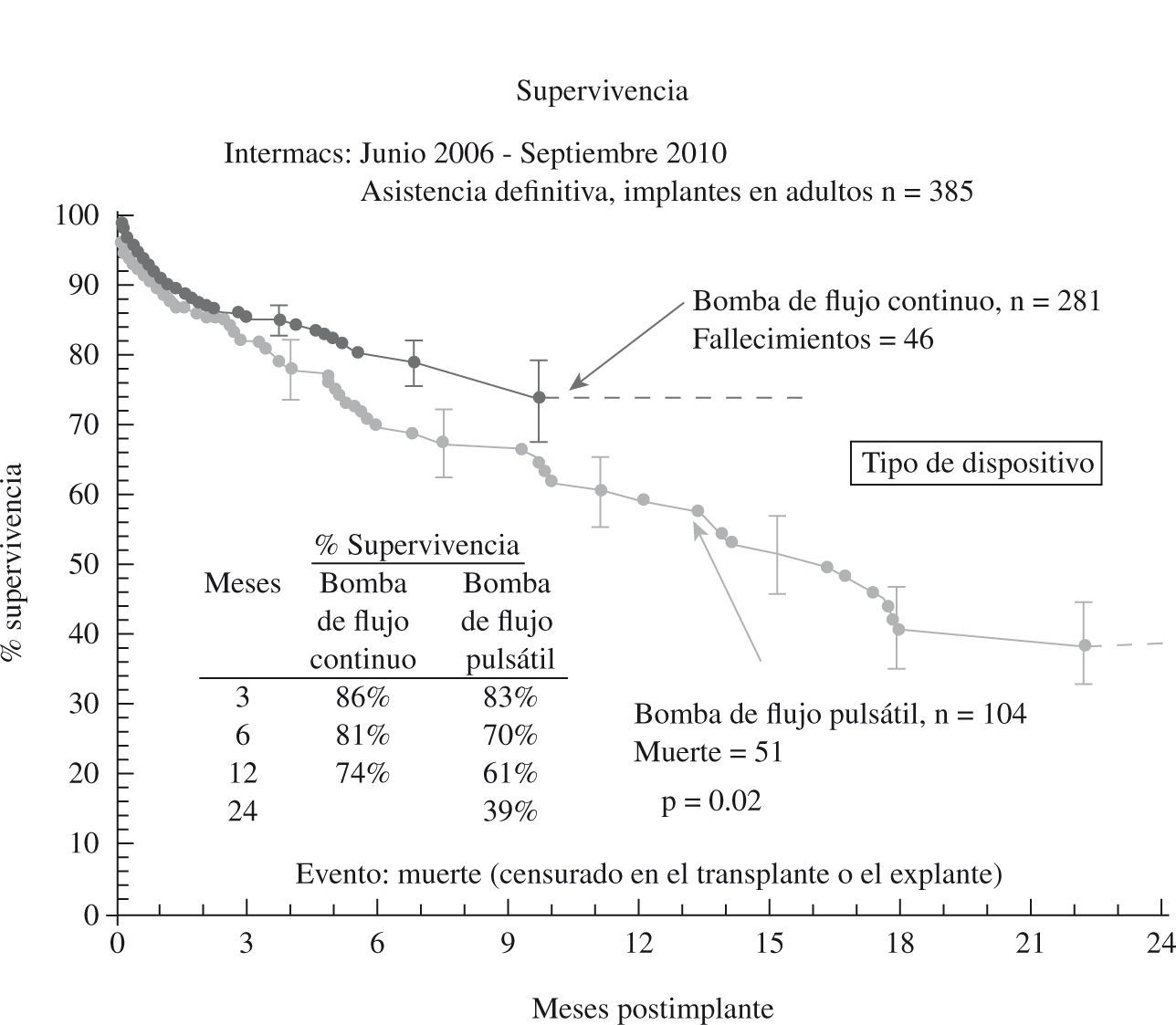
El presente y el futuro inmediato pasan por los dispositivos de flujo continuo, una vez éstos han demostrado su superioridad frente a los pulsátiles en el ensayo HeartMate® II DT (significativa ventaja del HeartMate® II en la probabilidad de supervivencia libre de ictus o fallo del dispositivo a 2 años respecto al HeartMate® XVE); ambos modelos mejoran significativamente tanto la calidad de vida como la capacidad funcional11, y eso ha sido corroborado por otros autores32. Asimismo, se ha constatado la capacidad de estos dispositivos para recuperar un discreto fracaso renal y/o hepático preimplante y normalizarlo durante apoyos de hasta 15 meses; la limitada evidencia clínica sugiere también que el apoyo con flujo continuo tampoco tiene un efecto deletéreo en la función cerebral33.
Quedan por perfilar aspectos como la velocidad y flujo de bomba ideal o la evolución de la insuficiencia aórtica durante la asistencia a largo plazo, y en ambos sentidos el papel del ecocardiograma es fundamental para tomar decisiones.
- –
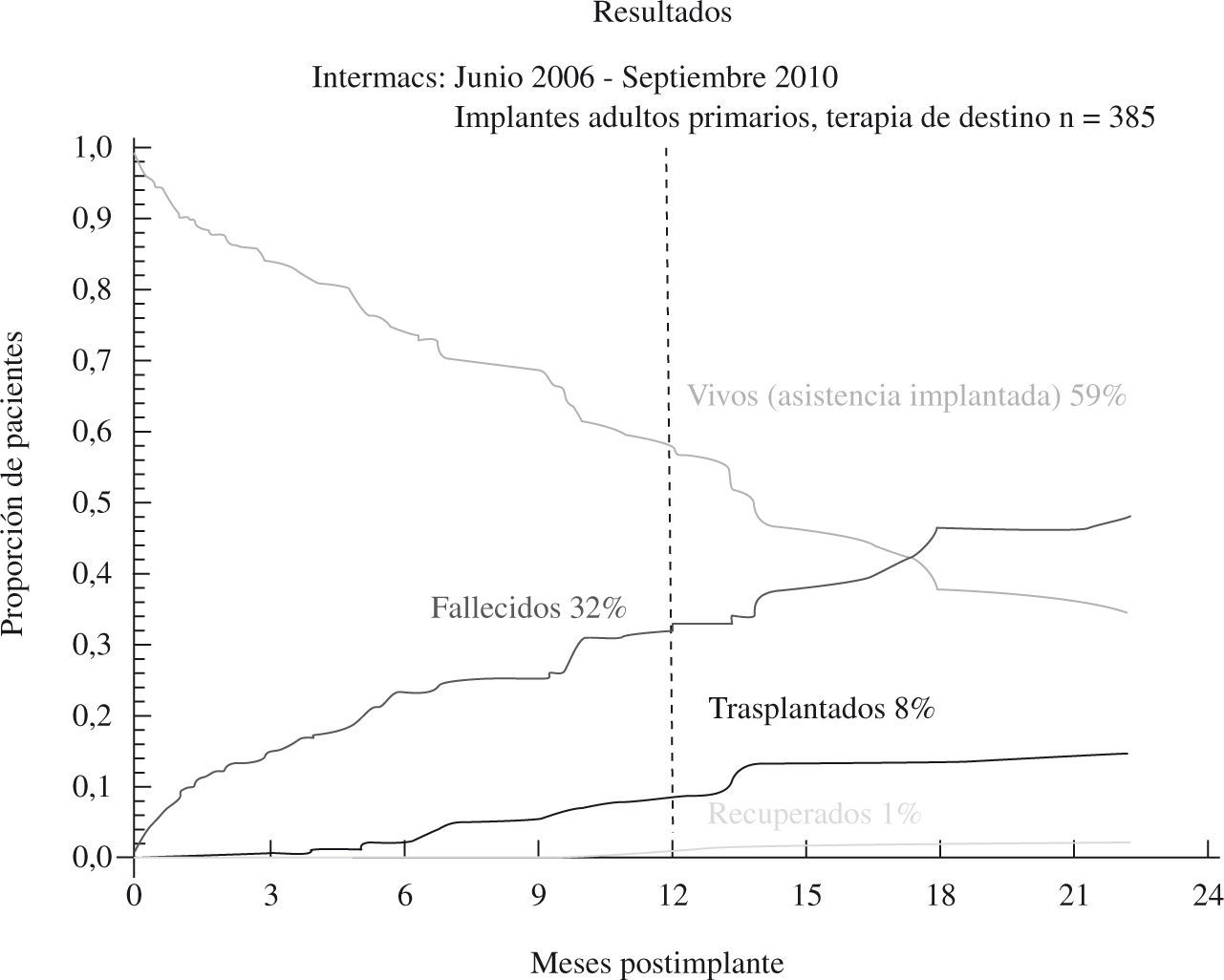
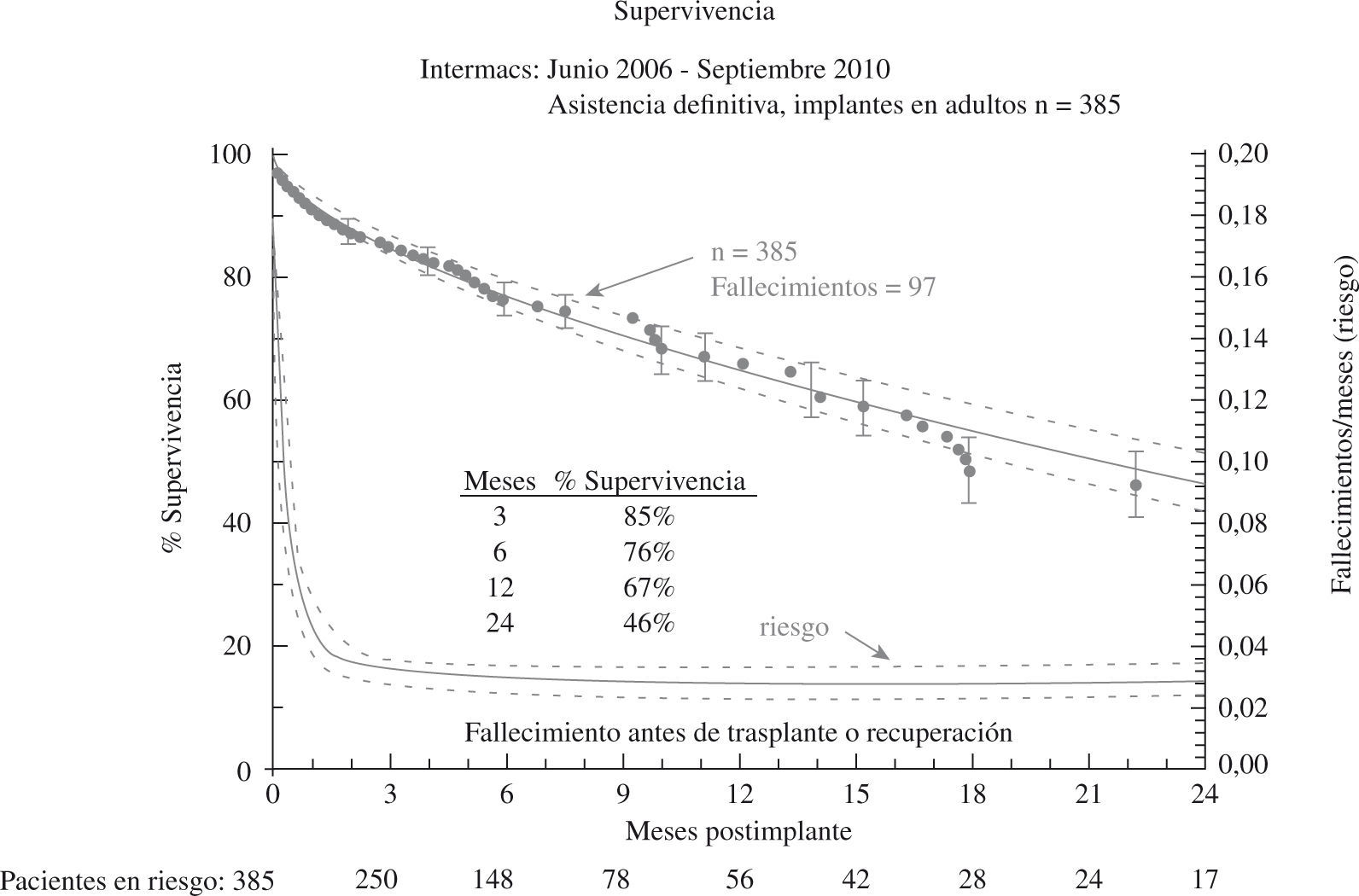
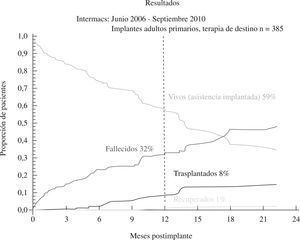
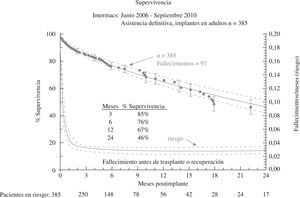
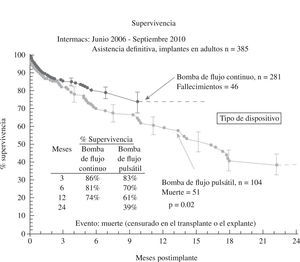
El tercer informe INTERMACS se dedica de forma monográfica a la evolución de la asistencia definitiva en EE.UU. (385 pacientes de los 2.506 adultos implantados hasta septiembre de 2010)23: el 80% de los pacientes se encontraban en niveles INTERMACS 2–4, y las indicaciones para terapia de destino fueron: edad, disfunción renal y alto índice de masa corporal (IMC), aunque resultaron potencialmente modificables en el 50% de casos, y un 10% fueron trasplantados o se les retiró el dispositivo por recuperación ventricular (Fig. 2). La supervivencia global a 1 año es 67%, y 46% a 2 años (Fig. 3), pero con el empleo de dispositivos de flujo continuo mejora hasta el 75% (Fig. 4), confirmando las buenas expectativas de estos modelos en la asistencia definitiva.
Figura 2.Evolución de los pacientes implantados para asistencia definitiva (informe INTERMACS 2011)23.
Figura 3.Supervivencia global en pacientes con asistencia definitiva (informe INTERMACS 2011)23.
Figura 4.Supervivencia en pacientes con asistencia definitiva según el tipo de flujo de bomba (informe INTERMACS 2011)23.
- –
El futuro a medio y largo plazo en la terapia de destino pasa por la definición de protocolos más precisos en la estratificación de riesgo para seleccionar candidatos con resultados óptimos y por la disponibilidad de modelos tecnológicamente mejores, más durables (actualmente entre 5–10 años teóricos) y con menos eventos adversos. Los dispositivos de implantación intrapericárdica (incluso sin circulación extracorpórea [CEC]) como el HeartWare o el HeartAssist 5 pueden disminuir la incidencia de sangrado e infección, y la sustitución del cable percutáneo por sistemas de transferencia transcutánea de energía evitarán infecciones.
Son necesarios estudios de coste-eficiencia dado que son dispositivos caros, pero que aportan un beneficio no sólo en términos de supervivencia y calidad de vida, sino también un ahorro en el gasto sanitario cuando están bien indicados.
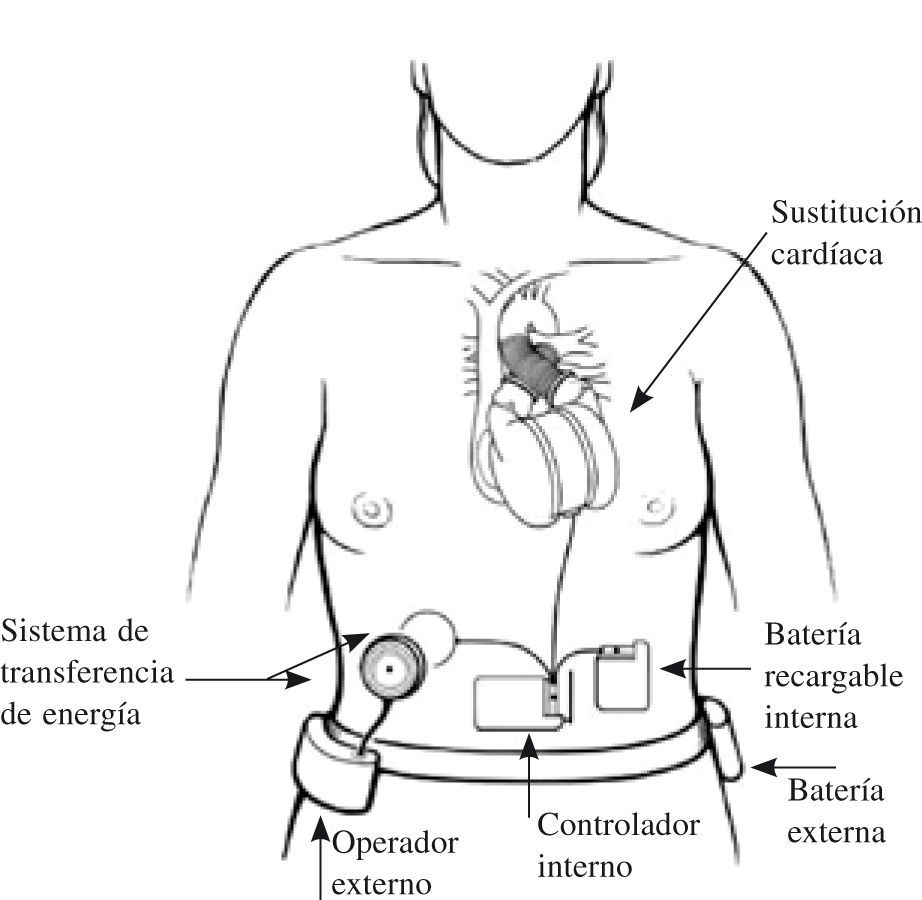
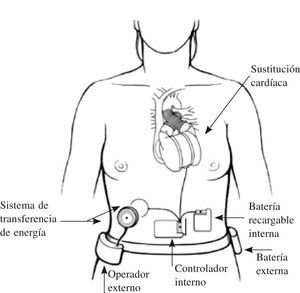
Corazón artificial total implantableEs el paradigma de la asistencia como indicación definitiva: el órgano nativo es sustituido completamente por otro artificial, que ocupa su lugar y permite al paciente movilización, deambulación y una vida normal, pues no hay ningún cable o línea que atraviese la piel hacia el exterior.
El único dispositivo actualmente disponible y de uso restringido es el AbioCor® (Abiomed, Danvers, MA); sus componentes básicos pueden verse en la figura 5. Ha sido modificado dando lugar a un modelo un 30% más pequeño, AbioCor® II, que debía haber iniciado su fase clínica a finales de 2008. Existen también distintos modelos experimentales (el MagScrew TAH en fase preclínica en la Cleveland Clinic, y 16 más entre Japón y Corea).
El objetivo primario del estudio era determinar el efecto del AbioCor® sobre todas las causas de mortalidad, y se completó con 14 pacientes: hubo dos muertes perioperatorias y se asistió a 12 pacientes entre 53–512 días (media de 5,3 meses), con un apoyo acumulado de 5,2 años y dos altas hospitalarias34. No hubo infecciones o hemólisis relacionadas con el dispositivo ni daño inmunológico o tisular significativo y las complicaciones neurológicas fueron similares a las de las asistencias convencionales, por lo que el resultado global del ensayo clínico debe considerarse positivo en términos de funcionamiento del dispositivo, supervivencia y calidad de vida.
Microbombas implantablesEl uso de DAVI que proporcionan apoyo circulatorio total está orientado actualmente a los enfermos en peor situación clínica, pero hay una gran población de pacientes no tan graves (clase funcional de la New York Heart Association [NYHA] IIIb o inicios de IV) que podrían beneficiarse de dispositivos más pequeños y menos invasivos capaces de ofrecer un apoyo circulatorio parcial. El único disponible por ahora es el CircuLite® Synergy® (Circulite Inc, Saddle Brook, NJ, USA), una microbomba de flujo axial del tamaño de una pila AA y 25 g de peso, que se aloja subcutáneamente como un marcapasos y es capaz de proporcionar hasta 3 l/min, descargando así parcialmente el ventrículo izquierdo.
Los datos iniciales del ensayo clínico para lograr la marca CE con 17 pacientes en espera de trasplante y un apoyo medio de 87 días (6–213) demuestran una mejoría hemodinámica y clínica desde el primer día, con un significativo incremento en la presión arterial e índice cardíaco y un marcado descenso en las presiones pulmonares y presión capilar pulmonar (PCP)35. Esta mejoría se ha demostrado mantenida en el tiempo según los datos del estudio multicéntrico europeo CircuLite® con 25 pacientes y un apoyo acumulado de 6,7 pacientes/año36. Antes de plantear estos dispositivos como una opción válida para la asistencia permanente se necesita un seguimiento que demuestre ese beneficio a más largo plazo y que evalúe los posibles riesgos asociados al apoyo crónico con este tipo de dispositivos.