La oxigenación con membrana extracorpórea (ECMO) ha resultado ser una opción terapéutica en los pacientes con insuficiencia respiratoria o cardiaca severa por COVID-19. Las indicaciones y manejo de estos pacientes están aún por determinar. Nuestro objetivo es evaluar los resultados de la terapia ECMO en pacientes con COVID-19 incluidos en un registro prospectivo e intentar optimizar los resultados.
MétodosEn marzo de 2020 se inició un registro multicéntrico anónimo prospectivo de pacientes con COVID-19 tratados mediante ECMO veno-arterial (V-A) o veno-venosa (V-V). Se registraron las variables clínicas, analíticas y respiratorias preimplante, datos de implante y evolución de la terapia. El evento primario fue la mortalidad hospitalaria de cualquier causa y los eventos secundarios fueron la recuperación funcional y el evento combinado de recuperación funcional y mortalidad de cualquier causa a partir de los 3 meses de seguimiento tras el alta.
ResultadosSe analizó a un total de 365 pacientes procedentes de 25 hospitales, 347 V-V y 18 V-A (edad media de 52,7 y 49,4 años, respectivamente). Los pacientes con ECMO V-V fueron más obesos, presentaban menos fracaso orgánico diferente al pulmonar y precisaron menos terapia inotrópica previa al implante. El 33,3% y el 34,9% de los pacientes con ECMO V-A y V-V, respectivamente, fueron dados de alta del hospital (p=NS) y la mortalidad fue similar, del 56,2% y 50,9% de los casos respectivamente, la inmensa mayoría durante la ECMO y sobre todo por fracaso multiorgánico. El 14,0% (51 pacientes) permanecían ingresados. El seguimiento medio fue de 196 ± 101,7 días. En el análisis multivariante, resultaron protectores de evento primario en pacientes con ECMO V-V el peso corporal (OR 0,967; IC 95%: 0,95-0,99; p=0,004) y la procedencia del propio hospital (OR 0,48; IC 95%: 0,27-0,88; p=0,018), mientras que la edad (OR 1,063; IC 95%: 1,005-1,12; p=0,032), la hipertensión arterial (3,593; IC 95%: 1,06-12,19; p=0,04) y las complicaciones en ECMO globales (2,44; IC 95%: 0,27-0,88; p=0,019), digestivas (OR 4,23, IC 95%: 1,27-14,07; p=0,019) y neurológicas (OR 4,66; IC 95%: 1,39-15,62; p=0,013) fueron predictores independientes de mortalidad. El único predictor independiente de aparición de los eventos secundarios resultó el momento de seguimiento del paciente.
ConclusionesLa terapia con ECMO permite supervivencias hospitalarias hasta del 50% en pacientes con COVID-19 grave. La edad, la hipertensión arterial y las complicaciones en ECMO son los predictores de mortalidad hospitalaria en pacientes con ECMO V-V. Un mayor peso corporal y la procedencia del propio hospital son factores protectores. La recuperación funcional solo se ve influida por el tiempo de seguimiento transcurrido tras el alta. La estandarización de los criterios de implante y manejo del paciente con COVID grave mejoraría los resultados y la futura investigación clínica.
COVID-19 patients with severe heart or respiratory failure are potential candidates for extracorporeal membrane oxygenation (ECMO). Indications and management of these patients are unclear. Our aim is to describe the results of a prospective registry of COVID-19 patients treated with ECMO.
MethodsAn anonymous prospective registry of COVID-19 patients treated with veno-arterial (V-A) or veno-venous (V-V) ECMO was created on march 2020. Clinical, analytical and respiratory preimplantation variables, implantation data and post-implantation course data were recorded. The primary endpoint was all cause in-hospital mortality. Secondary events were functional recovery and the combined endpoint of mortality and functional recovery in patients followed at least 3 months after discharge.
ResultsThree hundred and sixty-six patients from 25 hospitals were analyzed, 347 V-V ECMO and 18 V-A ECMO patients (mean age 52.7 and 49.5 years respectively). Patients with V-V ECMO were more obese, had less frequently organ damage other than respiratory failure and needed less inotropic support; Thirty three percent of V-A ECMO and 34.9% of V-A ECMO were discharged (P=NS). Hospital mortality was non-significantly different, 56.2% versus 50.9% respectively, mainly during ECMO therapy and mostly due to multiorgan failure. Other 51 patients (14%) remained admitted. Mean follow-up was 196± 101.7 days (95%CI: 170.8-221.6). After logistic regression, body weight (OR 0.967, 95%CI: 0.95-0.99, P=0.004) and ECMO implantation in the own centre (OR 0.48, 95%CI: 0.27-0.88, P=0.018) were protective for hospital mortality. Age (OR 1.063, 95%CI: 1.005-1.12, P=0.032), arterial hypertension (3.593, 95%CI: 1.06-12.19, P=0.04) and global (2.44, 95%CI: 0.27-0.88, P=0.019), digestive (OR 4,23, 95%CI: 1.27-14.07, P=0.019) and neurological (OR 4.66, 95%CI: 1.39-15.62, P=0.013) complications during ECMO therapy were independent predictors of primary endpoint occurrence. Only the post-discharge day at follow-up was independent predictor of both secondary endpoints occurrence.
ConclusionsHospital survival of severely ill COVID-19 patients treated with ECMO is near 50%. Age, arterial hypertension and ECMO complications are predictors of hospital mortality, and body weight and implantation in the own centre are protective. Functional recovery is only predicted by the follow-up time after discharge. A more homogeneous management of these patients is warranted for clinical results and future research optimization.
La Organización Mundial de la Salud (OMS) declaró en enero de 2020 la enfermedad causada por el coronavirus-2 del síndrome respiratorio agudo severo (SARS-CoV-2) como pandemia, tras haberse detectado los primeros casos en la provincia de Wuhan (China), en octubre de 2019 como cuadros de neumonía atípica severa1. Desde entonces, la enfermedad causada por este germen (coronavirus disease 2019, COVID-19) ha afectado hasta septiembre de 2021 a más de 233 millones de personas y ha causado más de 4,7 millones de muertos2.
La mayoría de los casos de COVID-19 cursan asintomáticos o con clínica leve1, pero entre el 15 y el 30% de los pacientes que desarrollan neumonía radiológica sufren insuficiencia respiratoria severa3 y el 5-12% desarrollan síndrome de distrés respiratorio del adulto (SDRA)4. En un porcentaje elevado de estos casos la hipoxemia se hace refractaria al tratamiento médico agresivo convencional, incluida la oxigenación con altos flujos, la ventilación mecánica protectora y la pronación5. La mortalidad del SDRA provocado por COVID-19 ronda el 40%, similar a lo que se ha reportado por otras causas6,7.
En pacientes con hipoxemia o hipercapnia refractarias por enfermedades diferentes a la COVID-19 se ha considerado que la oxigenación con membrana extracorpórea (ECMO) podría mejorar el pronóstico de los pacientes con SARS8. Aunque los datos aún no son claros8-11, la evidencia más reciente indica un beneficio de la ECMO, sobre todo cuando se realiza una correcta selección de pacientes. Durante la pandemia por SARS-CoV-2 se ha indicado que la terapia ECMO en pacientes con COVID-19 grave con fracaso respiratorio o circulatorio podría tener unos beneficios similares y se ha aconsejado su utilización12,13. Sin embargo, las peculiaridades de esta enfermedad, con una activación exagerada de la respuesta inflamatoria y de la coagulación, unidas a la escasez de recursos y al colapso del sistema sanitario inherentes a la situación de pandemia hace que se deban seleccionar correctamente las indicaciones para optimizar los resultados y ofrecer la terapia a aquellos pacientes con más probabilidades de sobrevivir13.
Por ello, durante la primera ola de la enfermedad y en el contexto de la gran incertidumbre generada por los resultados preliminares de estos dispositivos en este tipo de enfermos5,14-16, desde la Sociedad Española de Cirugía Cardiovascular y Endovascular (SECCE) se propuso generar un registro de pacientes con COVID-19 tratados mediante terapia ECMO con el objetivo de evaluar sus resultados e intentar optimizar sus indicaciones, contraindicaciones y manejo.
MétodosEn marzo de 2020 se contactó con todos los servicios españoles de cirugía cardiovascular a través de la SECCE y su Grupo de Trabajo de Asistencia Circulatoria y Trasplante Cardiaco (GRUTAT) para iniciar un registro prospectivo y anónimo de pacientes tratados con ECMO veno-venosa (V-V) o veno-arterial (V-A) por enfermedad cardiaca, respiratoria o mixta inducida por COVID-19. Para ello, se elaboró una base de datos (Registro ECMO-COVID de la SECCE) con acceso restringido a los responsables del registro en cada hospital. Las variables iniciales fueron similares a las propuestas por el registro ECMO-COVID de la Extracorporeal Life Support Organization (ELSO) y se promocionó la introducción de los datos en ambos registros mediante la elaboración de hojas de cálculo compatibles. Las variables incluían datos preprocedimiento y de indicación, así como parámetros, complicaciones y resultados de la terapia ECMO. Las variables se definieron según las ELSO Registry Data Definitions17. Posteriormente, según evolucionó la evidencia científica disponible, se implementaron nuevos campos para su cumplimentación retrospectiva y prospectiva, incluidas variables de seguimiento clínico para los pacientes dados de alta.
Las indicaciones de implante y emancipación de ECMO, las técnicas de canulación/explante y el manejo de los parámetros hemodinámicos y respiratorios durante y tras el implante fueron los establecidos por los protocolos de cada centro, incluidas la anticoagulación, ventilación mecánica protectora y manejo de las complicaciones de la ECMO. Se analizaron las características demográficas, clínicas y analíticas preimplante, los tratamientos preimplante, la evolución de la terapia y sus complicaciones. Las complicaciones de cada sistema se consideraron de manera global (isquémicas y hemorrágicas; en las pulmonares, también neumotórax). El listado completo de variables finalmente incluidas, estatus final y destino de los pacientes tras el alta hospitalaria está reflejado en el anexo 1. Los pacientes fallecidos durante el implante fueron considerados como «muerte en ECMO».
El seguimiento clínico se realizó mediante contacto telefónico con el paciente o el médico responsable de su cuidado una vez transcurridos 90 días del alta hospitalaria. Las variables de seguimiento están reflejadas en el anexo 1. El estatus funcional siguió la escala propuesta por la Universidad de Leiden, que lo clasifica en 5 grupos según la existencia de síntomas residuales atribuibles a la enfermedad, el grado de limitación funcional y la presencia de dependencia (grado 0, «ausencia de limitación funcional», grado 1 «limitación funcional despreciable», grado 2 «limitación funcional leve», grado 3 «limitación funcional moderada» y grado 4 «limitación funcional severa»)18.
El evento primario fue la mortalidad hospitalaria de cualquier causa durante el ingreso hospitalario. Los eventos secundarios fueron la limitación funcional en el seguimiento a más 90 días y el evento combinado de muerte o limitación funcional. La «limitación funcional» en ambos casos se definió como una clase funcional de la NYHA>II/IV o un estatus funcional según la escala de Leiden>2 (moderada o severa). Se analizó el impacto en los eventos primarios y secundarios de las variables analizadas únicamente en los pacientes tratados mediante ECMO V-V, dado el escaso número de pacientes con ECMO V-A.
Debido al carácter multicéntrico del estudio, a la urgencia en iniciar la recopilación de datos y en empezar a extraer conclusiones, no fue remitido para aprobación por los comités de ética de los centros implicados. El estudio cumplió con el código de ética de la Declaración de Helsinki de la World Medical Association. El consentimiento informado del paciente no se requirió para la recopilación de las variables demográficas, clínicas, de procedimiento y resultados hospitalarios, dado el carácter observacional del estudio, sin capacidad para alterar las características y evolución de los pacientes y, sobre todo, el carácter urgente y habitualmente de rescate de la terapia ECMO. Todos los pacientes dieron su consentimiento informado para autorizar el contacto telefónico de seguimiento y la recopilación, registro y análisis de las variables.
Análisis estadísticoLa normalidad de la distribución de las variables continuas fue comprobada con el test de Kolmogorov-Smirnov. Las variables con distribución normal se expresaron como media ± desviación estándar (intervalo de confianza al 95% [IC 95%] de la media) y se analizaron mediante la prueba t de Student. Las variables con distribución no normal se expresaron como mediana (rango intercuartil, RIQ) y se analizaron con la prueba U de Mann-Whitney. Las variables categóricas se expresaron como frecuencias y porcentajes y se analizaron mediante el test de χ2 o el test de Fisher, según los resultados de las frecuencias esperadas de las tablas de contingencia. Se utilizó el método de Bonferroni para el ajuste en caso de comparaciones múltiples. Todas las variables demográficas, preimplante y de evolución de la terapia ECMO fueron analizadas mediante modelos de regresión lineal univariante según la ocurrencia de los eventos primario y secundario. Tras ello, todas las variables con valores de p significativos en el análisis univariante y aquellas con valores de p menores de 0,2 consideradas clínicamente relevantes fueron incluidas en modelos de regresión logística binaria mediante método por pasos hacia delante y hacia atrás, usando como criterio el test de razón de verosimilitud y valorando los modelos según los resultados de la R2 de Nagelkerke y la prueba de bondad de ajuste de Hosmer-Lemeshow. Se utilizaron las áreas bajo la curva ROC para determinar el valor predictivo de las variables cuantitativas significativamente relacionadas con la aparición de eventos y se determinaron los valores de corte que proporcionaron la máxima sensibilidad y especificidad.
Todos los análisis estadísticos se hicieron con el paquete informático SPSS (IBM SPSS Statistics for Mac, Versión 20.0, Armonk, NY, EE. UU.).
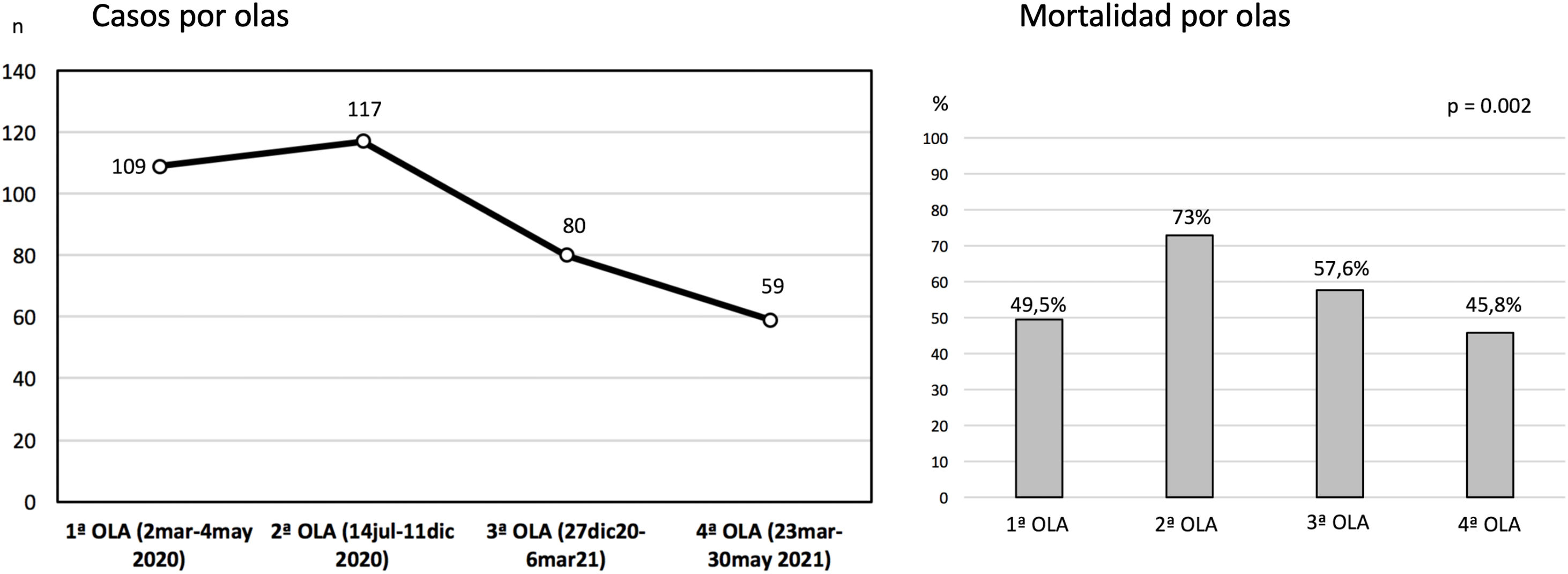
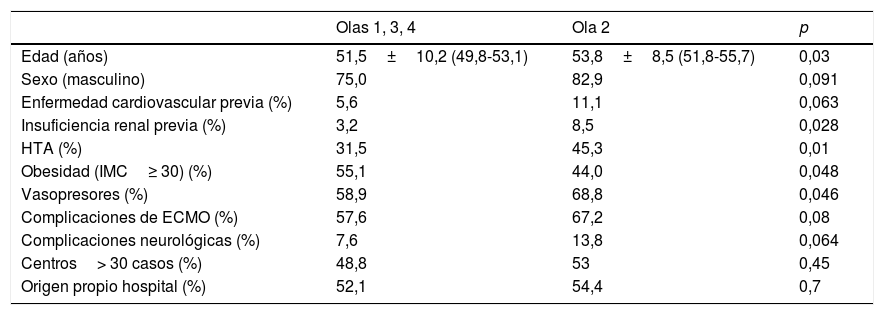
ResultadosDesde el 5 de marzo de 2020 hasta el 16 de mayo de 2021 se incluyeron en el Registro 373 pacientes procedentes de 25 hospitales (rango 1-56 casos). Ocho registros fueron excluidos por tener incompletas variables fundamentales, por lo que la muestra final englobó a 365 pacientes. En 4 centros la experiencia acumulada fue mayor de 30 casos y en ellos fueron tratados 183 pacientes (50,1% del total). Un hospital solo reportó los casos de la primera oleada (n=16). La distribución de los casos y la mortalidad hospitalaria global por olas se detallan en la figura 1.
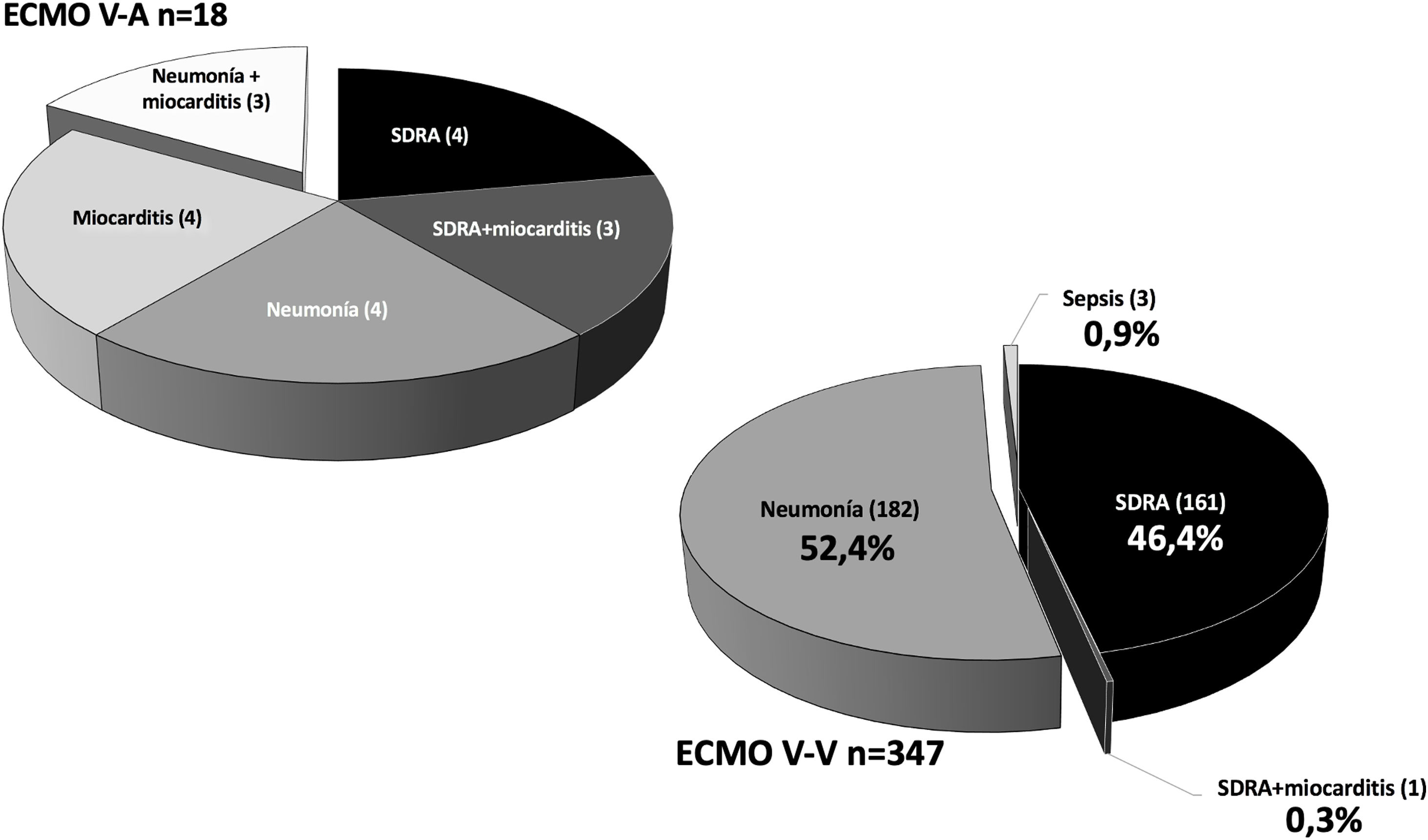
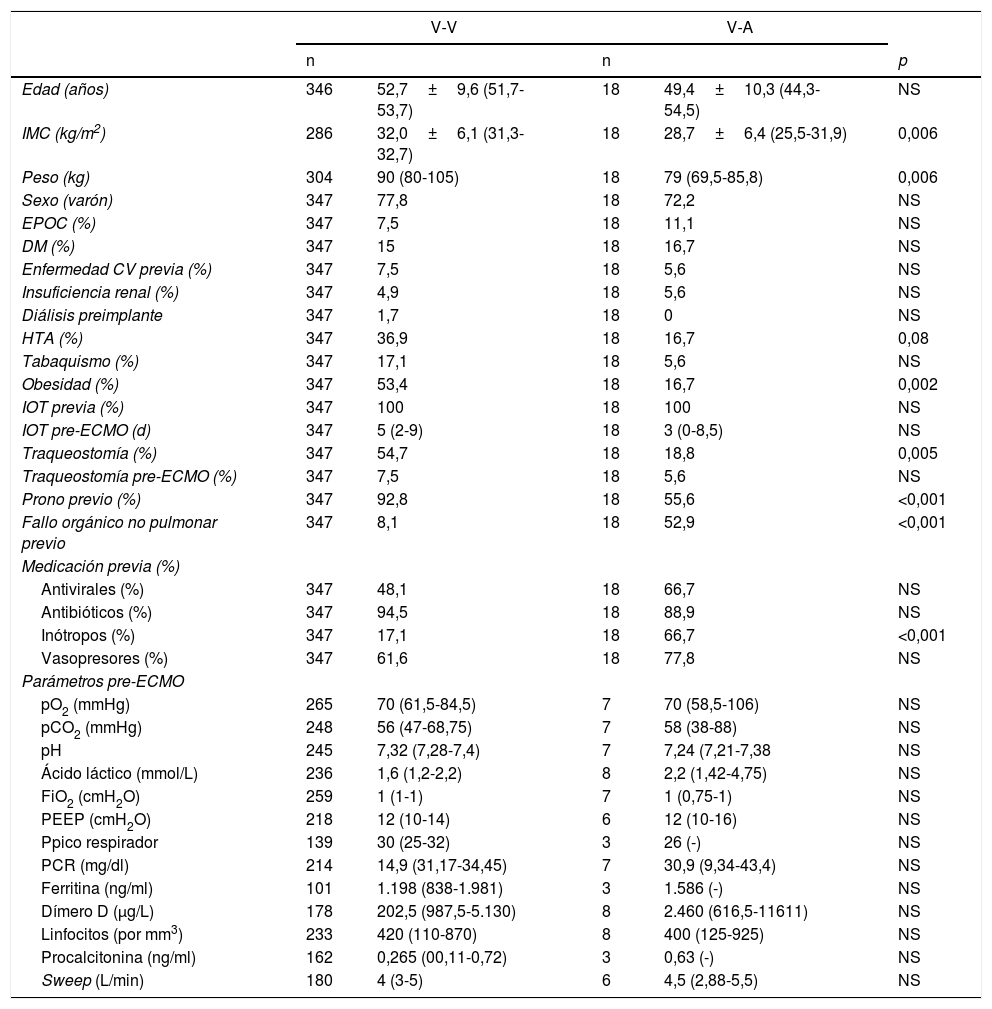
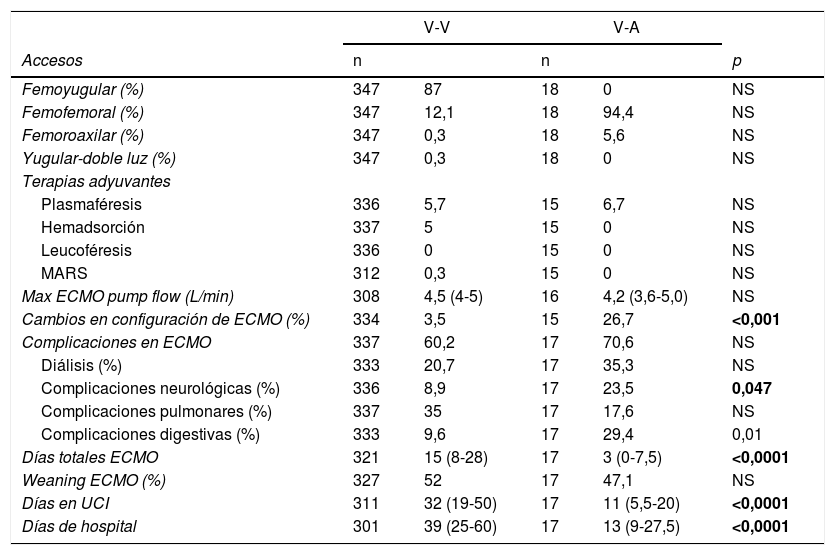
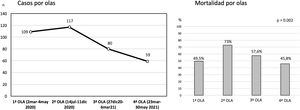
De los 365 pacientes, en 347 (95,1%) se implantó inicialmente una ECMO V-V y en 18 (4,9%) una ECMO V-A. Las características preimplante se muestran en la tabla 1. Los pacientes con ECMO V-V fueron más frecuentemente obesos (IMC>30kg/m2), presentaban menos fracaso orgánico diferente al pulmonar, precisaron menos terapia inotrópica previa al implante y se trataron con más frecuencia con terapia prono previa. Las indicaciones de implante de ECMO se detallan en la figura 2 y los detalles del implante y la evolución de la terapia en la tabla 2. El empleo de terapias adyuvantes durante la asistencia fue anecdótica. En el 3,5% de las ECMO V-V y el 16,7% de las ECMO V-A se precisó un cambio de configuración (p<0,001), sobre todo por fracaso cardiaco y pulmonar intercurrentes, respectivamente. El 3,6% (13/365) de los pacientes no se anticoagularon durante la terapia y el 6,8% (25/365) se anticoagularon con análogos de la hirudina (bivalirudina o argatrobán, 20 y 5 pacientes, respectivamente). El tipo de anticoagulación no influyó de manera significativa en la mortalidad hospitalaria. Las modalidades finales de configuración se expresan en la tabla 3.
Características clínicas preimplante de ECMO
| V-V | V-A | ||||
|---|---|---|---|---|---|
| n | n | p | |||
| Edad (años) | 346 | 52,7±9,6 (51,7-53,7) | 18 | 49,4±10,3 (44,3-54,5) | NS |
| IMC (kg/m2) | 286 | 32,0±6,1 (31,3-32,7) | 18 | 28,7±6,4 (25,5-31,9) | 0,006 |
| Peso (kg) | 304 | 90 (80-105) | 18 | 79 (69,5-85,8) | 0,006 |
| Sexo (varón) | 347 | 77,8 | 18 | 72,2 | NS |
| EPOC (%) | 347 | 7,5 | 18 | 11,1 | NS |
| DM (%) | 347 | 15 | 18 | 16,7 | NS |
| Enfermedad CV previa (%) | 347 | 7,5 | 18 | 5,6 | NS |
| Insuficiencia renal (%) | 347 | 4,9 | 18 | 5,6 | NS |
| Diálisis preimplante | 347 | 1,7 | 18 | 0 | NS |
| HTA (%) | 347 | 36,9 | 18 | 16,7 | 0,08 |
| Tabaquismo (%) | 347 | 17,1 | 18 | 5,6 | NS |
| Obesidad (%) | 347 | 53,4 | 18 | 16,7 | 0,002 |
| IOT previa (%) | 347 | 100 | 18 | 100 | NS |
| IOT pre-ECMO (d) | 347 | 5 (2-9) | 18 | 3 (0-8,5) | NS |
| Traqueostomía (%) | 347 | 54,7 | 18 | 18,8 | 0,005 |
| Traqueostomía pre-ECMO (%) | 347 | 7,5 | 18 | 5,6 | NS |
| Prono previo (%) | 347 | 92,8 | 18 | 55,6 | <0,001 |
| Fallo orgánico no pulmonar previo | 347 | 8,1 | 18 | 52,9 | <0,001 |
| Medicación previa (%) | |||||
| Antivirales (%) | 347 | 48,1 | 18 | 66,7 | NS |
| Antibióticos (%) | 347 | 94,5 | 18 | 88,9 | NS |
| Inótropos (%) | 347 | 17,1 | 18 | 66,7 | <0,001 |
| Vasopresores (%) | 347 | 61,6 | 18 | 77,8 | NS |
| Parámetros pre-ECMO | |||||
| pO2 (mmHg) | 265 | 70 (61,5-84,5) | 7 | 70 (58,5-106) | NS |
| pCO2 (mmHg) | 248 | 56 (47-68,75) | 7 | 58 (38-88) | NS |
| pH | 245 | 7,32 (7,28-7,4) | 7 | 7,24 (7,21-7,38 | NS |
| Ácido láctico (mmol/L) | 236 | 1,6 (1,2-2,2) | 8 | 2,2 (1,42-4,75) | NS |
| FiO2 (cmH2O) | 259 | 1 (1-1) | 7 | 1 (0,75-1) | NS |
| PEEP (cmH2O) | 218 | 12 (10-14) | 6 | 12 (10-16) | NS |
| Ppico respirador | 139 | 30 (25-32) | 3 | 26 (-) | NS |
| PCR (mg/dl) | 214 | 14,9 (31,17-34,45) | 7 | 30,9 (9,34-43,4) | NS |
| Ferritina (ng/ml) | 101 | 1.198 (838-1.981) | 3 | 1.586 (-) | NS |
| Dímero D (μg/L) | 178 | 202,5 (987,5-5.130) | 8 | 2.460 (616,5-11611) | NS |
| Linfocitos (por mm3) | 233 | 420 (110-870) | 8 | 400 (125-925) | NS |
| Procalcitonina (ng/ml) | 162 | 0,265 (00,11-0,72) | 3 | 0,63 (-) | NS |
| Sweep (L/min) | 180 | 4 (3-5) | 6 | 4,5 (2,88-5,5) | NS |
Media±desviación típica (intervalo de confianza de la media al 95%); mediana (rango intercuartil).
CV: cardiovascular; DM: diabetes mellitus; ECMO: oxigenación con membrana extracorpórea; EPOC: enfermedad pulmonar obstructiva crónica; FiO2: fracción inpirada de O2; HTA: hipertensión arterial; IMC: índice de masa corporal; IOT: intubación orotraqueal; NS: no significativa; PEEP: presión positiva teleespiratoria; Ppico: presión pico.
Implante y evolución de ECMO
| V-V | V-A | ||||
|---|---|---|---|---|---|
| Accesos | n | n | p | ||
| Femoyugular (%) | 347 | 87 | 18 | 0 | NS |
| Femofemoral (%) | 347 | 12,1 | 18 | 94,4 | NS |
| Femoroaxilar (%) | 347 | 0,3 | 18 | 5,6 | NS |
| Yugular-doble luz (%) | 347 | 0,3 | 18 | 0 | NS |
| Terapias adyuvantes | |||||
| Plasmaféresis | 336 | 5,7 | 15 | 6,7 | NS |
| Hemadsorción | 337 | 5 | 15 | 0 | NS |
| Leucoféresis | 336 | 0 | 15 | 0 | NS |
| MARS | 312 | 0,3 | 15 | 0 | NS |
| Max ECMO pump flow (L/min) | 308 | 4,5 (4-5) | 16 | 4,2 (3,6-5,0) | NS |
| Cambios en configuración de ECMO (%) | 334 | 3,5 | 15 | 26,7 | <0,001 |
| Complicaciones en ECMO | 337 | 60,2 | 17 | 70,6 | NS |
| Diálisis (%) | 333 | 20,7 | 17 | 35,3 | NS |
| Complicaciones neurológicas (%) | 336 | 8,9 | 17 | 23,5 | 0,047 |
| Complicaciones pulmonares (%) | 337 | 35 | 17 | 17,6 | NS |
| Complicaciones digestivas (%) | 333 | 9,6 | 17 | 29,4 | 0,01 |
| Días totales ECMO | 321 | 15 (8-28) | 17 | 3 (0-7,5) | <0,0001 |
| Weaning ECMO (%) | 327 | 52 | 17 | 47,1 | NS |
| Días en UCI | 311 | 32 (19-50) | 17 | 11 (5,5-20) | <0,0001 |
| Días de hospital | 301 | 39 (25-60) | 17 | 13 (9-27,5) | <0,0001 |
Media±desviación típica (intervalo de confianza de la media al 95%); mediana (rango intercuartil).
ECMO: oxigenación con membrana extracorpórea; MARS: sistema de adsorción molecular recirculante; NS: no significativa; UCI: unidad de cuidados intensivos; V-A: veno-arterial; V-VA: veno-venoarterial; VV-A: venoveno-arterial.
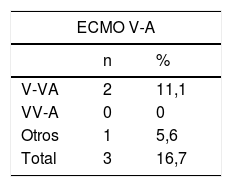
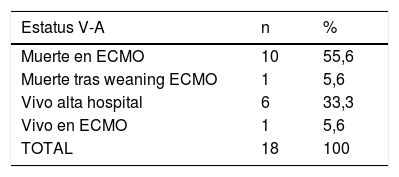
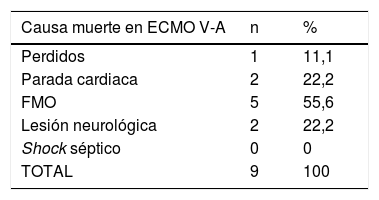
El estatus de los pacientes en el momento del cierre de la inclusión se puede observar en la tabla 4. El 33,3% y el 34,9% de los pacientes con ECMO V-A y V-V, respectivamente, habían sido dados de alta del hospital y el 56,2% y el 50,9% de los casos V-A y V-V habían fallecido, la inmensa mayoría durante la ECMO. De los pacientes dados de alta, un caso precisó trasplante pulmonar tras 122 días en ECMO por insuficiencia respiratoria severa refractaria. Fue dado de alta a los 86 días del trasplante. Las causas de muerte durante la terapia se describen en la tabla 5, con el fracaso multiorgánico como la causa de mortalidad más frecuente en ambos subgrupos.
Estatus final. ECMO V-A y V-V
| Estatus V-A | n | % |
|---|---|---|
| Muerte en ECMO | 10 | 55,6 |
| Muerte tras weaning ECMO | 1 | 5,6 |
| Vivo alta hospital | 6 | 33,3 |
| Vivo en ECMO | 1 | 5,6 |
| TOTAL | 18 | 100 |
| Estatus V-V | n | % |
|---|---|---|
| Muerte en ECMO | 148 | 42,7 |
| Muerte tras weaning ECMO | 28 | 8,1 |
| Vivo al alta del hospital | 121 | 34,9 |
| Vivo al alta de UCI | 8 | 2,3 |
| Vivo en ECMO | 23 | 6,6 |
| Vivo tras weaning ECMO | 19 | 5,5 |
| TOTAL | 347 | 100 |
UCI: unidad de cuidados intensivos.
Causas de muerte en ECMO
| Causa muerte en ECMO V-A | n | % |
|---|---|---|
| Perdidos | 1 | 11,1 |
| Parada cardiaca | 2 | 22,2 |
| FMO | 5 | 55,6 |
| Lesión neurológica | 2 | 22,2 |
| Shock séptico | 0 | 0 |
| TOTAL | 9 | 100 |
| Causa muerte en ECMO V-V | n | % |
|---|---|---|
| Perdidos | 1 | 0,6 |
| Parada cardiaca | 12 | 8,1 |
| Hemorrágica | 8 | 5,4 |
| FMO | 75 | 50,7 |
| Lesión neurológica | 15 | 10,1 |
| Shock séptico | 37 | 25 |
| TOTAL | 148 | 100 |
FMO: fracaso multiorgánico.
Para el análisis de los eventos primario y secundario se incluyeron los pacientes implantados hasta el 1 de abril de 2021, dado que una proporción significativa de pacientes implantados posteriormente a esa fecha (31/45, 68,9%) aún continuaban ingresados en el hospital al cierre del estudio (19 en ECMO, 9 vivos en UCI tras emancipación de ECMO y 3 en planta tras alta de UCI). Antes del 1 de abril de 2021, los pacientes en esa situación provisional eran tan solo del 6,3% (20/320) y fueron considerados «perdidos» durante el análisis, por lo que la muestra final para el análisis de predictores de mortalidad hospitalaria fue de 300 pacientes, 16 V-A y 284 V-V. En ese subgrupo, tanto la mortalidad hospitalaria (V-V 59,9 versus V-A 68,8%; p=0,48) como la desconexión de ECMO (V-V 48,6 versus V-A 43,8%; p=0,7) fue similar, aunque el escaso tamaño muestral del grupo V-A impide extraer conclusiones al respecto. Dada la escasa muestra de pacientes con ECMO V-A, solo se analizaron los predictores de mortalidad hospitalaria para el subgrupo ECMO V-V (n=284).
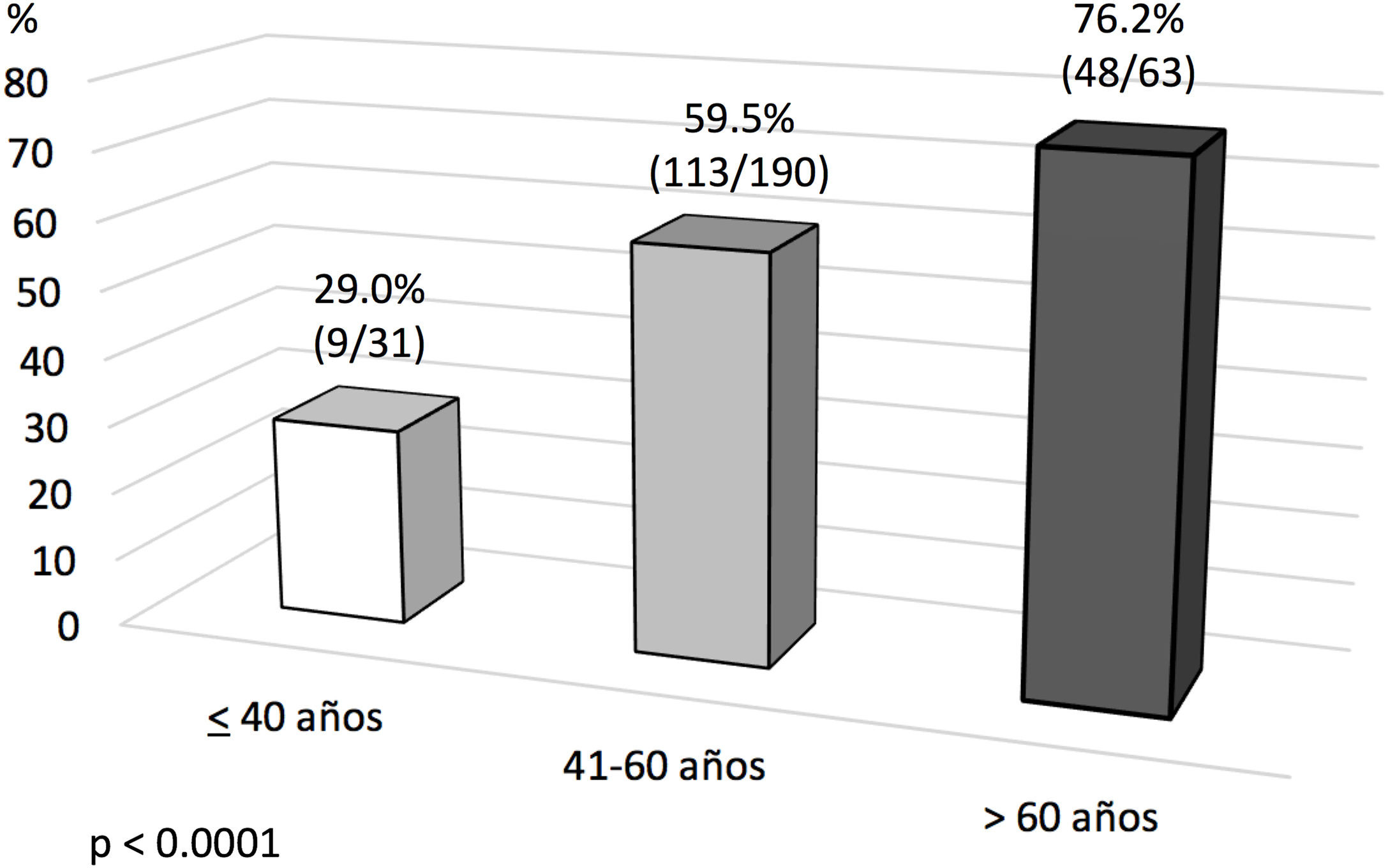
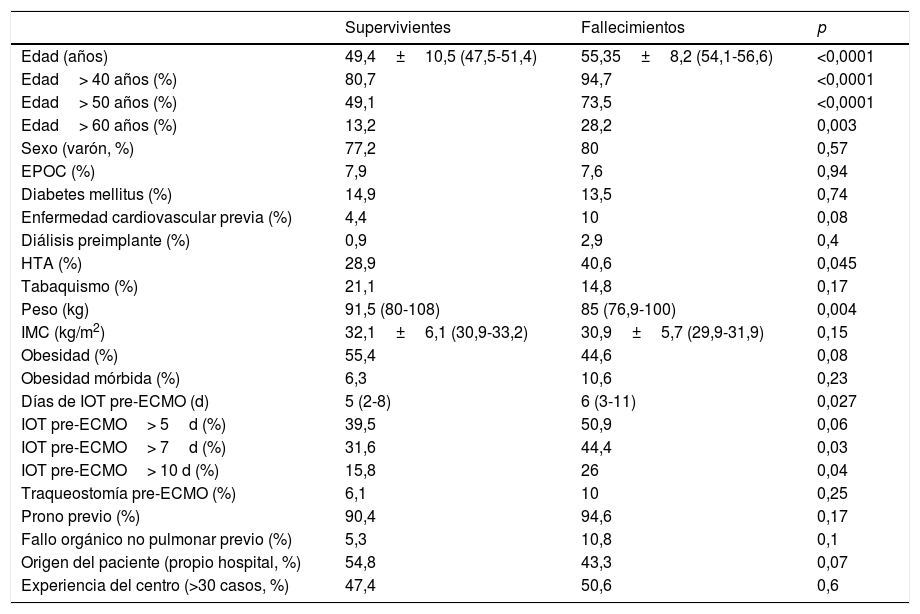
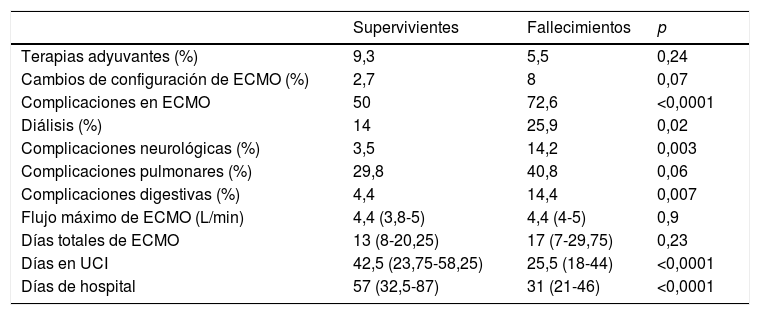
Análisis de evento primario en ECMO veno-venosa: predictores de mortalidad hospitalariaEn el análisis univariante (tablas 6 y 7), los pacientes fallecidos eran más mayores y presentaban mayores tiempos de intubación orotraqueal (IOT) previos al implante de ECMO, con una mayor mortalidad tras una intubación superior a 7 días antes del inicio de la ECMO. El 39,5% de los supervivientes versus el 50,9% de los pacientes fallecidos estuvieron intubados más de 5 días antes del implante de la ECMO, y esta diferencia rozó la significación estadística (p=0,06). La distribución de mortalidad fue significativamente diferente por grupos de edad (fig. 3). Los fallecimientos fueron más frecuentes de hipertensos y presentaban menos tratamientos antivirales y más inótropos y vasoconstrictores en el momento del implante. Aunque el IMC o la obesidad no resultaron diferentes entre ambos grupos, los pacientes fallecidos tenían significativamente menor peso que los supervivientes (p=0,004). La procalcitonina estaba significativamente más elevada en los pacientes fallecidos en el momento del implante de ECMO. Los pacientes supervivientes presentaron significativamente menos complicaciones, tanto consideradas de modo global como cuando se analizaron por separado las complicaciones renales, neurológicas, y digestivas. A diferencia de lo esperable, la necesidad de cambio de configuración a modalidades V-V-A o V-VA por complicaciones cardiacas no representó un mayor riesgo de muerte.
Análisis univariante de mortalidad en pacientes con ECMO V-V. Variables preimplante
| Supervivientes | Fallecimientos | p | |
|---|---|---|---|
| Edad (años) | 49,4±10,5 (47,5-51,4) | 55,35±8,2 (54,1-56,6) | <0,0001 |
| Edad> 40 años (%) | 80,7 | 94,7 | <0,0001 |
| Edad> 50 años (%) | 49,1 | 73,5 | <0,0001 |
| Edad> 60 años (%) | 13,2 | 28,2 | 0,003 |
| Sexo (varón, %) | 77,2 | 80 | 0,57 |
| EPOC (%) | 7,9 | 7,6 | 0,94 |
| Diabetes mellitus (%) | 14,9 | 13,5 | 0,74 |
| Enfermedad cardiovascular previa (%) | 4,4 | 10 | 0,08 |
| Diálisis preimplante (%) | 0,9 | 2,9 | 0,4 |
| HTA (%) | 28,9 | 40,6 | 0,045 |
| Tabaquismo (%) | 21,1 | 14,8 | 0,17 |
| Peso (kg) | 91,5 (80-108) | 85 (76,9-100) | 0,004 |
| IMC (kg/m2) | 32,1±6,1 (30,9-33,2) | 30,9±5,7 (29,9-31,9) | 0,15 |
| Obesidad (%) | 55,4 | 44,6 | 0,08 |
| Obesidad mórbida (%) | 6,3 | 10,6 | 0,23 |
| Días de IOT pre-ECMO (d) | 5 (2-8) | 6 (3-11) | 0,027 |
| IOT pre-ECMO> 5d (%) | 39,5 | 50,9 | 0,06 |
| IOT pre-ECMO> 7d (%) | 31,6 | 44,4 | 0,03 |
| IOT pre-ECMO> 10 d (%) | 15,8 | 26 | 0,04 |
| Traqueostomía pre-ECMO (%) | 6,1 | 10 | 0,25 |
| Prono previo (%) | 90,4 | 94,6 | 0,17 |
| Fallo orgánico no pulmonar previo (%) | 5,3 | 10,8 | 0,1 |
| Origen del paciente (propio hospital, %) | 54,8 | 43,3 | 0,07 |
| Experiencia del centro (>30 casos, %) | 47,4 | 50,6 | 0,6 |
| Supervivientes | Fallecimientos | p | |
|---|---|---|---|
| Medicaciones | |||
| Antivirales (%) | 59,6 | 47,1 | 0,04 |
| Antibióticos (%) | 95,6 | 95,3 | 0,9 |
| Inótropos (%) | 12,3 | 21,9 | 0,04 |
| Vasopresores (%) | 54,4 | 66,5 | 0,04 |
| pO2 (mmHg) | 70 (60-85) | 72 (63-86) | 0,74 |
| pCO2 (mmHg) | 56 (47-67,75) | 55,5 (45-69,5) | 0,9 |
| pH | 7,3 (7,29-7,4) | 7,3 (7,28-7,4) | 0,9 |
| Ácido láctico (mmol/L) | 1,6 (1,1-2,3) | 1,7 (1,2-2,25) | 0,9 |
| FiO2 (cmH2O) | 1 (1-1) | 1 (0,9-1) | 0,14 |
| PEEP (cmH2O) | 12 (10,25-14) | 12 (10-14) | 0,07 |
| Presión pico respirador (cmH2O) | 30 (25-32) | 30 (25-31) | 0,62 |
| Parámetros analíticos | |||
| PCR (mg/dl) | 13,3 (3,1-31) | 19 (3-40) | 0,45 |
| Ferritina (ng/ml) | 1.190 (800,25-1.828) | 1.157 (869-1.140) | 0,69 |
| D-Dímero (μg/L) | 1.958 (1.016-7.600) | 2.080 (1.049-5.174,75) | 0,64 |
| Linfocitos (por mm3) | 370 (98,5-847,5) | 420 (100-855) | 0,67 |
| Procalcitonina (ng/ml) | 0,15 (0,08-0,62) | 0,39 (0,135-0,845) | 0,004 |
| Sweep (L/min) | 4 (3-4,9) | 4 (3,5-5,0) | 0,23 |
Media±desviación típica (intervalo de confianza de la media al 95%); mediana (rango intercuartil).
EPOC: enfermedad pulmonar obstructiva crónica; FiO2: fracción inpirada de O2; HTA: hipertensión arterial; IMC: índice de masa corporal; IOT: intubación orotraqueal; PEEP: presión positiva teleespiratoria; Ppico: presión pico.
Análisis univariante de mortalidad en pacientes con ECMO V-V. Variables intraimplante y postimplante
| Supervivientes | Fallecimientos | p | |
|---|---|---|---|
| Terapias adyuvantes (%) | 9,3 | 5,5 | 0,24 |
| Cambios de configuración de ECMO (%) | 2,7 | 8 | 0,07 |
| Complicaciones en ECMO | 50 | 72,6 | <0,0001 |
| Diálisis (%) | 14 | 25,9 | 0,02 |
| Complicaciones neurológicas (%) | 3,5 | 14,2 | 0,003 |
| Complicaciones pulmonares (%) | 29,8 | 40,8 | 0,06 |
| Complicaciones digestivas (%) | 4,4 | 14,4 | 0,007 |
| Flujo máximo de ECMO (L/min) | 4,4 (3,8-5) | 4,4 (4-5) | 0,9 |
| Días totales de ECMO | 13 (8-20,25) | 17 (7-29,75) | 0,23 |
| Días en UCI | 42,5 (23,75-58,25) | 25,5 (18-44) | <0,0001 |
| Días de hospital | 57 (32,5-87) | 31 (21-46) | <0,0001 |
Media±desviación típica (intervalo de confianza de la media al 95%); mediana (rango intercuartil).
UCI: unidad de cuidados intensivos.
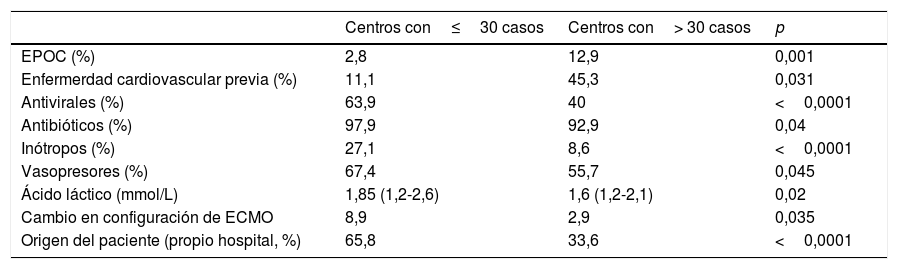
Los pacientes procedentes del propio hospital presentaron una supervivencia mayor y, aunque habían estado menos tiempo intubados antes del implante del dispositivo, presentaban una mayor administración previa de antirretrovirales e inótropos que aquellos procedentes de otros hospitales. No existen diferencias significativas en la supervivencia entre los centros de mayor volumen (más de 30 casos) y el resto, aunque la casuística de los pacientes fue diferente (tabla 8).
Comparación de pacientes tratados en centros con mayor (> 30 casos) o menos (< 30 casos) experiencia acumulada
| Centros con≤30 casos | Centros con> 30 casos | p | |
|---|---|---|---|
| EPOC (%) | 2,8 | 12,9 | 0,001 |
| Enfermerdad cardiovascular previa (%) | 11,1 | 45,3 | 0,031 |
| Antivirales (%) | 63,9 | 40 | <0,0001 |
| Antibióticos (%) | 97,9 | 92,9 | 0,04 |
| Inótropos (%) | 27,1 | 8,6 | <0,0001 |
| Vasopresores (%) | 67,4 | 55,7 | 0,045 |
| Ácido láctico (mmol/L) | 1,85 (1,2-2,6) | 1,6 (1,2-2,1) | 0,02 |
| Cambio en configuración de ECMO | 8,9 | 2,9 | 0,035 |
| Origen del paciente (propio hospital, %) | 65,8 | 33,6 | <0,0001 |
Media±desviación típica (intervalo de confianza de la media al 95%); mediana (rango intercuartil).
EPOC: enfermedad pulmonar obstructiva crónica.
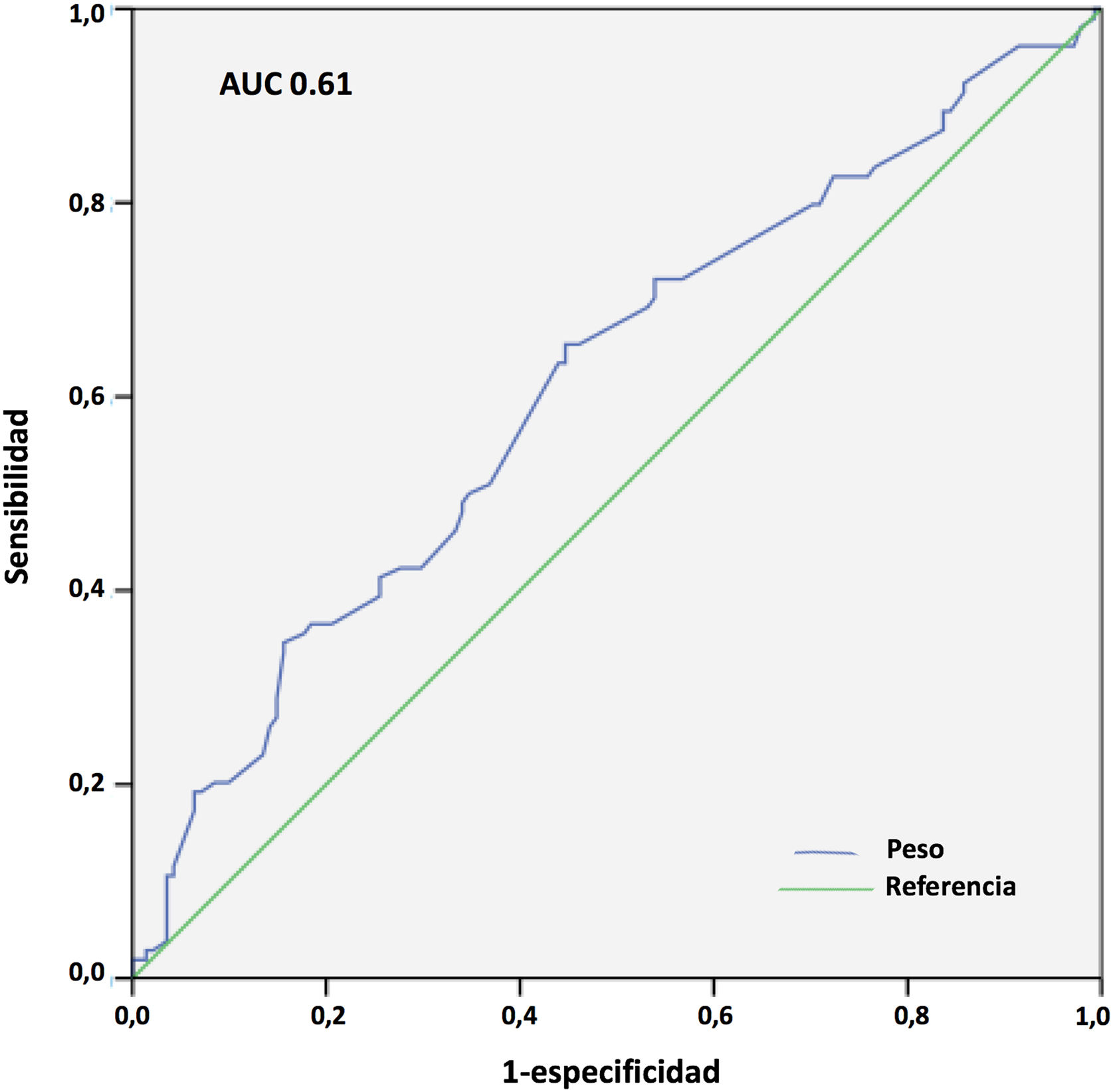
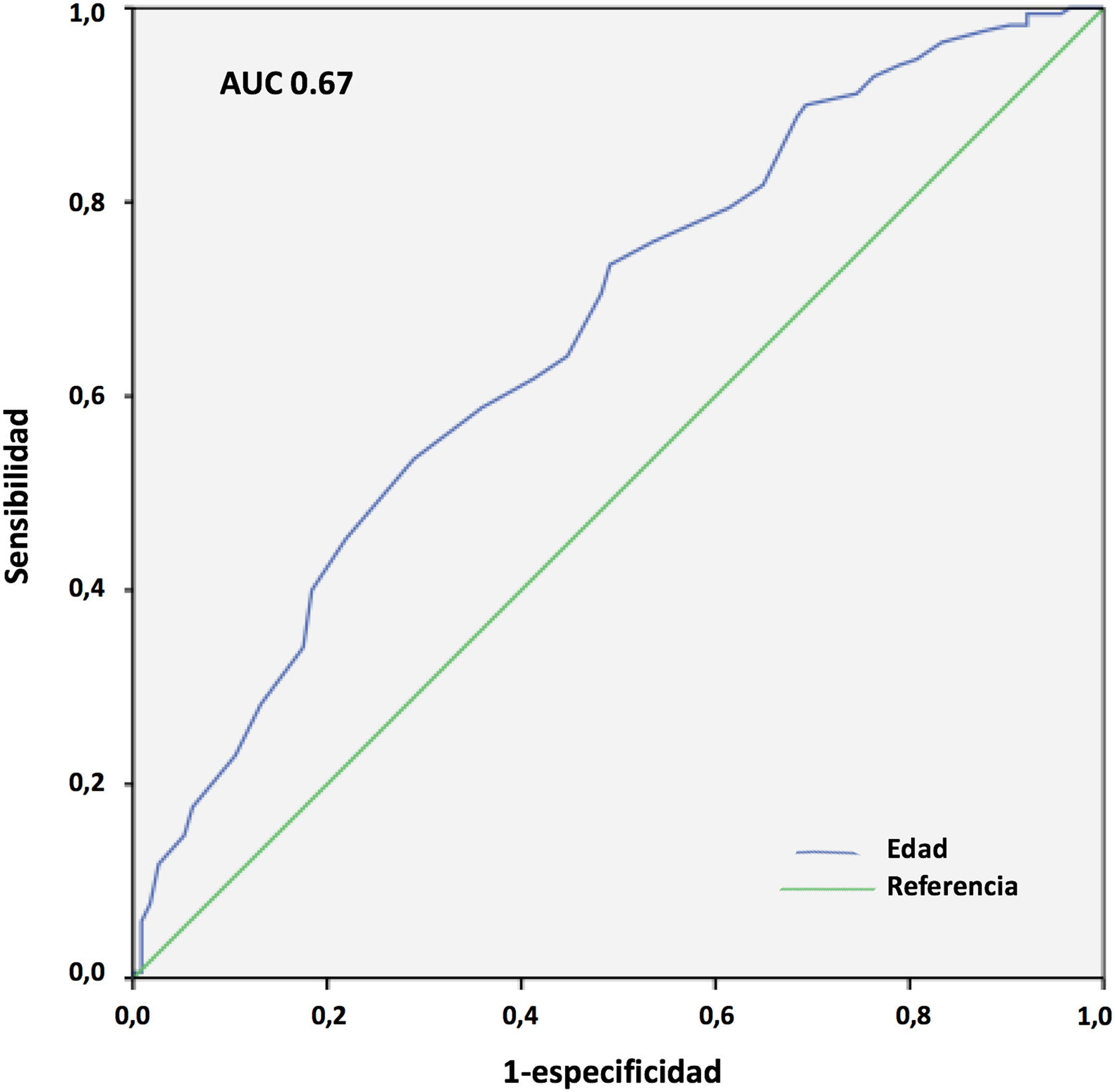
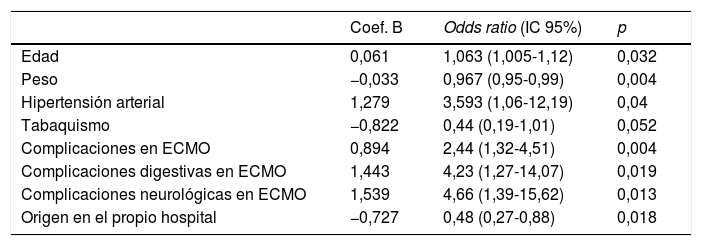
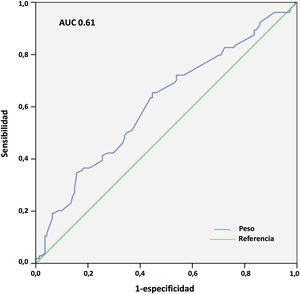
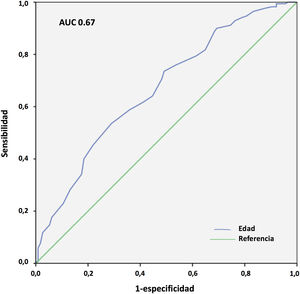
Los resultados del análisis multivariante se expresan en la tabla 9. El peso corporal (área bajo la curva [AUC] 0,61; IC 95%: 0,54-0,68, punto óptimo de corte 88kg, fig. 4) y la procedencia del propio hospital resultaron factores protectores de mortalidad; mientras que la edad (AUC 0,67; IC 95%: 0,60-0,73, punto óptimo de corte 48 años, fig. 5), la hipertensión arterial (HTA) y las complicaciones en ECMO, tanto consideradas de forma global como las complicaciones digestivas y neurológicas en concreto, fueron predictores independientes de mortalidad. El consumo de tabaco resultó una variable protectora con una significación limítrofe (p=0,052).
Análisis multivariante de mortalidad en pacientes con ECMO V-V
| Coef. B | Odds ratio (IC 95%) | p | |
|---|---|---|---|
| Edad | 0,061 | 1,063 (1,005-1,12) | 0,032 |
| Peso | −0,033 | 0,967 (0,95-0,99) | 0,004 |
| Hipertensión arterial | 1,279 | 3,593 (1,06-12,19) | 0,04 |
| Tabaquismo | −0,822 | 0,44 (0,19-1,01) | 0,052 |
| Complicaciones en ECMO | 0,894 | 2,44 (1,32-4,51) | 0,004 |
| Complicaciones digestivas en ECMO | 1,443 | 4,23 (1,27-14,07) | 0,019 |
| Complicaciones neurológicas en ECMO | 1,539 | 4,66 (1,39-15,62) | 0,013 |
| Origen en el propio hospital | −0,727 | 0,48 (0,27-0,88) | 0,018 |
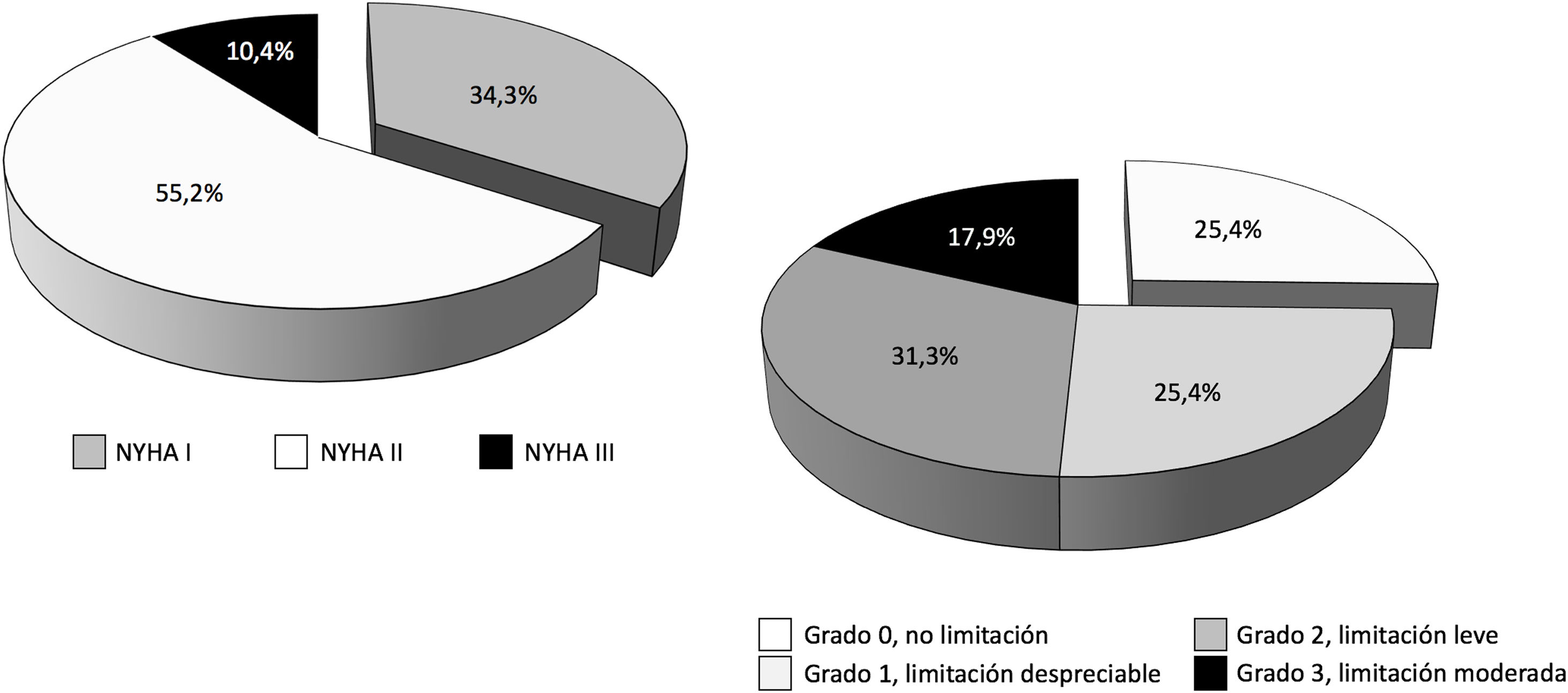
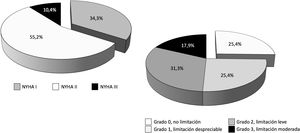
De los 114 pacientes con ECMO V-V dados de alta del hospital (40,1% del total), 8 casos procedían de un centro que no realizó seguimiento a ningún paciente y, además, coincidió con el centro que solo reportó datos de la primera ola, por lo que todos los pacientes implantados en ese centro fueron descartados en bloque del análisis de los eventos secundarios con todas sus variables. De los 106 pacientes restantes, la mayoría (67,4%) fueron remitidos a su domicilio y el 16,8% y el 15,8% fueron trasladados al hospital de referencia y a centros de rehabilitación, respectivamente. En 85 casos se había completado el periodo de 3o más meses tras el alta. De ellos, se les hizo seguimiento clínico a 68 pacientes (80,0% y 59,6% del total de pacientes dados de alta), con un seguimiento medio de 196±101,7 días (IC 95%: 170,8-221,6 días). El 100% de los pacientes estaban vivos en el momento del seguimiento. La distribución de la clase funcional y la limitación funcional se pueden observar en la figura 6.
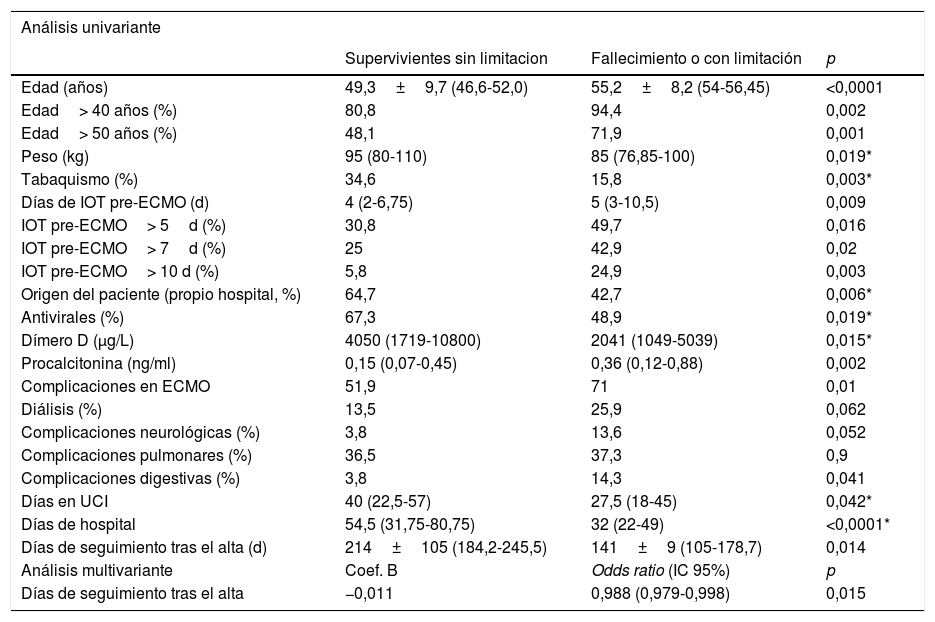
El análisis de los predictores del evento secundario combinado de muerte hospitalaria y discapacidad funcional durante el seguimiento en el grupo global de pacientes con ECMO V-V se llevó a cabo en una población de estudio de 249 pacientes. Entre ellos, 11 pacientes se consideraron perdidos por faltarles alguna de las variables necesarias de seguimiento, con una población final de 238 pacientes. De ellos, 178 presentaron el evento secundario combinado (74,8%). En la tabla 10 se pueden observar los predictores de aparición del evento tras el análisis univariante y multivariante. De nuevo, el tiempo desde el alta hospitalaria hasta el seguimiento clínico fue significativamente menor en los pacientes fallecidos o con peor clase funcional (141,9±66,5 versus 214,8±105,43 días; p=0,003).
Evento secundario combinado (mortalidad y clase funcional/dependencia): análisis univariante y multivariante de factores predictores
| Análisis univariante | |||
|---|---|---|---|
| Supervivientes sin limitacion | Fallecimiento o con limitación | p | |
| Edad (años) | 49,3±9,7 (46,6-52,0) | 55,2±8,2 (54-56,45) | <0,0001 |
| Edad> 40 años (%) | 80,8 | 94,4 | 0,002 |
| Edad> 50 años (%) | 48,1 | 71,9 | 0,001 |
| Peso (kg) | 95 (80-110) | 85 (76,85-100) | 0,019* |
| Tabaquismo (%) | 34,6 | 15,8 | 0,003* |
| Días de IOT pre-ECMO (d) | 4 (2-6,75) | 5 (3-10,5) | 0,009 |
| IOT pre-ECMO> 5d (%) | 30,8 | 49,7 | 0,016 |
| IOT pre-ECMO> 7d (%) | 25 | 42,9 | 0,02 |
| IOT pre-ECMO> 10 d (%) | 5,8 | 24,9 | 0,003 |
| Origen del paciente (propio hospital, %) | 64,7 | 42,7 | 0,006* |
| Antivirales (%) | 67,3 | 48,9 | 0,019* |
| Dímero D (μg/L) | 4050 (1719-10800) | 2041 (1049-5039) | 0,015* |
| Procalcitonina (ng/ml) | 0,15 (0,07-0,45) | 0,36 (0,12-0,88) | 0,002 |
| Complicaciones en ECMO | 51,9 | 71 | 0,01 |
| Diálisis (%) | 13,5 | 25,9 | 0,062 |
| Complicaciones neurológicas (%) | 3,8 | 13,6 | 0,052 |
| Complicaciones pulmonares (%) | 36,5 | 37,3 | 0,9 |
| Complicaciones digestivas (%) | 3,8 | 14,3 | 0,041 |
| Días en UCI | 40 (22,5-57) | 27,5 (18-45) | 0,042* |
| Días de hospital | 54,5 (31,75-80,75) | 32 (22-49) | <0,0001* |
| Días de seguimiento tras el alta (d) | 214±105 (184,2-245,5) | 141±9 (105-178,7) | 0,014 |
| Análisis multivariante | Coef. B | Odds ratio (IC 95%) | p |
| Días de seguimiento tras el alta | −0,011 | 0,988 (0,979-0,998) | 0,015 |
IOT: intubación orotraqueal; UCI: unidad de cuidados intensivos.
Cuando se analizaron los predictores de presentar mal estado funcional o dependencia tras el alta, los pacientes con clase funcional>II/IV de la NYHA o con limitación grado>2 fueron similares en cuanto a edad, sexo, IMC, duración de la terapia ECMO/IOT preoperatoria, comorbilidades (incluidas la obesidad, la enfermedad pulmonar obstructiva crónica [EPOC], el tabaquismo o la traqueostomía durante el ingreso) y complicaciones durante la ECMO. Sin embargo, los pacientes con peor estado funcional durante el seguimiento habían estado significativamente más días en UCI, no así en el hospital, y para ellos, de nuevo, había transcurrido menos tiempo desde el alta hospitalaria hasta el seguimiento clínico. En el análisis multivariante, de nuevo solo los días transcurridos del alta al seguimiento resultaron predictores de limitación o mala clase funcional (OR 0,99; IC 95%: 0,98-0,99; p=0,03).
DiscusiónLos principales hallazgos del análisis de los resultados del Registro ECMO-COVID de la SECCE son que la mortalidad hospitalaria de los pacientes diagnosticados de COVID-19 y tratados con ECMO V-A y V-V ha sido del 56,2 y el 50,9%, respectivamente y que la aparición de mortalidad hospitalaria en pacientes con ECMO VV se ha visto influida por el peso corporal y la procedencia del propio hospital como factores protectores y la edad, la HTA y las complicaciones en ECMO como predictores independientes de mortalidad. Además, solo el momento de seguimiento se ha mostrado como factor independiente de aparición de los eventos secundarios.
Los beneficios de la ECMO durante el SDRA por causas diferentes a COVID-19 siguen en debate, aunque la evidencia disponible indica un beneficio respecto al manejo conservador. En estudios clásicos, los resultados de estos dispositivos en pacientes con SDRA habían sido desalentadores, con mortalidades entre el 60 y el 90%19,20. Posteriormente, en un metaanálisis en el que se analizaron 7 estudios (2 aleatorizados, CESAR9, EOLIA10 y 5 estudios observacionales) con un total de 867 pacientes11 se observó que, comparada con la ventilación mecánica aislada, la ECMO reducía la mortalidad a 30, 60 y 90 días (RR 0,74; IC 95%: 0,59-0,93; p=0,01; I2=0%, de calidad moderada), con una incidencia de eventos adversos similar.
Tras estos resultados, la necesidad de tratar pacientes extremadamente graves durante la pandemia de COVID-19 indujo a que tanto la OMS como otras organizaciones internacionales y la opinión de expertos recomendaran el implante de ECMO para tratamiento de la insuficiencia respiratoria o circulatoria severas en este contexto12,13.
La experiencia inicial de ECMO en pacientes con COVID-19 fue también desalentadora, con mortalidades superiores al 80%5,14,15. El aumento de la mortalidad, asociado a la linfopenia y a los incrementos de IL-6 en estos pacientes, condujeron a sospechar que esta terapia pudiera ser incluso dañina debido a la gran alteración inmunológica e inflamatoria que produce16.
Después se han señalado mejores resultados. Schmidt et al.12 reportaron una mortalidad estimada a 60 días del 31% (IC 95%: 22-42%) tras SDRA severo tratado con ECMO en una experiencia de 83 pacientes jóvenes con mediana de edad de 49 años (RIQ: 41-56 años). El Registro de la Sociedad Italiana de Cirugía Cardiaca analizó los datos de 71 pacientes tratados con ECMO V-V (94%) o V-A (6%) en 12 hospitales21, con una supervivencia hospitalaria del 36,6% (n=26). Por su parte, la ELSO, en su reporte en tiempo real22 a 2 de octubre de 2021, reportó más de 9.430 casos confirmados de COVID-19 con ECMO con más de 7.750 casos con ECMO indicada al menos en los 90 días previos. La mortalidad hospitalaria ronda el 48%, con 913 pacientes en soporte ECMO activo. En nuestro Registro, la mortalidad hospitalaria global ha sido al cierre del 51,2% (187/365), 56,2% en los casos V-A y 50,9% en los casos V-V. La inmensa mayoría de los fallecimientos se producen durante la terapia (90,9% en caso de V-A y 84,1% en V-V), por lo que la cifra final de mortalidad puede variar cuando se analice el desenlace definitivo de esos pacientes.
La mortalidad en la segunda ola fue significativamente superior a la del resto, lo que coincide con los hallazgos del último reporte del gran registro de la ELSO, con más de 4.800 pacientes, en el que la mortalidad a 90 días fue de 36,9% (IC 95%: 34,1-39,7) cuando la ECMO se implantó antes del 1 de mayo de 2020 y del 51,9% (50,0-53,8) tras esa fecha. A pesar de que el perfil de riesgo de los pacientes fue similar entre ambos grupos23, las características y tratamientos preimplante indican que fueron pacientes con fenotipos de COVID-19 más agresivos. En una experiencia nacional, Riera et al. han comunicado también mayor mortalidad en la segunda ola24. Los autores achacan esta diferencia a una mayor edad, mayores comorbilidades, a menor porcentaje de pacientes tratados en centros con experiencia>30 casos y a mayor tasa de sobreinfecciones asociadas. En nuestra experiencia los pacientes de la segunda ola fueron efectivamente más mayores que los del resto de las olas y con mayor morbilidad (más HTA, insuficiencia renal y mayor necesidad de vasopresores), por lo que también pudo influir una relajación en las indicaciones debido a los resultados obtenidos en la primera, mucho mejores que los obtenidos con las primeras experiencias clínicas. Sin embargo, no fueron tratados con más frecuencia en centros con experiencia ni pertenecían al grupo de pacientes trasladados de centro para su tratamiento (tabla 11).
Comparación de las poblaciones de las diferentes olas durante la pandemia
| Olas 1, 3, 4 | Ola 2 | p | |
|---|---|---|---|
| Edad (años) | 51,5±10,2 (49,8-53,1) | 53,8±8,5 (51,8-55,7) | 0,03 |
| Sexo (masculino) | 75,0 | 82,9 | 0,091 |
| Enfermedad cardiovascular previa (%) | 5,6 | 11,1 | 0,063 |
| Insuficiencia renal previa (%) | 3,2 | 8,5 | 0,028 |
| HTA (%) | 31,5 | 45,3 | 0,01 |
| Obesidad (IMC≥ 30) (%) | 55,1 | 44,0 | 0,048 |
| Vasopresores (%) | 58,9 | 68,8 | 0,046 |
| Complicaciones de ECMO (%) | 57,6 | 67,2 | 0,08 |
| Complicaciones neurológicas (%) | 7,6 | 13,8 | 0,064 |
| Centros> 30 casos (%) | 48,8 | 53 | 0,45 |
| Origen propio hospital (%) | 52,1 | 54,4 | 0,7 |
HTA: hipertensión arterial; IMC: índice de masa corporal.
Los pacientes con ECMO V-V estuvieron significativamente más días en terapia ECMO y presentaron estancias más prolongadas en UCI y en el hospital de forma global. La afectación miocárdica y tromboembolia pulmonar aguda masivas por COVID-19, a pesar de que son letales más precozmente, se resuelven de manera también más temprana que las complicaciones pulmonares propias de los pacientes con ECMO V-V (SDRA y neumonía bilateral).
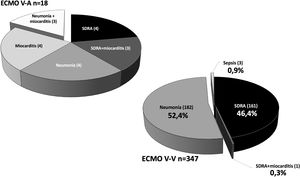
La IOT prolongada previa al implante de ECMO es un frecuente predictor de mortalidad en estos pacientes25,26. En nuestro Registro, tal y como se observa en otras experiencias27, la duración de la IOT pre-ECMO no resultó factor independiente de mortalidad en pacientes con ECMO V-V. Aunque en el análisis univariante, la mortalidad fue más frecuente en pacientes intubados más de 7 y 10 días previos, y por encima de 5 días la significación fue limítrofe, en el análisis multivariante las diferencias no fueron significativas. Por su parte, en nuestra experiencia la edad resultó el factor predictor de mortalidad más consistente, con diferencias significativas entre grupos y de manera similar a lo observado en la mayoría de las series21,25,27-29. El 19,7% de nuestros pacientes eran mayores de 60 años. La mortalidad resultó del 43,7% versus 65,3% para los menores y mayores de 47 años, respectivamente (p=0,001). La discriminación de la curva ROC fue pobre (AUC=0,67).
Las diferencias en edad y tiempos de IOT con otras experiencias pueden explicar las diferencias de mortalidad. En el registro LIFEGARDS, que recogió los datos de 350 pacientes con SDRA no COVID-19 tratados con ECMO V-V, la edad media fue de 47±17 años y la mediana de días entre la IOT y el inicio de la ECMO fue realmente baja (2 días, RIQ: 0-5 días)25. La supervivencia a 6 meses fue del 61%. En el análisis multivariante, la edad avanzada (OR por cada año adicional 1,03; IC 95%: 1,02-1,05; p<0,001) y el retraso en el inicio de ECMO desde la IOT (OR por cada día de retraso 1,08; IC 95%: 1,03-1,14; p=0,004) fueron factores independientes de mortalidad. Schmidt et al.12 reportaron una mortalidad estimada a 60 días del 31% (IC 95%: 22-42%) tras SDRA severo por COVID-19 tratado con ECMO en una experiencia de 83 pacientes jóvenes con mediana de edad de 49 años (RIQ: 41-56) y con una mediana de IOT previa a la terapia de 4 días (RIQ: 3-6). En nuestro Registro, las variables concernientes al estado ventilatorio previo al implante de ECMO, fundamentales en los resultados de recuperación pulmonar tras ECMO V-V, se recogieron de manera retrospectiva y, por último, se dispuso de datos de presión pico y PEEP del respirador previas en un 38,0% (108/284) y 60,6% (172/284) de los pacientes con ECMO V-V, respectivamente. Es probable que esto nos haya impedido valorar de forma adecuada su impacto en la mortalidad y puede haber interactuado negativamente para encontrar diferencias significativas en el análisis multivariante en cuanto a la significación de los tiempos de IOT previos. Además, las medianas de presiones pico de los subgrupos de pacientes supervivientes y fallecidos fueron de 30 cmH2O, consistentemente superiores a las de otras series que han reportado excelentes resultados25, por lo que quizá nuestra selección de pacientes a ese respecto haya sido menos exigente. Todo ello indica que la edad, los tiempos de IOT previos y las presiones del ventilador se deben tener en cuenta en el momento de indicar la ECMO, porque así se pueden optimizar de forma significativa los resultados.
Se ha demostrado de manera consistente que los pacientes con COVID-19 presentan significativamente más prevalencia tanto de enfermedad cardiovascular como de HTA7, relacionando esta última con morbimortalidad de los pacientes con COVID-1930,31. En los pacientes tratados mediante ECMO este hallazgo no ha sido tan constante27. Sin embargo, la HTA aumenta la expresión de ECA2, molécula que puede favorecer la disfunción endotelial, la protrombosis y la hiperinflamación durante la COVID-1932 y, por tanto, incrementar su gravedad.
En nuestra serie, las complicaciones durante la ECMO predijeron la mortalidad hospitalaria de manera consistente, tanto consideradas de forma global como cuando se analizaron los subgrupos de complicaciones digestivas y neurológicas. Los pacientes con COVID-19 tienen un estado protrombótico que predispone a presentar eventos trombóticos arteriales y venosos33-35. En los pacientes tratados con ECMO V-V, la incidencia de TVP es todavía más elevada, pudiendo llegar al 85% de los pacientes monitorizados con ecografía. De igual modo, las complicaciones hemorrágicas en los pacientes con COVID-19 son elevadas debido a la activación de la fibrinólisis, al consumo de factores de la coagulación y a la aparición de coagulación intravascular diseminada4,36,37, que empeoran el pronóstico.
El tabaquismo mostró una significación limítrofe como factor protector de mortalidad en nuestros pacientes. Aunque el hábito tabáquico se ha relacionado con un incremento de la incidencia y de la severidad de los síntomas de COVID-19, la respuesta inflamatoria en esta enfermedad está, en parte, mediada por una disfunción de la vía colinérgica antiinflamatoria. La nicotina estimula esta vía mediante la activación de receptores colinérgicos nicotínicos (a7nAChR)38 y se ha postulado que podría reducir la respuesta inflamatoria y la gravedad de COVID-19 debido a una atenuación de la tormenta de citocinas y a una regulación de la reacción inflamatoria alveolar pulmonar a través de la modulación de la respuesta neuroendocrina local39. Suzuki et al. han observado en un análisis de la mortalidad a 30 días de 341.166 pacientes que el tabaquismo activo previno la mortalidad en personas infectadas por COVID-19 (aRR ajustado 0,81; IC 95%: 0,66-0,989)30. En la población de pacientes críticos con necesidad de ECMO en los que la reacción inflamatoria es exacerbada por la fisiología del propio dispositivo, la nicotina podría desempeñar un papel en la regulación de la reacción inflamatoria sistémica y pulmonar.
En nuestro estudio, el incremento de peso resultó claramente protector para la mortalidad hospitalaria. La mortalidad fue del 54,1 versus 68,4% para los pacientes con más y menos de 88 kg, respectivamente (p=0,016), aunque la discriminación de la curva ROC fue, de nuevo, pobre (AUC=0,61). En un reciente metaanálisis de 22 estudios observacionales con 1.896 pacientes tratados mediante ECMO V-V y V-A por COVID-19, se observó que el incremento del IMC era un factor protector de mortalidad (OR 0,997; IC 95%: 0,956-0,999; p=0,04)27. Estas observaciones no se han confirmado, sin embargo, en otros estudios y metaanálisis31. En cualquier caso, es muy conocida la «paradoja» de la obesidad, en la que los pacientes con IMC leve o moderadamente aumentado tienen menor mortalidad en UCI que los pacientes con normopeso, y se han reportado hallazgos similares en pacientes con sepsis40, insuficiencia cardiaca o cardiopatía isquémica41, entre otros. Varias de las condiciones asociadas a la obesidad y que se postula que favorecen esa «protección» podrían contribuir a una menor morbimortalidad durante la ECMO por COVID-19, como son unas mayores reservas energéticas, el preacondicionamiento inflamatorio, un perfil inmunológico antiinflamatorio o el incremento de la síntesis adrenal de esteroides42. Nuestro estudio señala que los pacientes más mayores y con más deterioro ponderal previo son los que pueden presentar peor pronóstico cuando precisan ECMO en este contexto.
La mortalidad de los pacientes trasladados desde centros de referencia ha sido mayor en nuestra serie que los pacientes implantados en el propio centro. El tratamiento con ECMO en este subgrupo de pacientes supone un consumo importante de recursos26, especialmente reducidos durante la pandemia. Esto hace que se haya promulgado que el uso de ECMO en pacientes COVID-19 debe efectuarse en centros con experiencia en el manejo de estos dispositivos para optimizar los resultados1,12,43,44. En una serie retrospectiva multicéntrica e internacional, el tratamiento en centros con experiencia acumulada>30 casos entre la primera y la segunda ola fue predictor de mortalidad hospitalaria24. En nuestro caso, los pacientes tratados en centros con mayor experiencia (definida como>30 casos entre las 4 olas) presentaban con más frecuencia EPOC y más enfermedad cardiovascular previa, pero precisaron menos antibióticos, antivirales, inotrópicos y vasoconstrictores previos. Además, presentaron menor ácido láctico en el momento del implante y precisaron menos cambios de configuración de ECMO. La mortalidad de los pacientes con ECMO V-V en estos centros no difirió de la de hospitales con menor volumen, aunque, debido a las diferencias poblacionales, a todo lo que supone un traslado interhospitalario y a la heterogeneidad de la selección y manejo de los pacientes entre centros, es muy difícil sacar conclusiones.
A este respecto, Lebreton et al.45 describen una experiencia regional francesa con 302 pacientes en la que se centralizaron los implantes por equipos limitados y se homogeneizó la selección y el manejo periprocedimiento. Entre las contraindicaciones caben destacar la edad mayor de 70 años y una IOT mayor de 10 días. Sin embargo, no se hicieron restricciones respecto a las presiones del respirador. Las presiones meseta medias fueron similares a las presiones pico de nuestros pacientes (30 cmH2O) y casi idénticas también entre los pacientes supervivientes y fallecidos. La supervivencia a 90 días fue del 46%, similar a la de nuestro Registro, pero con una mayor supervivencia en centros con mayor experiencia (OR 2,98; IC 95%: 1,46-6,04; p=0,0026) y sin diferencias entre los pacientes trasladados y los tratados en el propio centro.
Existen muy pocas experiencias con seguimiento a medio plazo de estos enfermos. Biancari et al.46 reportaron una mortalidad hospitalaria del 53% y, también de manera similar a nuestra serie, todos los pacientes dados de alta sobrevivieron a un seguimiento de 6 meses. En cuanto a la recuperación funcional, en otras causas de SDRA tratadas en UCI, casi un tercio de los pacientes continúan sin incorporarse a su puesto laboral al año del alta47. Los déficits que presentan a largo plazo son tanto motores como cognitivos y emocionales. En los supervivientes de la COVID-19 estas afectaciones son probablemente más intensas que en otras enfermedades debido a que el carácter contagioso de la enfermedad genera una limitación de los cuidados, con reducción significativa de cambios posturales, precocidad y sesiones de fisioterapia, etc., además del aislamiento social y familiar impuesto. En una pequeña serie de 23 pacientes jóvenes con mediana de edad de 47 años, de los 14 pacientes supervivientes al año de seguimiento solo 6 habían recobrado la vida laboral48. Según el Cuestionario de Discapacidad de la OMS de la Escala de Rankin, el 75% de los pacientes presentaban discapacidad. Además, el 40% mostraba signos de depresión y el 60%, de ansiedad. De todos estos estudios se infiere que, aunque la ECMO puede ser eficaz para mejorar la mortalidad de estos pacientes, necesitan un importante soporte de rehabilitación funcional y psicológica posterior que, en el mejor de los casos, debe ser prolongado. A este respecto se ha iniciado un proyecto encaminado a promover la recuperación de este tipo de pacientes (ORACLE, Outcomes and Recovery After COVID-19 Leading to ECMO)49.
En nuestra serie, tras 196±101,7 días de seguimiento, el 100% de los pacientes con ECMO V-V a los que se hizo seguimiento clínico estaban vivos en el momento del contacto telefónico, el 89,6% de los pacientes se encontraban en clase funcional I-II/IV de la NYHA y el 82,1% presentaban limitaciones nulas, despreciables o leves para las actividades diarias, según la escala de Leiden. Lamentablemente solo se realizó seguimiento más allá de los 3meses al 59,6% del total de los pacientes dados de alta, por lo que es difícil extraer conclusiones hasta que se complete el seguimiento en toda la serie. Entre los pacientes supervivientes, los predictores con peor resultado funcional fueron los días en UCI y un menor tiempo desde el alta hospitalaria al seguimiento clínico, sin diferencias en otras características, incluidas las complicaciones durante la ECMO. La mayor estancia en UCI supone una evolución más complicada con un mayor riesgo de polineuropatía, sarcopenia, secuelas pulmonares, etc., que inducen una peor evolución. En el análisis multivariante, solo los días transcurridos desde el alta al seguimiento resultaron predictores de limitación o mala clase funcional. En los modelos de regresión, la inclusión de la variable del momento del seguimiento neutralizaba de manera consistente la capacidad de la edad para predecir la aparición de evento secundario y los efectos protectores del peso corporal y del origen del paciente en el propio hospital frente a su aparición. Este hallazgo es un indicativo claro de la lentitud de la recuperación funcional de estos pacientes, con largas estancias en UCI, largos periodos de prono, traqueostomía, frecuentes secuelas pulmonares, dificultades para su soporte psicológico, social y familiar, etc.
Nuestro estudio tiene varias limitaciones. El carácter observacional no aleatorizado respecto a un grupo control de tratamiento médico óptimo frente a ECMO nos impide extraer conclusiones en cuanto al beneficio de esta terapia en pacientes con COVID-19 severo. La mayoría de los datos se recopilaron de manera prospectiva, pero algunas variables se recogieron retrospectivamente, según evolucionó la evidencia científica. Esto ha hecho que se haya producido una pérdida de casos importante en algunas determinaciones, sobre todo en variables analíticas y respiratorias pre-ECMO, lo que impide extraer conclusiones al respecto. El carácter multicéntrico aporta gran extrapolabilidad a los resultados. Sin embargo, la variabilidad de las indicaciones, contraindicaciones y manejo de los pacientes, establecidos según la experiencia y protocolos de cada centro, supone un importante sesgo en la valoración de los resultados y en su potencial comparación con otras experiencias. Por otro lado, aunque incluye a pacientes de 25 hospitales, no podemos estar seguros de que represente correctamente a toda la población ECMO-COVID española, máxime cuando nuestra muestra procede sobre todo de centros en los que el implante lo realizan cirujanos cardiovasculares. El seguimiento de los pacientes ha sido limitado al 80,0% de los pacientes que habían cumplido los 3 meses tras el alta, lo que supone, además, el 59,6% del total de los pacientes dados de alta, lo cual puede inducir un sesgo para la interpretación de los resultados del evento secundario. Además, un porcentaje no desdeñable de los pacientes todavía estaban ingresados en el momento del análisis. Para definir más exactamente la evolución a medio y largo plazo de estos pacientes se precisa completar un seguimiento adicional, que se va a realizar al año del cierre de la inclusión de pacientes.
ConclusionesEn nuestra experiencia la terapia ECMO proporciona supervivencias hospitalarias favorables, cercanas al 50% en pacientes gravemente enfermos por COVID-19. La edad, la HTA y las complicaciones en ECMO, tanto globales como digestivas y neurológicas consideradas de forma individual, son los predictores de mortalidad en pacientes con ECMO V-V, mientras que un mayor peso corporal y la procedencia del propio hospital son factores protectores. El deterioro funcional tras el alta hospitalaria solo se ve influida de manera independiente por el tiempo de seguimiento transcurrido tras el alta, lo que indica una lenta recuperación. Es necesario implementar equipos multidisciplinares de cuidados tras el alta hospitalaria de estos pacientes, dada la multifocalidad de las causas de su deterioro funcional.
La optimización clínica de los resultados y la investigación futura requieren unificar las indicaciones, contraindicaciones y el manejo de estos pacientes. Completar el seguimiento al año de toda la serie nos va a permitir definir mejor nuestros resultados.
Conflictos de interesesLos autores declaran no tener conflictos de intereses.
Centro código
Fecha de nacimiento
Edad (años)
Peso (kg)
Índice de masa corporal (kg/m2)
Obesidad IMC>30 (sí, no)
EPOC (sí, no) Uso prolongado de broncodilatadores o corticosteroides por enfermedad pulmonar crónica
Diabetes (sí, no) Diagnóstico de diabetes mellitus previo al implante
Enfermedad cardiovascular (sí, no) Enfermedad cardiaca estructural concomitante o cardiopatía isquémica o insuficiencia cardiaca con o sin fracción de eyección reducida previa concomitante
Insuficiencia renal (sí, no) Aclaramiento de creatinina menor de 50 ml/min/1,73 m2
Diálisis preimplante (sí, no)
Hipertensión arterial (sí, no)
Tabaquismo (sí, no)
Sexo (masculino, femenino, desconocido)
Raza (desconocida, asiática, negra, hispana, blanca)
Intubación orotraqueal (IOT) (sí, no)
Fecha de intubación
Días de IOT pre-ECMO
Traqueostomía (sí, no)
Fecha de traqueostomía
Terapia médica pre-ECMO (sí, no) (antibióticos o antivirales o inótropos o vasopresores)
Antibióticos (sí, no)
Antivirales (sí, no)
Inótropos (sí, no)
Vasopresores (sí, no)
Pronado pre-ECMO (sí, no)
Fecha de inicio de pronado
pO2 pre-ECMO (mmHg)
pCO2 pre-ECMO (mmHg)
pH pre-ECMO
Láctico pre-ECMO (mmol/L)
FiO2 pre-ECMO
PEEP pre-ECMO (cmH2O)
P pico ventilador pre-ECMO (cmH2O)
PCR (mg/dl) preimplante
Ferritina (ng/ml) preimplante
Dímero-D (mcg/l) preimplante
Linfocitos/mm3 preimplante
Procalcitonina (ng/ml) preimplante
Sweep (L/min) al implante
Tipo de ECMO (V-V, V-A)
Fecha de implante ECMO
Accesos ECMO (femorofemoral, femoyugular, yugular-femoral, yugular doble luz, femoroaxilar, central)
Perfusión distal de miembro inferior (sí, no)
Venteo de VI (sí, no)
Tipo de venteo de VI (describir)
Indicación ECMO (SDRA)
Fallo orgánico no pulmonar preimplante (cardiaco, renal, hepático) (sí, no) SECCE
Terapia coadyuvante con plasmaféresis (sí, no)
Terapia coadyuvante con Cytosorb (sí, no)
Terapia coadyuvante con leucoféresis (sí, no)
Terapia coadyuvante con MARS (sí, no)
Cambio de configuración de ECMO (sí, no)
Fecha de cambio de configuración de ECMO
Configuración de ECMO tras cambio de configuración (sí, no)
Indicación de cambio de configuración de ECMO
Anticoagulación (heparina, bivalirudina, argatrobán, no anticoagulación, otros)
Máximo flujo de ECMO pump flow (L/min)
Complicaciones en ECMO (sí, no)
Fracaso renal (diálisis) (sí, no)
Complicación neurológica (sí, no) (hemorrágica, isquémica)
Complicación pulmonar (neumotórax/sangrado/TEP) (sí, no)
Complicación digestiva (isquemia/sangrado) (sí, no)
Desconexión de ECMO (sí, no)
Fecha de desconexión de ECMO
Muerte en ECMO (sí, no)
Fecha de muerte en ECMO
Causa de muerte en ECMO (parada cardiaca, fracaso respiratorio, shock séptico, lesión neurológica, fracaso multiorgánico, otros)
Días en UCI
Días de hospital
Alta vivo de hospital (sí, no)
Origen del paciente (propio hospital, hospital de referencia)
Fecha de alta del hospital
Destino del paciente
Fecha de seguimiento (>3 meses tras el alta)
Estatus (>3 meses tras el alta) (vivo, muerto)
Clase funcional de NYHA (>3 meses tras el alta)
Estado de dependencia / funcional (>3 meses tras el alta) (grado 0, «ausencia de limitación funcional», grado 1 «limitación funcional despreciable», Grado 2 «limitación funcional leve», Grado 3 «limitación funcional moderada», Grado 4 «limitación funcional severa»).
Estatus actual (muerte en ECMO, muerte tras desconexión ECMO, vivo en ECMO, vivo tras desconexión ECMO, vivo alta de UCI, vivo alta del hospital)